OPMERKINGEN: een recensie van de toponderzoeker over obesitas en voedselverslaving.
Volume 69, uitgave 4, 24 februari 2011, pagina's 664 – 679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Beoordeling
Paul J. Kenny1, ,
1 Laboratorium voor Gedrags- en Moleculaire Neurowetenschappen, Afdeling Moleculaire Therapeutica, The Scripps Research Institute, Jupiter, FL 33458, VS
________________________________________
Er wordt voedsel geconsumeerd om de energiebalans op homeostatische niveaus te handhaven. Daarnaast wordt smakelijk voedsel ook geconsumeerd vanwege zijn hedonistische eigenschappen, onafhankelijk van de energiestatus. Dergelijke beloningsgerelateerde consumptie kan ertoe leiden dat de calorie-inname de behoeften overschrijdt en wordt beschouwd als een belangrijke boosdoener in de snel toenemende mate van obesitas in de ontwikkelde landen. Vergeleken met homeostatische mechanismen van voeding, is er veel minder bekend over hoe hedonistische systemen in de hersenen voedselinname beïnvloeden. Intrigerend genoeg kan overmatige consumptie van smakelijk voedsel neuroadaptieve reacties in brain reward-circuits teweegbrengen, vergelijkbaar met drugs van misbruik. Bovendien kunnen vergelijkbare genetische kwetsbaarheden in hersenbeloningssystemen de aanleg voor drugsverslaving en obesitas vergroten. Hier zullen recente ontwikkelingen in ons begrip van de hersencircuits die de hedonistische aspecten van het voedingsgedrag reguleren worden herzien. Ook nieuw bewijs dat suggereert dat obesitas en drugsverslaving gemeenschappelijke hedonistische mechanismen kunnen delen, zal ook worden overwogen.
________________________________________
Belangrijkste tekst
"Er is geen grotere liefde dan de liefde voor eten."
-George Bernard Shaw
Introductie
Obesitas, gedefinieerd als een body mass index (BMI) van> 30, is een aandoening waarbij adipositas abnormaal hoog is en het gevolg kan zijn van hyperfagie of een verminderde stofwisseling (O'Rahilly, 2009). Overmatige adipositas is een belangrijke risicofactor voor hart- en vaatziekten, kanker, diabetes type 2 en stemmingsgerelateerde stoornissen, waarbij zwaarlijvige personen vaak last hebben van sociale stigmatisering ([Bean et al., 2008], [Centers for Disease Control and Prevention, 2009] en [Luppino et al., 2010]). Volgens het Center for Disease Control (CDC) bedroegen de aan obesitas gerelateerde gezondheidszorguitgaven in de Verenigde Staten tussen 1998 en 2000 ongeveer $ 213 miljard. Verder kunnen jaarlijks 300,000 sterfgevallen in de Verenigde Staten worden toegeschreven aan ziekten die verband houden met overgewicht en obesitas (Allison et al., 1999), waarbij obesitas de tweede belangrijkste doodsoorzaak is na tabaksgebruik. Desalniettemin blijft de prevalentie van obesitas in westerse samenlevingen dramatisch toenemen, waarbij de huidige schattingen suggereren dat meer dan 30% van de volwassenen in de Verenigde Staten zwaarlijvig is (Flegal et al., 2010).
De meeste conceptualisaties van voedingsregulatie suggereren dat twee parallelle systemen op elkaar inwerken om de voedselinname te beïnvloeden ([Hommel et al., 2006], [Lutter en Nestler, 2009] en [Morton et al., 2006]). Het homeostatische systeem omvat hormonale regulatoren van honger, verzadiging en vetniveaus, zoals leptine, ghreline en insuline, die werken op hypothalamische en hersenstamcircuits om voeding te stimuleren of te remmen om de juiste energiebalans te handhaven. Dysfunctie in componenten van het homeostatische systeem, zoals aangeboren leptinedeficiëntie, kan leiden tot een aanhoudende toestand van positieve energiebalans en de ontwikkeling van obesitas ([Campfield et al., 1995], [Halaas et al., 1995] en [Pelleymounter et al., 1995]). De mechanismen waardoor hormonale regulatoren van honger en verzadiging werken op hypothalamische en hersenstamcircuits om homeostase van energie in stand te houden, zijn elders in detail beschreven en lezers die geïnteresseerd zijn in dit onderwerp worden verwezen naar de vele uitstekende recensies over dit onderwerp (bijvoorbeeld [Abizaid et al., 2006a] en [Gao en Horvath, 2007]).
Naast metabole systemen spelen ook hersenbeloningssystemen een belangrijke rol bij voedingsgedrag ([Lutter en Nestler, 2009] en [Saper et al., 2002]). Over het algemeen worden smakeloos smakende voedingsmiddelen niet teveel gegeten, terwijl smakelijke voedingsmiddelen vaak worden geconsumeerd, zelfs nadat aan de energiebehoefte is voldaan. Gemakkelijke toegang tot smakelijk, energierijk voedsel wordt beschouwd als een belangrijke milieurisicofactor voor obesitas (Volkow en Wise, 2005), en overconsumptie van smakelijk voedsel wordt beschouwd als een belangrijke factor die bijdraagt aan de recente toename van obesitas ([Finkelstein et al., 2005], [Hill et al., 2003] en [Swinburn et al., 2009]). Het verkrijgen van de plezierige effecten van smakelijk voedsel is inderdaad een krachtige motiverende kracht die bij bepaalde individuen homeostatische signalen kan negeren ([Shomaker et al., 2010], [Sunday et al., 1983] en [Zheng et al., 2009]) . Als ze een keuze krijgen, geven ratten er in overweldigende mate de voorkeur aan om een calorievrije sacharine-oplossing te consumeren in plaats van zichzelf intraveneuze infusies van cocaïne toe te dienen (Lenoir et al., 2007). Bovendien zullen goedgevoede ratten zichzelf vrijwillig blootstellen aan extreme kou (-15 ° C), schadelijke hittepijn of aversieve footshock om smakelijke etenswaren te verkrijgen, zoals zandgebak, vleespastei, pindakaas, Coca-Cola, M & M-snoepjes, chocolade chips, of yoghurtdruppels, zelfs als minder smakelijk standaardvoer vrij verkrijgbaar is ([Cabanac en Johnson, 1983], [Foo en Mason, 2005] en [Oswald et al., 2010]). Deze bevindingen laten zien hoe intens macronutriënten in smakelijk voedsel hersenbeloningssystemen kunnen stimuleren, onafhankelijk van hun calorische waarde ([Wang et al., 2004a] en [Wang et al., 2004b]) en hoe hoog de motivatie om smakelijk voedsel te consumeren kan zijn. zelfs als er geen homeostatische energiebehoefte is. Misbruikbare drugs, zoals cocaïne of nicotine, kunnen op dezelfde manier een hoog consumptiegedrag veroorzaken, ook al hebben ze geen calorie- of voedingswaarde. Vanwege de vele overeenkomsten tussen te veel eten bij obesitas en overmatig drugsgebruik bij verslaving (Volkow en Wise, 2005), is er zelfs aangevoerd dat obesitas moet worden beschouwd als een hersenaandoening en als diagnostische categorie moet worden opgenomen in de komende vijfde editie. van de Diagnostic and Statistical Manual of Mental Disorders (DSM-V) ([Devlin, 2007] en [Volkow en O'Brien, 2007]). Vergeleken met homeostatische mechanismen van voedingsgedrag is er veel minder bekend over hoe hedonische systemen de voedselopname precies beïnvloeden. Evenzo blijft de invloed van intrinsieke of door voeding veroorzaakte veranderingen op het reactievermogen van hersenbeloningssystemen, en hoe deze effecten bijdragen aan overeten en obesitas, onduidelijk. Hieronder worden recente gegevens samengevat die de vooruitgang benadrukken in ons begrip van hedonische mechanismen van eten en dieet-geïnduceerde veranderingen in hersenbeloningsactiviteit die kunnen bijdragen aan de ontwikkeling van obesitas
Activering van Brain Reward-systemen in reactie op smakelijk voedsel: interacties met hormonale regulatoren van energiebalans
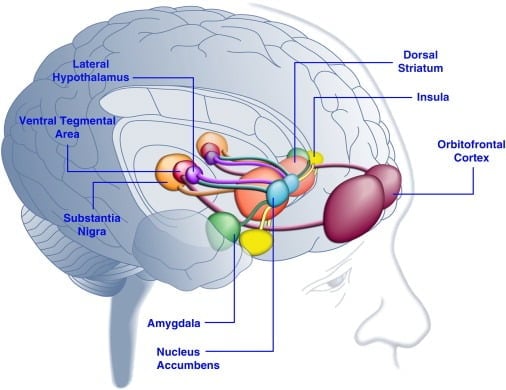
Consumptie van smakelijk voedsel kan de stemming bij de mens verbeteren ([Dallman et al., 2003] en [Macht en Mueller, 2007]) en de oprichting van een geconditioneerde plaatsvoorkeur bij proefdieren ondersteunen ([Imaizumi et al., 2001] en [ Sclafani et al., 1998]). Deze effecten houden waarschijnlijk verband met de stimulering van beloningssystemen voor de hersenen door smakelijk voedsel (figuur 1). Immers, studies van menselijke hersenen hebben aangetoond dat voedsel en voedselgerelateerde visuele of olfactorische signalen corticolimbische en meso accumbens hersencircuits kunnen activeren die betrokken zijn bij beloning, met name de orbitofrontale cortex (OFC), insula, amygdala, hypothalamus, striatum en middenhersenen inclusief het ventrale tegmentale gebied (VTA) en substantia nigra (SN) ([Bragulat et al., 2010], [Pelchat et al., 2004], [Schur et al., 2009] en [Simmons et al., 2005] ). De striatum-, insula-, anterior cingulate cortex- en middenhersenstructuren coderen voor de subjectieve waarde van beloningen, ongeacht hun type (bijvoorbeeld voedsel, seks, geldbeloningen), consistent met een rol voor dit neuronale netwerk in algemene hedonische representatie (Sescousse et al. , 2010). Daarentegen lijkt de OFC een bijzonder prominente rol te spelen in representaties met betrekking tot de waarde van specifieke soorten beloningen, waaronder smakelijk voedsel ([Man et al., 2009], [Rolls, 2008] en [Sescousse et al., 2010] ). Honger kan smakelijke voedselgeïnduceerde activering van corticolimbische en middenhersenengebieden bij mensen verbeteren (LaBar et al., 2001). De intensiteit van activering van het ventrale striatum, amygdala, insula en OFC als reactie op smakelijk voedsel met veel calorieën was veel groter wanneer mensen honger hadden in plaats van goed gevoed (Goldstone et al., 2009). Dit komt overeen met het feit dat periodes van honger en dieet een toename van zelfgerapporteerde beoordelingen van de "kracht" van smakelijk voedsel en het verlangen naar "verleidelijk" voedsel ([Hofmann et al., 2010] en [Rolls et al., 1983] ). Omgekeerd kan overvoeding de neuronale reacties op smakelijk voedsel verminderen, met name in de insulaire cortex en hypothalamus (Cornier et al., 2009). Daarom wordt de hedonische waarde van voedsel beïnvloed door de metabole toestand, wat suggereert dat regulatoren van het metabolisme zoals leptine en ghreline de activiteit van hedonische systemen in de hersenen kunnen beïnvloeden. In overeenstemming met deze visie, menselijke proefpersonen behandeld met leptine of het van de darm afgeleide postprandiale factorpeptide YY3-36 (PYY) ([Batterham et al., 2007] en [Farooqi et al., 2007]), of diegenen die maagzwelling ondergingen het nabootsen van maaltijdinname (Wang et al., 2008), had verminderde activiteit in beloningsgerelateerde hersengebieden. Omgekeerd vertonen hyperfagische menselijke patiënten met aangeboren leptinedeficiëntie verhoogde activiteit in de insulaire cortex en striatum in reactie op beelden van voedsel ([Baicy et al., 2007] en [Farooqi et al., 2007]). Bij deze personen verzwakte leptinevervangingstherapie de verbeterde insulaire en striatale activiteit en verminderde zelfgerapporteerde voorkeur voor voedsel ([Baicy et al., 2007] en [Farooqi et al., 2007]). Leptine-behandeling blokkeert ook de lonende eigenschappen van sucrose in voedselbeperkte ratten vergelijkbaar met de dopamine-receptorantagonist α-flupenthixol (Figlewicz et al., 2001). Bovendien worden leptinereceptoren tot expressie gebracht op dopamine-neuronen in de middenhersenen in de VTA en SN (Figlewicz et al., 2003), wat suggereert dat leptine hedonische aspecten van voedingsgedrag kan beïnvloeden door modulatie van mesostriatale dopamine-transmissie. Bevestiging van deze mogelijkheid remde leptine-infusies in de VTA de activiteit van dopamine-neuronen en verminderde voedselinname bij ratten (Hommel et al., 2006; zie ook Krügel et al., 2003). Omgekeerd verhoogde knockdown van leptinereceptoren in de VTA de voedselinname, verbeterde motorische activiteit en verhoogde voorkeur voor smakelijk voedsel bij ratten (Hommel et al., 2006). Leptine heeft daarom een remmende invloed op de dopaminetransmissie van mesoaccumbens, een neurotransmittersysteem dat sterk betrokken is geweest bij beloning en motivatie, maar minder bij energiehomeostase ([de Araujo et al., 2010] en [Vucetic en Reyes, 2010]). Meer recent is aangetoond dat het hongergerelateerde hormoon ghrelin ([Kojima et al., 1999] en [Nakazato et al., 2001]) de activering van hedonische systemen in de hersenen versterkt als reactie op voedselsignalen (Malik et al. , 2008). In het bijzonder verhoogde ghreline de activering van OFC, amygdala, insula, striatum, VTA en SN in reactie op foto's van zeer smakelijk voedsel bij zwaarlijvige individuen (Malik et al., 2008). Bij ratten oefent ghreline een stimulerend effect uit op dopamine-systemen in de middenhersenen ([Abizaid et al., 2006b], [Jerlhag et al., 2006] en [Jerlhag et al., 2007]) en verhoogt de lonende waarde van smakelijk voedsel (Perello et al., 2010).
Figuur 1. Gebieden van het menselijk brein die worden geactiveerd als reactie op smakelijke voeding of voedselgerelateerde aanwijzingen. Aangenomen wordt dat de orbitofrontale cortex en amygdala informatie coderen met betrekking tot de beloningswaarde van voedsel ([Baxter en Murray, 2002], [Holland en Gallagher, 2004], [Kringelbach et al., 2003], [O'Doherty et al. , 2002] en [Rolls, 2010]). De insula verwerkt informatie met betrekking tot de smaak van voedsel en de hedonistische waardering ervan ([Balleine en Dickinson, 2000] en [Small, 2010]). De nucleus accumbens en het dorsale striatum, die dopaminerge input ontvangen van het ventrale tegmentale gebied en substantia nigra, reguleren de motiverende en stimulerende eigenschappen van voedsel ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi et al., 2007], [Malik et al., 2008] en [Söderpalm en Berridge, 2000]). De laterale hypothalamus kan lonende reacties op smakelijk voedsel reguleren en voedselzoekgedrag stimuleren (Kelley et al., 1996). Deze hersenstructuren werken op een gecoördineerde manier om het leren over de hedonische eigenschappen van voedsel te reguleren, de aandacht en inspanning te verleggen naar het verkrijgen van voedselbeloningen en het reguleren van de stimuleringswaarde van omgevingsstimuli die de beschikbaarheid van voedselbeloningen voorspellen (Dagher, 2009). Voor de duidelijkheid zijn niet alle onderlinge verbindingen tussen deze structuren weergegeven.
Soortgelijke hersengebieden worden geactiveerd door smakelijk voedsel in de hersenen van ratten als die geactiveerd bij mensen, zoals gemeten door expressie van onmiddellijke vroege genen (IEG) zoals c-fos, arc of zif268. Smakelijk voedsel activeert inderdaad het dorsale en ventrale striatum, VTA, laterale hypothalamus (LH) en centrale en basolaterale kernen van de amygdala en beloningsgerelateerde corticale structuren in ratten ([Angeles-Castellanos et al., 2007], [Park en Carr, 1998] en [Schiltz et al., 2007]). Interessant is dat FOS-immunoreactiviteit in ratten daadwerkelijk afnam in de laterale en mediale habenula bij ratten na smakelijke voedselconsumptie (LHb) (Park en Carr, 1998). Bij niet-menselijke primaten wordt het LHb geactiveerd door aversieve stimuli of weglaten van verwachte beloningen en geremd door de afgifte van een smakelijke sapbeloning (Matsumoto en Hikosaka, 2007). Bovendien remt LHb-activiteit beloningsgerelateerde dopamine-bevattende mesoaccumbens neuronen via een indirecte route waarbij de rostromediale tegmentale nucleus (RMTg) betrokken is (Jhou et al., 2009). Habenulaire activiteit is daarom omgekeerd evenredig met voedsel-hedonics, wat suggereert dat het habenulaire complex niet-homeostatisch eten kan beïnvloeden. Inderdaad is recent aangetoond dat activering van het LHb het sucrose-verbruik bij ratten verlaagt, terwijl laesies van LHb het zoekgedrag naar sucrose verhogen (Friedman et al., 2011). Gezien het feit dat het habenulaire complex klein en uitdagend is om te identificeren en functioneel in te beelden bij mensen (Salas et al., 2010), kan dit verklaren waarom veranderingen in habenulaire activiteit niet zijn gemeld in menselijke beeldvormende onderzoeken in reactie op smakelijk voedsel.
Hersencircuits die hedonaal eten reguleren: Midbrain Dopamine Systems
De dopamine-route van mesoaccumbens wordt geactiveerd bij mensen en laboratoriumdieren als reactie op smakelijk voedsel of eetlustopwekkende voedselgerelateerde signalen en leptine, ghreline en andere regulatoren van eetlust beïnvloeden de activiteit in dit systeem. Dit suggereert dat dopaminesystemen van de middenhersenen een belangrijke rol spelen bij smakelijke voedselconsumptie. Misschien wel de duidelijkste aanwijzing dat dopamine-overdracht in de middenhersenen de smakelijke voedselopname bij mensen beïnvloedt, is het feit dat patiënten met de ziekte van Parkinson (PD), waarbij er degeneratie is van dopamine-bevattende neuronen in de middenhersenen, de neiging hebben om minder voedsel te consumeren dan niet-getroffen personen (Nirenberg en Waters, 2006). Bovendien kan behandeling van PD-patiënten met dopaminereceptoragonisten een dwangmatige consumptie van smakelijk voedsel teweegbrengen ([Dagher en Robbins, 2009] en [Nirenberg en Waters, 2006]). In feite kunnen dopaminereceptoragonisten hedonische overeten induceren, zelfs bij niet-PD-individuen (Cornelius et al., 2010). Bij dieren stimuleren smakelijke sucroseoplossingen de overdracht van dopamine in het NAc (Hernandez en Hoebel, 1988), een effect dat consistent is met beeldvormingsstudies van de menselijke hersenen (Small et al., 2003). Met behulp van cyclische voltammetrie met snelle scan werd aangetoond dat aanwijzingen die de afgifte van een sucrose-beloning of de onverwachte afgifte van sucrose voorspelden, dopamine-overdracht opwekten in NAc ([Roitman et al., 2004] en [Roitman et al., 2008]). Verder had de onverwachte afgifte van schadelijke kinine-oplossingen het tegenovergestelde effect, waardoor de accumulatie van dopamine-overdracht afnam (Roitman et al., 2008). Ten slotte vertonen muizen waarin het enzym tyrosinehydroxylase (TH) is geïnactiveerd, waardoor ze dopamine-deficiënt zijn, nog steeds een duidelijke voorkeur voor sucrose (of sacharine) -oplossingen in vergelijking met water, maar verbruiken ze minder totale hoeveelheden van de sucrose dan controlemuizen ( Cannon en Palmiter, 2003). Dit suggereert dat dopamine-deficiënte muizen nog steeds de smakelijkheid van sucrose kunnen detecteren en deze oplossingen prefereren boven water, maar niet in staat zijn om consumptie van smakelijke oplossingen te ondersteunen. Daarom is voorgesteld dat mesoaccumbens dopamine-overdracht motiverende aspecten van voedingsgedrag reguleert die betrokken zijn bij het verkrijgen van voedsel en dat andere neurotransmittersystemen waarschijnlijk hedonische aspecten van smakelijke voedselconsumptie reguleren.
Hersencircuits die hedonaal eten reguleren: Striatohypothalamic-systemen
Infusie van μ-opioïde receptoragonisten zoals [D-Ala2-N-Me-Phe4-gly-ol5] -enkephalin (DAMGO) in de NAc stimuleert het voedingsgedrag bij ratten met ad libitum toegang tot voedsel (dwz niet-homeostatische voeding) ( [Peciña en Berridge, 2005] en [Zhang et al., 1998]). Omgekeerd verminderen opioïdereceptorantagonisten die in de NAc zijn geïnfuseerd de consumptie van voorkeursvoedsel zonder de inname van minder smakelijke alternatieven te beïnvloeden (Kelley et al., 1996). Deze gegevens komen overeen met de opvatting dat striatale opioïdesystemen de hedonische eigenschappen van smakelijk voedsel reguleren. Het schaalgebied van het NAc en in het bijzonder hedonische "hotspots" in het rostrodorsale gebied van de mediale schaal ([Peciña en Berridge, 2005] en [Peciña et al., 2006b]) speelt een bijzonder belangrijke rol bij niet-homeostatische voeding. Omdat activering van de μ-opioïde receptor resulteert in de remming van medium doornige neuronactiviteit in de NAc, is voorgesteld dat de NAc-schaal een tonische remmende invloed uitoefent op de smakelijke voedselconsumptie (Kelley et al., 2005). In overeenstemming met deze visie, stimulatie van remmende GABAA- of GABAB-receptoren ([Basso en Kelley, 1999] en [Stratford en Kelley, 1997]) of blokkade van exciterende ionotrope glutamaatreceptoren (Maldonado-Irizarry et al., 1995) in de NAc-schaal verhoogt de voedselconsumptie. Evenzo verhoogt excitotoxische laesie van de NAc-schaal ook de voedselconsumptie en verhoogt de gevoeligheid voor voedselbeloning ([Johnson et al., 1996] en [Maldonado-Irizarry en Kelley, 1995]). In het bijzonder wordt de consumptie van energierijk smakelijk voedsel bij voorkeur veroorzaakt door deze manipulaties ([Basso en Kelley, 1999], [Kelley et al., 2005] en [Zhang et al., 1998]).
Gezien de grote invloed van accumulaire signalen op hedonische voeding, gebruikten Thompson en Swanson (2010) een procedure voor het volgen van circuits om nauwkeurig de precieze anatomische netwerken te identificeren waardoor de NAc de smakelijke voedselconsumptie kan beïnvloeden. In deze elegante onderzoeken ontvingen ratten twee niet-overlappende injecties van anterograde / retrograde tracers (COIN's genoemd) in plaatsen van de NAc-schaal die de smakelijke voedselconsumptie sterk beïnvloeden, en afferente / efferente verbindingen werden geïdentificeerd. Er werd aangetoond dat voedingsgerelateerde plaatsen in het NAc remmende projecties voornamelijk uitstrekken tot de voorste LH en ventrale pallidum (VP) (Thompson en Swanson, 2010). In tegenstelling tot de rest van de NAc, die dicht op de VTA uitsteekt, projecteren voedselgerelateerde hedonische hotspots in NAc-schaal naar de interfasciculaire kern (IFN), een structuur die zich naast de VTA bevindt en die dopaminerge projecties op een wederkerige manier terug naar de NAc-schaal (Thompson en Swanson, 2010). Verder projecteert de voorste LH naar de LHb (Thompson en Swanson, 2010), hetgeen opnieuw suggereert dat het habenulaire complex een rol kan spelen in voedsel hedonics (Friedman et al., 2011).
Bovenstaande gegevens tonen aan dat de LH prominente remmende input ontvangt van plaatsen in NAc die een tonische remmende invloed uitoefenen op smakelijke voedselconsumptie. De LH heeft ook functionele connectiviteit met andere corticale en limbische hersensites die betrokken zijn bij het organiseren en sturen van gedrag naar het verkrijgen van smakelijk voedsel (figuur 1), zoals de OFC, insula en amygdala. Belangrijk is dat inactivering van de LH de stimulerende effecten van NAc-manipulaties op voedselinname opheft ([Maldonado-Irizarry et al., 1995] en [Will et al., 2003]). Verder verhoogt inactivering van de NAc-schaal de activiteit van de LH, met name LH-neuronen die de neuropeptide hypocretine (ook bekend als orexin) synthetiseren, zoals gemeten door Fos-immunoreactiviteit ([Baldo et al., 2004] en [Stratford en Kelley, 1999 ]). Inderdaad, infusie van de μ-opioïde receptoragonist DAMGO in de NAc-schaal activeert hypocretine-bevattende neuronen in de hypothalamus (Zheng et al., 2007), en verstoring van hypocretine-overdracht in VTA schaft smakelijke voedselinname veroorzaakt door intra-NAc DAMGO-infusies af (Zheng et al., 2007). Aldus oefenen hedonische hot spots in de NAc-schaal een tonische remmende invloed uit op LH-neuronen, en in het bijzonder hypocretine-bevattende neuronen (Louis et al., 2010), waardoor de consumptie van smakelijk voedsel wordt beperkt. Verstoring van dit verzamelde "stopsignaal", bijvoorbeeld door verbeterde opioïdereceptorsignalering, resulteert in verbeterde LH-activiteit die niet-homeostatische consumptie van smakelijk voedsel stimuleert (Figuur 2).
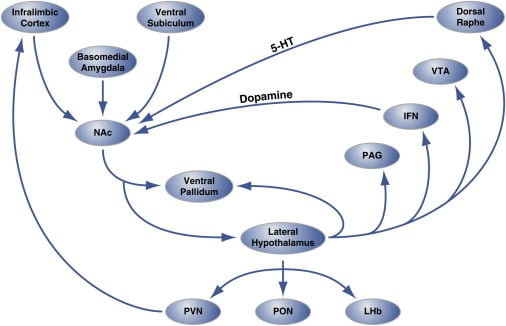
Figuur 2. Organisatie op circuitniveau van hedonische 'hotspots' in Nucleus Accumbens Shell die hedonaal eten reguleren
Het shell-gebied van de nucleus accumbens (NAc) ontvangt innervatie van corticale en limbische hersensites en projecten naar de laterale hypothalamus en ventrale pallidum. Op zijn beurt projecteert de laterale hypothalamus ook naar het ventrale pallidum en ook naar de PAG, IFN, VTA en dorsale raphe-kern. De IFN en dorsale raphe verlengen respectievelijk dopaminerge en serotonerge projecties terug naar de NAc. De laterale hypothalamus innerveert ook thalamische (PVN en PON) en epithalamische (LHb) structuren. Niet getoond zijn de kleine projecties van de laterale hypothalamus naar septale hersengebieden. 5-HT, serotonine; IFN, interfasciculaire kern; LHb, laterale habenula; PON, pre-optische kern; PVN, paraventriculaire kern van de thalamus; VTA, ventrale tegmentale gebied. Figuur is aangepast met toestemming van Thompson en Swanson (2010).
Hersencircuits die hedonaal eten reguleren: striatopallidale systemen
Naast de LH projecteren NAc shell neuronen ook naar de VP (figuur 2). In een interessante serie experimenten werd aangetoond dat accumulaire projecties op de VP en LH dissocieerbare aspecten van niet-homeostatisch eten kunnen reguleren (Smith and Berridge, 2007). DAMGO-infusies in de NAc-schaal of de VP verhoogden de orofaciale reacties op sucrose-oplossingen waarvan werd verondersteld dat ze reacties "sympathieën" bij ratten weerspiegelen (dwz smakelijkheidsrespons) en ook verhoogde voedselconsumptie (Smith en Berridge, 2007). Infusies van naloxon in NAc of VP verminderden reacties van sucrose op het gezicht op sucrose, wat suggereert dat gesynchroniseerde opioïdeoverdracht in NAc en VP noodzakelijk is om informatie-gerelateerde voedsel smakelijkheid te verwerken. Naloxon toegediend in de NAc, maar niet de VP, verminderde echter het niet-homeostatisch eten (Smith en Berridge, 2007), wat suggereert dat niet-homeostatisch eten plaatsvindt onafhankelijk van deze NAc → VP-connectiviteit en in plaats daarvan waarschijnlijk vertrouwt op de NAc → LH-route ([Smith en Berridge, 2007] en [Taha et al., 2009]). Consistent met het idee dat aspecten van niet-homeostatisch eten kunnen worden gedissocieerd, hebben opnames van één eenheid aangetoond dat een populatie van NAc-neuronen selectief lijkt te coderen voor informatie met betrekking tot de relatieve versterkende eigenschappen van voedsel (dwz smakelijkheid) (Taha en Fields, 2005) . Bij dezelfde ratten bleken veranderingen in de activiteit van een tweede populatie NAc-neuronen samen te vallen met de initiatie van voedingsgedrag (Taha and Fields, 2005).
Hersencircuits die hedonaal eten reguleren: Amygdalar-systemen
Verder ondersteunend het idee dat aspecten van niet-homeostatisch eten dissocieerbaar zijn, naloxoninfusies in de NAc-shell of VP, maar niet de basolaterale amygdala (BLA), verminderde de smakelijkheid van sucrose-oplossingen (Wassum et al., 2009). Toen echter de μ-opioïdereceptorantagonisten naloxon of CTOP werden geïnfuseerd in de BLA, maar niet NAc-schaal of VP, was er een duidelijke verzwakking van de verhoogde motivatie om te reageren op sucrose-oplossingen die doorgaans worden gezien in een hongerige toestand ([Wassum et al. ., 2011] en [Wassum et al., 2009]). Dit suggereert dat de stimulerende eigenschappen van sucrose worden gereguleerd door amygdalaire circuits. Over het algemeen laten de bovenstaande bevindingen zien dat verschillende aspecten van hedonaal eten, zoals het verwerken van informatie met betrekking tot de smakelijkheid van voedsel, naderingsgedrag en toename van de stimulerende waarde van smakelijk voedsel bij hongerige dieren, differentieel worden gereguleerd door afzonderlijke microschakelingen in de context van een grotere corticolimbische-striatopallidale-hypothalamische-thalamocorticale circuits (figuur 2).
Doen aanpassingen in Brain Hedonic Circuitries dwangmatig eten aan?
Kelley et al. Hebben de functionele relevantie van hedonische hotspots in de NAc-schaal en hun invloed op bredere voedingsgerelateerde circuits in de hersenen overwogen. (2005). Ze veronderstellen dat de NAc shell → LH-route, samen met stroomopwaartse en stroomafwaartse regulerende hersengebieden (figuur 2), een "schildwacht" -doel dienen (Kelley et al., 2005). In het bijzonder stellen zij voor dat zelfs bij hongerige dieren wanneer de drang om te eten sterk is, het vermogen om het voedingsgedrag te stoppen moet worden behouden in geval van bedreigingen van de omgeving (Kelley et al., 2005). Als zodanig kan activering van NAc-schaalneuronen en gelijktijdige remming van LH-neuronen de lopende voeding verstoren en het schakelen van gedrag naar geschiktere adaptieve responsen, zoals bevriezen of ontsnappen, vergemakkelijken (Kelley et al., 2005). Als dit inderdaad het geval is, is het belangrijk om te onderzoeken of deze NAc-shell → LH-controletraject wordt aangetast door overconsumptie van smakelijk voedsel of door genetische factoren die de kwetsbaarheid voor obesitas beïnvloeden. Met dit in gedachten hebben ons laboratorium en anderen onlangs gemeld dat overconsumptie van smakelijk, calorierijk voedsel wordt geassocieerd met de opkomst van dwangmatig voedingsgedrag bij ratten ([Johnson en Kenny, 2010], [Latagliata et al., 2010] en [Oswald et al., 2010]). Specifiek vonden we dat smakelijke voedselconsumptie bij zwaarlijvige ratten resistent was tegen verstoring door een aversieve geconditioneerde stimulus die een negatieve uitkomst voorspelde (elektrische voetschok) (Johnson en Kenny, 2010). Het is dus belangrijk om te testen of tekorten in de NAc-schaal → LH-controletraject veroorzaakt door te veel eten, ten minste gedeeltelijk bijdragen aan het opvallende falen van overgewicht en obese individuen om informatie te gebruiken over de schadelijke gevolgen van hun consumptiegedrag om hun voedselinname te matigen .
Veranderde hersenbeloningsactiviteit bij obesitas: onderzoeken naar menselijke hersens
Het verkrijgen van de stimulerende effecten van smakelijk voedsel op beloningssystemen voor de hersenen wordt beschouwd als een belangrijke motiverende factor die bijdraagt aan te veel eten. Een belangrijke vraag is dus of veranderingen in de beloningsfunctie van de hersenen kunnen bijdragen aan de ontwikkeling van obesitas. Een intuïtieve voorspelling is dat een verbeterde constitutieve responsiviteit van hersenbeloningssystemen op smakelijk voedsel zou resulteren in overeten en gewichtstoename. In overeenstemming met deze hypothese vertonen personen met hoge niveaus van gevoeligheid voor beloning van eigenschappen verhoogde activiteit in hersengebieden die betrokken zijn bij voedselbeloning, inclusief de NAc, amygdala, OFC en VP, bij blootstelling aan smakelijk voedsel zoals chocoladetaart en pizza (Beaver et al. , 2006). Zwaarlijvige individuen tonen op vergelijkbare wijze verhoogde activering van beloningscircuits voor de hersenen in reactie op smakelijk voedsel of voedselgerelateerde signalen vergeleken met magere controles ([Gautier et al., 2000], [Karhunen et al., 1997] en [Rothemund et al., 2007 ]). Hoge niveaus van gevoeligheid voor beloning waren ook gecorreleerd met toegenomen lichaamsgewicht bij menselijke proefpersonen ([Davis et al., 2004] en [Franken en Muris, 2005]). Belangrijk is echter dat zwaarlijvige vrouwen (BMI> 30) hogere niveaus van anhedonie hadden (dwz verminderde baseline gevoeligheid voor beloning) dan vrouwen met overgewicht (BMI> 25 <30) (Davis et al., 2004). Evenzo hebben Stice en collega's (2008b) aangetoond dat zwaarlijvige adolescente meisjes een verhoogde activering van de insula en andere corticale hersengebieden hadden als reactie op smakelijk voedsel of voedsel-geassocieerde signalen vergeleken met magere controlepersonen, maar die activering van het caudate gebied van de striatum als reactie op het smakelijke voedsel was omgekeerd omgekeerd gecorreleerd met BMI bij de zwaarlijvige proefpersonen. Bovendien hadden vrouwen die gedurende een periode van 6 in gewicht aankwamen een duidelijke afname in striatale activiteit als reactie op smakelijk voedsel gedurende deze periode in vergelijking met vrouwen die niet aankwamen (Stice et al., 2010a). Alles bij elkaar genomen, lijkt het erop dat overgevoeligheid van beloningscircuits een individu vatbaar kan maken voor overeten en gewichtstoename (Stice et al., 2010b). Naarmate gewichtstoename toeneemt, kunnen echter tekorten in de activiteit van specifieke componenten van het hersenbeloningssysteem, met name het striatum, ontstaan. Er is voorgesteld dat de opkomst van deze staat van beloningshyposensitiviteit de overconsumptie van smakelijk voedsel kan bestendigen om dergelijke beloningsgebreken te overwinnen ([Stice et al., 2008a] en [Wang et al., 2002]). Daarom lijkt te weinig of te veel voedselbeloning de kwetsbaarheid voor te veel eten en obesitas te vergroten (Stoeckel, 2010). Een aantrekkelijk conceptueel kader voor het combineren van deze schijnbaar tegengestelde standpunten is dat corticolimbische gebieden die betrokken zijn bij het organiseren van gedrag om voedselbeloningen te verkrijgen en voorspellingen doen over verwachte toekomstige voedselbeloningen hyperactief kunnen worden bij personen met overgewicht en mensen met aanleg voor obesitas. Omgekeerd kunnen striatale hersensites die de daadwerkelijke plezierbeleving van hedonisch eten verwerken, geleidelijk minder functioneel worden bij dezelfde individuen. Daarom wordt verwacht dat de relatieve motivatiewaarde van smakelijk voedsel toeneemt tijdens de ontwikkeling van obesitas, terwijl de hedonische waarde die wordt verkregen door het nuttigen van smakelijk voedsel afneemt.
Veranderde hersenbeloningsactiviteit bij obesitas: knaagdierstudies
De effecten van smakelijke voedselconsumptie op hersensbeloningssystemen zijn rechtstreeks bij proefdieren vastgesteld met behulp van de hersenstimulatie-beloningsprocedure (BSR). Het is bekend dat elektrische stimulatie van de LH, die tonische remmende input ontvangt van accumulaire hedonische hotspots (figuur 2), zeer de moeite waard is en ratten zullen hard werken om dit hersengebied zelf te stimuleren, bijv. (Markou en Frank, 1987 ). Naast het ondersteunen van zelfstimulatiegedrag, kan elektrische stimulatie van LH ook intense periodes van voedingsgedrag veroorzaken (Margules and Olds, 1962), en er is voorgesteld dat de lonende eigenschappen van LH-stimulatie verband kunnen houden met de intrinsieke rol hiervan hersenplaats in de smakelijke en stimulerende eigenschappen van voedsel (Margules and Olds, 1962). In overeenstemming met deze visie verhogen honger en gewichtsverlies de gevoeligheid van ratten voor de lonende waarde LH zelfstimulatie ([Blundell en Herberg, 1968], [Carr en Simon, 1984] en [Margules en Olds, 1962]), een effect die kan worden geblokkeerd door intracerebroventriculaire infusie van leptine (Fulton et al., 2000). Omgekeerd wordt elektrische zelfstimulatie van de LH geremd bij verzadigde dieren (Wilkinson en Peele, 1962). Overvoeding van ratten via de intragastrische voedingssonde (Hoebel en Teitelbaum, 1962), maagzwelling of intraveneuze glucagoninfusie die postprandiale verzadiging nabootst ([Hoebel, 1969], [Hoebel en Balagura, 1967] en [Mount and Hoebel, 1967] ), alle verzwakken reageren voor LH-stimulatie. In feite zullen ratten die eerder krachtig reageerden op het belonen van LH-stimulatie reageren alsof deze stimulatie aversief was na voedselinname of de ontwikkeling van obesitas (Hoebel en Thompson, 1969). Daarom verbetert chronische voedselbeperking en gewichtsverlies, terwijl overvoeding de gevoeligheid van beloningsgerelateerde sites in de LH vermindert. De gevoeligheid van LH-neuronen voor het belonen van elektrische zelfstimulatie kan daarom belangrijke inzichten verschaffen in het functioneren van hersencircuits die hedonische reacties op voedsel reguleren.
Omdat gemakkelijke toegang tot energievriendelijk smakelijk voedsel en bijgevolg overconsumptie wordt beschouwd als een belangrijke omgevingsfactor die bijdraagt aan obesitas (Volkow en Wise, 2005), heeft ons laboratorium onlangs de BSR-procedure gebruikt om hersenbeloningsactiviteit bij ratten met uitgebreide toegang tot smakelijk voedsel te beoordelen. . In het bijzonder hebben we respons geregistreerd voor elektrische stimulatie van de LH bij ratten die ad libitum toegang hadden tot voedingsvoer alleen of voer in combinatie met 18 – 23 dagelijkse toegang tot een smakelijk dieet. Dit dieet bestond uit cheesecake, spek, worst en andere smakelijke etenswaren (Johnson and Kenny, 2010). We ontdekten dat ratten met uitgebreide toegang tot het smakelijke voedsel snel een aanzienlijke hoeveelheid gewicht bereikten en een progressief verslechterend hersenbeloningsdeficiëntie vertoonden (weerspiegeld als een verminderde respons op het belonen van LH-stimulatie) (Johnson en Kenny, 2010; figuur 3). Dit suggereert dat de ontwikkeling van door voedsel geïnduceerde obesitas wordt geassocieerd met een geleidelijke afname van de responsiviteit van beloningssites in de LH (Johnson and Kenny, 2010). Tekorten in beloningssignalering zijn ook gemeld bij volwassen ratten die voorheen onbeperkte toegang hadden tot sucrose of vetrijk voedsel tijdens de adolescentie ([Teegarden et al., 2009], [Vendruscolo et al., 2010a] en [Vendruscolo et al., 2010b]). Deze effecten bij ratten doen denken aan de verminderde striatale activering als reactie op de hierboven beschreven voedselbeloning bij menselijke proefpersonen naarmate ze over een 6-maandperiode aankwamen (Stice et al., 2010a; zie figuur 4). Zulke dieet-geïnduceerde beloningstekorten bij ratten met overgewicht, en misschien bij mensen die aankomen, weerspiegelen waarschijnlijk een contra-adaptieve reactie in voedselbeloningscircuits om zich te verzetten tegen hun overstimulatie door smakelijk voedsel (Johnson en Kenny, 2010). Een belangrijk aspect van deze bevinding is dat vergelijkbare tekorten in beloningsfunctie ook worden gedetecteerd bij ratten die cocaïne of heroïne overconsumeren ([Ahmed et al., 2002], [Kenny et al., 2006] en [Markou en Koob, 1991]; Figuur 3). Er is zelfs een hypothese dat door drugs geïnduceerde beloningsdisfunctie kan bijdragen aan de overgang van gecontroleerd naar ongecontroleerd drugsgebruik door een nieuwe motivatiebron te bieden om het medicijn te consumeren om de aanhoudende staat van verminderde beloning te verlichten ([Ahmed en Koob , 2005] en [Koob en Le Moal, 2008]). Daarom is het mogelijk dat tekorten in de gevoeligheid van beloningssites in de LH die worden veroorzaakt door te veel eten, de langdurige persistentie van smakelijke voedselconsumptie bij ratten met overgewicht kunnen verhogen door de voedingsvoorkeur te verschuiven naar voedsel met een hogere hedonische impact om de aanhoudende negatieve toestand te verlichten. beloning.
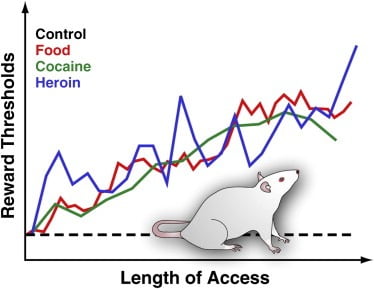
Figuur 3. Beloningsdrempels bij ratten met uitgebreide dagelijkse toegang tot smakelijk voedsel, cocaïne of heroïne
Om beloningsdrempels te meten, wordt een stimulerende elektrode chirurgisch geïmplanteerd in de laterale hypothalamus van ratten, een regio waarin elektrische stimulatie krachtig de moeite waard is en intense aanvallen van voedingsgedrag kan veroorzaken. Na herstel mogen dieren dit gebied zelf stimuleren door aan een wiel te draaien. Nadat stabiel zelfstimulatiegedrag is vastgesteld, wordt de minimale stimulatie-intensiteit bepaald die het zelfstimulatiegedrag handhaafde (dwz de beloningsdrempel). Deze beloningsdrempel biedt een operationele meting van de activiteit van het beloningssysteem. Beloningsdrempels blijven stabiel en ongewijzigd in controleratten die toegang hebben tot standaard laboratoriumvoer en die medicijnnaïef blijven. Drempels stijgen echter geleidelijk in ratten met uitgebreide dagelijkse toegang tot een energierijk smakelijk dieet bestaande uit smakelijke etenswaren (bijv. Cheesecake, spek, chocolade, etc.). Evenzo worden beloningsdrempels geleidelijk verhoogd bij ratten die dagelijkse toegang hebben tot intraveneuze infusies met cocaïne of heroïne. Verhoogde beloningsdrempel wordt geïnterpreteerd om de verminderde gevoeligheid van het hersenbeloningssysteem weer te geven. Deze effecten suggereren dat overconsumptie van smakelijk voedsel en bijbehorende gewichtstoename ernstige tekorten in de beloning van de hersenen kunnen veroorzaken, vergelijkbaar met die veroorzaakt door overmatige consumptie van verslavend medicijn
Figuur 4. Striatale plasticiteit bij obesitas Gewichtstoename wordt geassocieerd met verminderde striatale activering in reactie op smakelijk voedsel, zoals gemeten met fMRI, en lagere niveaus van striatale dopamine D2-receptor (D2R) beschikbaarheid bij mensen (zie tekst voor details).
Deficiënt dopamine D2 receptor signalering bij obesitas
Verschillende recente rapporten hebben mogelijke mechanismen onthuld waardoor beloningstekorten kunnen ontstaan als reactie op overconsumptie van smakelijk voedsel tijdens de ontwikkeling van obesitas. Zoals hierboven opgemerkt, hadden vrouwen die over een 6-maandperiode aankwamen een duidelijke afname in striatale activiteit als reactie op smakelijk voedsel gedurende deze periode vergeleken met vrouwen die niet aankwamen (Stice et al., 2010a; Figuur 4). Vastende individuen die hun favoriete maaltijd tot verzadiging mochten eten, hadden lagere niveaus van binding van de dopamine D2-receptor (D2R) antagonist raclopride in striatum (Small et al., 2003), wat suggereert dat D2R-signalering afneemt als reactie op smakelijke voedselconsumptie. Zwaarlijvige individuen hebben lagere niveaus van striatale D2R-beschikbaarheid in vergelijking met magere controles ([Barnard et al., 2009], [Stice et al., 2008a] en [Wang et al., 2001]; Figuur 4), terwijl gewichtsverlies bij zwaarlijvige patiënten wordt geassocieerd met een verhoogde striatale D2R-dichtheid (Wang et al., 2008). Gezien het feit dat de striatale dopaminetransmissie een sleutelrol speelt bij het reguleren van hedonaal eten, zouden adaptieve dalingen in D2R-signalering kunnen bijdragen aan de verminderde responsiviteit van het striatum op smakelijk voedsel bij zwaarlijvige individuen. Om deze mogelijkheid te testen, hebben Small en collega's activiteit in hersenbeloningscircuits onderzocht in reactie op een smakelijke milkshake bij controle-individuen en degenen die het TaqIA A1-allel droegen (Felsted et al., 2010). Het polymorfisme van de TaqIA-restrictiefragmentlengte is stroomafwaarts van het D2R-gen (Neville et al., 2004), en individuen die het A1-allel van het polymorfisme dragen hebben tussen 30% –40% minder striatale D2R's vergeleken met degenen die het allel niet dragen ([Jönsson et al., 1999], [Ritchie and Noble, 2003] en [Stice et al., 2010b]). Bovendien hebben A1-alleldragers ook een verlaagd glucosemetabolisme in striatale en corticale hersengebieden die betrokken zijn bij hedonische reacties op voedsel (Jönsson et al., 1999). Individuen die het TaqIA A1-allel herbergen zijn oververtegenwoordigd in zwaarlijvige populaties ([Barnard et al., 2009], [Stice et al., 2008a] en [Wang et al., 2001]). Bovendien verhoogt het A1-allel ook de kwetsbaarheid voor alcohol, opioïde en psychomotorische stimulansverslaving ([Lawford et al., 2000], [Noble et al., 1993] en [Noble et al., 2000]). Er werd gevonden dat gebieden van de middenhersenen waarschijnlijk inclusief de VTA en SN, die dopaminergische input voor het striatum leveren, werden geactiveerd als reactie op een smakelijke milkshake bij controle-individuen (Felsted et al., 2010). Omgekeerd was de activiteit op deze hersensites juist afgenomen als reactie op voedselbeloning in de A1-alleldragers (Felsted et al., 2010). Soortgelijke omgekeerde responsen bij hersenactivatie tussen A1 allelische dragers en niet-dragers werden ook gedetecteerd in thalamische en corticale hersensites (Felsted et al., 2010). Deze gegevens zijn zeer consistent met een sleutelrol voor D2R's bij het reguleren van mesostriatale responsiviteit op smakelijk voedsel. Stice en collega's (2008a) vonden een omgekeerde correlatie tussen BMI en activering van het striatum (caudaat en putamen) in reactie op smakelijke chocolademilkshake bij menselijke patiënten. Bovendien was deze omgekeerde relatie het duidelijkst bij individuen die het TaqIA A1-allel droegen (Stice et al., 2008a). Toekomstige gewichtstoename bij deze individuen, gemeten 1 jaar na initiële beeldvorming van de hersenen, toonde aan dat de omvang van striatale activering als reactie op smakelijk voedsel negatief gecorreleerd was met gewichtstoename bij proefpersonen met het A1-allel en positief gecorreleerd bij de niet-A1-allelonderwerpen Stice et al., 2008a). In een vervolgstudie werd gemeld dat de omvang van striatale activering als reactie op ingebeeld eten van smakelijk voedsel, in tegenstelling tot de werkelijke consumptie, omgekeerd evenredig was met gewichtstoename in het volgende jaar bij proefpersonen met het A1-allel, maar positief gecorreleerd bij niet-A1-allelonderwerpen (Stice et al., 2010b). Deze bevindingen suggereren dat D2R's striatale respons op smakelijk voedsel reguleren en dat verminderde D2R-signalen geïnduceerd door gewichtstoename of genetische factoren de kwetsbaarheid voor obesitas kunnen vergroten.
Defecte D2R-signalering draagt bij aan beloningsgebrek bij obesitas
Vergelijkbaar met de naar beneden gereguleerde striatale D2R-waarden bij zwaarlijvige menselijke proefpersonen, worden D2R-waarden ook verlaagd bij muizen en ratten die een smakelijk dieet kregen (bijv. [Colantuoni et al., 2001], [Geiger et al., 2009] en [Johnson en Kenny , 2010]) en bij ratten genetisch vatbaar voor obesitas (Zucker-ratten) (Thanos et al., 2008). Ons laboratorium heeft direct de rol onderzocht voor verstoorde striatale dopaminetransmissie in het algemeen, en dalingen in D2R-signalering in het bijzonder, in de verslavingsachtige beloningstekorten die ontstaan bij ratten tijdens de ontwikkeling van obesitas (zie figuur 5). In het bijzonder hebben we de effecten getest van het verminderen van de expressie van striatale D2R's bij ratten met behulp van virale gemedieerde RNA-interferentie, en vervolgens BSR-drempels beoordeeld wanneer ratten alleen toegang hadden tot chow of chow in combinatie met 18 – 23 hr dagelijkse toegang tot een smakelijke high-energy dieet (dwz een cafetaria dieet) (Johnson and Kenny, 2010). We ontdekten dat de respons op het belonen van LH-stimulatie vrijwel onmiddellijk begon af te nemen na blootstelling aan het cafetariadieet in de D2R knockdown-ratten (Johnson en Kenny, 2010; Figuur 5). Dalingen van het striatale D2R-niveau versnellen daarom snel het ontstaan van beloningshypofunctionaliteit bij ratten met uitgebreide toegang tot zeer smakelijk voedsel, een proces dat meestal vele weken duurt om op te komen in controleratten met uitgebreide toegang tot smakelijk dieet. De knockdown van striatale D2R's bij ratten met toegang tot voer veranderde echter alleen de respons niet voor het belonen van LH-stimulatie, wat suggereert dat verminderde striatale D2R-signalen interageren met andere dieet-geïnduceerde adaptieve responsen in hersenbeloningscircuits om hyposensitiviteit van de beloning te activeren. Naast verlaagde D2R-niveaus, zijn ook andere aspecten van striatale dopaminerge transmissie ook veranderd in de hersenen van zwaarlijvige ratten. Sprague-Dawley-ratten fokten selectiviteit om snel aan te komen op een energierijk dieet (obesitasgevoelige ratten) hebben lagere basale en opgeroepen dopamine-waarden in de NAc dan ratten die bestand zijn tegen gewichtstoename (obesitasbestendige ratten) (Geiger et al., 2008; zie ook Rada et al., 2010). De obesitas-gevoelige ratten hebben ook verlaagde niveaus van dopamine-biosynthese en opslagmachines, wat suggereert dat een mislukking in de productie en afgifte van dopamine bijdraagt aan tekorten in striatum dopamine-overdracht bij obese ratten (Geiger et al., 2008). Ratten die obesitas ontwikkelden door overconsumptie van een smakelijk hoog-energetisch dieet, hadden ook lagere basale en opgeroepen dopamine-waarden in de NAc vergeleken met ratten die alleen toegang hadden tot standaard voer ([Davis et al., 2008] en [Geiger et al., 2009]). Belangrijk is dat een maaltijd met standaardvoer voldoende was om de dopaminewaarden in de NAc van de controleratten te verhogen, terwijl alleen de zeer smakelijke voedselproducten voldoende waren om accumulatie van dopamine bij obese ratten met een geschiedenis van uitgebreide toegang tot het smakelijke voedsel te veroorzaken. (Geiger et al., 2009). Deze bevindingen tonen aan dat de ontwikkeling van obesitas bij ratten wordt geassocieerd met disfunctie bij mesostriatale dopaminetransmissie, het meest opvallend bij striatale D2R's, en dat een gebrekkige D2R-signalering bijdraagt aan het ontstaan van beloningsgebreken tijdens de ontwikkeling van obesitas bij ratten. Dit is consistent met het feit dat downregulatie van striatale D2R's een opmerkelijke neuroadaptieve reactie is op gewichtstoename bij mensen ([Barnard et al., 2009], [Stice et al., 2008a] en [Wang et al., 2001]), en dat een tekort aan striatale D2R-signalering striatale reacties op hedonisch voedsel bij menselijke proefpersonen kan afzwakken, waardoor het individu vatbaar wordt voor toekomstige gewichtstoename ([Stice et al., 2008a] en [Wang et al., 2001]).
Figuur 5. D2-dopaminereceptoren, beloningsdisfunctie en compulsiviteit bij obesitas - Knockdown van dopamine D2-receptoren (D2R) knockdown in rattenstriatum versnelt de opkomst van beloningsstoornissen en dwangmatig eten bij ratten met uitgebreide toegang tot smakelijk voedsel.
Defecte D2R-signalering kan leiden tot dwangmatig eten bij obesitas
Obesitas wordt gekenmerkt door te veel eten, ondanks een uitgesproken wens om consumptie en kennis van de diepgaande negatieve gezondheids- en sociale gevolgen van aanhoudende overmatige consumptie te beperken ([Booth et al., 2008], [Delin et al., 1997] en [Puhl et al., 2008]). Dit wordt geïllustreerd door het feit dat veel zwaarlijvige patiënten potentieel gevaarlijke bariatrische (maagomleiding) chirurgie ondergaan om hun gewicht te beheersen (Yurcisin et al., 2009), maar vaak terugvallen op overeten, hoewel de operatie de subjectieve beoordelingen van honger vermindert en de capaciteit om grote hoeveelheden voedsel te consumeren ([Kalarchian et al., 2002] en [Saunders, 2001]). Drugsverslaving wordt op dezelfde manier gedefinieerd als een verlies van remmende controle over drugsgebruik en persistentie in de gewoonte ondanks een besef van de potentieel verwoestende gezondheids-, sociale of financiële gevolgen (DSM-IV; American Psychiatric Association, 1994). Als zodanig delen obesitas en drugsverslaving de kenmerken van dwangstoornissen doordat er een opvallend falen is om informatie te gebruiken over toekomstige schadelijke gevolgen voor matige consumptie en persistentie in consumptie ondanks de beschikbaarheid van minder schadelijk alternatief gedrag.
Dwangmatig drugsgebruik is bij knaagdieren operationeel gedefinieerd als consumptie die resistent is tegen onderdrukking door straf of omgevingsstimuli die straf voorspellen ([Pelloux et al., 2007] en [Vanderschuren en Everitt, 2004]). Perioden van uitgebreide toegang tot cocaïne en andere drugs kunnen misbruik veroorzaken bij dwanggedrag bij ratten ([Ahmed en Koob, 1998], [Deroche-Gamonet et al., 2004] en [Vanderschuren en Everitt, 2004] ). Ratten met een geschiedenis van uitgebreide cocaïneconsumptie vertonen inderdaad opname die resistent is tegen verstoring door een aversieve geconditioneerde stimulus (CS) die een negatieve uitkomst voorspelt (dwz een cue light dat de aflevering van aversieve footshock voorspelt) ([Belin et al., 2008] en [Vanderschuren en Everitt, 2004]). Omgekeerd kan dezelfde aversieve CS de antwoorden op zoek naar medicijnen bij ratten met een relatief beperkte toegang tot het medicijn aanzienlijk verminderen. Gezien de overeenkomsten tussen dwangmatig drugsgebruik bij verslaving en overeten bij obesitas, hebben we onlangs onderzocht of ratten met obesitas smakelijk voedsel op een dwangmatige manier zouden consumeren en of striatale D2R's een rol spelen in dit proces (Johnson en Kenny, 2010). We vonden dat zwaarlijvige ratten met een geschiedenis van uitgebreide toegang tot smakelijk voedsel smakelijk voedsel bleven eten, zelfs in de aanwezigheid van een schadelijk CS (een lichte keu) dat de aflevering van aversieve footshock voorspelde (Johnson en Kenny, 2010). Daarentegen verstoorde dezelfde aversieve CS smakelijke voedselconsumptie bij magere ratten met een zeer beperkte blootstelling aan energiedicht smakelijk voedsel. Smakelijke voedselconsumptie kan daarom dwangmatig worden bij obese ratten, net zoals cocaïneconsumptie dwangmatig kan worden. In overeenstemming met deze interpretatie van de gegevens brachten muizen die eerder toegang hadden tot een smakelijk vetrijk dieet meer tijd door in een aversieve omgeving (fel verlicht) om het smakelijke voedsel te verkrijgen dan muizen die geen eerdere ervaring met het dieet hadden (Teegarden en Bale , 2007). Uit angst voor predatie zijn fel verlichte open arena's zeer afkerig van muizen (Suarez en Gallup, 1981). Muizen worden daarom resistent tegen de potentieel negatieve gevolgen van hun foerageergedrag en zullen predatie riskeren om smakelijk voedsel te verkrijgen, zelfs wanneer minder smakelijk voedsel beschikbaar is op een veel lager risico.
Intrigerend is dat het A1-allel van het TaqIA-polymorfisme dat resulteert in een verlaagde striatale D2R-dichtheid (Noble, 2000) en stompe striatale activering in reactie op smakelijk voedsel (Stice et al., 2008a) ook wordt geassocieerd met tekorten bij het leren om acties te vermijden die negatieve gevolgen (Klein et al., 2007). Het is precies dit soort falen om informatie te gebruiken die verband houdt met toekomstige negatieve gevolgen van overeten die kan bijdragen aan de ontwikkeling van dwangmatig eten bij zwaarlijvige personen. We vonden dat de opkomst van dwangmatig eten bij ratten met toegang tot smakelijk voedsel dramatisch werd versneld na striatale D2R knockdown (Johnson en Kenny, 2010). Ratten met striatale D2R knock-down die voorheen slechts 14 dagen van uitgebreide toegang tot energetisch smakelijk voedsel hadden, vertoonden smakelijke voedselconsumptie die resistent was tegen verstoring door een aversieve CS (Johnson en Kenny, 2010; Figuur 5). Deze 14-dagperiode van beperkte blootstelling aan het smakelijke voedsel was echter niet voldoende om dwangmatig eten bij controleratten te induceren (Johnson en Kenny, 2010). Deze bevindingen suggereren dat verslavingachtige dwangmatige inname van smakelijk voedsel kan voorkomen bij obese ratten. Bovendien versnelt een tekort aan striatale D2R-signalering, die de opkomst van beloningsovergevoeligheid versnelt als reactie op overconsumptie van smakelijk voedsel, ook de opkomst van dwangmatig eten (figuur 5).
Interacties tussen D2R's en hormonale regulatoren van energiebalans bij obesitas
Exogeen leptine toegediend in de VTA remt mesoaccumbens dopamine-overdracht en voedingsgedrag ([Hommel et al., 2006] en [Krügel et al., 2003]). Naast het acute remmende effect op dopamine-systemen in de middenhersenen, is er steeds meer bewijs dat tonische leptinesignalering ook nodig kan zijn om de juiste niveaus van mesostriatale dopamine-signalering te handhaven. Flier en collega's ontdekten dat ob / ob-muizen lagere niveaus van tyrosinehydroxylase hadden in dopamine-neuronen in de middenhersenen, een sleutelenzym in de biosynthese van dopamine (Fulton et al., 2006). Bovendien hadden ob / ob-muizen verminderde opgeroepen dopamine-afgifte in de NAc (Fulton et al., 2006) en verminderde somatodendritische vesiculaire vesiculaire voorraden dopamine in VTA en SN (Roseberry et al., 2007). Deze tekortkomingen in dopamineproductie en signaaltransductiemachines bij ob / ob-muizen werden gecorrigeerd door behandeling met leptine ([Fulton et al., 2006] en [Pfaffly et al., 2010]). In feite was leptine dat alleen in de LH was geïnfuseerd voldoende om disfunctionele dopaminetransmissie in ob / ob-muizen te corrigeren (Leinninger et al., 2009), hetgeen suggereert dat de cellen die de leptinereceptor tot expressie brengen in de LH de juiste niveaus van dopamine-signalering handhaven. Naast een verminderde productie en afgifte van dopamine, hadden ob / ob-muizen ook de neiging om lagere niveaus van D2R-expressie in striatum te hebben (Pfaffly et al., 2010). Bovendien verlaagde de exogene leptinebehandeling onder een regime dat resulteerde in de ontwikkeling van ongevoeligheid voor leptinesignalering (dwz leptineresistentie) de striatale D2R-niveaus in wildtype muizen aanzienlijk (Pfaffly et al., 2010). Zwaarlijvige ratten ontwikkelen leptineresistentie in de VTA ([Matheny et al., 2011] en [Scarpace et al., 2010]) en hebben ook lagere TH-niveaus in VTA, verminderde dopamine-afgifte in striatum en verminderde striatale D2R-niveaus (Geiger et al., 2008). Samengevat tonen deze gegevens aan dat leptine complexe acties heeft op dopamine-systemen in de middenhersenen. Enerzijds oefent acute activering van leptinereceptoren in de VTA een remmend effect uit op de dopaminetransmissie van mesoaccumbens en kan het voedingsgedrag remmen ([Hommel et al., 2006] en [Krügel et al., 2003]). Anderzijds is leptinesignalering in de middenhersenen noodzakelijk om de juiste dopamineproductie en signaaltransmissie te handhaven, en genetische tekorten bij leptinesignalering of de ontwikkeling van leptineresistentie bij obesitas verstoort de dopamine-systemen van mesoaccumbens diepgaand. Als zodanig is het een interessante mogelijkheid dat de ontwikkeling van leptineresistentie in dopaminerge neuronen in de middenhersenen tijdens de ontwikkeling van obesitas een centrale rol kan spelen in de verstoring van striatale D2R-signalen die de opkomst van verslavingsachtige beloningsstoornissen en dwangmatig te veel eten lijken aan te sturen. (Figuur 5) bij ratten met obesitas.
Naast de complexe effecten van leptinesignalering op mesostriatale dopaminerge transmissie, is er steeds meer bewijs dat D2R's op hun beurt leptinesignalering kunnen reguleren. De D2R-agonist bromocriptine verlaagt de circulerende niveaus van leptine ([Doknic et al., 2002], [Kok et al., 2006] en [Mastronardi et al., 2001]), wat suggereert dat D2R's een remmende invloed uitoefenen op de leptinegehalte. Bovendien hebben muizen met nulmutatie in het D2R-gen verbeterde leptinesignalering in hypothalamus en zijn ze gevoeliger voor de anorectische effecten van leptine (Kim et al., 2010). Het is bekend dat de leptinespiegels stijgen tijdens de ontwikkeling van obesitas (hyperleptinemie), maar er is een gelijktijdige afname van de gevoeligheid voor leptinesignalering (dwz leptineresistentie) (Hamilton et al., 1995). Het is dus een interessante mogelijkheid dat afname van de striatale D2R-signalering tijdens de ontwikkeling van obesitas een compenserende reactie kan zijn op overconsumptie van smakelijk voedsel en gewichtstoename die de circulerende leptinegehalte verhoogt en de signaalefficiëntie verhoogt om de ontwikkeling van leptineresistentie te overwinnen. Een dergelijke actie kan de remmende effecten van leptine op striatale systemen verbeteren die de respons op smakelijk voedsel reguleren ([Farooqi et al., 2007], [Fulton et al., 2006] en [Hommel et al., 2006]), waardoor ze werken om hedonische reacties op smakelijk voedsel te verzachten. Door deze bevinding te combineren met de regulerende rol van leptine op D2R's die hierboven zijn beschreven, lijkt het erop dat leptine- en D2R-signalering op een wederkerige manier kunnen worden gekoppeld om homeostatische en hedonische aspecten van voedingsgedrag te reguleren.
Onregelmatige hersenstress-systemen bij obesitas
Leptinesignalering in de middenhersenen reguleert de dopaminetransmissie van mesoaccumbens en het reactievermogen op hedonisch voedsel. Echter, neuronen in de VTA die leptinereceptoren tot expressie brengen, projecteren schaars naar de NAc en vertonen in plaats daarvan meer prominente projecties naar de centrale kern van de amygdala (CeA) (Leshan et al., 2010). In de context van voedingsgedrag is bekend dat CeA de remmende effecten van schadelijke omgevingsstimuli op voedselconsumptie reguleert (Petrovich et al., 2009). In het bijzonder heffen laesies van de CeA, maar niet basolaterale amygdala (BLA), de remmende effecten op van een gepaarde voetstimulatie geconditioneerde stimulus op voeding, wat suggereert dat de CeA kritisch is voor remmende controle over voedingsgedrag in reactie op signalen uit de omgeving die een negatieve uitkomst voorspellen ( Petrovich et al., 2009). Zwaarlijvige ratten, of nonobese ratten met striatale D2R knockdown en toegang tot smakelijk voedsel, blijven smakelijk voedsel eten op een dwangmatige manier in aanwezigheid van een aversieve CS. Deze effecten zijn opvallend vergelijkbaar met de verstoring van de reactiviteit op een aversieve CS bij ratten met CeA-laesie (Petrovich et al., 2009). Het zal dus belangrijk zijn om te bepalen of veranderingen in CeA-activiteit, misschien als gevolg van striatale D2R-downregulatie of ontwikkeling van leptineresistentie in de middenhersenen, bijdragen aan het ontstaan van dwangmatig eten bij obese ratten.
Naast het reguleren van de effecten van schadelijke omgevingsstimuli op het voedingsgedrag, kan de CeA ook een sleutelrol spelen bij stressgerelateerd hedonisch eten. Bij mensen motiveert stress op krachtige wijze de selectie en consumptie van energierijk smakelijk voedsel, onafhankelijk van de caloriebehoefte ([Gluck et al., 2004], [Kandiah et al., 2006] en [O'Connor et al., 2008]) , en obesitas is geassocieerd met verhoogde stressgerelateerde glucocorticoïde secretie ([Björntorp en Rosmond, 2000] en [la Fleur, 2006]). Omgevings- en sociale stressfactoren veroorzaken ook hyperfagie van energierijk smakelijk voedsel bij knaagdieren en apen, waarbij smakelijke voedselconsumptie mogelijk de nadelige effecten van stress verzacht ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et al., 2004], [Pecoraro et al., 2008]. al., 1] en [Wilson et al., 1]). Verder kan het stressopwekkende medicijn yohimbine eerder uitgedoofde smakelijke voedselzoekende reacties (hendel indrukken) bij ratten herstellen, een effect dat wordt verzwakt door de corticotropine-afgevende factor-2006 (CRF-2010) receptorantagonist antalarmin (Ghitza et al., XNUMX ). Het is belangrijk erop te wijzen dat de precieze effecten van stress op voedselconsumptie bij mensen en proefdieren afhankelijk zijn van de aard en omvang van de stressfactor, het soort voedsel dat voor consumptie beschikbaar is (smakelijk versus flauw), lichaamsgewicht en geslacht (Dallman , XNUMX).
Muizen met uitgebreide toegang tot een smakelijk vetrijk dieet hadden een verminderde expressie van het stresshormoon CRF in de CeA (Teegarden and Bale, 2007). Omgekeerd hadden muizen die "ontwenning" ondergingen van het smakelijke dieet een verhoogde CRF-expressie in de CeA (Teegarden and Bale, 2007). Dit laatste effect is zeer vergelijkbaar met de verhoogde CRF-expressie in CeA die is gedetecteerd bij ratten die zich terugtrekken uit alle belangrijke misbruikmiddelen (Koob, 2010). Omdat verder drugsgebruik deze aversieve neurobiologische reactie op het staken van geneesmiddelen kan normaliseren, is de hypothese dat hyperactieve CRF-transmissie in CeA en andere limbische structuren de ontwikkeling van dwangmatig drugsgebruik kan bevorderen (Koob en Zorrilla, 2010). In overeenstemming met deze visie brachten muizen die zich terugtrekken uit smakelijk, energierijk voedsel, dat de CRF-waarden in CeA had verhoogd, aanzienlijk meer tijd in een aversieve (helder verlichte) omgeving door om smakelijk voedsel te verkrijgen dan muizen zonder eerdere ervaring met het voedsel, zelfs hoewel minder smakelijk was beschikbaar in een niet-aversieve (donker verlichte) omgeving (Teegarden and Bale, 2007). Muizen worden daarom resistent tegen de potentieel negatieve gevolgen van hun foerageergedrag en riskeerde predatie om smakelijk voedsel te verkrijgen, zelfs wanneer minder smakelijk voedsel beschikbaar is op een veel lager risico, gedeeltelijk om CRF-transmissie in de CeA te verzwakken (Teegarden en Bale, 2007). Verschillende andere bewijsstukken ondersteunen een rol voor CRF-overdracht bij dwangmatig eten. In het bijzonder beoordeelde een recente studie de effecten van de CRF-1-receptorantagonist R121919 op voedselconsumptie bij ratten die cyclische variatie in hun dieet ondergaan waarin zij toegang hadden tot standaard voer 5 dagen per week en toegang tot een smakelijk suikerdieet 2 dagen per dag week (Cottone et al., 2009). Na 7 weken van deze cyclische variatie in dieet, verzwakte R121919 de overmatige consumptie van het zeer smakelijke dieet en verhoogde consumptie van flauw chow (Cottone et al., 2009). Verder waren CRF-expressieniveaus in de CeA verhoogd in de gefietste ratten tijdens terugtrekking uit het smakelijke dieet maar keerden ze terug naar basislijnniveaus na hernieuwde blootstelling aan het smakelijke dieet (Cottone et al., 2009). Ten slotte was de CRF-regulering van GABAergic-transmissie in de CeA verbeterd in de gefietste ratten die zich terugtrokken uit het smakelijke dieet in vergelijking met controleratten die voorheen alleen toegang hadden tot flauw voer, weerspiegeld in het feit dat R121919 het verstoorde GABAergic-remmend post-synaptisch potentieel in CeA-plakjes van de gefietste ratten in een concentratie die de overdracht in plakjes van de controleratten niet veranderde (Cottone et al., 2009). Interessant is dat een vergelijkbaar effect van CRF op GABAergic-transmissie in CeA ook is waargenomen bij ratten die zich terugtrokken aan chronische blootstelling aan ethanol (Roberto et al., 2010). Ten slotte vormen de CeA, bednucleus van de stria terminalis (BNST) en NAc-schaal een grotere aaneengesloten structuur genaamd de 'extended amygdala'. Infusie van CRF in de NAc-schaal op locaties die hedonaal eten stimuleert, verbetert de motivatie van een milieuomgeving cue die eerder gepaard ging met de beschikbaarheid van smakelijk voedsel (Peciña et al., 2006a). Stress kan daarom de saillantie van voedsel-gepaarde omgevingssignalen verhogen door de activiteit van NAc shell neuronen te moduleren. Al met al suggereren deze bevindingen dat overmatig consumeerbaar voedsel of misbruik van geneesmiddelen vergelijkbare neuroadaptieve responsen kunnen induceren in extrahypothalamische stresspaden in de hersenen, wat kan bijdragen aan dwangmatig consumptiegedrag.
Conclusies
Er is onlangs veel vooruitgang geboekt bij het identificeren van hersensystemen die betrokken zijn bij hedonische effecten van smakelijk voedsel en de aanpassingen die in deze circuits optreden als reactie op overconsumptie van smakelijk voedsel en gewichtstoename. Opvallend is dat vergelijkbare hersensystemen en veel voorkomende adaptieve reacties worden geactiveerd als reactie op consumptie van zowel smakelijk voedsel als verslavende medicijnen. In het bijzonder veroorzaakt overconsumptie van smakelijk voedsel of misbruik van drugs vergelijkbare tekorten in het reactievermogen van hersenbeloningssystemen. Smakelijk voedsel en verslavende medicijnen veroorzaken tekorten in de overdracht van striatale dopamine en de expressie van striatale D2R's. Smakelijk voedsel en verslavende medicijnen veroorzaken ook de opkomst van dwangmatig consumerend gedrag bij knaagdieren en zorgen voor extrahypothalamische stressreacties. Ten slotte kunnen gemeenschappelijke genetische kwetsbaarheden in beloningssystemen voor de hersenen individuen vatbaar maken voor overeten en obesitas en ook voor drugsgebruik en verslaving. Op basis van deze en andere overeenkomsten tussen zwaarlijvigheid en drugsverslaving is in feite gesteld dat obesitas als diagnostische categorie moet worden opgenomen in de aanstaande DSM-V ([Devlin, 2007] en [Volkow en O'Brien, 2007] ). Met dit in gedachten zullen cruciale gebieden voor toekomstig onderzoek verder onderzoek inhouden van de mogelijke neurobiologische overlappingen tussen dwangmatig overeten en drugsgebruik. Het zal bijvoorbeeld belangrijk zijn om te testen of obesitas verband houdt met de ontwikkeling van gewoonte-achtig consumptiegedrag als gevolg van plasticiteit in het dorsale striatum, net zoals drugsverslaving verband kan houden met striatale hermodellering en de opkomst van gewoonte-achtige zoektocht naar drugs. gedragingen ([Everitt en Robbins, 2005], [Hollander et al., 2010] en [Kasanetz et al., 2010]). Ook zijn corticale hersengebieden die betrokken zijn bij uitvoerende controle en besluitvorming (dwz prefrontale cortex) en bij interoceptieve verwerking (insulaire cortex) sterk betrokken bij drugsverslaving ([Everitt et al., 2008], [Fineberg et al., 2010) ], [Koob en Volkow, 2010] en [Naqvi en Bechara, 2009]), maar er is weinig bekend over hun precieze rol bij dwangmatig eten en obesitas, bijvoorbeeld ([Nair et al., 2011] en [Volkow et al. , 2009]). Alles bij elkaar ondersteunen de hierboven besproken gegevens het idee dat obesitas en drugsverslaving kunnen voortkomen uit vergelijkbare neuroadaptieve reacties in hersenbeloningscircuits, en suggereren dat bekende verslavingsmechanismen een heuristisch raamwerk kunnen bieden voor het begrijpen van obesitas.
Dankwoord
De auteur wordt ondersteund door subsidies van het National Institute on Drug Abuse (NIDA). De auteur is Paul Johnson en Christie Fowler dankbaar voor waardevolle inzichten en opmerkingen over het manuscript. Dit is manuscriptnummer 21042 van het Scripps Research Institute.
Referenties
1.
o Abizaid et al., 2006a
o A. Abizaid, Q. Gao, TL Horvath
o Gedachten over voedsel: hersenmechanismen en perifere energiebalans
o Neuron, 51 (2006), pp. 691 – 702
o
2.
o Abizaid et al., 2006b
o A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschöp et al.
o Ghrelin moduleert de activiteit en synaptische inputorganisatie van dopamine-neuronen in de middenhersenen terwijl de eetlust wordt bevorderd
o J. Clin. Invest., 116 (2006), pp. 3229 – 3239
o
3.
o Ahmed en Koob, 1998
o SH Ahmed, GF Koob
o Overgang van matige naar overmatige inname van geneesmiddelen: verandering in hedonische setpoint
o Wetenschap, 282 (1998), pp. 298 – 300
o
4.
o Ahmed en Koob, 2005
o SH Ahmed, GF Koob
o Overgang naar drugsverslaving: een negatief versterkingsmodel op basis van een allostatische afname van de beloningsfunctie
o Psychopharmacology (Berl.), 180 (2005), pp. 473 – 490
o
5.
o Ahmed et al., 2002
o SH Ahmed, PJ Kenny, GF Koob, A. Markou
o Neurobiologisch bewijs voor hedonische allostasis geassocieerd met escalerend cocaïnegebruik
o Nat. Neurosci., 5 (2002), pp. 625 – 626
o
6.
o Allison et al., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItallie
o Jaarlijkse sterfgevallen die te wijten zijn aan obesitas in de Verenigde Staten
o JAMA, 282 (1999), pp. 1530 – 1538
o
7.
o American Psychiatric Association, 1994
o American Psychiatric Association
o Diagnostische en statistische handleiding voor psychische stoornissen
o (Vierde editie) American Psychiatric Association, Washington, DC (1994)
o
8.
o Angeles-Castellanos et al., 2007
o M. Angeles-Castellanos, J. Mendoza, C. Escobar
o Beperkte voedingsschema's faseverschuiving dagelijkse ritmes van c-Fos en eiwit Per1 immunoreactiviteit in corticolimbische regio's bij ratten
o Neurowetenschappen, 144 (2007), pp. 344 – 355
o
9.
o Baicy et al., 2007
o K. Baicy, ED London, J. Monterosso, ML Wong, T. Delibasi, A. Sharma, J. Licinio
o Leptinevervanging verandert de hersenrespons op voedselsignalen bij volwassenen met een genetische leptine-deficiëntie
o Proc. Natl. Acad. Sci. VS, 104 (2007), pp. 18276 – 18279
o
10.
o Baldo et al., 2004
o BA Baldo, L. Gual-Bonilla, K. Sijapati, RA Daniel, CF Landry, AE Kelley
o Activatie van een subpopulatie van orexine / hypocretine bevattende hypothalamische neuronen door GABAA-receptor-gemedieerde remming van de nucleus accumbens shell, maar niet door blootstelling aan een nieuwe omgeving
o Eur. J. Neurosci., 19 (2004), pp. 376 – 386
o
11.
o Balleine en Dickinson, 2000
o BW Balleine, A. Dickinson
o Het effect van laesies van de insulaire cortex op instrumentele conditionering: bewijs voor een rol in stimulerend geheugen
o J. Neurosci., 20 (2000), pp. 8954 – 8964
o
12.
o Barnard et al., 2009
o ND Barnard, EP Noble, T. Ritchie, J. Cohen, DJ Jenkins, G. Turner-McGrievy, L. Gloede, AA Green, H. Ferdowsian
o D2 dopamine-receptor Taq1A polymorfisme, lichaamsgewicht en voedingsinname bij type 2 diabetes
o Voeding, 25 (2009), pp. 58 – 65
o
13.
o Basso en Kelley, 1999
o AM Basso, AE Kelley
o Voeding geïnduceerd door GABA (A) -receptorstimulatie in de nucleus accumbens shell: regionale mapping en karakterisatie van macronutriënten en smaakvoorkeur
o Gedrag. Neurosci., 113 (1999), pp. 324 – 336
o
14.
o Batterham et al., 2007
o RL Batterham, DH ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
o PYY-modulatie van corticale en hypothalamische hersengebieden voorspelt voedingsgedrag bij mensen
o Natuur, 450 (2007), pp. 106 – 109
o
15.
o Baxter en Murray, 2002
o MG Baxter, EA Murray
o De amygdala en beloning
o Nat. Neurosci., 3 (2002), pp. 563 – 573
o
16.
o Bean et al., 2008
o MK Bean, K. Stewart, ME Olbrisch
o Obesitas in Amerika: implicaties voor klinische en gezondheidspsychologen
o J. Clin. Psychol. Med. Instellingen, 15 (2008), pp. 214 – 224
o
17.
o Beaver et al., 2006
o JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o Individuele verschillen in beloningsdrive voorspellen neurale reacties op beelden van voedsel
o J. Neurosci., 26 (2006), pp. 5160 – 5166
o
18.
o Belin et al., 2008
o D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o Hoge impulsiviteit voorspelt de omschakeling naar dwangmatige cocaïne-inname
o Wetenschap, 320 (2008), pp. 1352 – 1355
o
19.
o Berridge, 1996
o KC Berridge
o Voedselbeloning: hersensubstraten van willen en leuk vinden
o Neurosci. Biobehav. Rev., 20 (1996), pp. 1 – 25
o
20.
o Berridge, 2009
o KC Berridge
o 'Liken' en 'willen' van voedselbeloningen: hersensubstraten en rollen bij eetstoornissen
o Physiol. Gedrag, 97 (2009), pp. 537 – 550
o
21.
o Björntorp en Rosmond, 2000
o P. Björntorp, R. Rosmond
o Obesitas en cortisol
o Voeding, 16 (2000), pp. 924 – 936
o
22.
o Blundell en Herberg, 1968
o JE Blundell, LJ Herberg
o Relatieve effecten van voedingstekort en deprivatieperiode op snelheid van elektrische zelfstimulatie van laterale hypothalamus
o Natuur, 219 (1968), pp. 627 – 628
o
23.
o Booth et al., 2008
o ML Booth, RL Wilkenfeld, DL Pagnini, SL Booth, LA King
o Percepties van adolescenten op overgewicht en obesitas: het gewicht van opiniestudie
o J. Paediatr. Gezondheid van kinderen, 44 (2008), pp. 248 – 252
o
24.
o Bragulat et al., 2010
o V. Bragulat, M. Dzemidzic, C. Bruno, CA Cox, T. Talavage, RV Considine, DA Kareken
o Voedingsgerelateerde geursondes van hersenspoelcircuits tijdens honger: een pilot fMRI-studie
o Obesitas, Silver Spring, MD (2010)
o
25.
o Cabanac en Johnson, 1983
o M. Cabanac, KG Johnson
o Analyse van een conflict tussen smakelijkheid en blootstelling aan koude bij ratten
o Physiol. Gedrag, 31 (1983), pp. 249 – 253
o
26.
o Campfield et al., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o Recombinant OB-eiwit van muizen: bewijs voor een perifeer signaal dat adipositeit en centrale neurale netwerken met elkaar verbindt
o Wetenschap, 269 (1995), pp. 546 – 549
o
27.
o Cannon en Palmiter, 2003
o CM Cannon, RD Palmiter
o Beloning zonder dopamine
o J. Neurosci., 23 (2003), pp. 10827 – 10831
o
28.
o Carr en Simon, 1984
o KD Carr, EJ Simon
o Potentie van beloning door honger wordt opioïde gemedieerd
o Brain Res., 297 (1984), pp. 369 – 373
o
29.
o Centra voor ziektebestrijding en preventie, 2009
o Centra voor ziektebestrijding en preventie (2009). Amerikaanse obesitastrends (Atlanta: Centers for Disease Control and Prevention).
o
30.
o Colantuoni et al., 2001
o C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, GJ Schwartz, TH Moran, BG Hoebel
o Overmatige suikerinname verandert de binding aan dopamine en mu-opioïde receptoren in de hersenen
o Neuroreport, 12 (2001), pp. 3549 – 3552
o
31.
o Cornelius et al., 2010
o JR Cornelius, M. Tippmann-Peikert, NL Slocumb, CF Frerichs, MH Silber
o Stoornissen in de impulsbeheersing bij het gebruik van dopaminerge middelen bij het rusteloze benen syndroom: een case-control studie
o Slaapstand, 33 (2010), pp. 81 – 87
o
32.
o Cornier et al., 2009
o MA Cornier, AK Salzberg, DC Endly, DH Bessesen, DC Rojas, JR Tregellas
o De effecten van overvoeding op de neuronale respons op visuele voedselsignalen bij personen met een dunne of obesitas
o PLAATS EEN, 4 (2009), p. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone et al., 2009
o P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis et al.
o CRF-systeemwerving bemiddelt de donkere kant van dwangmatig eten
o Proc. Natl. Acad. Sci. VS, 106 (2009), pp. 20016 – 20020
o
34.
o Dagher, 2009
o A. Dagher
o De neurobiologie van eetlust: honger als verslaving
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), pp. S30 – S33
o
35.
o Dagher en Robbins, 2009
o A. Dagher, TW Robbins
o Persoonlijkheid, verslaving, dopamine: inzichten uit de ziekte van Parkinson
o Neuron, 61 (2009), pp. 502 – 510
o
36.
o Dallman, 2010
o MF Dallman
o Door stress veroorzaakte obesitas en het emotionele zenuwstelsel
o Trends Endocrinol. Metab., 21 (2010), pp. 159 – 165
o
37.
o Dallman et al., 2003
o MF Dallman, N. Pecoraro, SF Akana, SE La Fleur, F. Gomez, H. Houshyar, ME Bell, S. Bhatnagar, KD Laugero, S. Manalo
o Chronische stress en obesitas: een nieuwe kijk op "comfort food"
o Proc. Natl. Acad. Sci. VS, 100 (2003), pp. 11696 – 11701
o
38.
o Dallman et al., 2006
o MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
o Glucocorticoïden, chronische stress en obesitas
o Prog. Brain Res., 153 (2006), pp. 75 – 105
o
39.
o Davis et al., 2004
o C. Davis, S. Strachan, M. Berkson
o Gevoeligheid voor beloning: implicaties voor te veel eten en overgewicht
o Eetlust, 42 (2004), pp. 131 – 138
o
40.
o Davis et al., 2008
o JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o Blootstelling aan verhoogde niveaus van voedingsvet vermindert beloning van psychostimulant en mesolimbische dopamine-omzet bij de rat
o Gedrag. Neurosci., 122 (2008), pp. 1257 – 1263
o
41.
o de Araujo et al., 2010
o IE de Araujo, X. Ren, JG Ferreira
o Metabole detectie in dopamine-systemen in de hersenen
o Resultaten problemen. Cell Differ., 52 (2010), pp. 69 – 86
o
42.
o Delin et al., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
o Eetgedrag en de ervaring van honger na een bypassoperatie wegens morbide obesitas
o Obes. Surg., 7 (1997), pp. 405 – 413
o
43.
o Deroche-Gamonet et al., 2004
o V. Deroche-Gamonet, D. Belin, PV Piazza
o Bewijs voor verslavingsachtig gedrag bij de rat
o Wetenschap, 305 (2004), pp. 1014 – 1017
o
44.
o Devlin, 2007
o MJ Devlin
o Is er een plaats voor obesitas in DSM-V?
o Int. J. Eat. Disord., 40 (Suppl) (2007), pp. S83 – S88
o
45.
o Doknic et al., 2002
o M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
o Dopaminerge tonus en obesitas: een inzicht van prolactinomen behandeld met bromocriptine
o Eur. J. Endocrinol., 147 (2002), pp. 77 – 84
o
46.
o Everitt en Robbins, 2005
o BJ Everitt, TW Robbins
o Neurale versterkingssystemen voor drugsverslaving: van acties tot gewoonten tot dwang
o Nat. Neurosci., 8 (2005), pp. 1481 – 1489
o
47.
o Everitt et al., 2008
o BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o Beoordeling. Neurale mechanismen die ten grondslag liggen aan de kwetsbaarheid om dwangmatige drugszoekende gewoonten en verslaving te ontwikkelen
o Philos. Trans. R. Soc. Lond. B Biol. Sci., 363 (2008), pp. 3125 – 3135
o
48.
o Farooqi et al., 2007
o IS Farooqi, E. Bullmore, J. Keogh, J. Gillard, S. O'Rahilly, PC Fletcher
o Leptine reguleert striatale gebieden en menselijk eetgedrag
o Science, 317 (2007), p. 1355
o
49.
o Felsted et al., 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Small
o Genetisch bepaalde verschillen in hersenreactie op een primaire voedselbeloning
o J. Neurosci., 30 (2010), pp. 2428 – 2432
o
50.
o Figlewicz et al., 2001
o DP Figlewicz, MS Higgins, SB Ng-Evans, PJ Havel
o Leptine keert de met sucrose geconditioneerde plaatsvoorkeur om in voedselbeperkte ratten
o Physiol. Gedrag, 73 (2001), pp. 229 – 234
o
51.
o Figlewicz et al., 2003
o DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o Expressie van receptoren voor insuline en leptine in het ventrale tegmentale gebied / substantia nigra (VTA / SN) van de rat
o Brain Res., 964 (2003), pp. 107 – 115
o
52.
o Fineberg et al., 2010
o NA Fineberg, MN Potenza, SR Chamberlain, HA Berlin, L. Menzies, A. Bechara, BJ Sahakian, TW Robbins, ET Bullmore, E. Hollander
o Onderzoek naar dwangmatig en impulsief gedrag, van diermodellen tot endofenotypen: een verhalend overzicht
o Neuropsychopharmacology, 35 (2010), pp. 591 – 604
o
53.
o Finkelstein et al., 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
o Economische oorzaken en gevolgen van obesitas
o Annu. Volksgezondheid, 26 (2005), pp. 239 – 257
o
54.
o Flegal et al., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o Prevalentie en trends in obesitas bij Amerikaanse volwassenen, 1999-2008
o JAMA, 303 (2010), pp. 235 – 241
o
55.
o Foo en Mason, 2005
o H. Foo, P. Mason
o Sensorische onderdrukking tijdens het voeden
o Proc. Natl. Acad. Sci. VS, 102 (2005), pp. 16865 – 16869
o
56.
o Franken en Muris, 2005
o IH Franken, P. Muris
o Individuele verschillen in beloningsgevoeligheid zijn gerelateerd aan hunkering naar voedsel en relatief lichaamsgewicht bij gezonde vrouwen
o Eetlust, 45 (2005), pp. 198 – 201
o
57.
o Friedman et al., 2011
o A. Friedman, E. Lax, Y. Dikshtein, L. Abraham, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
o Elektrische stimulatie van de laterale habenula heeft een remmend effect op zelftoediening van sucrose
o Neuropharmacology, 60 (2011), pp. 381 – 387
o
58.
o Fulton et al., 2000
o S. Fulton, B. Woodside, P. Shizgal
o Modulatie van hersenbeloningscircuits door leptine
o Wetenschap, 287 (2000), pp. 125 – 128
o
59.
o Fulton et al., 2006
o S. Fulton, P. Pissios, RP Manchon, L. Stiles, L. Frank, EN Pothos, E. Maratos-Flier, JS Flier
o Leptine-regulatie van de dopamineweg van mesoaccumbens
o Neuron, 51 (2006), pp. 811 – 822
o
60.
o Gao en Horvath, 2007
o Q. Gao, TL Horvath
o Neurobiologie van voeding en energieverbruik
o Annu. Neurosci., 30 (2007), pp. 367 – 398
o
61.
o Gautier et al., 2000
o JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
o Differentiële hersenreacties op verzadiging bij zwaarlijvige en magere mannen
o Diabetes, 49 (2000), pp. 838 – 846
o
62.
o Geiger et al., 2008
o BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, EG Kokkotou, EN Pothos
o Bewijs voor defecte mesolimbische dopamine-exocytose bij ratten met overgewicht
o FASEB J., 22 (2008), pp. 2740 – 2746
o
63.
o Geiger et al., 2009
o BM Geiger, M. Haburcak, NM Avena, MC Moyer, BG Hoebel, EN Pothos
o Tekorten van mesolimbische dopamine-neurotransmissie bij obesitas bij ratten
o Neurowetenschappen, 159 (2009), pp. 1193 – 1199
o
64.
o Ghitza et al., 2006
o UE Ghitza, SM Gray, DH Epstein, KC Rice, Y. Shaham
o Neuropsychopharmacology
o Het anxiogene medicijn yohimbine herstelt smakelijk voedsel zoeken in een ratterugvalmodel: een rol van CRF (1) receptoren, 33 (2006), pp. 2188 – 2196
o
65.
o Gluck et al., 2004
o ME Gluck, A. Geliebter, J. Hung, E. Yahav
o Cortisol, honger en eetlust na een koude stress-test bij zwaarlijvige vrouwen met eetstoornis
o Psychosom. Med., 66 (2004), pp. 876 – 881
o
66.
o Goldstone et al., 2009
o AP Goldstone, CG Prechtl de Hernandez, JD Beaver, K. Muhammed, C. Croese, G. Bell, G. Durighel, E. Hughes, AD Waldman, G. Frost, JD Bell
o Vasten neigt beloningssystemen van hersenen naar calorierijk voedsel
o Eur. J. Neurosci., 30 (2009), pp. 1625 – 1635
o
67.
o Halaas et al., 1995
o JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o Gewichtsverlagende effecten van het plasma-eiwit gecodeerd door het obese gen
o Wetenschap, 269 (1995), pp. 543 – 546
o
68.
o Hamilton et al., 1995
o BS Hamilton, D. Paglia, AY Kwan, M. Deitel
o Verhoogde obese mRNA-expressie in omentale vetcellen van massaal zwaarlijvige mensen
o Nat. Med., 1 (1995), pp. 953 – 956
o
69.
o Hernandez en Hoebel, 1988
o L. Hernandez, BG Hoebel
o Voedselbeloning en cocaïne verhogen extracellulaire dopamine in de nucleus accumbens zoals gemeten door microdialyse
o Life Sci., 42 (1988), pp. 1705 – 1712
o
70.
o Hill et al., 2003
o JO Hill, HR Wyatt, GW Reed, JC Peters
o Obesitas en het milieu: waar gaan we naartoe?
o Wetenschap, 299 (2003), pp. 853 – 855
o
71.
o Hoebel, 1969
o BG Hoebel
o Voeden en zelfstimulatie
o Ann. NY Acad. Sci., 157 (1969), pp. 758 – 778
o
72.
o Hoebel en Balagura, 1967
o BG Hoebel, S. Balagura
o Zelfstimulatie van de laterale hypothalamus gemodificeerd door insuline en glucagon
o Physiol. Gedrag, 2 (1967), pp. 337 – 340
o
73.
o Hoebel en Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Hypothalamische controle van voeding en zelfstimulatie
o Wetenschap, 135 (1962), pp. 375 – 377
o
74.
o Hoebel en Thompson, 1969
o BG Hoebel, RD Thompson
o Afkeer van laterale hypothalamische stimulatie veroorzaakt door intragastrische voeding of obesitas
o J. Comp. Physiol. Psychol., 68 (1969), pp. 536 – 543
o
75.
o Hofmann et al., 2010
o W. Hofmann, GM van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o Terwijl plezier zich ontvouwt: Hedonische reacties op verleidelijk voedsel
o Psychol. Sci., 21 (2010), pp. 1863 – 1870
o
76.
o Holland en Gallagher, 2004
o PC Holland, M. Gallagher
o Amygdala-frontale interacties en beloningsverwachting
o Curr. Opin. Neurobiol., 14 (2004), pp. 148 – 155
o
77.
o Hollander et al., 2010
o JA Hollander, HI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahlestedt, MD Conkright, PJ Kenny
o Striatale microRNA regelt de inname van cocaïne via CREB-signalering
o Natuur, 466 (2010), pp. 197 – 202
o
78.
o Hommel et al., 2006
o JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
o Leptinereceptorsignalering in dopamine neuronen in de middenhersenen reguleert de voeding
o Neuron, 51 (2006), pp. 801 – 810
o
79.
o Imaizumi et al., 2001
o M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o Voorkeur voor vetrijk voedsel bij muizen: gebakken aardappelen in vergelijking met gekookte aardappelen
o Eetlust, 36 (2001), pp. 237 – 238
o
80.
o Jerlhag et al., 2006
o E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
o Ghrelin stimuleert locomotorische activiteit en accumulatie van dopamine-overflow via centrale cholinerge systemen bij muizen: implicaties voor zijn betrokkenheid bij hersenbeloning
o Verslaafde. Biol., 11 (2006), pp. 45 – 54
o
81.
o Jerlhag et al., 2007
o E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
o Ghrelinetoediening in tegmentale gebieden stimuleert de locomotorische activiteit en verhoogt de extracellulaire concentratie van dopamine in de nucleus accumbens
o Verslaafde. Biol., 12 (2007), pp. 6 – 16
o
82.
o Jhou et al., 2009
o TC Jhou, HL Fields, MG Baxter, CB Saper, PC Holland
o De rostromediale tegmentale nucleus (RMTg), een GABAergische afferente dopamine neuronen in de middenhersenen, codeert aversieve stimuli en remt motorische reacties
o Neuron, 61 (2009), pp. 786 – 800
o
83.
o Johnson en Kenny, 2010
o PM Johnson, PJ Kenny
o Dopamine D2-receptoren bij verslavingachtige beloningsstoornissen en dwangmatig eten bij obese ratten
o Nat. Neurosci., 13 (2010), pp. 635 – 641
o
84.
o Johnson et al., 1996
o PI Johnson, MA Parente, JR Stellar
o Door NMDA geïnduceerde laesies van de nucleus accumbens of het ventrale pallidum verhogen de lonende werkzaamheid van voedsel voor achtergestelde ratten
o Brain Res., 722 (1996), pp. 109 – 117
o
85.
o Jönsson et al., 1999
o EG Jönsson, MM Nöthen, F. Grünhage, L. Farde, Y. Nakashima, P. Propping, GC Sedvall
o Polymorfismen in het dopamine D2-receptorgen en hun relaties met striatale dopaminereceptordichtheid van gezonde vrijwilligers
o Mol. Psychiatry, 4 (1999), pp. 290 – 296
o
86.
o Kalarchian et al., 2002
o MA Kalarchian, MD Marcus, GT Wilson, EW Labouvie, RE Brolin, LB LaMarca
o Binge eating onder maag-bypass-patiënten bij langdurige follow-up
o Obes. Surg., 12 (2002), pp. 270 – 275
o
87.
o Kandiah et al., 2006
o J. Kandiah, M. Yake, J. Jones, M. Meyer
o Stress beïnvloedt eetlust en comfortvoedingsvoorkeuren bij universiteitsvrouwen
o Nutr. Res., 26 (2006), pp. 118 – 123
o
88.
o Karhunen et al., 1997
o LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o Regionale cerebrale bloedstroom tijdens voedselblootstelling bij zwaarlijvige en vrouwen met een normaal gewicht
o Brain, 120 (1997), pp. 1675 – 1684
o
89.
o Kasanetz et al., 2010
o F. Kasanetz, V. Deroche-Gamonet, N. Berson, E. Balado, M. Lafourcade, O. Manzoni, PV Piazza
o Overgang naar verslaving gaat gepaard met een aanhoudende verslechtering van de synaptische plasticiteit
o Wetenschap, 328 (2010), pp. 1709 – 1712
o
90.
o Kelley et al., 1996
o AE Kelley, EP Bless, CJ Swanson
o Onderzoek naar de effecten van opiaatantagonisten toegediend in de nucleus accumbens op voeding en sucrose drinken bij ratten
o J. Pharmacol. Exp. Ther., 278 (1996), pp. 1499 – 1507
o
91.
o Kelley et al., 2005
o AE Kelley, BA Baldo, WE Pratt, MJ Will
o Corticostriatale-hypothalamische circuits en voedselmotivatie: integratie van energie, actie en beloning
o Physiol. Gedrag, 86 (2005), pp. 773 – 795
o
92.
o Kenny et al., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o Geconditioneerde terugtrekking stimuleert de consumptie van heroïne en vermindert de gevoeligheid van de beloning
o J. Neurosci., 26 (2006), pp. 5894 – 5900
o
93.
o Kim et al., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sun, JH Baik
o Verbeterde hypothalamische leptinesignalering bij muizen zonder dopamine D2-receptoren
o J. Biol. Chem., 285 (2010), pp. 8905 – 8917
o
94.
o Klein et al., 2007
o TA Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o Genetisch bepaalde verschillen in leren van fouten
o Wetenschap, 318 (2007), pp. 1642 – 1645
o
95.
o Kojima et al., 1999
o M. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsuo, K. Kangawa
o Ghreline is een groeihormoonafgevend geacyleerd peptide uit de maag
o Natuur, 402 (1999), pp. 656 – 660
o
96.
o Kok et al., 2006
o P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o Activering van dopamine D2-receptoren verlaagt circadiane leptineconcentraties bij zwaarlijvige vrouwen
o J. Clin. Endocrinol. Metab., 91 (2006), pp. 3236 – 3240
o
97.
o Koob, 2010
o GF Koob
o De rol van CRF en CRF-gerelateerde peptiden in de donkere kant van verslaving
o Brain Res., 1314 (2010), pp. 3 – 14
o
98.
o Koob en Le Moal, 2008
o GF Koob, M. Le Moal
o Verslaving en het antireward systeem van de hersenen
o Annu. Rev. Psychol., 59 (2008), pp. 29 – 53
o
99.
o Koob en Volkow, 2010
o GF Koob, ND Volkow
o neurocircuit van verslaving
o Neuropsychopharmacology, 35 (2010), pp. 217 – 238
o
100.
o Koob en Zorrilla, 2010
o GF Koob, EP Zorrilla
o Neurobiologische verslavingsmechanismen: focus op corticotropin-releasing factor
o Curr. Opin. Investig. Geneesmiddelen, 11 (2010), pp. 63 – 71
o
101.
o Kringelbach et al., 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o Activatie van de menselijke orbitofrontale cortex tot een vloeibare voedselstimulus is gecorreleerd met zijn subjectieve aangenaamheid
o Cereb. Cortex, 13 (2003), pp. 1064 – 1071
o
102.
o Krügel et al., 2003
o U. Krügel, T. Schraft, H. Kittner, W. Kiess, P. Illes
o Basale en door voeding opgewekte dopamine-afgifte in de accumbens van de rattenkern wordt onderdrukt door leptine
o Eur. J. Pharmacol., 482 (2003), pp. 185 – 187
o
103.
o la Fleur, 2006
o ZO la Fleur
o De effecten van glucocorticoïden op het voedingsgedrag bij ratten
o Physiol. Gedrag, 89 (2006), pp. 110 – 114
o
104.
o LaBar et al., 2001
o KS LaBar, DR Gitelman, TB Parrish, YH Kim, AC Nobre, MM Mesulam
o Honger moduleert selectief de corticolimbische activering op voedselprikkels bij mensen
o Gedrag. Neurosci., 115 (2001), pp. 493 – 500
o
105.
o Latagliata et al., 2010
o EC Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o Voedsel zoeken ondanks schadelijke gevolgen staat onder prefrontale corticale noradrenerge controle
o BMC Neurosci., 11 (2010), p. 15
o
106.
o Lawford et al., 2000
o BR Lawford, RM Young, EP Noble, J. Sargent, J. Rowell, S. Shadforth, X. Zhang, T. Ritchie
o Het D (2) dopamine-receptor A (1) allel en opioïde afhankelijkheid: associatie met heroïnegebruik en reactie op methadonbehandeling
o Am. J. Med. Genet., 96 (2000), pp. 592 – 598
o
107.
o Leinninger et al., 2009
o GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong et al.
o Leptine werkt via leptinereceptor tot expressie brengende laterale hypothalamische neuronen om het mesolimbische dopamine-systeem te moduleren en voeding te onderdrukken
o Celmetab., 10 (2009), pp. 89 – 98
o
108.
o Lenoir et al., 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
o Intense zoetheid overtreft cocaïnebeloning
o PLAATS EEN, 2 (2007), p. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Leshan et al., 2010
o RL Leshan, DM Opland, GW Louis, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
o Ventrale tegmentale gebied leptinereceptorneuronen projecteren en reguleren specifiek cocaïne- en amfetamine-gereguleerde transcriptneuronen van de uitgebreide centrale amygdala
o J. Neurosci., 30 (2010), pp. 5713 – 5723
o
110.
o Louis et al., 2010
o GW Louis, GM Leinninger, CJ Rhodes, MG Myers Jr.
o Directe innervatie en modulatie van orexine-neuronen door laterale hypothalamische LepRb-neuronen
o J. Neurosci., 30 (2010), pp. 11278 – 11287
o
111.
o Luppino et al., 2010
o FS Luppino, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
o Overgewicht, obesitas en depressie: een systematische review en meta-analyse van longitudinale studies
o Arch. Gen. Psychiatry, 67 (2010), pp. 220 – 229
o
112.
o Lutter en Nestler, 2009
o M. Lutter, EJ Nestler
o Homeostatische en hedonische signalen werken samen bij de regulatie van voedselinname
o J. Nutr., 139 (2009), pp. 629 – 632
o
113.
o Macht en Mueller, 2007
o M. Macht, J. Mueller
o Onmiddellijke effecten van chocolade op experimenteel opgewekte gemoedstoestanden
o Eetlust, 49 (2007), pp. 667 – 674
o
114.
o Maldonado-Irizarry en Kelley, 1995
o CS Maldonado-Irizarry, AE Kelley
o Excitotoxische laesies van de kern- en shell-subregio's van de kern accumbens differentiëren verstoren lichaamsgewichtregulatie en motorische activiteit bij ratten
o Brain Res. Bull., 38 (1995), pp. 551 – 559
o
115.
o Maldonado-Irizarry et al., 1995
o CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o Glutamaatreceptoren in de kern accumbens shell control voedingsgedrag via de laterale hypothalamus
o J. Neurosci., 15 (1995), pp. 6779 – 6788
o
116.
o Malik et al., 2008
o S. Malik, F. McGlone, D. Bedrossian, A. Dagher
o Ghrelin moduleert hersenactiviteit in gebieden die eetlustgedrag beheersen
o Celmetab., 7 (2008), pp. 400 – 409
o
117.
o Man et al., 2009
o MS Man, HF Clarke, AC Roberts
o De rol van de orbitofrontale cortex en het mediale striatum bij de regulatie van prepotente reacties op voedselbeloningen
o Cereb. Cortex, 19 (2009), pp. 899 – 906
o
118.
o Margules and Olds, 1962
o DL Margules, J. Olds
o Identieke "voedende" en "lonende" systemen in de laterale hypothalamus van ratten
o Wetenschap, 135 (1962), pp. 374 – 375
o
119.
o Markou en Frank, 1987
o A. Markou, RA Frank
o Het effect van operant en elektrodeplaatsing op zelf-stimulatie trein-duurresponsfuncties
o Physiol. Gedrag, 41 (1987), pp. 303 – 308
o
120.
o Markou en Koob, 1991
o A. Markou, GF Koob
o Postcocaïne anhedonie. Een diermodel voor cocaïne-ontwenning
o Neuropsychopharmacology, 4 (1991), pp. 17 – 26
o
121.
o Mastronardi et al., 2001
o CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o Door lipopolysacharide geïnduceerde afgifte van leptine wordt neuraal geregeld
o Proc. Natl. Acad. Sci. VS, 98 (2001), pp. 14720 – 14725
o
122.
o Matheny et al., 2011
o M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o Regiospecifieke dieet-geïnduceerde en leptine-geïnduceerde cellulaire leptineresistentie omvat het ventrale tegmentale gebied bij ratten
o Neuropharmacology (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 in druk. Online gepubliceerd November 5, 2010
o
123.
o Matsumoto en Hikosaka, 2007
o M. Matsumoto, O. Hikosaka
o Laterale habenula als een bron van negatieve beloningssignalen in dopamine-neuronen
o Natuur, 447 (2007), pp. 1111 – 1115
o
124.
o Morton et al., 2006
o GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
o Controle van het centrale zenuwstelsel van voedselinname en lichaamsgewicht
o Natuur, 443 (2006), pp. 289 – 295
o
125.
o Mount en Hoebel, 1967
o G. Mount, BG Hoebel
o Laterale hypothalamische zelfstimulatie: zelfbepaalde drempel verhoogd met voedselinname
o Psychon. Sci., 9 (1967), pp. 265 – 266
o
126.
o Nair et al., 2011
o SG Nair, BM Navarre, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o Rol van dorsale mediale prefrontale cortex dopamine D1-familie receptoren bij terugval naar vetrijk voedsel zoeken geïnduceerd door het anxiogene medicijn yohimbine
o Neuropsychopharmacology, 36 (2011), pp. 497 – 510
o
127.
o Nakazato et al., 2001
o M. Nakazato, N. Murakami, Y. Date, M. Kojima, H. Matsuo, K. Kangawa, S. Matsukura
o Een rol voor ghreline in de centrale regulering van voeding
o Natuur, 409 (2001), pp. 194 – 198
o
128.
o Naqvi en Bechara, 2009
o NH Naqvi, A. Bechara
o Het verborgen eiland van verslaving: de insula
o Trends Neurosci., 32 (2009), pp. 56 – 67
o
129.
o Neville et al., 2004
o MJ Neville, EC Johnstone, RT Walton
o Identificatie en karakterisatie van ANKK1: een nieuw kinasegen nauw verbonden met DRD2 op chromosoomband 11q23.1
o Hum. Mutat., 23 (2004), pp. 540 – 545
o
130.
o Nirenberg and Waters, 2006
o MJ Nirenberg, C. Waters
o Dwangmatig eten en gewichtstoename gerelateerd aan gebruik van dopamine-agonisten
o Mov. Disord., 21 (2006), pp. 524 – 529
o
131.
o Noble, 2000
o EP Noble
o Verslaving en het beloningsproces door polymorfismen van het D2 dopamine-receptorgen: een overzicht
o Eur. Psychiatry, 15 (2000), pp. 79 – 89
o
132.
o Noble et al., 1993
o EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin et al.
o Allelische associatie van het D2 dopamine-receptorgen met cocaïneverslaving
o Drug Alcoholafhankelijk., 33 (1993), pp. 271 – 285
o
133.
o Noble et al., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
o Haplotypes op de DRD2 locus en ernstig alcoholisme
o Am. J. Med. Genet., 96 (2000), pp. 622 – 631
o
134.
o O'Connor et al., 2008
o DB O'Connor, F. Jones, M. Conner, B. McMillan, E. Ferguson
o Effecten van dagelijkse rompslomp en eetstijl op eetgedrag
o Gezondheidspsychol., 27 (1, Suppl) (2008), pp. S20 – S31
o
135.
o O'Doherty et al., 2002
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Neurale reacties tijdens het anticiperen op een primaire smaakbeloning
o Neuron, 33 (2002), pp. 815 – 826
o
136.
o O'Rahilly, 2009
o S. O'Rahilly
o Menselijke genetica verlicht de wegen naar metabole ziekten
o Natuur, 462 (2009), pp. 307 – 314
o
137.
o Oswald et al., 2010
o KD Oswald, DL Murdaugh, VL King, MM Boggiano
o Motivatie voor smakelijk voedsel ondanks de gevolgen in een diermodel van eetaanvallen
o Int. J. Eat. Disord. (2010) http://dx.doi.org/10.1002/eat.20808 in druk. Gepubliceerd online februari 22, 2010
o
138.
o Park en Carr, 1998
o TH Park, KD Carr
o Neuroanatomische patronen van fos-achtige immunoreactiviteit geïnduceerd door een smakelijke maaltijd en maaltijd-gepaarde omgeving in met zoutoplossing en met naltrexon behandelde ratten
o Brain Res., 805 (1998), pp. 169 – 180
o
139.
o Peciña en Berridge, 2005
o S. Peciña, KC Berridge
o Hedonische hotspot in nucleus accumbens shell: waar veroorzaken mu-opioïden een verhoogde hedonische impact van zoetheid?
o J. Neurosci., 25 (2005), pp. 11777 – 11786
o
140.
o Peciña et al., 2006a
o S. Peciña, J. Schulkin, KC Berridge
o Nucleus accumbens corticotropin-releasing factor verhoogt cue-triggered motivatie voor sucrosebeloning: paradoxale positieve stimulerende effecten bij stress?
o BMC Biol., 4 (2006), p. 8
o
141.
o Peciña et al., 2006b
o S. Peciña, KS Smith, KC Berridge
o Hedonische hotspots in de hersenen
o Neurowetenschapper, 12 (2006), pp. 500 – 511
o
142.
o Pecoraro et al., 2004
o N. Pecoraro, F. Reyes, F. Gomez, A. Bhargava, MF Dallman
o Chronische stress bevordert smakelijke voeding, die tekenen van stress vermindert: Feedforward en feedback-effecten van chronische stress
o Endocrinologie, 145 (2004), pp. 3754 – 3762
o
143.
o Pelchat et al., 2004
o ML Pelchat, A. Johnson, R. Chan, J. Valdez, JD Ragland
o Beelden van verlangen: activering van voedselhonger tijdens fMRI
o Neuroimage, 23 (2004), pp. 1486 – 1493
o
144.
o Pelleymounter et al., 1995
o MA Pelleymounter, MJ Cullen, MB Baker, R. Hecht, D. Winters, T. Boone, F. Collins
o Effecten van het obese genproduct op de regulering van het lichaamsgewicht bij ob / ob-muizen
o Wetenschap, 269 (1995), pp. 540 – 543
o
145.
o Pelloux et al., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Dwangmatig zoeken naar drugs door ratten onder straf: effecten van geschiedenis van drugsgebruik
o Psychopharmacology (Berl.), 194 (2007), pp. 127 – 137
o
146.
o Perello et al., 2010
o M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Woloszyn, M. Yanagisawa, M. Lutter, JM Zigman
o Ghreline verhoogt de lonende waarde van vetrijk dieet op een orexine-afhankelijke manier
o Biol. Psychiatry, 67 (2010), pp. 880 – 886
o
147.
o Petrovich et al., 2009
o GD Petrovich, CA Ross, P. Mody, PC Holland, M. Gallagher
o Centraal, maar niet basolateraal, amygdala is van cruciaal belang voor de controle van voeding door aversieve aangeleerde signalen
o J. Neurosci., 29 (2009), pp. 15205 – 15212
o
148.
o Pfaffly et al., 2010
o J. Pfaffly, M. Michaelides, GJ Wang, JE Pessin, ND Volkow, PK Thanos
o Leptine verhoogt striatale dopamine D2-receptorbinding bij leptine-deficiënte obese (ob / ob) muizen
o Synaps, 64 (2010), pp. 503 – 510
o
149.
o Puhl et al., 2008
o RM Puhl, CA Moss-Racusin, MB Schwartz, KD Brownell
o Gewichtsstigmatisering en vooroordeelreductie: perspectieven van volwassenen met overgewicht en obesitas
o Gezondheid Educ. Res., 23 (2008), pp. 347 – 358
o
150.
o Rada et al., 2010
o P. Rada, ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
o Verminderde accumbens dopamine in Sprague-Dawley-ratten die gevoelig zijn voor te veel eten van een vetrijk dieet
o Physiol. Gedrag, 101 (2010), pp. 394 – 400
o
151.
o Ritchie en Noble, 2003
o T. Ritchie, EP Noble
o Associatie van zeven polymorfismen van het D2 dopamine-receptorgen met hersenreceptor-bindende eigenschappen
o Neurochem. Res., 28 (2003), pp. 73 – 82
o
152.
o Roberto et al., 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
o Corticotropine-afgevende factor-geïnduceerde amygdala-gamma-aminoboterzuurafgifte speelt een sleutelrol bij alcoholafhankelijkheid
o Biol. Psychiatry, 67 (2010), pp. 831 – 839
o
153.
o Roitman et al., 2004
o MF Roitman, GD Stuber, PE Phillips, RM Wightman, RM Carelli
o Dopamine werkt als een tweede seconde modulator van voedsel zoeken
o J. Neurosci., 24 (2004), pp. 1265 – 1271
o
154.
o Roitman et al., 2008
o MF Roitman, RA Wheeler, RM Wightman, RM Carelli
o Realtime chemische responsen in de nucleus accumbens differentiëren belonende en aversieve stimuli
o Nat. Neurosci., 11 (2008), pp. 1376 – 1377
o
155.
o Rollen, 2008
o ET Rolls
o Functies van de orbitofrontale en pregenual cingulate cortex in smaak, reukzin, eetlust en emotie
o Acta Physiol. Hung., 95 (2008), pp. 131 – 164
o
156.
o Rollen, 2010
o ET Rolls
o Smaak, geur en voedseltextuur belonen verwerking in de hersenen en obesitas
o Int. J. Obes. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 in druk. Online gepubliceerd Augustus 3, 2010
o
157.
o Rolls et al., 1983
o ET Rolls, BJ Rolls, EA Rowe
o Sensorische en motivatie-specifieke verzadiging voor het zicht en de smaak van voedsel en water bij de mens
o Physiol. Gedrag, 30 (1983), pp. 185 – 192
o
158.
o Roseberry et al., 2007
o AG Roseberry, T. Painter, GP Mark, JT Williams
o Verminderde vesiculaire somatodendritische dopamine-voorraden in muizen met een tekort aan leptine
o J. Neurosci., 27 (2007), pp. 7021 – 7027
o
159.
o Rothemund et al., 2007
o Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Differentiële activering van het dorsale striatum door visueel prikkels met veel calorieën bij zwaarlijvige personen
o Neuroimage, 37 (2007), pp. 410 – 421
o
160.
o Salas et al., 2010
o R. Salas, P. Baldwin, M. de Biasi, PR Montague
o Vette reacties op negatieve beloningsvoorspellingsfouten in menselijke habenula
o voorzijde. Brommen. Neurosci., 4 (2010), p. 36
o
161.
o Saper et al., 2002
o CB Saper, TC Chou, JK Elmquist
o De noodzaak om te voeden: homeostatische en hedonische controle van eten
o Neuron, 36 (2002), pp. 199 – 211
o
162.
o Saunders, 2001
o R. Saunders
o Dwangmatig eten en maagomleidingschirurgie: wat heeft honger ermee te maken?
o Obes. Surg., 11 (2001), pp. 757 – 761
o
163.
o Scarpace et al., 2010
o PJ Scarpace, M. Matheny, Y. Zhang
o Wiellopen elimineert de voorkeur voor vet en verbetert leptinesignalering in het ventrale tegmentale gebied
o Physiol. Gedrag, 100 (2010), pp. 173 – 179
o
164.
o Schiltz et al., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Met voedsel geassocieerde signalen veranderen de functionele connectiviteit van de voorhersenen zoals beoordeeld met onmiddellijke vroege gen- en proenkefaline-expressie
o BMC Biol., 5 (2007), p. 16
o
165.
o Schur et al., 2009
o EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o Activatie in hersenenergieregulatie en beloningscentra door voedselsignalen varieert met de keuze van visuele stimulus
o Int. J. Obes. (Lond.), 33 (2009), pp. 653 – 661
o
166.
o Sclafani et al., 1998
o A. Sclafani, RJ Bodnar, AR Delamater
o Farmacologie van voedsel geconditioneerde voorkeuren
o Eetlust, 31 (1998), p. 406
o
167.
o Sescousse et al., 2010
o G. Sescousse, J. Redouté, JC Dreher
o De architectuur van beloningswaardecodering in de menselijke orbitofrontale cortex
o J. Neurosci., 30 (2010), pp. 13095 – 13104
o
168.
o Shomaker et al., 2010
o LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, MK Crocker, AH Ali et al.
o Eten bij afwezigheid van honger bij adolescenten: inname na een uitgebreide maaltijd vergeleken met die na een gestandaardiseerde maaltijd
o Am. J. Clin. Nutr., 92 (2010), pp. 697 – 703
o
169.
o Simmons et al., 2005
o WK Simmons, A. Martin, LW Barsalou
o Foto's van smakelijk voedsel activeren smaakcortices voor smaak en beloning
o Cereb. Cortex, 15 (2005), pp. 1602 – 1608
o
170.
o Klein, 2010
o DM Small
o Smaakrepresentatie in de menselijke insula
o Brain Struct. Funct., 214 (2010), pp. 551 – 561
o
171.
o Small et al., 2003
o DM Small, M. Jones-Gotman, A. Dagher
o Door voeding geïnduceerde afgifte van dopamine in dorsaal striatum correleert met beoordelingen van maaltijdvriendelijkheid bij gezonde menselijke vrijwilligers
o Neuroimage, 19 (2003), pp. 1709 – 1715
o
172.
o Smith en Berridge, 2007
o KS Smith, KC Berridge
o Opioïde limbisch circuit voor beloning: interactie tussen hedonische hotspots van nucleus accumbens en ventrale pallidum
o J. Neurosci., 27 (2007), pp. 1594 – 1605
o
173.
o Söderpalm en Berridge, 2000
o AH Söderpalm, KC Berridge
o Voedselinname na diazepam, morfine of muscimol: micro-injecties in de kern accumbens shell
o Pharmacol. Biochem. Gedrag, 66 (2000), pp. 429 – 434
o
174.
o Stice et al., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Small
o Relatie tussen obesitas en botte striatale reactie op voedsel wordt gemodereerd door TaqIA A1 allel
o Wetenschap, 322 (2008), pp. 449 – 452
o
175.
o Stice et al., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Small
o Relatie van beloning van voedselinname en verwachte voedselinname tot obesitas: een onderzoek naar functionele beeldvorming met magnetische resonantie
o J. Abnorm. Psychol., 117 (2008), pp. 924 – 935
o
176.
o Stice et al., 2010a
o E. Stice, S. Yokum, K. Blum, C. Bohon
o Gewichtstoename wordt geassocieerd met een verminderde striatale reactie op smakelijk voedsel
o J. Neurosci., 30 (2010), pp. 13105 – 13109
o
177.
o Stice et al., 2010b
o E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o Responsiviteit van beloningscircuits op voedsel voorspelt toekomstige toename van lichaamsmassa: matigende effecten van DRD2 en DRD4
o Neuroimage, 50 (2010), pp. 1618 – 1625
o
178.
o Stoeckel, 2010
o Stoeckel, LE (2010). Het Goldilocks-principe van obesitas. Wetenschappelijke Amerikaan. Juni 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Stratford en Kelley, 1997
o TR Stratford, AE Kelley
o GABA in de nucleus accumbens shell neemt deel aan de centrale regulatie van voedingsgedrag
o J. Neurosci., 17 (1997), pp. 4434 – 4440
o
180.
o Stratford en Kelley, 1999
o TR Stratford, AE Kelley
o Bewijs van een functionele relatie tussen de nucleus accumbens shell en laterale hypothalamus die de controle van voedingsgedrag onderwerpt
o J. Neurosci., 19 (1999), pp. 11040 – 11048
o
181.
o Suarez en Gallup, 1981
o SD Suarez, GGJ Gallup
o Een ethologische analyse van open-veldgedrag bij ratten en muizen
o leren. Motiv., 12 (1981), pp. 342 – 363
o
182.
o Sunday et al., 1983
o SR Sunday, SA Sanders, G. Collier
o Smakelijkheid en maaltijdpatronen
o Physiol. Gedrag, 30 (1983), pp. 915 – 918
o
183.
o Swinburn et al., 2009
o B. Swinburn, G. Sacks, E. Ravussin
o Een verhoogde voedselvoorziening is meer dan voldoende om de Amerikaanse obesitas-epidemie te verklaren
o Am. J. Clin. Nutr., 90 (2009), pp. 1453 – 1456
o
184.
o Taha and Fields, 2005
o SA Taha, HL Fields
o Codering van smakelijkheid en eetlustgedrag door verschillende neuronale populaties in de nucleus accumbens
o J. Neurosci., 25 (2005), pp. 1193 – 1202
o
185.
o Taha et al., 2009
o SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Fields
o Convergente, niet seriële, striatale en pallidale circuits reguleren door opioïden geïnduceerde voedselinname
o Neurowetenschappen, 161 (2009), pp. 718 – 733
o
186.
o Teegarden and Bale, 2007
o SL Teegarden, TL Bale
o Dalingen van de voedingsvoorkeur produceren een verhoogde emotionaliteit en een risico op terugval van de voeding
o Biol. Psychiatry, 61 (2007), pp. 1021 – 1029
o
187.
o Teegarden et al., 2009
o SL Teegarden, AN Scott, TL Bale
o Vroege blootstelling aan een vetrijk dieet bevordert langdurige veranderingen in voedingsvoorkeuren en centrale beloningssignalering
o Neurowetenschappen, 162 (2009), pp. 924 – 932
o
188.
o Thanos et al., 2008
o PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o Voedselbeperking verhoogt de dopamine D2-receptor (D2R) aanzienlijk in een rattenmodel van obesitas zoals beoordeeld met in-vivo muPET-beeldvorming ([11C] raclopride) en in-vitro ([3H] spiperon) autoradiografie
o Synaps, 62 (2008), pp. 50 – 61
o
189.
o Thompson en Swanson, 2010
o RH Thompson, LW Swanson
o Hypothese-gestuurde structurele connectiviteitsanalyse ondersteunt netwerk over hiërarchisch model van hersenarchitectuur
o Proc. Natl. Acad. Sci. VS, 107 (2010), pp. 15235 – 15239
o
190.
o Vanderschuren en Everitt, 2004
o LJ Vanderschuren, BJ Everitt
o Het zoeken naar drugs wordt dwangmatig na langdurig zelf toedienen van cocaïne
o Wetenschap, 305 (2004), pp. 1017 – 1019
o
191.
o Vendruscolo et al., 2010a
o LF Vendruscolo, AB Gueye, M. Darnaudéry, SH Ahmed, M. Cador
o Suikerconsumptie tijdens de adolescentie verandert selectief de motivatie en beloningsfunctie bij volwassen ratten
o PLAATS EEN, 5 (2010), p. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo et al., 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o Minder alcoholgebruik bij volwassen ratten die tijdens de adolescentie aan sucrose zijn blootgesteld
o Neuropharmacology, 59 (2010), pp. 388 – 394
o
193.
o Volkow en O'Brien, 2007
o ND Volkow, CP O'Brien
o Kwesties voor DSM-V: moet obesitas worden opgenomen als een hersenstoornis?
o Am. J. Psychiatry, 164 (2007), pp. 708 – 710
o
194.
o Volkow en Wise, 2005
o ND Volkow, RA Wise
o Hoe kan drugsverslaving ons helpen obesitas te begrijpen?
o Nat. Neurosci., 8 (2005), pp. 555 – 560
o
195.
o Volkow et al., 2009
o ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan
o Omgekeerd verband tussen BMI en prefrontale metabole activiteit bij gezonde volwassenen
o Obesitas (Silver Spring), 17 (2009), pp. 60 – 65
o
196.
o Vucetic en Reyes, 2010
o Z. Vucetic, TM Reyes
o Centrale dopaminerge circuits die voedselinname en beloning regelen: implicaties voor de regulering van obesitas
o Wiley Interdiscip. Rev. Syst. Biol. Med., 2 (2010), pp. 577 – 593
o
197.
o Wang et al., 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o Hersen dopamine en obesitas
o Lancet, 357 (2001), pp. 354 – 357
o
198.
o Wang et al., 2002
o GJ Wang, ND Volkow, JS Fowler
o De rol van dopamine in motivatie voor voedsel bij mensen: implicaties voor obesitas
o Opinies van experts. Ther. Doelen, 6 (2002), pp. 601 – 609
o
199.
o Wang et al., 2004a
o GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
o Blootstelling aan eetlustprikkels activeert duidelijk het menselijk brein
o Neuroimage, 21 (2004), pp. 1790 – 1797
o
200.
o Wang et al., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o Overeenkomsten tussen obesitas en drugsverslaving zoals beoordeeld door neurofunctionele beeldvorming: een conceptevaluatie
o J. Addict. Dis., 23 (2004), pp. 39 – 53
o
201.
o Wang et al., 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
o Maagzwelling activeert verzadigingsschakelingen in het menselijk brein
o Neuroimage, 39 (2008), pp. 1824 – 1831
o
202.
o Wassum et al., 2009
o KM Wassum, SB Ostlund, NT Maidment, BW Balleine
o Verschillende opioïde circuits bepalen de smakelijkheid en de wenselijkheid van belonende gebeurtenissen
o Proc. Natl. Acad. Sci. VS, 106 (2009), pp. 12512 – 12517
o
203.
o Wassum et al., 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
o μ-Opioïdereceptoractivering in de basolaterale amygdala bemiddelt het leren van verhogingen, maar geen verlagingen van de stimulanswaarde van een voedselbeloning
o J. Neurosci., 31 (2011), pp. 1591 – 1599
o
204.
o Wilkinson en Peele, 1962
o HA Wilkinson, TL Peele
o Modificatie van intracraniële zelfstimulatie door hongerverzadiging
o Am. J. Physiol., 203 (1962), pp. 537 – 540
o
205.
o Will et al., 2003
o MJ Will, EB Franzblau, AE Kelley
o Nucleus accumbens mu-opioïden reguleren de inname van een vetrijk dieet via activering van een gedistribueerd hersennetwerk
o J. Neurosci., 23 (2003), pp. 2882 – 2888
o
206.
o Wilson et al., 2008
o ME Wilson, J. Fisher, A. Fischer, V. Lee, RB Harris, TJ Bartness
o Kwantificering van voedselinname bij sociaal apen: sociale statuseffecten op calorische consumptie
o Physiol. Gedrag, 94 (2008), pp. 586 – 594
o Artikel | PDF (553 K) |
Bekijk record in Scopus
| Cited By in Scopus (22)
207.
o Yurcisin et al., 2009
o BM Yurcisin, MM Gaddor, EJ DeMaria
o Obesitas en bariatrische chirurgie
o Clin. Borstmed., 30 (2009), pp. 539 – 553, ix
o
208.
o Zhang et al., 1998
o M. Zhang, BA Gosnell, AE Kelley
o De inname van vetrijk voedsel wordt selectief verbeterd door mu opioïdereceptorstimulatie in de nucleus accumbens
o J. Pharmacol. Exp. Ther., 285 (1998), pp. 908 – 914
o Bekijk record in Scopus
| Cited By in Scopus (148)
209.
o Zheng et al., 2007
o H. Zheng, LM Patterson, HR Berthoud
o Orexinesignalering in het ventrale tegmentale gebied is vereist voor vetrijke eetlust veroorzaakt door opioïde stimulatie van de nucleus accumbens
o J. Neurosci., 27 (2007), pp. 11075 – 11082
o Bekijk record in Scopus
| Cited By in Scopus (64)
210.
o Zheng et al., 2009
o H. Zheng, NR Lenard, AC Shin, HR Berthoud
o Eetlustcontrole en energiebalansregulatie in de moderne wereld: beloningsgestuurde hersenen hebben voorrang op repletiesignalen
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), pp. S8 – S13
o Bekijk record in Scopus
| Cited By in Scopus (34)