Wetenschappelijke rapporten volume 9, Artikel nummer: 16918 (2019)
Abstract
Overmatig gebruik van sucrose roept verslavingachtige trek op die de obesitas-epidemie kan ondersteunen. Opioïden en dopamine bemiddelen de lonende effecten van drugs van misbruik, en van natuurlijke beloningen van stimuli zoals smakelijk voedsel. We hebben de effecten van sucrose onderzocht met behulp van PET-beeldvorming met [11C] carfentanil (μ-opioïde receptoragonist) en [11C] raclopride (dopamine D2 / 3-receptorantagonist) in zeven vrouwelijke geanesthetiseerde Göttingen-minivarkens. Vervolgens gaven we minipigs toegang tot sucrose-oplossing gedurende één uur op 12 opeenvolgende dagen en hebben we 24 uur na de laatste sucrose-toegang opnieuw beeldvorming uitgevoerd. In een kleinere steekproef van vijf minivarkens hebben we een extra [11C] carfentanil PET-sessie na de eerste blootstelling aan sucrose. We berekenden voxelgewijze bindingspotentialen (BPND) gebruik van het cerebellum als een gebied van niet-verplaatsbare binding, analyseerde verschillen met statistische niet-parametrische mapping en voerde een regionale analyse uit. Na 12 dagen toegang tot sucrose, BPND van beide tracers was significant gedaald in striatum, nucleus accumbens, thalamus, amygdala, cingulate cortex en prefrontale cortex, consistent met down-regulatie van receptordichtheden. Na een enkele blootstelling aan sucrose vonden we een verminderde binding van [11C] carfentanil in nucleus accumbens en cingulate cortex, consistent met opioïde afgifte. De lagere beschikbaarheid van opioïde- en dopaminereceptoren kan het verslavende potentieel van de inname van sucrose verklaren.
Introductie
Vijf procent van de wereldbevolking is klinisch zwaarlijvig1. Als kenmerk van het metabool syndroom wordt obesitas geassocieerd met diabetes type 2, hart- en vaatziekten, ademhalingsproblemen en het risico op depressie en mogelijk dementie2. De toegenomen consumptie van energierijk voedsel heeft het fysiologische onderscheid tussen homeostatische honger die volgt op voedselgebrek en hedonische honger of 'verlangen', dat optreedt in afwezigheid van ontbering, overdreven3,4. Omdat de homeostatische regulering alleen de huidige toename van obesitas niet kan verklaren, is het verplicht om het effect op de hersenmechanismen van beloning en plezier van de verslavende eigenschappen van zeer smakelijk voedsel te testen.
Consumptie van sucrose wordt geassocieerd met obesitas en sucrose wordt steeds meer als een verslavende stof beschouwd5. Sommige bevindingen zijn in tegenspraak met deze claim vanwege problemen bij het scheiden van niet-smakelijke voedselconsumptie van hedonische voedselreacties, en bij het bepalen van het verslavende ingrediënt in verwerkt voedsel, evenals de verschillende mechanismen waarmee voedsel hersencircuits verandert via natuurlijke paden6. Desalniettemin veroorzaakt de inname van sucrose in specifieke contexten beloning en verlangen, vergelijkbaar in omvang als die veroorzaakt door verslavende medicijnen, die leiden tot overconsumptie en uiteindelijke obesitas6,7.
Honger wordt geassocieerd met 'willen' dat nauw verband houdt met effecten van dopaminerge neurotransmissie in een aantal beloningsomstandigheden8, maar het blijft onduidelijk hoe de werking van dopamine (DA) wordt gemoduleerd als reactie op dwangmatig eten. Consumptie van smakelijk voedsel is gekoppeld aan "smaak", voornamelijk gemedieerd door het endogene opioïde systeem, vooral de μ-opioïde receptor (μOR)9,10, die overconsumptie kan bevorderen wanneer gedereguleerd. In het huidige rapport testen we de claim dat sucrose leidt tot afgifte van opioïden en dopamine die de beschikbaarheid van μOR- en DA D2 / 3-receptoren verlaagt. De beschikbaarheid is een index van het aantal niet-bezette receptoren beschikbaar voor tracerbinding en maakt in principe geen onderscheid tussen ligandbezetting en receptordichtheid11.
Het begin van dwangmatig eten is afhankelijk van meerdere factoren en causaal onderzoek bij mensen roept ethische problemen op. De meeste onderzoeken richten zich daarom op het voedingsgedrag bij ratten12. Hoewel ratten een "zoetekauw" hebben, verschillen hun homeostatische mechanismen die belangrijk zijn voor gewichtstoename, metabolisme en type vetophoping aanzienlijk van die van mensen. De minipig van Göttingen is een groot omnivoor dier met een goed ontwikkeld gyrencefalisch brein, dat met voldoende resolutie kan worden afgebeeld. De goed gedefinieerde subcorticale en prefrontale corticale regio's13 een meer directe vertaling naar de menselijke hersenfunctie mogelijk maken. Hier gebruiken we positronemissietomografie (PET) -beeldvorming om te testen in vivo μOR en DA D2 / 3 beschikbaarheid in een minipig model van subchronische blootstelling aan sucrose. In een kleinere steekproef onderzochten we de onmiddellijke effecten op de bezettingsgraad van μOR na de eerste blootstelling aan sucrose. Ten slotte hebben we de relatie getest tussen de veranderingen in receptorbeschikbaarheid van de twee tracers.
Resultaten
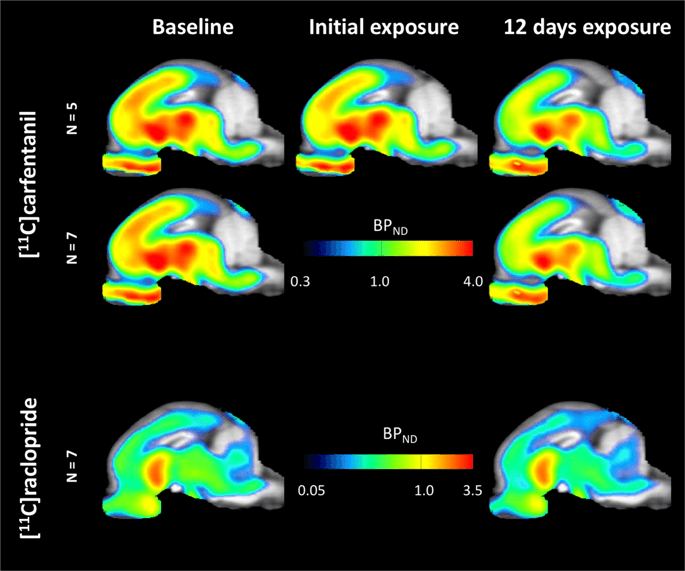
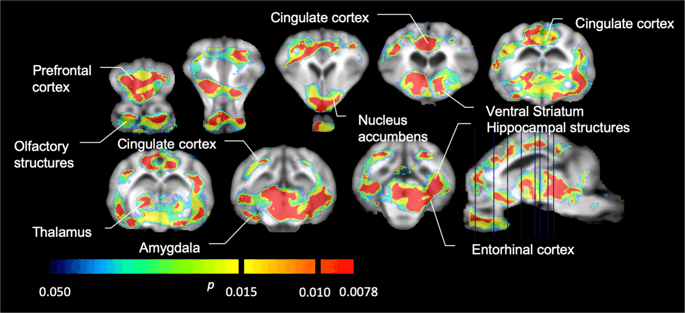
Gemiddelde parametrische kaarten van [11C] carfentanil en [11C] raclopride bindend potentieel (BPND) worden getoond in Fig. 1. Om de veranderingen te analyseren die optreden na de eerste blootstelling aan sucrose bij vijf minivarkens ten opzichte van de uitgangswaarde en één dag na de 12th sucrose-toegang in zeven minivarkens vergeleken met de uitgangswaarde, we gebruikten permutatietheorie en niet-regionaal beperkte gehele hersenen-analyse, de voorkeursmethode voor monsters van deze grootte14.
Gemiddeld voxelgewijs niet-verplaatsbaar bindingspotentieel (BPND) kaarten gesuperponeerd op MRI-afbeeldingen in sagittale weergave. Gegevens worden gepresenteerd voor [11C] carfentanil BPND van de 5 minivarkens afgebeeld bij aanvang, na initiële blootstelling aan sucrose en na 12 dagen blootstelling aan sucrose (bovenste rij). [11C] carfentanil BPND van alle 7 minivarkens afgebeeld op basislijn en na 12 dagen toegang tot sucrose worden gepresenteerd in de middelste rij. [11C] raclopride BPND van alle 7 minivarkens afgebeeld op basislijn en na 12 dagen toegang tot sucrose worden weergegeven in de onderste rij. Merk op dat de kleurenschaal exponentieel is om de [11C] raclopride BPND in extrastriatale gebieden.
Eerste blootstelling aan sucrose
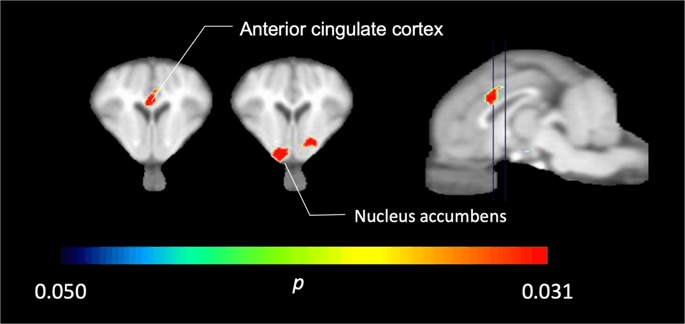
In de vijf minivarkens afgebeeld met [11C] carfentanil bij aanvang en onmiddellijk na de eerste blootstelling aan sucrose, vonden we een aanzienlijk verminderde tracerbinding in de voorste cingulaire cortex en de nucleus accumbens in reactie op sucrose, in kleur weergegeven in Fig. 2, wat aangeeft p <0.05. We ontdekten maar liefst 14% verminderde tracerbinding in beide gebieden in vergelijking met de basislijn.
Aanzienlijke dalingen van [11C] carfentanil BPND na de eerste blootstelling aan sucrose water vergeleken met baseline (n = 5). Alleen voxels met significante (p <0.05) afnames worden weergegeven als gekleurde gebieden die worden geprojecteerd op T1-gewogen MRI-coupes op het niveau van de anterieure cingulate cortex (links) en nucleus accumbens (midden) vanuit een stereotactische minipig-hersenatlas. Merk op dat het maximale significantieniveau dat haalbaar is met 5 dieren 2 is-5 ≈ 0.031 (zie kleurenbalk). Gegevens worden gepresenteerd over coronale secties van de varkenshersenen op de niveaus aangegeven op het sagittale beeld (rechts).
12 dagen toegang tot sucrose
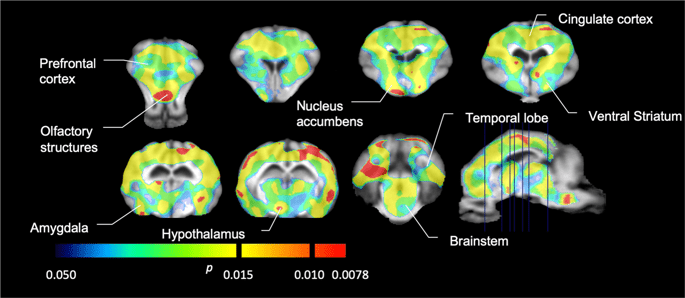
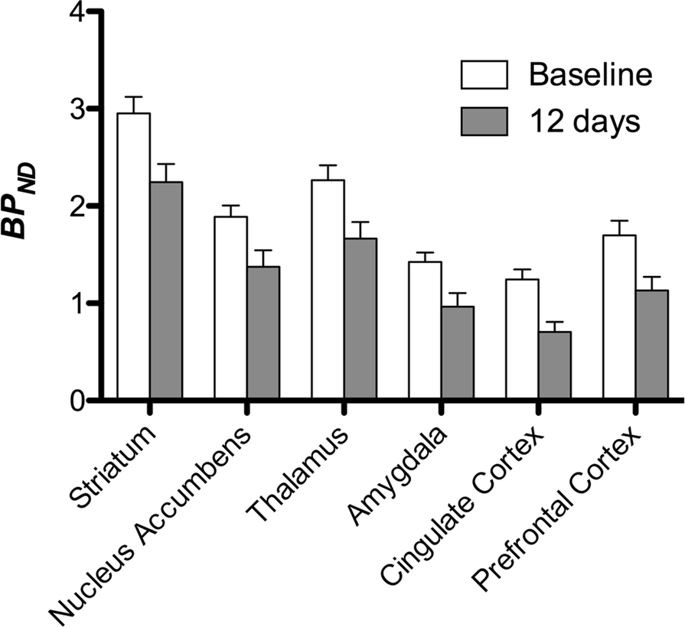
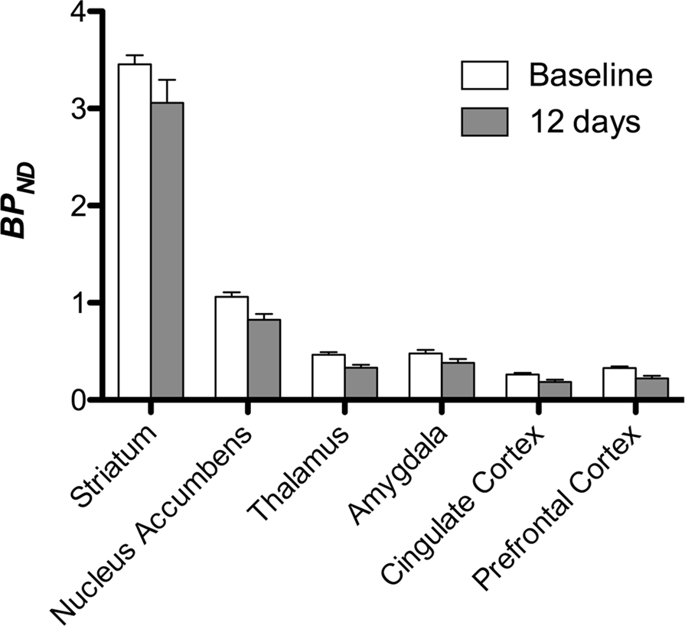
We hebben vervolgens de analyse uitgevoerd van zeven minivarkens afgebeeld met [11C] carfentanil bij aanvang en na 12 dagen toegang tot sucrose en vond significant verminderde tracerbinding bij aan sucrose blootgestelde dieren in vergelijking met uitgangswaarde. De meest sterk getroffen gebieden worden in Fig. 3 (p <0.01) en omvatten delen van de reukstructuren, nucleus accumbens / ventrale striatum en de temporale cortex / lob, gevolgd door gebieden die in geel zijn weergegeven (p <0.015) die delen van de prefrontale cortex, cingulaire cortex, amygdala en hersenstam omvatten . Om BP te krijgenND waarden en beoordelen percentage verandering, voerden we regionale analyse uit en verkregen gemiddelde waarden in elke regio bij aanvang en na sucrose consumptie (Fig. 4).
Aanzienlijke dalingen van [11C] carfentanil bindend potentieel (BPND) tussen nulmeting en na 12 dagen blootstelling aan sucrose water (n = 7). De voxels met significante (p <0.05) afnames worden weergegeven als gekleurde gebieden die worden geprojecteerd op T1-gewogen MRI-coupes van een stereotactische minivarkensatlas. Gegevens worden gepresenteerd op coronale hersencoupes op de niveaus die zijn aangegeven op de sagittale afbeelding (rechtsonder). Merk op dat het maximale significantieniveau dat haalbaar is met 7 dieren 2 is-7 ≈ 0.0078 (zie kleurenbalk).
We gebruikten [11C] raclopride als de tracer van DA D2 / 3-receptoren in striatale en extrastriatale hersengebieden in minivarkens bij aanvang en na 12 dagen toegang tot sucrose (Fig. 1). We vonden verminderde tracerbinding bij aan sucrose blootgestelde dieren, vergeleken met de basislijn met de grootste effecten (p <0.01) in gebieden van de prefrontale cortex, nucleus accumbens / ventraal striatum, cingulaire cortex, amygdala, thalamus, mesencephalon, hippocampusgebieden en reukgebieden. (Afb. 5). Gegevens uit regionale analyse worden gepresenteerd in Fig. 6.
Aanzienlijke dalingen van [11C] raclopride bindend potentieel (BPND) tussen nulmeting en na 12 dagen blootstelling aan sucrose water (n = 7). De voxels met significante (p <0.05) afnames worden weergegeven als gekleurde gebieden die worden geprojecteerd op T1-gewogen MRI-coupes van een stereotactische minivarkensatlas. Gegevens worden gepresenteerd over coronale secties van de varkenshersenen op de niveaus die zijn aangegeven op de sagittale afbeelding (rechtsonder). Merk op dat het maximale significantieniveau dat haalbaar is met 7 dieren 2 is-7 ≈ 0.0078 (zie kleurenbalk).
Correlaties tussen [11C] raclopride en [11C] carfentanil gegevens
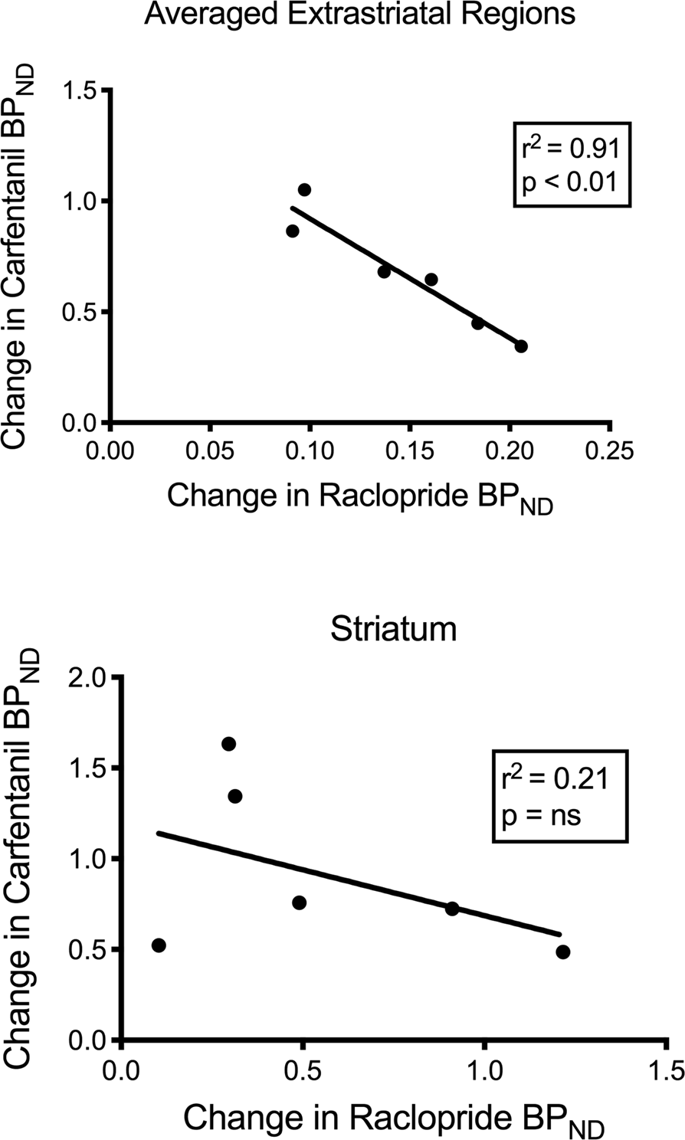
We hebben de potentiële correlatie getest tussen [11C] raclopride en [11C] carfentanil waarden van BPND in striatale en niet-striatale gebieden bij minivarkens bij aanvang en na 12 dagen sucrose-inname, zonder associaties waargenomen. We hebben vervolgens getest of dalingen van tracerbinding gecorreleerd waren en we vergeleken de veranderingen van BPND voor [11C] raclopride met de veranderingen van BPND voor [11C] carfentanil alleen in de minivarkens die een lagere bloeddruk haddenND van beide tracers na inname van sucrose (n = 6). We vonden significante negatieve correlaties in gemiddeld extrastriataal (r2 = 0.91, p <0.01), maar niet in striatale regio's (Fig. 7).
Correlaties tussen pre-minus post-dalingen van [11C] raclopride en [11C] carfentanil bindend potentieel (BPND) bij minivarkens met verminderde tracerbinding na sucrose-inname (n = 6). Gegevens van de gemiddelde extrastriatale gebieden (boven) en striatum (onder) worden gepresenteerd. De bepalingscoëfficiënt (r2) en de p-waarden worden voor elke grafiek weergegeven.
Discussie
We bepaalden de effecten van herhaalde intermitterende toegang tot sucrose op opioïde en DA neurotransmissie in zoogdierhersenen. lengte- in vivo PET-beeldvorming van de μOR- en DA D2 / 3-receptoren onthulde een verminderde beschikbaarheid van de receptor gedurende het hele beloningscircuit, inclusief de nucleus accumbens, prefrontale cortex en de voorste cingulaire cortex. De resultaten tonen duidelijk aan dat sucrose beloningsmechanismen beïnvloedt op een manier die vergelijkbaar is met die van drugs.
Het is bekend dat de inname van sucrose als een smakelijke stof DA vrijmaakt en afhankelijkheid bij knaagdieren veroorzaakt15, waarbij sucrose in bepaalde contexten zelfs nog aangenamer is dan cocaïne bij knaagdieren. Aldus werken knaagdieren intensiever om sucrose te verkrijgen dan cocaïne, zelfs in afwezigheid van voedselgebrek5. De effecten van sucrose worden echter zowel gereguleerd door het homeostatische systeem als door hedonische beloningscircuits16,17 dat het onderscheid tussen voedings- en hedonische aspecten van sucrose-actie kan bemiddelen18. We kozen voor een schema van één uur per dag om 'binging' te bevorderen, omdat eerdere studies bij ratten een hogere inname hadden aangetoond tijdens het eerste uur van dagelijkse toegang in een intermitterend schema15,19. Gedragsstudies van voedselinname zijn vaak gericht op voedselbeperkte dieren, maar het ontwerp hoeft niet noodzakelijk dezelfde neurale mechanismen te weerspiegelen die actief zijn bij obesitas. Varkens in het huidige onderzoek hadden geen voedselbeperking en kregen naast de toegang tot sucrose de gebruikelijke hoeveelheden van hun normale dieet.
Opioïdereceptoren (OF) komen op grote schaal tot expressie in de hersenen, met name in structuren waarvan bekend is dat ze eet- en beloningsprocessen moduleren20. Van OR's is aangetoond dat ze belangrijk zijn voor de lonende en recidiverende effecten van cocaïne21,22,23,24. Wijzigingen in binding zijn ook in verband gebracht met de homeostatische reacties op eten en het plezier geassocieerd met smakelijk voedsel25. In het bijzonder is het 'liken' van voedsel gekoppeld aan het endogene opioïde systeem, met name de μOR9,10 in de schil van de nucleus accumbens en het ventrale pallidum26. Infusies van een μOR-agonist in afzonderlijke gedeelten van de nucleus accumbens en ventrale pallidum verbeteren het "liking" -gedrag sterk, inclusief tonguitsteeksels en likken van de poot, na verhoogde smakelijke voedselinname27,28,29. Verder bewijs voor opioïdensignalering bij de verwerking van hedonische regulatie is afkomstig van μOR-antagonisten die de consumptie van smakelijke chow in beide verminderen ad libitum-diervoeders en voedselbeperkte dieren, maar met een beperkter effect op de inname van niet-smakelijke standaardpellets30,31. Bij mensen verminderen μOR-antagonisten de voedselinname op de korte termijn en verminderen de aangenaamheid van smakelijk voedsel32,33,34. Opioïdesignalering in de basolaterale amygdala draagt ook bij aan het 'willen' van voedsel door modulatie van beloning zoeken en de stimulerende waarde van voedsel35.
Met [11C] carfentanil, we hebben beelden verkregen van tracerbinding die gevoelig is voor zowel μOR-niveaus als voor de afgifte van endogene opioïden door de hersenen36,37. We ontdekten onmiddellijk verlies van μOR beschikbaarheid in gebieden van de nucleus accumbens en anterior cingulate cortex, specifieke hersengebieden van de beloningsroute, na initiële consumptie van sucrose door vijf minivarkens, consistent met endogene opioïde afgifte. Eerdere studies hebben aangetoond dat smakelijk eten kan leiden tot gevoelens van plezier38 door opioïde afgifte te stimuleren. Na 12 dagen toegang tot sucrose, namen we af [11C] carfentanil binding, die verschillende mogelijke verklaringen heeft39 inclusief endogene opioïde afgifte en binding aan μOR, μOR internalisatie als gevolg van verhoogde opioïde binding en verhoogde DA D2 / 3-receptoractivatie leidend tot heterologe desensitisatie van μOR40.
Ter ondersteuning van de huidige bevindingen, [11C] carfentanil studies bij patiënten met boulimia41obesitas42,43,44en eetstoornis45, tonen verminderde beschikbaarheid van de receptor. Dit zijn echter chronische aandoeningen, terwijl de minivarkens slechts 12 dagen sucrose ontvingen. In een onderzoek naar acuut voedingsgedrag bij gezonde mannen leidde voeding tot robuuste en wijdverspreide endogene cerebrale opioïde afgifte, zowel in aanwezigheid als afwezigheid van hedonia, hetgeen suggereert dat opioïde afgifte metabolische en homeostatische, evenals hedonische reacties weergeeft25. Deze studie, samen met een andere die patiënten in beeld bracht na een vloeibare chocoladesmaak44, is direct relevant voor het acute onderzoek van vijf minivarkens na de eerste blootstelling aan sucrose, maar verschilt van het onderzoek naar subchronische blootstelling aan sucrose gedurende 12 dagen, waar de verminderde beschikbaarheid van de receptor waarschijnlijk een weerspiegeling is van herhaalde overstimulatie en gelijktijdige verlaging van μOR.
De prefrontale cortex is belangrijk bij het nemen van beslissingen en het toekennen van waarde aan items en daarom kan de μOR in de prefrontale cortex verantwoordelijk zijn voor de veranderde evaluatie van de voedselsufficiëntie, die het verslavende potentieel van voedsel kan verhogen. We hebben een verminderde binding in de prefrontale cortex gevonden, consistent met eerdere studies die aantonen dat een vetrijk dieet de hoeveelheid μOR mRNA in de prefrontale cortex verlaagt46 en dat infusie van een μOR-agonist in de prefrontale cortex de inname van zoet voedsel verhoogt47. Wederom rijst echter de vraag of het vetrijke dieet een meer chronische aandoening is die waarschijnlijk de receptor-downregulatie bemiddelt, in vergelijking met het sucrose-voedende ontwerp op kortere termijn, wat suggereert aanhoudende afgifte van endogene opioïden die tracer carfentanil verdringt gebonden aan μOR , zelfs na 12 dagen sucrose.
DA is betrokken bij zowel beloningen van drugs als van gedrag. Chronisch cocaïnegebruik bleek DA-signalering te remmen48. DA D1- en D2 / 3-receptorniveaus worden veranderd door nicotine in varkenshersenen49, en in niet-menselijke primaten met een geschiedenis van cocaïne-misbruik50, consistent met de downregulatie van D2 / 3-receptoren in de hersenen van cocaïneverslaafden51,52. Wat betreft geneesmiddelen voor misbruik is aangetoond dat sucrose DA D1-receptoren opreguleert19 en verhoog de DA-release53, het versterken van de rol van DA in "willen" in relatie tot smakelijk voedsel. Eerdere PET-studies hebben een afname aangetoond in de beschikbaarheid van striatale DA D2 / 3-receptoren in morbide obesitas versus gemiddeld gewicht54,55, vergelijkbaar in grootte met de vermindering van drugsverslaafde patiënten56en in dieren met modellen van obesitas57. In knaagdierstudies bevordert D2 / 3-receptor knockdown in het striatum de ontwikkeling van dwangmatig voedsel zoeken bij ratten met toegang tot smakelijk voedsel57.
Onze waarnemingen van verminderde D2 / 3-receptorbeschikbaarheid van het varken kunnen duiden op verhoogde DA-waarden als reactie op de stimulerende saillantie geassocieerd met de inname van sucrose, omdat DA wordt vrijgegeven als onderdeel van het willen van drugs van misbruik en andere plezierige activiteiten52,58,59,60. Omdat de varkens tijdens de beeldvorming waren verdoofd en binnen 24 uur geen sucrose hadden ontvangen, nam de verlaagde D2 / 3 BP afND meer waarschijnlijk weerspiegelt een vermindering van het aantal receptoren in reactie op langdurige toename van DA-afgifte bij elk van de 12 dagen van toegang tot sucrose. De reductie kan de beloningsdrempels van de hersenen verhogen, geassocieerd met downregulatie van striatale DA D2-receptoren. Dit kan de verhoogde gevoeligheid voor misbruik van medicijnen verklaren die in eerdere studies met te veel sucrose bij ratten zijn waargenomen, wat leidde tot kruisgevoeligheid voor cocaïne, hyperactiviteit na een lage dosis amfetamine, verhoogde alcoholinname bij het onthouden van sucrose en tolerantie voor de pijnstillende effecten van opiaten6.
Een eerdere studie van obesitas in de minipig van Göttingen identificeerde een verminderde cerebrale bloedstroom in de nucleus accumbens, ventrale tegmentale zone (VTA) en prefrontale cortex, met single photon emissie computertomografie (SPECT) van de hersenen61. In overeenstemming met deze bevindingen zagen we een verminderde DA D2 / 3-binding in het ventroforebraingebied met de nucleus accumbens en in de prefrontale cortex. Extracellulaire niveaus van DA worden 3-voudig verhoogd in de nucleus accumbens na opname van sucrose in vrij bewegende ratten die microdialyse ondergaan62. Bij van sucrose afhankelijke dieren kan herhaalde inname van sucrose leiden tot afgifte van DA uit de schil van nucleus accumbens63. Dieren die een beperkt dieet met beperkte toegang tot sucrose kregen, hadden een lagere DA D2-receptorbinding in de nucleus accumbens shell en het dorsale striatum64. Beperkte diëten met hoog vet- en sucrosegehalte kunnen leiden tot langdurige downregulatie van D1- en D2-receptormRNA in de nucleus accumbens65. Een microdialyse-onderzoek naar de effecten van smakelijk voedsel onthulde een verhoogde DA-afgifte in de nucleus accumbens en prefrontale cortex toen het voedsel nog als nieuw werd beschouwd; zodra de ratten gewend waren aan het nieuwe voer, werd de verhoogde afgifte afgestompt in de nucleus accumbens, maar niet in de prefrontale cortex66. De differentiële gevoeligheid voor gewenning en conditionering van de activiteit in twee regio's kan de grotere toename in waargenomen in prefrontale cortex verklaren dan in nucleus accumbens van minivarkens blootgesteld aan dezelfde smakelijke substantie die na twaalf dagen nieuwigheid verloor. Omdat we minipigs echter niet hebben afgebeeld met [11C] raclopride na de eerste sucrose-toediening, deze verklaring is speculatief.
De prefrontale cortex moduleert uitvoerende functie, besluitvorming en zelfbeheersing67. Dysfunctionele DA-neurotransmissie in de prefrontale cortex schaadt modulatie van beloningsverwerking, hetgeen suggereert dat een verminderde uitvoerende functie en besluitvormingsvaardigheden bij zwaarlijvige individuen68,69. Bovendien correleerde een humaan PET-onderzoek een verminderd metabolisme van de frontale cortex met een verminderde striatale D2-binding bij obesitas70. Hier vinden we een verminderde beschikbaarheid van D2 / 3-receptoren in de prefrontale cortex, inclusief de orbitofrontale cortex van varkens die zijn blootgesteld aan het sucrose-regime.
Dopaminerge neuronen van de VTA sturen projecties naar de hippocampus en amygdala, waar ze gewoonteachtig gedrag ondersteunen71 en bemiddelen bij het coderen en ophalen van conditionering tot medicijn72,73 en eten signalen74,75. Beeldvorming van het menselijk brein heeft hippocampale activering aangetoond als reactie op hunkering en smaak76. Consistent met onze bevindingen van een verminderde beschikbaarheid van hippocampale en amygdalaire D2 / 3-receptoren in reactie op sucrose, in kaart brengen van menselijke hersenen met [18F] fallypride vertoonde door cocaïne cue geïnduceerde DA-afgifte in amygdala en hippocampus77. In knaagdierhersenen veroorzaakte blootstelling aan cocaïne cue DA-afgifte in de amygdala78en veranderingen van de amygdala DA-niveaus hadden invloed op door cue veroorzaakt cocaïnezoekend gedrag79.
In een onderzoek onder zwaarlijvige individuen werd de associatie tussen D2 / 3 en μOR beschikbaarheid, waarvan bekend is dat deze voorkomt in striatale regio's van magere individuen, verstoord in het ventrale striatum80. We vergeleken de waarden van BPND van de twee tracers om te testen of de gegevens dit effect reproduceren. In tegenstelling tot magere mensen, hadden de huidige hersenen van varkens geen verband tussen de waarden van BPND van de twee tracers, bij aanvang of na de blootstelling aan sucrose. We hebben vervolgens getest of de dieren met de grootste afname van de tracer-raclopride-binding ook de grootste afname van de tracer-carfentanil-binding zouden hebben, maar in plaats daarvan vonden we een negatieve correlatie in de gemiddelde extrastriatale regio's, wat suggereert dat dieren met de grootste verandering in het bindingspotentieel van tracer raclopride had de laagste verandering van het bindingspotentieel van tracer carfentanil. De omgekeerde relatie tussen de veranderingen suggereert dat de effecten van sucrose-inname op de beschikbaarheid van de respectieve receptoren in tegengestelde richtingen worden gereguleerd. Het is bekend dat overmatige consumptie van smakelijk voedsel of medicijnen kan worden aangedreven door willen of leuk vinden, of beide60,81. Het is mogelijk dat de grootte van willen gedreven door dopamine de grootte van likeren gedreven door opioïden teniet doet, of vice versa. Recent bewijs wijst op rollen van GABAA receptoren in de VTA en cholinerge terminals in striatum en mogelijk cortex die fungeren als schakelaars tussen dopamine-afhankelijke en dopamine-onafhankelijke mechanismen van opioïde werking82,83 dat kan de wederkerigheid van dopamine- en opioïde-effecten in extrastriatale regio's bij varkens verklaren.
Een tekort aan PET, ook bij relatief grote dieren, is de beperkte ruimtelijke resolutie van de tomografie die de resultaten beïnvloedt van kleine hersengebieden die betrokken zijn bij voedselgerelateerd gedrag. Ondanks deze zorgen is [11C] raclopride binding werd eerder zowel in striatale als extrastriatale gebieden geregistreerd84,85,86,87. Het gebruik van [11C] raclopride om hetzelfde type receptoren te labelen, geeft geen aanleiding tot mogelijke affiniteitsverschillen die het gebruik van afzonderlijke tracers voor dezelfde receptoren in verschillende regio's kunnen beïnvloeden. Recente studies omvatten records van extrastriatale binding van [11C] raclopride. Alakurtti c.s.. vond goede reproduceerbaarheid van maatregelen van striatale raclopride-binding in het striatum, met alleen goede tot matige reproduceerbaarheid in de cortex85. In een latere studie, Svensson c.s.. verschillende kwesties besproken die van invloed zijn op het gebruik van [11C] raclopride als marker voor extrastriatale D2 / 3-receptoren in een onderzoek bij gezonde mensen, waaronder slechte reproduceerbaarheid in cortex en beperkte afname van extrastriatale binding in frontale cortex in reactie op een D2 / 3-blokkeermiddel88. De test-hertest-vergelijkingen onthulden variabelen van 4-7% in striatum en 13-59% in corticale regio's, maar de tijd tussen onderzoeken bedroeg gemiddeld 20 dagen, in tegenstelling tot de meer informatieve 1-2 dagen van de meeste onderzoeken. Een aantal factoren in het leven van die proefpersonen heeft misschien tijd gehad om de bevindingen te beïnvloeden. We laten hier inderdaad zien dat alleen het toevoegen van sucroseconsumptie aan een ochtendroutine gedurende 12 dagen mogelijk bindende maatregelen heeft beïnvloed die twee weken later werden verkregen. Andere factoren die zo vaak voorkomen als het spelen van videogames, winkelen, het aangaan van nieuwe romantische relaties en seksuele activiteit, het gebruik van drugs of het veranderen van dieet en lichaamsbeweging kunnen de extrastriatale dopamine-niveaus beïnvloeden met potentieel voor grote variatie aan datasets. De huidige studie bij minivarkens introduceerde een goed gecontroleerde opzet met als enige variabele de afwezigheid of aanwezigheid van sucrose in het dieet. In deze context hadden de gegevens van zeven dieren een voldoende lage variabiliteit in relevante extrastriatale gebieden om een statistisch significante vermindering van binding in respons op sucrose te identificeren.
Een beperking van de huidige studie is het gebruik van anesthetica die nodig is om immobiliteit tijdens te garanderen in vivo beeldvorming van dieren. De effecten van specifieke anesthetica en hun interacties met geneesmiddelen of andere interventies kunnen de binding van radioliganden verstoren89,90. Ketamine is een anti-glutamatergisch medicijn met snelle antidepressieve effecten in subanesthetica91,92,93, die striatal niet verminderen [11C] raclopride binding bij mensen94. S-ketamine bleek echter de bindingsbeschikbaarheid van dopamine D2 / 3-receptoren in het striatum van bewuste niet-menselijke primaten te verminderen95. Isofluraan is een algemeen verdovingsmiddel in dierlijk PET. In eerdere studies vonden we striatale accumulatie van [11C] SCH23390, een radioligand van de dopamine D1-receptoren die significant hoger is bij minivarkens verdoofd met isofluraan in plaats van propofol, hetgeen duidt op gevoeligheid van de dopaminerge neurotransmissie voor effecten van anesthesie96. In het huidige onderzoek werden alle minivarkens op beide tijdstippen afgebeeld onder ketamine-voormedicatie en isofluraananesthesie, waardoor de huidige vergelijkingen geldig zijn.
Conclusie
Overmatige consumptie van smakelijk voedsel kan zowel verslaving als het gevolg zijn van verslaving met directe gevolgen voor de gezondheid door obesitas. We hebben de bewering getest dat opioïden en dopamine beloningen bemiddelen, belangrijk voor zowel overleving als drugsmisbruik. Minivarkens met intermitterende toegang tot een sucrose-oplossing op 12 opeenvolgende dagen toonden verminderde dopamine D2 / 3 en μ − opioïdereceptorbeschikbaarheid in striatale en extrastriatale hersenregio's, wat impliceert dat voedingsmiddelen met veel sucrose hersenbeloningscircuits beïnvloeden op dezelfde manier als waargenomen bij verslavende geneesmiddelen worden geconsumeerd. De eerste eenmalige blootstelling aan sucrose was consistent met de afgifte van opioïden in hersengebieden die actief waren in beloning. De veranderingen in de beschikbaarheid van opioïden en dopamine verklaren het verslavende potentieel van te veel geconsumeerde sucrose.
Materialen en methoden
Dierethiek
Deze studie werd goedgekeurd en gereguleerd door de Deense Inspectie voor dierproeven en alle experimenten werden uitgevoerd in overeenstemming met de richtlijn 2010/63 / EU van het Europees Parlement en de Raad inzake de bescherming van dieren die voor wetenschappelijke doeleinden worden gebruikt en de ARRIVE-richtlijnen. We gebruikten zeven veertien maanden oude vrouwelijke Göttingen-minivarkens (Ellegaard, Dalmose, Denemarken). Minivarkens kregen een pelletdieet (6 dL, 2 keer per dag, Special Diets Services, Aarhus, Denemarken) met leidingwater beschikbaar ad libitum. De omgevingstemperatuur was 20-22 ° C, de relatieve luchtvochtigheid 50-55% en de lucht werd acht keer per uur ververst.
Intermitterend sucrose-verbruik
We hebben zeven minivarkens afgebeeld met [11C] raclopride en [11C] carfentanil bij aanvang, en opnieuw één dag na 12 opeenvolgende dagen blootstelling aan sucrose water. Blootstelling aan sucrose bestond uit één uur sucrose (sucrose, Dansukker, Kopenhagen, Denemarken) toegang tot water (500 gram sucrose in 2 liter water), dagelijks gedurende een periode van 12 dagen. De hoeveelheid sucrose-inname werd geregistreerd en alle minivarkens consumeerden elke dag 2 liter. We hebben ook vijf van dezelfde minivarkens afgebeeld met [11C] carfentanil, 30 minuten na de eerste toegang tot sucrose, om acute afgifte van opioïden te bestuderen.
De minivarkens wonnen gemiddeld 13.6% lichaamsgewicht van 25.4 kg (± 0.73 SEM) bij aanvang tot 28.9 kg (± 0.69 SEM) na de 12-daagse blootstelling aan sucrose, wat significant hoger was (eenzijdige t-test, p < 0.001) dan de toenames die werden waargenomen in een steekproef van controle-minivarkens verkregen in eerdere onderzoeken, waar het gewicht gemiddeld slechts met 4.9% toenam, tijdens dezelfde ontwikkelingsperiode.
Hersenen PET-beeldvorming
We vasten varkens 's nachts met vrije toegang tot water voorafgaand aan beeldvorming. We hebben minivarkens met medicijnen behandeld en onder narcose gebracht zoals eerder beschreven97 en plaatste ze in rugligging in een PET / CT-apparaat (Siemens Biograph 64 Truepoint PET). We hebben voorafgaand aan elke PET-acquisitie een lage dosis CT-scan uitgevoerd voor anatomische definitie en demping van PET-emissiegegevens. We hebben intraveneus toegediend [11C] raclopride bij aanvang (360 ± 18 MBq, specifieke activiteit 77 ± 76 GBq / μmol, geïnjecteerde massa 0.12 ± 0.08 μg / kg) en na 12 dagen sucrose (374 ± 54 MBq, specifieke activiteit 127 ± 85 GBq / μmol, geïnjecteerde massa 0.06 ± 0.05 μg / kg), en [11C] carfentanil bij aanvang (377 ± 43 MBq, specifieke activiteit 311 ± 195 GBq / μmol, geïnjecteerde massa 0.03 ± 0.02 μg / kg) en na 12 dagen sucrose (337 ± 71 MBq, specifieke activiteit 177 ± 157 GBq / μmol, geïnjecteerde massa 0.06 ± 0.08 μg / kg) via oorader, in 10 ml zoutoplossing, tijdens de eerste minuut van een scan van 90 minuten. We hebben PET-gegevens gereconstrueerd met behulp van TrueX 3D OSEM (3 iteraties, 21 subsets), een matrix van 256 × 256 × 109 en een Gauss-filter van 2 mm, met een tijdframe-structuur van 5 × 60, 3 × 300, 4 × 600 , 2 × 900 seconden (totaal 14 frames, 90 minuten). Bij aanvang en na 12 dagen sucrose werden minivarkens afgebeeld met beide tracers met een tussenpoos van ten minste 100 minuten, vanwege de halfwaardetijd van [11C] PET-tracers. Na voltooiing van de laatste PET-sessie euthaniseerden we minivarkens onder diepe anesthesie door een intraveneuze overdosis pentobarbital (100 mg / kg).
Kwantitatieve analyses en statistieken
We hebben preprocessing-stappen uitgevoerd met PMOD 3.7 (PMOD Technologies Ltd, Zürich, Zwitserland). Om de stereotactische transformatieparameters uit tijdgemiddelde PET-afbeeldingen te definiëren, gebruikten we ligand-specifieke sjablonen. We hebben de gegenereerde transformatiematrices en krommingsvelden toegepast op de overeenkomstige dynamische PET-tijdreeksen. We hebben parametrische afbeeldingen gegenereerd van [11C] raclopride bindend potentieel (BPND) door middel van de multilineaire referentieweefselmethode van Ichise en collega's98. We hebben een op maat gemaakt masker van het cerebellum gemaakt dat het vermis uitsluit om de radioactiviteit van het cerebellaire weefsel in de tijd te verkrijgen in een gebied met een verwaarloosbare DA D2 / 3-receptordichtheid. We hebben parametrische afbeeldingen gegenereerd van [11C] carfentanil met behulp van een implementatie van het Logan referentieweefselmodel99,100 met t * = 30 minuten. Studies van [11C] carfentanilbinding in menselijke hersenen heeft de occipitale cortex als referentiegebied gebruikt36; in het varken was echter volgens de tijdactiviteitskrommen de niet-verplaatsbare binding lager in het cerebellum dan in de occipitale cortex, consistent met bevindingen uit een autoradiografieonderzoek bij ratten101. Daarom hebben we in het huidige onderzoek het cerebellum als referentiegebied gekozen.
statistische analyse
We hebben kaarten onderworpen aan een voxelgewijze analyse met statistische niet-parametrische kaarten (SnPM v13.01, http://warwick.ac.uk/snpm) SPM-toolbox die niet-parametrische permutatietheorie gebruikt om een kader voor statistische inferentie te bieden, een benadering die goed werkt voor kleine steekproeven vanwege strikte controle van valse positieven14 en toegepast zoals eerder beschreven102. Een expert in neuroanatomie van varkens (DO) vergeleek de resulterende beelden met een drempelwaarde van 5% met een hoge resolutie Göttingen minipig-atlas103,104 om gebieden met verminderde DA D2 / 3 en μOR BP te definiëren en te labelenND van baseline tot de post-sucrose conditie. Vervolgens hebben we een regio-van-belang-analyse (ROI) uitgevoerd om BP te extraherenND waarden van specifieke regio's die interessant zijn gebleken op basis van de SnPM-analyse, waaronder het striatum, nucleus accumbens, thalamus, amygdala, cingulaire cortex en prefrontale cortex. Er zijn geen aanvullende statistieken uitgevoerd over de ROI-analyse, omdat deze regio's al significant bleken met behulp van SnPM.
Referenties
- 1.
Smyth, S. & Heron, A. Diabetes en obesitas: de dubbele epidemieën. Nat Med 12, 75-80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Prevalentie en trends in obesitas bij volwassenen in de VS, 1999-2008. JAMA 303, 235-241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA c.s.. Dopamine voor "willen" en opioïden voor "leuk": een vergelijking van zwaarlijvige volwassenen met en zonder eetaanvallen. Obesitas (Silver Spring) 17, 1220-1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obesitas en de voedselomgeving: energiedichtheid in de voeding en voedingskosten. Amerikaans tijdschrift voor preventieve geneeskunde 27, 154-162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Intense zoetheid overtreft de beloning van cocaïne. PLoS ONE 2e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In Neurowetenschappen in de 21ste eeuw (ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Verdere ontwikkelingen in de neurobiologie van voedsel en verslaving: update over de stand van de wetenschap. Voeding 28, 341-343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M.In Genoegens van de hersenen (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Van smaak hedonics tot motiverende drive: centrale mu-opioïde receptoren en eetaanvallen. Int J Neuropsychopharmacol 12, 995-1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Food-beloning: hersensubstraten van willen en houden van. Neurowetenschappen en biobeoordelingen 20, 1â € "25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Neuroreceptoren aan het werk in kaart brengen: over de definitie en interpretatie van bindende potentialen na 20 jaar vooruitgang. Int Rev Neurobiol 63, 1-20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Diermodellen van suiker- en vetbuien: relatie met voedselverslaving en verhoogd lichaamsgewicht. Methoden Mol Biol 829, 351-365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. c.s.. De prefrontale cortex in de minipig hersenen van Gottingen, gedefinieerd door neurale projectiecriteria en cytoarchitectuur. Brain Res Bull 70, 322-336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Niet-parametrische permutatietests voor functionele neuroimaging: een inleiding met voorbeelden. Hum Brain Mapp 15, 1â € "25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Bewijs voor suikerverslaving: gedrags- en neurochemische effecten van intermitterende, overmatige suikerinname. Neurowetenschappen en biobeoordelingen 32, 20-39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. c.s.. Beloningssysteem voor voedsel: huidige perspectieven en toekomstige onderzoeksbehoeften. Nutr Rev 73, 296-307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Sucrose zelftoediening en CZS-activering bij de rat. Am J Physiol Regul Integr Comp Physiol 300, R876-884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA c.s.. Afzonderlijke circuits coderen voor de hedonische en voedingswaarden van suiker. Aard neurowetenschap 19, 465-470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. c.s.. Overmatige suikerinname verandert de binding aan dopamine en mu-opioïde receptoren in de hersenen. Neuroreport 12, 3549â € "3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiaatreceptor: autoradiografische lokalisatie in de hersenen van ratten. Proc Natl Acad Sci USA 73, 3729â € "3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Cocaïnebeloning en hyperactiviteit bij de rat: locaties van mu-opioïde receptormodulatie. Neurowetenschap leerprogramma 154, 1506-1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamine beïnvloedt de zelftoediening van cocaïne bij ratten die reageren op een progressief versterkingsschema. Farmacologie, biochemie en gedrag 75, 301â € "307 (2003).
- 23.
Schroeder, JA c.s.. Een rol voor mu opioïde receptoren bij door cocaïne geïnduceerde activiteit, sensibilisatie en beloning bij de rat. Psychopharmacology 195, 265-272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Door cocaïne geïnduceerd herstel vereist endogene stimulatie van mu-opioïde receptoren in het ventrale pallidum. The Journal of neuroscience: het officiële tijdschrift van de Society for Neuroscience 25, 4512-4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ c.s.. Voeding geeft endogene opioïden bij mensen vrij. J Neurosci 37, 8284-8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Opioïde limbisch circuit voor beloning: interactie tussen hedonische hotspots van nucleus accumbens en ventraal pallidum. J Neurosci 27, 1594-1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Opioïde-site in nucleus accumbens-schaal bemiddelt bij het eten en hedonistische 'smaak' voor voedsel: kaart op basis van micro-injectie Fos-pluimen. Brain Res 863, 71â € "86 (2000).
- 28.
Zhang, M. & Kelley, AE De opname van sacharine-, zout- en ethanoloplossingen wordt verhoogd door infusie van een mu-opioïde-agonist in de nucleus accumbens. Psychopharmacology 159, 415-423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE De inname van vetrijk voedsel wordt selectief versterkt door stimulatie van de mu-opioïde receptor in de nucleus accumbens. The Journal of farmacologie en experimentele therapeutica 285, 908â € "914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Naloxone blokkeert dat deel van de voeding aangedreven door zoete smaak bij voedselbeperkte ratten. Am J Physiol 268, R248-252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioïden en voedselinname: gedistribueerde functionele zenuwbanen? neuropeptiden 33, 360-368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Een opioïde antagonist, naltrexon, vermindert de voorkeur voor sucrose bij mensen. Am J Physiol 251, R91-96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Het effect van naltrexon op smaakdetectie en herkenningsdrempel. Eetlust 32, 241-249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxone, een opiaatblokker, vermindert de consumptie van zoet vetrijk voedsel bij zwaarlijvige en magere vrouwelijke eetbuien. Am J Clin Nutr 61, 1206â € "1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Verschillende opioïde circuits bepalen de smakelijkheid en wenselijkheid van belonende evenementen. Proc Natl Acad Sci USA 106, 12512-12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. c.s.. Endogene opioïdenafgifte in het beloningssysteem van de menselijke hersenen geïnduceerd door acute amfetaminetoediening. Biol Psychiatry 72, 371-377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, ik. c.s.. Amfetamine induceerde endogene opioïde afgifte in het menselijk brein gedetecteerd met [11C] carfentanil PET: replicatie in een onafhankelijk cohort. Int J Neuropsychopharmacol, 1-6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Opioïde peptiden en de controle van menselijk inslikken. Neurowetenschappen en biobeoordelingen 26, 713â € "728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Wat te leren van in vivo opioidergische beeldvorming van de hersenen? Eur J Pain 9, 117-121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M.Dopamine-opioïde interacties in het striatum van de rat: een modulerende rol voor dopamine D1-receptoren in door delta-opioïde receptor gemedieerde signaaltransductie. Neurofarmacologie 39, 372â € "381 (2000).
- 41.
Bencherif, B. c.s.. Regionale mu-opioïdereceptorbinding in insulaire cortex is verminderd in boulimia nervosa en correleert omgekeerd met vastend gedrag. Journal of nucleaire geneeskunde: officiële publicatie, Society of Nuclear Medicine 46, 1349â € "1351 (2005).
- 42.
Karlsson, HK c.s.. Obesitas wordt geassocieerd met verminderde mu-opioïde maar ongewijzigde beschikbaarheid van dopamine D2-receptoren in de hersenen. J Neurosci 35, 3959-3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK c.s.. Gewichtsverlies na bariatrische chirurgie normaliseert de opioïdereceptoren van de hersenen bij morbide obesitas. Mol Psychiatry 21, 1057-1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Endogene opioïde mechanismen zijn betrokken bij obesitas en gewichtsverlies bij mensen. J Clin Endocrinol Metab 100, 3193-3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. c.s.. Dopamine en opioïde neurotransmissie bij gedragsverslavingen: een vergelijkende PET-studie bij pathologisch gokken en eetaanvallen. Neuropsychopharmacology 42, 1169-1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Chronisch vetrijk dieet stimuleert de postnatale epigenetische regulatie van de mu-opioïde receptor in de hersenen. Neuropsychopharmacology: officiële publicatie van het American College of Neuropsychopharmacology 36, 1199-1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Inductie van hyperfagie en koolhydraatinname door stimulatie van de mu-opioïde receptor in afgebakende gebieden van de frontale cortex. The Journal of neuroscience: het officiële tijdschrift van de Society for Neuroscience 31, 3249-3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Chronische cocaïne dempt dopamine-signalering tijdens cocaïne-intoxicatie en onevenwichtigheden D1 ten opzichte van D2-receptorsignalering. The Journal of neuroscience: het officiële tijdschrift van de Society for Neuroscience 33, 15827-15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Klaarkomen, P. c.s.. Effecten van acute nicotine op hemodynamica en binding van [11C] raclopride aan dopamine D2,3-receptoren in varkenshersenen. NeuroImage 19, 1127â € "1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Effect van zelftoediening door cocaïne op dopamine D2-receptoren bij resusapen. Synaps 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND c.s.. Cocaïne-signalen en dopamine in dorsaal striatum: mechanisme van verlangen bij cocaïneverslaving. The Journal of neuroscience: het officiële tijdschrift van de Society for Neuroscience 26, 6583-6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF c.s.. Verhoogde bezettingsgraad van dopamine-receptoren in menselijk striatum tijdens hunkering naar cocaïne. Neuropsychopharmacology 31, 2716-2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Orale sucrosestimulatie verhoogt accumbens dopamine bij de rat. Am J Physiol Regul Integr Comp Physiol 286, R31-37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Imaging van de rol van dopamine bij drugsmisbruik en verslaving. Neurofarmacologie 56(Suppl 1), 3-8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ c.s.. Hersenen dopamine en obesitas. Lancet 357, 354â € "357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Overeenkomsten tussen obesitas en drugsverslaving zoals beoordeeld door neurofunctionele beeldvorming: een conceptbeoordeling. Journal of verslavende ziekten 23, 39-53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Dopamine D2-receptoren bij verslavingsachtige beloningsstoornissen en dwangmatig eten bij zwaarlijvige ratten. Aard neurowetenschap 13, 635-641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Affectieve neurowetenschap van plezier: beloning bij mens en dier. Psychopharmacology 199, 457-480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Pleasure-systemen in de hersenen. Neuron 86, 646-664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Voorspellend beloningssignaal van dopamine-neuronen. J Neurophysiol 80, 1-27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Veranderingen in hersenactiviteit na door voeding geïnduceerde obesitas. Obesitas 19, 749-756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens dopamine-mechanismen bij de inname van sucrose. Brain Res 904, 76â € "84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Dagelijkse eetbuien van suiker geven herhaaldelijk dopamine vrij in de accumbens-schaal. Neurowetenschap leerprogramma 134, 737-744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Herhaalde toegang tot sucrose beïnvloedt de dopamine D2-receptordichtheid in het striatum. Neuroreport 13, 1575â € "1578 (2002).
- 65.
Alsio, J. c.s.. Dopamine D1-receptorgenexpressie neemt in de kern af na langdurige blootstelling aan smakelijk voedsel en verschilt afhankelijk van dieet-geïnduceerd obesitasfenotype bij ratten. Neurowetenschap leerprogramma 171, 779-787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Differentiële invloed van associatieve en niet-associatieve leermechanismen op de responsiviteit van prefrontale en accumulatie van dopamine-overdracht op voedselprikkels bij ratten die ad libitum worden gevoerd. J Neurosci 17, 851â € "861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Ongebalanceerde neuronale circuits bij verslaving. Curr Opin Neurobiol 23, 639-648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexia, boulimia en obesitas: gedeelde besluitvormingstekorten bij de Iowa Gambling Task (IGT). J Int Neuropsychol Soc 16, 711-715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Besluitvormingstekorten en overeten: een risicomodel voor obesitas. Obes Res 12, 929-935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND c.s.. Lage dopamine-striatale D2-receptoren worden geassocieerd met prefrontaal metabolisme bij obese personen: mogelijk bijdragende factoren. NeuroImage 42, 1537-1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Amygdala centrale kern interageert met dorsolaterale striatum om de verwerving van gewoonten te reguleren. J Neurosci 32, 1073-1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, s. c.s.. Activering van geheugencircuits tijdens het verlangen naar cocaïne. Proc Natl Acad Sci USA 93, 12040â € "12045 (1996).
- 73.
Childress, AR c.s.. Limbische activering tijdens door cocaïne geïnduceerde hunkering naar cocaïne. Am J Psychiatry 156, 11-18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC Wat en wanneer “willen”? Op Amygdala gebaseerde focus van incentive-salience op suiker en seks. Psychopharmacology 221, 407-426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiologie van verslaving: een neurocircuitanalyse. Lancet Psychiatrie 3, 760-773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Corticale activering als reactie op pure smaakstimuli tijdens de fysiologische staten van honger en verzadiging. NeuroImage 44, 1008-1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotos, A. c.s.. Door cocaïne geïnduceerde afgifte van dopamine in amygdala en hippocampus: een hoge resolutie PET [(1) (8) F] fallypride-studie bij cocaïne-afhankelijke deelnemers. Neuropsychopharmacology 38, 1780-1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. c.s.. Controle van cocaïnezoekend gedrag door aan drugs gerelateerde stimuli bij ratten: effecten op herstel van gedoofde operant-reagerende en extracellulaire dopamine-waarden in amygdala en nucleus accumbens. Proc Natl Acad Sci USA 97, 4321â € "4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dopamine D1- of D2-receptorantagonisme binnen de basolaterale amygdala verandert op verschillende manieren de verwerving van cocaïne-cue-associaties die nodig zijn voor cue-geïnduceerd herstel van het zoeken naar cocaïne. Neurowetenschap leerprogramma 137, 699-706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. c.s.. Afwijkende mesolimbische dopamine-opiaat interactie bij obesitas. NeuroImage 122, 80-86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Gedragss dopamine signalen. Trends Neurosci 30, 203-210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. De neurobiologie van opiaatmotivatie. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Nicotine en opioïde receptor regulatie van striatale dopamine D2-receptor gemedieerde transmissie. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. c.s.. Leeftijdsafhankelijke afname van dopamine D2 / 3-receptorbeschikbaarheid gemeten met [C-11] raclopride in niet-striatale hersengebieden: vergelijking van vier methoden. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. c.s.. Test-hertestbetrouwbaarheid op lange termijn van striatale en extrastriatale dopamine D2 / 3-receptorbinding: studie met [(11) C] raclopride en PET met hoge resolutie. J Cereb Blood Flow Metab 35, 1199-1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Endogene dopamine-afgifte na farmacologische uitdagingen bij de ziekte van Parkinson. Ann Neurol 53, 647-653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. c.s.. Cognitieve tekorten en striato-frontale dopamine-afgifte bij de ziekte van Parkinson. Hersenen 131, 1294-1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE c.s.. Validiteit en betrouwbaarheid van extrastriatale [(11) C] raclopride bindende kwantificering in de levende menselijke hersenen. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. c.s.. Isofluraananesthesie verbetert de remmende effecten van cocaïne en GBR12909 op dopaminetransporter: PET-studies in combinatie met microdialyse in de hersenen van de aap. Brain Res 849, 85â € "96 (1999).
- 90.
Hassun, W. c.s.. PET-studie van de [11C] raclopride-binding in het striatum van de wakkere kat: effecten van anesthetica en de rol van cerebrale bloedstroom. Europees tijdschrift voor nucleaire geneeskunde en moleculaire beeldvorming 30, 141-148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. De rol van ketamine bij therapieresistente depressie: een systematische review. Curr Neuropharmacol 12, 444-461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM c.s.. Antidepressieve effecten van ketamine bij depressieve patiënten. Biol Psychiatry 47, 351â € "354 (2000).
- 93.
Browne, CA & Lucki, I. Antidepressieve effecten van ketamine: mechanismen die ten grondslag liggen aan snelwerkende nieuwe antidepressiva. Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. c.s.. Ketamine vermindert de striatale dopamine D2-receptorbinding bij de mens niet. Psychopharmacology 164, 401-406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H.Reductie van dopamine D2 / 3-receptorbinding in het striatum na een enkele toediening van esketamine, maar niet R-ketamine: een PET studie bij bewuste apen. Eur Arch Psychiatry Clin Neurosci 267, 173-176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK c.s.. Effecten van anesthesie en soorten op de opname of binding van radioliganden in vivo in de minipig van Göttingen. BioMed research international 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP c.s.. Longitudinale monoaminerge PET-beeldvorming van chronische proteasoomremming bij minivarkens. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Strategieën om de schatting van neuroreceptorparameters te verbeteren door lineaire regressieanalyse. J Cereb Blood Flow Metab 22, 1271-1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. c.s.. Verdelingsvolumeverhoudingen zonder bloedmonsters uit grafische analyse van PET-gegevens. J Cereb Blood Flow Metab 16, 834-840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Kwantificering van mu-opioïde receptoren in de hersenen met [11C] carfentanil: referentieweefselmethoden. Nucl Med Biol 30, 177â € "186 (2003).
- 101.
Panksepp, J. & Bishop, P.Een autoradiografische kaart van (3H) diprenorfine-binding in rattenhersenen: effecten van sociale interactie. Brain Res Bull 7, 405â € "410 (1981).
- 102.
Landau, AM c.s.. Elektroconvulsieve stimulatie beïnvloedt differentieel [(11) C] MDL100,907 binding aan corticale en subcorticale 5HT2A-receptoren in varkenshersenen. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Het telencephalon van de Gottingen-minivarkens, cytoarchitectuur en corticale oppervlakteanatomie. Brain Struct Funct 222, 2093-2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Online histologische atlas van het Gottingen minivarkensbrein. Heliyon 5e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Danksagung
Een "AU Ideas Project Development Grant" van Aarhus University aan AML heeft het onderzoek gefinancierd. We zijn dankbaar voor de technische ondersteuning van het personeel van het PET-centrum van het Aarhus University Hospital en de Farm Farm van Aarhus voor hulp bij de behandeling van de dieren. We danken professor Morten Kringelbach, professor Jørgen Scheel-Kruger en universitair hoofddocent Arne Møller voor hulp bij het initiëren van deze studies.
Ethische verklaringen
Tegenstrijdige belangen
De auteurs verklaren geen concurrerende belangen.
Specificaties
Opmerking van uitgever Springer Nature blijft neutraal met betrekking tot rechtsvorderingen in gepubliceerde kaarten en institutionele voorkeuren.
Rechten en machtigingen
Open Access Dit artikel is gelicentieerd onder een Creative Commons Naamsvermelding 4.0 Internationale licentie, die gebruik, delen, aanpassing, distributie en reproductie in elk medium of formaat toestaat, op voorwaarde dat u de oorspronkelijke auteur (s) en de bron de juiste bron geeft, een link naar de Creative Commons-licentie en geef aan of er wijzigingen zijn aangebracht. De afbeeldingen of ander materiaal van derden in dit artikel zijn opgenomen in de Creative Commons-licentie van het artikel, tenzij anders aangegeven in een kredietlimiet voor het materiaal. Als materiaal niet is opgenomen in de Creative Commons-licentie van het artikel en uw beoogde gebruik niet is toegestaan door de wettelijke regelgeving of het toegestane gebruik overschrijdt, moet u rechtstreeks toestemming krijgen van de auteursrechthouder. Ga naar om een kopie van deze licentie te bekijken http://creativecommons.org/licenses/by/4.0/.