KOMMENTARER: En recension av chefen för National Institute on Drug Abuse, Nora Volkow och hennes team. Denna recension listar de tre största neurobiologiska dysfunktionerna som är involverade i alla missbruk. Enkelt sagt är de: a) Desensibilisering: ett dumt nöjessvar på grund av en minskning av dopamin-signalering; b) Sensibilisering: Förhöjt dopaminrespons på missbrukskänslor, utlösare eller stress; och c) Hypofrontalitet: försvagade självkontrollkretsar på grund av minskad volym och funktion av frontal cortex. Samma hjärnförändringar beskrevs av American Society for Addiction Medicine (ASAM) i deras ny definition av beroende släpptes i augusti, 2011.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Telang F, Baler R. Bioessays. 2010 Sep; 32 (9): 748-55.
National Institute on Drug Abuse, NIH, Bethesda, MD 20892, USA.
Abstrakt
Baserat på hjärnbildningsfynd presenterar vi en modell enligt vilken missbruk framträder som en obalans i informationsbehandling och integration mellan olika hjärnkretsar och funktioner.
Dysfunktionerna reflekterar:
(a) minskad känslighet av belöningskretsar,
b) Förhöjda känslighet för minneskretsar till konditionerade förväntningar på läkemedel och läkemedelskänslor, stressreaktivitet och negativ humör,
(c) och en försvagad styrkrets.
Även om inledande experiment med missbruk är till stor del ett frivilligt beteende, kan fortsatt droganvändning i slutändan försämra neuronala kretsar i hjärnan som är inblandade i fri vilja, vilket gör droganvändning till ett automatiskt tvångsbeteende. De beroendeframkallande läkemedlets förmåga att samordna neurotransmittersignaler mellan neuroner (inklusive dopamin, glutamat och GABA) modifierar funktionen hos olika neuronala kretsar, som börjar svika i olika steg i en missbruksbanan. Vid exponering för läkemedlet resulterar läkemedelssignaler eller stress detta i oförstörd hyperaktivisering av motivations / körkretsen som resulterar i det kompulsiva läkemedelsintaget som kännetecknar beroende.
Beskrivning
De senaste 25-åren av neurovetenskaplig forskning har visat att missbruk är en hjärnans sjukdom, vilket ger ett kraftfullt argument för att upprätthålla samma sjukvårdsstandard för den beroende personen som de som är gemensamma för andra sjukdomar med stor allmän inverkan, till exempel diabetes. Faktum är att forskning om missbruk har börjat avslöja händelsens följd och långvariga följder som kan bero på det bestående missbruk av ett beroendeframkallande ämne. Dessa studier har visat hur upprepad narkotikamissbruk kan inriktas på nyckelmolekyler och hjärnkretsar och slutligen störa de högre orderprocesser som ligger till grund för känslor, kognition och beteende. Vi har lärt oss att missbruk kännetecknas av en expanderande cykel av dysfunktion i hjärnan. Nedsättningen börjar vanligtvis i de evolutionärt mer primitiva områdena i hjärnan som processbelönar och flyttar sedan vidare till andra områden som är ansvariga för mer komplexa kognitiva funktioner. Förutom belöning kan missbrukare uppleva allvarliga störningar i lärandet (minne, konditionering, habituation), verkställande funktion (impulsinhibering, beslutsfattande, försenad tillfredsställelse), kognitiv medvetenhet (interoception) och till och med känslomässig (stämning och stressreaktivitet) funktioner.
Ritning i stor utsträckning från resultaten av hjärnbildningsstudier som använde positronemissionstomografi (PET), introducerar vi de viktigaste hjärnkretsarna som påverkas av det kroniska missbruket av droger och presenterar sedan en sammanhängande modell enligt vilket beroende uppstår som nettoresultatet av obalanserad informationsbehandling i och bland dessa kretsar. En grundlig förståelse för dessa gradvis adaptiva (neuroplastiska) hjärnprocesser och av de biologiska och miljömässiga sårbarhetsfaktorerna som påverkar deras sannolikhet är avgörande för utvecklingen av effektivare förebyggande och behandlingsmetoder för att bekämpa missbruk.
Höga, men korta, brist på dopamin krävs för missbruk
Missbruk är först och främst en sjukdom i hjärnans belöningssystem. Detta system använder neurotransmittorn dopamin (DA) som sin viktigaste valuta för att vidarebefordra information. Brain DA spelar en nyckelroll i behandlingen av information om viktighet [1, 2], som ligger i centrum för sin förmåga att reglera eller påverka belöning [3, 4], belöning förväntan [5], motivation, känslor och känslor av nöje. Övergående frisättning av DA i hjärnans ventrala striatum är en nödvändig, om än inte tillräcklig, händelse i de komplexa processerna som skapar känslan av belöning: ökningen av DA verkar vara positivt relaterad till intensiteten av "hög" som ämnen upplever. Konditionerade svar framkallas endast när DA upprepade gånger släpps eftersom dessa skarpa, övergående, svängningar, som svar på droger eller läkemedelsassocierade signaler.
Intressant, direkt eller indirekt, arbetar alla beroendeframkallande läkemedel genom att utlösa överdrivna men övergående ökningar av extracellulär DA i en nyckelregion i belöningssystemet (limbic)6, 7], specifikt i kärnans accumbens (Nac) belägen i ventralstriatumet. Sådana DA-störningar liknar, och i vissa fall överträffar de fysiologiska ökningar som utspelas av naturligt behagliga stimuli (vanligen kallad naturliga förstärkare eller belöningar). Som vi skulle ha förväntat har mänskliga bildbildningsstudier med positronemissionstomografi (PET) visat tydligt att DA ökar inducerad av olika klasser av läkemedel (t.ex. stimulanter (Fig. 1A), [8, 9], nikotin [10] och alkohol [11]) inom ventralstriatumet är kopplade till den subjektiva erfarenheten av eufori (eller hög) under förgiftning [12, 13, 14]. Eftersom PET-studier kan göras i vakna människor är det också möjligt att kartlägga förhållandet mellan de subjektiva rapporterna om läkemedelseffekter och de relativa förändringarna i DA-nivåer. De flesta studier har rapporterat att de som uppvisar den största DA-ökningen efter exponering av läkemedel [amfetamin, nikotin, alkohol, metylfenidat (MPH)] rapporterar också den mest intensiva höga eller euforiska (Fig. 1B).
Djur- och mänskliga studier har visat att hastigheten med vilken ett läkemedel går in, verkar på och lämnar hjärnan (dvs dess farmakokinetiska profil) spelar en grundläggande roll för att bestämma dess förstärkande effekter. Faktum är att varje missbrukande ämne, vars hjärn farmakokinetik har uppmätts med PET (kokain, MPH, metamfetamin och nikotin) uppvisar samma profil när administreringen är intravenös, dvstoppnivåer i den mänskliga hjärnan uppnås inom 10 min (Fig. 2A) och detta snabba upptag är förenat med "hög" (Fig. 2B). Baserat på denna förening följer det att att se till att ett beroendeframkallande läkemedel kommer in i hjärnan så långsamt som möjligt borde vara ett effektivt sätt att minimera dess förstärkningspotential, följaktligen dess missbruksansvar. Vi utformade ett experiment för att exakt testa denna hypotes med stimulantmedicinet MPH, vilket, som kokain, ökar DA genom att sakta ner transporten tillbaka till presynaptisk neuron (dvs genom att blockera DA-transportörer), vilket förstorar DA-signalen. Faktum är att vi fann att medan intravenös administrering av MPH ofta är euforigenisk, oralt administrerad MPH, vilken också ökar DA i striatumen [15], men med 6- till 12-faldig långsammare farmakokinetik uppfattas inte typiskt som förstärkning [16, 17]. Således misslyckades oralt MPH- eller amfetamin [18] för den delen - att framkalla en hög är sannolikt reflektionen av deras långsamma upptag i hjärnan [19]. Det är därför rimligt att föreslå förekomsten av en nära korrelation mellan den hastighet vid vilken ett missbruksläkemedel kommer in i hjärnan, vilket bestämmer hur snabbt DA ökar i ventralstriatum och dess förstärkande effekter [20, 21, 22]. Med andra ord, för att ett läkemedel ska utöva förstärkande effekter måste det uppstå DA brått. Varför skulle det vara så?
Baserat på omfattningen och varaktigheten av neuronavbrott kan DA-signalering ta en av två grundläggande former: fasisk eller tonisk. Fasisk signalering kännetecknas av hög amplitud och kort bristning, medan tonisk signalering har typiskt låg amplitud och en mer långvarig eller fördröjd tidskurs. Skillnaden är viktig eftersom det visar sig att phasic DA-signalering är nödvändig för missbruksmissbruk för att inducera "konditionerade svar", vilket är en av de första neuroadaptationerna som följer exponering för förstärkande stimuli (inklusive ett läkemedel). En av de utmärkande aspekterna som kopplar fasasignalering med konditionering är involveringen av D2R och glutamat n-metyl-d-asparaginsyra (NMDA) -receptorer [23]. Å andra sidan spelar tonisk DA-signalering en roll i moduleringen av arbetsminne och andra processer. Några av de funktioner som skiljer det här signaleringsläget från fasetypen är att det verkar huvudsakligen genom lägre affinitet DA-receptorer (DA D1-receptorer). Emellertid, och trots de olika mekanismerna involverade, har långvarig drogexponering (och förändringar i tonisk DA-signalering genom dessa receptorer) också implicerats i de neuroplastiska förändringar som i slutändan resulterar i konditionering [25] genom modifieringen av NMDA och och alfa-amino-3-hydroxyl-5-metyl-4-isoxazon-propionat (AMPA) glutamatreceptorer [24].
Beviset indikerar att abrupta läkemedelsinducerade ökningar i DA efterliknar fasisk DA-cellbränning. Detta hjälper till att förklara varför den kroniska användningen av ett beroendeframkallande ämne kan ge upphov till sådana kraftfullt konditionerade svar på själva läkemedlet, dess förväntningar och myriader (människor, saker och platser) i samband med användningen. Men medan de akuta förstärkande effekterna av missbruksmedel som beror på sådana snabba DA-ökningar sannolikt är "nödvändiga" för att utveckla missbruk, är de helt klart inte "tillräckliga". Upprepad drogexponering orsakar förändringar i DA-hjärnfunktionen som tar tid att utvecklas eftersom de härrör från sekundära neuroadaptationer i andra neurotransmittorsystem (t.ex glutamat [26] och kanske också y-aminobutyirinsyra (GABA)) som i slutändan påverkar ytterligare hjärnkretsar modulerade av DA. Dessa kretsar är i fokus för nästa avsnitt.
Kronisk drogmissbruk nedregulerar dopaminreceptorer och dopaminproduktion: "High" är trubbigt
Det faktum att narkotikamissbruk måste bli kronisk innan missbruk tar rod är en tydlig indikation på att sjukdomen beräknas, hos utsatta individer, på upprepade störningar av belöningssystemet. Dessa störningar kan så småningom leda till neuroadaptationer i många andra kretsar (motivation / körning, hämmande kontroll / verkställande funktion och minne / konditionering) som också moduleras av DA [27]. Bland de neuro-anpassningar som har rapporterats konsekvent i beroende ämnen är de signifikanta minskningarna i nivåerna av D2R-receptorer (högaffinitetsreceptorer) och i mängden DA som frisätts av DA-celler [28] (Fig 3). Viktigt är att dessa underskott är förknippade med lägre regional metabolisk aktivitet i områden av prefrontal cortex (PFC) som är kritiska för korrekt verkställande prestanda (dvs anterior cingulate gyrus (CG) och orbitofrontal cortex (OFC)) (Fig. 4A). Denna observation ledde oss att postulera att detta kan vara en av de mekanismer som förbinder den läkemedelsinducerad störningen i DA-signaleringen med kompulsiv läkemedelsadministration och bristen på kontroll över läkemedelsintag som karakteriserar missbruk [29]. Dessutom skulle det resulterande hypodopaminergiska tillståndet förklara en beroende person minskad känslighet för naturliga belöningar (t.ex. mat, kön, etc) och förvaring av droganvändning som ett sätt att tillfälligt kompensera för detta underskott [30]. En viktig följd av denna kunskap är att hantering av dessa underskott (genom ökande striatal D2R-nivåer och ökad DA-frisättning i striatum och prefrontala regioner) kan erbjuda en klinisk strategi för att förbättra effekten av missbruk [31]. Finns det några bevis på att reversering av hypodopaminerat tillstånd kan ha en positiv inverkan på substansmissbrukrelaterade beteenden? Svaret är ja. Våra studier visar att genom att tvinga överproduktionen av D2R, djupt inuti belöningssystemet av kokain- eller alkoholresterade råttor, kan vi avsevärt minska den självförvaltning av kokain [31] eller alkohol [32] respektive. Dessutom, hos gnagare, såväl som hos människa metamfetaminmissbrukare [33], en minskad striatal nivå av D2R är också associerad med impulsivitet, och hos gnagare förutsäger det kompulsiva mönster för läkemedels självförvaltning (se nedan).
Imagingstudier har också visat att hos människor är beroende beroende av en minskning av DA-frisättning i ventralstriatumet och i andra regioner av striatumen och i trubbiga behagliga reaktioner på läkemedlet hos aktiva och avgifta narkotikabrukare (Fig 5) [34]. Detta var ett oväntat funn eftersom det hade antagits att missbruk återspeglade en ökad känslighet för de givande (och därmed de dopaminerga) svaren på droger. I drogmissbrukare kan minskningar i DA-frisättning återspegla antingen störd neurofysiologi inom belöningskretsarna (dvs i DA neuroner som släpper DA i striatumet) eller alternativt en störd återkopplingsreglering av belöningskretsen genom prefrontal (executive control) eller amygdalar (emotionella) vägar (prefrontal-striatal, amygdalarstriatal glutamatergiska vägar). Eftersom en ren dopaminerg dysfunktion i striatumet, som ses hos den kroniska drogmissbrukaren, inte klarar av de egenskaper som karakteriserar beroendeframkallande beteenden, som impulsivitet, begär och återfall som utlöses av läkemedelsanordningar är det mycket troligt att prefrontala regioner (som liksom amygdala) är också involverade här, eftersom deras störningar skulle möjliggöra eller åtminstone påverka dessa beteendeegenskaper.
Lägre dopaminreceptor (DR2) -nivåer försämrar impulsivitetsstyrningen genom prefrontal cortex
Det har antagits att den försämrade kontrollen över kompulsiva läkemedelsupptagande beteenden som kännetecknar missbruk kan bero delvis på specifika dysfunktioner i hjärnans främre områden [35]. Det finns nu en betydande mängd bevis som stöder detta begrepp, som börjar med djurstudier som undersöker sambandet mellan D2R och beteendekontroll. Experiment med råttor visar tydligt en korrelation mellan låg D2R och impulsivitet [36] och mellan impulsivitet och läkemedelsförvaltning [37]. Men vad är anslutningen? Som tidigare nämnts, hos drogmissbrukare, korrigerar lägre striatal D2R signifikant med glukosmetabolism i nedre hjärnan i nyckelområdena i PFC, såsom OFC (involverad i salamsattribut och vars störning leder till tvångsmässigt beteende) och i CG (involverad med hämmande kontroll och felövervakning och vars avbrott resulterar i impulsivitet) (Fig. 4B) [38, 39]. Dessutom, i en studie som vi utförde hos individer (genomsnittlig SD ± ålder, 24 ± 3 år) en familjehistoria av alkoholism, men som inte var alkoholister själva upptäckte vi också en betydande samband mellan striatal D2R och metabolism i frontregioner (CG , OFC och dorsolateral PFC) och även i främre insula (involverad i avlyssning, självmedvetenhet och läkemedelsbehov)40] (Fig 6). Intressant var att dessa individer hade högre striatal D2R än matchade kontroller utan någon alkoholhistoria av alkoholism, även om de inte skilde sig i frontalmetabolism. Även i kontrollerna korrelerade striatal D2R inte med frontalmetabolism. Detta ledde oss att spekulera att den högre än normala striatal D2R hos personer med hög genetisk risk för alkoholism skyddar dem mot alkoholism delvis genom att stärka aktiviteten i prefrontala regioner. När de kombineras, tyder dessa data på att höga halter av D2R i striatum kan skydda mot drogmissbruk och missbruk genom att hålla impulsivitetsegenskaper under kontroll, dvs, genom att reglera kretsar som är inblandade i att hämma beteenderesponser och i att kontrollera känslor.
På samma sätt förutsåg vi att prefrontala regioner också är involverade i minskningen av striatal DA-frisättning (och förstärkning) observerad i missbrukade ämnen eftersom de reglerar DA-cellbränning i midbrain och DA-frisättning i striatum. För att testa denna hypotes bedömde vi förhållandet mellan baslinje metabolism i PFC och ökningarna i striatal DA inducerad genom intravenös administrering av MPH i kontroller och i avgiftade alkoholister. I överensstämmelse med hypotesen kunde vi inte identifiera den normala sambandet mellan baslinje prefrontal metabolism och DA-frisättning i striatum, vilket tyder på att de markanta minskningarna av DA-frisättning i striatum ses hos alkoholisterna delvis reflekterar oregelbunden reglering av hjärnaktivitet genom prefrontala hjärnområden [34].
Således har vi funnit en koppling mellan reducerad baslinjeaktivitet i PFC och reducerad striatal D2R hos narkotikamissbrukare och mellan baslinje PFC-aktivitet och DA-frisättning i kontroller som inte är närvarande i beroende personer. Dessa föreningar uppenbarar de starka sambanden mellan neuroadaptationer i PFC-vägar och nedströms dysfunktioner i DA-belöningen och motivationssystemet, troligen på grund av PFCs påverkan på impulsivitet och tvångsförmåga. Dessa misslyckas dock med att redogöra för ytterligare beteendemässiga fenomen, såsom effekterna av läkemedelsrelaterade signaler i utlösande begär, vilket antagligen skulle innebära minnes- och inlärningskretsar.
Konditionerade minnen och stereotypa beteenden ersätter "hög" som föraren
Överstimulering av DA-celler i ventralstriatum etablerar slutligen nya funktionella kopplingar i hjärnan mellan uppgiften att uppfylla trängseln och de situativa händelserna som omger det (t.ex. miljö, rutin för att förbereda drogen etc.) , kraftfulla lärda föreningar som kan utlösa beteende. I slutändan kan bara minnet eller förväntan på drogen utlösa det impulsiva beteendet som kännetecknar beroende personer. Med upprepad användning av drog börjar avfyrningen av DA-celler i striatumet att förändra neurokemin bakomliggande associativt lärande. Detta underlättar konsolideringen av maladaptiva minnesspår som är kopplade till läkemedlet, vilket hjälper till att förklara förmågan hos alla slags läkemedelsrelaterade stimuli (i den lärda förväntan att få läkemedelsbelöningen när den utsätts för dessa stimuli)41] för att enkelt utlösa DA-celler. Och på grund av DA: s roll i motivation ökar dessa DA utmaningarna för motivation som krävs för att säkra belöningen [42]. Faktum är att när råttor exponeras upprepade gånger till en neutral stimulans som är ihopkopplad med läkemedlet (konditionerat), kan det framkalla DA ökar och återinför läkemedlets självadministrering [43]. Sådana konditionerade svar är kliniskt relevanta i substansanvändningsstörningar eftersom de är ansvariga för den höga sannolikheten för en beroende patient att återfalla även efter långvariga perioder av avgiftning. Nu tillåter hjärntekniktekniker oss att testa om exponering av människor för narkotikarelaterade signaler kan utlösa läkemedelsbehov som visas i laboratoriedjur.
Med upprepad användning av drog börjar avfyrningen av DA-celler i striatumet att förändra neurokemin bakomliggande associativt lärande. Detta underlättar konsolideringen av maladaptiva minnesspår som är kopplade till läkemedlet, vilket hjälper till att förklara förmågan hos alla slags läkemedelsrelaterade stimuli (i den lärda förväntan att få läkemedelsbelöningen när den utsätts för dessa stimuli)41] för att enkelt utlösa DA-celler. Och på grund av DA: s roll i motivation ökar dessa DA utmaningarna för motivation som krävs för att säkra belöningen [42]. Faktum är att när råttor exponeras upprepade gånger till en neutral stimulans som är ihopkopplad med läkemedlet (konditionerat), kan det framkalla DA ökar och återinför läkemedlets självadministrering [43]. Sådana konditionerade svar är kliniskt relevanta i substansanvändningsstörningar eftersom de är ansvariga för den höga sannolikheten för en beroende patient att återfalla även efter långvariga perioder av avgiftning. Nu tillåter hjärntekniktekniker oss att testa om exponering av människor för narkotikarelaterade signaler kan utlösa läkemedelsbehov som visas i laboratoriedjur.
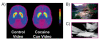
Denna fråga har undersökts i aktiva missbrukare av kokain. Användning av PET och [11C] racloprid, två oberoende studier visade att exponering för en cocaine-cues-video (av ämnen som röker kokain) men inte till en neutral video (av naturscener) ökade striatal DA hos människor som var beroende av kokain (Fig 7) och att DA ökar var associerade med subjektiva rapporter om läkemedelsbehov [44, 45]. Ju högre DA ökar som utlöses av exponering för kokain-cues-video, desto intensivare efterfrågar läkemedlet. Dessutom ökar storleken på DA-ökningen även i samband med missionsgraditetspoäng, vilket framhäver relevansen av konditionerade svar i det kliniska syndromet av missbruk.
Det är viktigt att understryka att trots att de maladaptiva föreningarna antagit styrkan har vi nyligen samlat nya bevis som tyder på att missbrukare av kokain behåller viss förmåga att avsiktligt hämma begär. Därför kan strategier för att stärka fronto-striatalreglering ge potentiella terapeutiska fördelar [46].
Få alltid att falla på plats
Några av de mest skadliga egenskaperna hos narkotikamissbruk är det överväldigande begäret att ta droger som kan återhämta sig även efter år av avhållsamhet och de allvarligt komprometterade förmågan hos missbrukare att hämma läkemedelssökande när begäret utbrott trots kända negativa konsekvenser.
Vi har föreslagit en modell för missbruk [47] som förklarar den multidimensionella karaktären av denna sjukdom genom att föreslå ett nätverk av fyra sammanhängande kretsar, vars kombinerade dysfunktionella utgång kan förklara många av de stereotypa beteendefunktionerna hos missbruk: (a) belöning, inklusive flera kärnor i basalganglierna, särskilt ventral striatum, vars Nac mottar inmatning från det ventrala tegmentala området och reläerar informationen till ventral pallidum (VP); (b) motivation / körning, lokaliserad i OFC, subcallosal cortex, dorsalstriatum och motorcortex; (c) minne och lärande, beläget i amygdala och hippocampus; och (d) planering och kontroll, lokaliserad i dorsolateral prefrontal cortex, främre CG och inferior frontal cortex. Dessa fyra kretsar mottar direkta innervations från DA neuroner men är också kopplade till varandra genom direkta eller indirekta utsikter (mest glutamatergiska).
De fyra kretsarna i denna modell fungerar tillsammans och deras verksamhet förändras med erfarenhet. Varje är kopplad till ett viktigt begrepp: saliency (belöning), internt tillstånd (motivation / drive), lärda föreningar (minne, konditionering) och konfliktlösning (kontroll). Dessutom interagerar dessa kretsar även med kretsar som är inblandade i humör (inklusive stressreaktivitet) [48] och med avlyssning (vilket resulterar i medvetenhet om drogbehov och humör) [49]. Vi har föreslagit att aktivitetsmönstret i det fyrkretsnät som beskrivs här påverkar hur en normal individ gör val bland konkurrerande alternativ. Dessa val påverkas systematiskt av belöning, minne / konditionering, motivation och styrkretsar och dessa moduleras i sin tur av kretsar som ligger till grund för humör och medveten medvetenhet (Fig. 8A).
Svaret på en stimulans påverkas av dess momentala förmåga, dvs dess förväntade belöning. I sin tur behandlas belöningsförväntningen delvis av DA neuroner som projicerar in i ventralstriatum och påverkas av glutamatergiska projicer från OFC (som tilldelar salvitetsvärde som en funktion av sammanhanget) och amygdala / hippocampus (som förmedlar konditionerade svar och minnesåterkallelser). Stimulans värde är vägt (jämfört) med andra alternativa stimuli men ändras också som en funktion av individens interna behov, som moduleras av humör (inklusive stressreaktivitet) och interceptiv medvetenhet. Särskilt spänningsexponering ökar läkemedlets förmånsvärde samtidigt som den minskar prefrontal reglering av amygdala [50]. Dessutom, eftersom kronisk drogexponering är kopplad till ökad sensibilisering för stressresponser förklarar detta varför stress kan utlösa ett läkemedelsreaktor så ofta i kliniska situationer. Ju starkare stimulansvärdet av stimulansen, delvis formad av tidigare memorerade erfarenheter, desto större aktivering av motivationskretsen och desto starkare är drivkraften för att skaffa den. Det kognitiva beslutet att agera (eller inte) för att skaffa stimulansen behandlas delvis av PFC och CG, som väger balansen mellan det omedelbara positiva mot de försenade negativa resultaten och av den underlägsna frontalkorten (Broadmann Area 44), som arbetar för att hämma det prepotentiska svaret på att agera [51].
Enligt denna modell, i det beroende ämnet (Fig. 8B), uppmättes värdet av missbrukets drog och dess associerade signaler på bekostnad av andra (naturliga) belöningar, vars förmånlighet är markant minskad. Detta skulle förklara den ökade motivationen att söka drogen. Akut drogexponering återställer emellertid också belöningsgränser, vilket resulterar i minskad känslighet av belöningskretsen till förstärkare [52], vilket också bidrar till att förklara det minskande värdet av icke-läkemedelsförstärkare i den beroende personen. En annan orsak till en ökad förmåga att använda ett läkemedel är bristen på uppkomst av DA-reaktioner på missbruksmissbruk (tolerans) jämfört med den normala omvårdnaden som finns för naturliga belöningar och som resulterar i mättnad [53].
Dessutom är exponering för konditionerade stimuli tillräcklig för att öka belöningsgränserna [54]; Därmed skulle vi förutsäga att exponering för en miljö med konditionerade signaler skulle försvåra deras nedsatta känslighet för naturliga fördelar hos en beroende person. I avsaknad av konkurrens från andra förstärkare ökar konditionerat lärande förvärv av läkemedlet till nivån av en huvudmotivationsdrivning för individen. Vi antar att drogläkemedel (eller stress) resulterar i snabba DA ökar i Nac i ventralstriatum och i dorsalstriatum som driver motivationen att ta drogen och inte kan motsättas korrekt av en dysfunktionell PFC. På grund av läkemedelsförbrukning och berusning skulle således förbättringen av DA-signalerna resultera i en motsvarande överaktivering av motivations- / driv- och minneskretsarna, vilka deaktiverar PFC (prefrontal inhibering sker med intensiv amygdala-aktivering)50], blockerar PFC: s kraft för att styra motivations- / drivkretsen. Utan denna hämmande kontroll etableras en positiv återkopplingsslinga, vilket resulterar i kompulsivt läkemedelsintag. Eftersom interaktionerna mellan kretsarna är dubbelriktade tjänar tjänsten av nätverket under rusning för att ytterligare stärka läkemedlets förmånsvärde och konditionering till läkemedelsanordningar.
Slutsatser
Kortfattat föreslår vi en modell som berättar för missbruk enligt följande: Under missbruk ökar det förbättrade värdet av läkemedelsinställningar i minneskretsarna förväntningarna och ökar motivationen att konsumera läkemedlet, övervinna den inhiberande kontrollen som utövas av en redan dysfunktionell PFC. Fastän läkemedelsinducerad DA-ökning avsevärt försämras hos läkemedelsmissbrukare, blir läkemedlets farmakologiska effekter konditionerade svar i sig, vilket ytterligare driver motivationen att ta drogen och favoriserar en positiv återkopplingsslinga nu oupplösad på grund av avbrytandet av den prefrontala styrkretsen. Samtidigt kommer missbruk sannolikt också att kalibrera de kretsar som skapar humör och medvetenhet (representerad av mörkare nyanser av grå) (Fig. 8B) på sätt som, om experimentellt bekräftas, skulle ytterligare luta balansen bort från hämmande kontroll och mot begär och tvångsmedel.
Vi erkänner enkelt att detta är en förenklad modell: vi inser att andra hjärnregioner också måste vara involverade i dessa kretsar, den ena regionen kan bidra till flera kretsar, och att andra kretsar sannolikt också kommer att vara involverade i missbruk. Dessutom, även om denna modell fokuserar på DA, framgår det av prekliniska studier att modifieringar i glutamatergiska projicer förmedlar många av de anpassningar som observerats i missbruk och som vi diskuterade här. Det framgår också av prekliniska studier att andra neurotransmittorer är inblandade i förstärkande effekter av droger, inklusive cannabinoider och opioider. Tyvärr har den begränsade tillgången till radiospårare för PET-bildbehandling till och med nyligen begränsat kapaciteten att undersöka andra neurotransmittors medverkan i drogbelöning och beroende.
Förkortningar
- AMPA
- α-amino-3-hydroxyl-5-metyl-4-isoxazol-propionat
- CG
- cingulera gyrus
- CTX
- cortex
- D2R
- dopamin typ 2 / 3-receptor
- DA
- dopamin
- FDG
- fluordeoxiglukos
- GABA
- y-aminobutyirinsyra
- HPA
- hypotalamisk hypofysaxel
- MILES PER TIMME
- metylfenidat
- Nac
- kärnan accumbens
- NMDA
- n-metyl-d-asparaginsyra
- OFC
- orbitofrontal cortex
- SÄLLSKAPSDJUR
- positronemissionstomografi
- PFC
- prefrontala cortex
- VP
- ventral pallidum
Referensprojekt
55. Fowler JS, Volkow ND, Logan J, et al. Snabbt upptag och långvarig bindning av metamfetamin i den mänskliga hjärnan: jämförelse med kokain. Neuroimage. 2008;43: 756-63. [PMC gratis artikel] [PubMed