Entwickler Rev 2008; 28(1): 62-77. doi: 10.1016 / j.dr.2007.08.003
Abstrakt
Die Adoleszenz ist eine Entwicklungsphase, die durch suboptimale Entscheidungen und Handlungen gekennzeichnet ist, die zu einer erhöhten Inzidenz von unbeabsichtigten Verletzungen und Gewalt, Alkohol- und Drogenmissbrauch, ungewollter Schwangerschaft und sexuell übertragbaren Krankheiten führen. Herkömmliche neurobiologische und kognitive Erklärungen für jugendliches Verhalten haben die nichtlinearen Verhaltensänderungen während der Adoleszenz relativ zur Kindheit und zum Erwachsenenalter nicht berücksichtigt. Diese Übersicht liefert eine biologisch plausible Konzeptualisierung der neuronalen Mechanismen, die diesen nichtlinearen Verhaltensänderungen zugrunde liegen, als eine erhöhte Reaktionsfähigkeit auf Anreize, während die Impulskontrolle während dieser Periode noch relativ unreif ist. Neuere Studien zur menschlichen Bildgebung und Tierversuche liefern eine biologische Grundlage für diese Ansicht, was auf eine unterschiedliche Entwicklung von limbischen Belohnungssystemen im Vergleich zu Top-Down-Kontrollsystemen während der Adoleszenz im Vergleich zur Kindheit und zum Erwachsenenalter hindeutet. Dieses Entwicklungsmuster kann sich bei Jugendlichen mit einer Prädisposition für Risikobereitschaft verschärfen, was das Risiko für schlechte Ergebnisse erhöht.
Laut dem National Center for Health Statistics gibt es in den Vereinigten Staaten jedes Jahr über 13,000 jugendliche Todesfälle. Ungefähr 70% dieser Todesfälle resultieren aus Kraftfahrzeugunfällen, unbeabsichtigten Verletzungen, Totschlag und Selbstmord (Eaton et al., 2006). Die Ergebnisse der 2005-Erhebung zum Youth Risk Behavior Survey (YRBS) zeigen, dass Jugendliche Verhaltensweisen entwickeln, die ihre Wahrscheinlichkeit von Tod oder Krankheit erhöhen, indem sie ein Fahrzeug nach dem Trinken oder ohne Sicherheitsgurt fahren, Waffen tragen, illegale Substanzen verwenden und ungeschützten Sex betreiben mit ungewollten Schwangerschaften und sexuell übertragbaren Krankheiten, einschließlich HIV-Infektion (Eaton et al., 2006). Diese Statistiken unterstreichen die Bedeutung des Verständnisses von riskanten Entscheidungen und Handlungen bei Jugendlichen.
Eine Reihe kognitiver und neurobiologischer Hypothesen wurde postuliert, warum Jugendliche suboptimales Wahlverhalten betreiben. In einer kürzlich erschienenen Übersicht über die Literatur zur Gehirnentwicklung von Jugendlichen Yurgelun-Todd (2007) weist darauf hin, dass die kognitive Entwicklung im Jugendalter mit einer zunehmend höheren Effizienz kognitiver Kontrollkapazitäten einhergeht. Diese Effizienz wird als abhängig von der Reifung des präfrontalen Kortex beschrieben, was durch erhöhte Aktivität in fokalen präfrontalen Regionen (Rubia et al., 2000; Tamm, Menon & Reiss, 2002) und verminderte Aktivität in irrelevanten Hirnregionen (Brown et al., 2005; Durston et al., 2006).
Dieses allgemeine Muster einer verbesserten kognitiven Kontrolle mit Reifung des präfrontalen Kortex deutet auf einen linearen Anstieg der Entwicklung von der Kindheit bis zum Erwachsenenalter hin. Doch suboptimale Entscheidungen und Handlungen, die während der Adoleszenz beobachtet werden, stellen eine nichtlineare Verhaltensänderung dar, die sich von der Kindheit und dem Erwachsenenalter unterscheiden lässt, wie das Nationale Zentrum für Gesundheitsstatistik zu Verhalten und Sterblichkeit bei Jugendlichen zeigt. Wenn kognitive Kontrolle und ein unreifer präfrontaler Kortex die Basis für ein suboptimales Wahlverhalten sind, sollten Kinder aufgrund ihres weniger entwickelten präfrontalen Kortex und ihrer kognitiven Fähigkeiten bemerkenswert ähnlich oder sogar schlechter aussehen als Jugendliche. Somit kann die unreife präfrontale Funktion allein nicht für jugendliches Verhalten verantwortlich sein.
Eine genaue Konzeptualisierung kognitiver und neurobiologischer Veränderungen während der Adoleszenz muss die Adoleszenz als Übergangszeit behandeln (Speer, 2000) statt einer einzigen Momentaufnahme (Casey, Tottenham, Liston & Durston, 2005). Mit anderen Worten, um diese Entwicklungsperiode zu verstehen, sind Übergänge in und aus der Pubertät notwendig, um verschiedene Eigenschaften dieses Entwicklungsstadiums zu unterscheiden. Die Entwicklung von Entwicklungstrajektorien für kognitive und neurale Prozesse ist essentiell, um diese Übergänge zu charakterisieren und Interpretationen über Verhaltensänderungen in diesem Zeitraum zu beschränken. Auf kognitiver oder verhaltensbezogener Ebene werden Heranwachsende als impulsiv (dh ohne kognitive Kontrolle) und Risikobereitschaft charakterisiert, wobei diese Konstrukte synonym und ohne Wertschätzung für unterschiedliche Entwicklungsverläufe verwendet werden. Auf einer neurobiologischen Ebene legen menschliche Bildgebungs- und Tierstudien unterschiedliche neurobiologische Grundlagen und Entwicklungsverläufe für die neuronalen Systeme nahe, die diesen getrennten Konstrukten von Impulskontrolle und riskanten Entscheidungen zugrunde liegen.
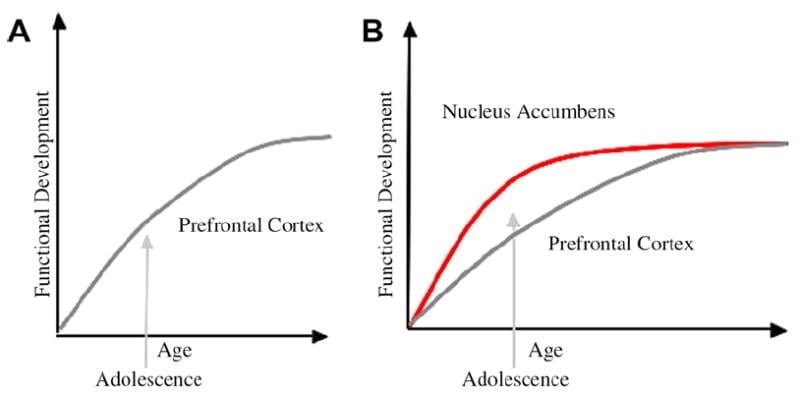
Wir haben ein neurobiologisches Modell der Entwicklung von Jugendlichen in diesem Rahmen entwickelt, der auf Nagetiermodellen aufbaut (Laviola, Adriani, Terranova & Gerra, 1999; Speer, 2000) und neuere bildgebende Untersuchungen zur Adoleszenz (Ernst et al., 2005; Galvan, Hare, Voss, Glover & Casey, 2007; Galvan et al., 2006). Abb.. 1 Unten zeigt dieses Modell. Auf der linken Seite bezieht sich die traditionelle Charakterisierung der Adoleszenz fast ausschließlich auf die Unreife des präfrontalen Kortex. Rechts ist unser vorgeschlagenes neurobiologisches Modell, das veranschaulicht, wie limbische subkortikale und präfrontale Top-Down-Kontrollregionen zusammen betrachtet werden müssen. Die Karikatur illustriert verschiedene Entwicklungsverläufe für diese Systeme, wobei sich limbische Systeme früher als präfrontale Kontrollregionen entwickeln. Gemäß diesem Modell ist das Individuum stärker durch funktionell ausgereifte limbische Regionen während der Adoleszenz (dh ein Ungleichgewicht der limbischen im Vergleich zur präfrontalen Kontrolle) im Vergleich zu Kindern, für die sich diese Systeme (dh limbisch und präfrontal) immer noch entwickeln; und im Vergleich zu Erwachsenen, für die diese Systeme voll ausgereift sind. Diese Perspektive bietet eine Grundlage für nichtlineare Verschiebungen im Verhalten über die Entwicklung hinweg, aufgrund der früheren Reifung dieser limbischen relativ zu einer weniger reifen präfrontalen Kontrollregion von oben nach unten. Mit der Entwicklung und Erfahrung bietet die funktionale Verbindung zwischen diesen Regionen einen Mechanismus für die Kontrolle dieser Regionen von oben nach unten (Hare, Voss, Glover & Casey, 2007a). Außerdem versöhnt das Modell den Widerspruch der Gesundheitsstatistik von riskantem Verhalten während der Adoleszenz mit der klugen Beobachtung durch Reyna und Farley (2006) dass Jugendliche in der Lage sind, Risiken von Verhaltensweisen zu verstehen und zu verstehen, an denen sie beteiligt sind. Gemäß unserem Modell wird das limbische System in emotional hervorstechenden Situationen angesichts seiner Reife gegenüber dem präfrontalen Kontrollsystem Kontrollsysteme gewinnen. Evidenz aus verhaltensbezogenen und humanen Bildgebungsstudien zur Unterstützung dieses Modells werden im Kontext von Aktionen in belohnenden und emotionalen Kontexten (Galvan et al., 2006, 2007; Hare, Voss, Glover & Casey, 2007b; Hase et al., 2007a). Darüber hinaus spekulieren wir darüber, warum sich das Gehirn auf diese Weise entwickeln könnte und warum einige Jugendliche möglicherweise ein größeres Risiko haben, suboptimale Entscheidungen zu treffen, die zu schlechteren Langzeitergebnissen führen (Galvan et al., 2007; Hase et al., 2007b).
Die traditionelle Erklärung des jugendlichen Verhaltens wurde als Ursache für die langwierige Entwicklung des präfrontalen Cortex (A) angenommen. Unser Modell berücksichtigt die Entwicklung des präfrontalen Kortex zusammen mit subkortikalen limbischen Regionen (z. B. Nucleus accumbens), die mit riskanten Entscheidungen und Handlungen in Verbindung gebracht wurden (B).
Entwicklung von zielgerichtetem Verhalten
Ein Eckpfeiler der kognitiven Entwicklung ist die Fähigkeit, unangemessene Gedanken und Handlungen gezielt zugunsten von zielgerichteten zu unterdrücken, insbesondere bei Vorhandensein von überzeugenden Anreizen (Casey, Galvan & Hare, 2005; Casey et al., 2000b; Casey, Thomas, David-Sohn, Kunz & Franzen, 2002a; Casey, Tottenham & Fossella, 2002b). Eine Reihe von klassischen Entwicklungsstudien haben gezeigt, dass sich diese Fähigkeit im gesamten Kindes- und Jugendalter entwickelt (Fall, 1972; Flavell, Feach & Chinsky, 1966; Keating & Bobbitt, 1978; Pascual-Leone, 1970). Mehrere Theoretiker haben argumentiert, dass die kognitive Entwicklung auf eine Steigerung der Verarbeitungsgeschwindigkeit und -effizienz zurückzuführen ist und nicht auf eine Erhöhung der geistigen Leistungsfähigkeit zurückzuführen ist (z. B. Björkland, 1985; Björkland, 1987; Fall, 1985). Andere Theoretiker haben das Konstrukt der "inhibitorischen" Prozesse in ihren Beitrag zur kognitiven Entwicklung (Harnishfeger & Bjorkland, 1993). Nach dieser Darstellung ist unreife Wahrnehmung durch Störanfälligkeit durch konkurrierende Quellen gekennzeichnet, die unterdrückt werden müssen (z. B. Brainerd & Reyna, 1993; Casey, Thomas, Davidson, Kunz & Franzen, 2002a; Dempster, 1993; Diamant, 1985; Munakata & Yerys, 2001). Daher erfordert zielgerichtetes Verhalten die Steuerung von Impulsen oder eine Verzögerung der Befriedigung zur Optimierung der Ergebnisse, und diese Fähigkeit scheint über Kindheit und Jugend hinweg zu reifen.
Heranwachsendes Verhalten wurde als impulsiv und riskant beschrieben, fast synonym, doch beruhen diese Konstrukte auf verschiedenen kognitiven und neuralen Prozessen, die unterschiedliche Konstrukte mit unterschiedlichen Entwicklungsverläufen nahelegen. Eine Literaturübersicht zeigt, dass die Impulsivität mit zunehmendem Alter im Kindes- und Jugendalter abnimmt (Casey et al., 2002a; Casey, Galvan und andere, 2005; Galvan et al., 2007) und ist mit einer protrahierten Entwicklung des präfrontalen Cortex assoziiert (Casey, Galvan und andere, 2005), obwohl es Unterschiede im Grad gibt, zu dem eine gegebene Person unabhängig vom Alter impulsiv ist oder nicht.
Im Gegensatz dazu scheint die Risikobereitschaft während der Adoleszenz im Vergleich zur Kindheit und zum Erwachsenenalter zu steigen und mit subkortikalen Systemen in Verbindung gebracht zu werden, von denen bekannt ist, dass sie an der Bewertung von Belohnungen beteiligt sind. Human-Imaging-Studien, die überprüft werden, deuten auf eine Zunahme der subkortikalen Aktivierung (z. B. accumbens) bei riskanten Entscheidungen hin (Kuhnen & Knutson, 2005; Matthews & et al., 2004; Montague & Berns, 2002) Das ist bei Jugendlichen, im Vergleich zu Kindern und Erwachsenen (Ernst et al., 2005; Galvan et al., 2006). Diese Ergebnisse deuten auf unterschiedliche Entwicklungslinien für belohnungs- oder anreizbasiertes Verhalten hin, wobei die Entwicklung dieser Systeme im Vergleich zu Kontrollsystemen, die einen langwierigen und linearen Entwicklungsverlauf aufweisen, im Hinblick auf die Übersteuerung unangemessener Entscheidungen und Maßnahmen zugunsten zielgerichteter Verhaltensweisen erfolgt.
Hinweise aus bildgebenden Studien zur Entwicklung des menschlichen Gehirns
Jüngste Untersuchungen zur Entwicklung von jugendlichen Gehirnen basierten auf Fortschritten in bildgebenden Verfahren, die leicht mit sich entwickelnden menschlichen Populationen verwendet werden können. Diese Methoden beruhen auf Magnetresonanztomographie (MRT) - Methoden (vgl Abb.. 2) und umfassen: strukturelle MRI, die zur Messung der Größe und Form von Strukturen verwendet wird; funktionelle MRT, die verwendet wird, um Muster der Gehirnaktivität zu messen; und Diffusionstensor-Bildgebung (DTI), die verwendet wird, um die Konnektivität von Faserbereichen mit weißer Substanz zu indizieren. Evidenz für unser Entwicklungsmodell der Konkurrenz zwischen kortikalen und subkortikalen Regionen wird durch unreife strukturelle und funktionelle Konnektivität, gemessen durch DTI bzw. fMRI, unterstützt.
MRI-Studien zur Entwicklung des menschlichen Gehirns
Mehrere Studien haben strukturelle MRI verwendet, um den anatomischen Verlauf der normalen Entwicklung des Gehirns abzubilden (siehe Review von Durston et al., 2001). Obwohl die Gesamtgröße des Gehirns im Alter von etwa sechs Jahren etwa 90% seiner Erwachsenengröße beträgt, verändern sich die Subkomponenten der grauen und weißen Substanz des Gehirns während der Pubertät weiterhin dynamisch. Daten aus aktuellen longitudinalen MRI-Studien weisen darauf hin, dass das Volumen der grauen Substanz ein umgekehrtes U-förmiges Muster mit einer größeren regionalen Variation als die weiße Substanz aufweist (Giedd, 2004; Gogtay et al., 2004; Sowell und andere, 2003; Sowell, Thompson & Toga, 2004). Im Allgemeinen reifen Regionen, die primäre Funktionen wie motorische und sensorische Systeme nutzen, am frühesten; Vereinigungsgebiete höherer Ordnung, die diese primären Funktionen integrieren, reifen später (Gogtay et al., 2004; Sowell, Thompson & Toga, 2004). Zum Beispiel zeigen Studien mit MRT-basierten Messungen, dass kortikale graue Substanz am frühesten in den primären sensomotorischen Bereichen und zuletzt in den dorsolateralen präfrontalen und lateralen temporalen Kortizes auftritt (Gogtay et al., 2004). Dieses Muster steht im Einklang mit nicht-menschlichen Primaten- und humanen postmortalen Studien, die zeigen, dass der präfrontale Kortex eine der letzten Gehirnregionen ist, die reifen (Bourgeois, Goldman-Rakic & Rakic, 1994; Huttenlocher, 1979). Im Gegensatz zur grauen Substanz nimmt das Volumen der weißen Substanz in einem annähernd linearen Muster zu und nimmt während der gesamten Entwicklung bis ins Erwachsenenalter zu (Gogtay et al., 2004). Diese Veränderungen reflektieren vermutlich die fortschreitende Myelinisierung von Axonen durch Oligodendrozyten, die die neuronale Leitung und Kommunikation verbessern.
Obwohl subkortikalen Regionen bei der Untersuchung struktureller Veränderungen weniger Beachtung geschenkt wurde, werden in diesen Regionen einige der größten Veränderungen im Gehirn während der Entwicklung beobachtet, insbesondere in den Basalganglien (Sowell et al., 1999, Siehe Abb.. 3) und besonders bei Männern (Giedd et al., 1996). Entwicklungsveränderungen im strukturellen Volumen innerhalb von Basalganglien und präfrontalen Regionen sind angesichts bekannter Entwicklungsprozesse (z. B. dendritische Verzweigung, Zelltod, synaptischer Schnitt, Myelinisierung), die während der Kindheit und Jugend auftreten, interessant. Diese Prozesse ermöglichen eine Feinabstimmung und Stärkung der Verbindungen zwischen präfrontalen und subkortikalen Regionen mit Entwicklung und Lernen, die mit einer stärkeren kognitiven Kontrolle zusammenfallen können. Wie hängen diese strukturellen Veränderungen mit kognitiven Veränderungen zusammen? Eine Reihe von Studien haben die strukturelle Reifung des Frontallappens und kognitive Funktionen mit neuropsychologischen und kognitiven Maßnahmen (z. B. Sowell et al., 2003). Insbesondere wurden Assoziationen zwischen MRT-basierten präfrontalen kortikalen und basalen Ganglien, regionalen Volumina und Maßen der kognitiven Kontrolle (dh der Fähigkeit, eine unangemessene Reaktion zugunsten einer anderen zu überschreiben oder die Aufmerksamkeit auf irrelevante Stimulusattribute zugunsten eines relevanten Reizattributs zu unterdrücken, berichtet.Casey, Trainor ua, 1997). Diese Befunde deuten darauf hin, dass sich kognitive Veränderungen in strukturellen Veränderungen des Gehirns widerspiegeln und die Bedeutung subkortikaler (Basalganglien) sowie kortikaler (zB präfrontaler Kortex) Entwicklung unterstreichen.

DTI-Studien zur Entwicklung des menschlichen Gehirns
Die MRT-basierten Morphometrie-Studien deuten darauf hin, dass kortikale Verbindungen mit der Beseitigung eines Überflusses an Synapsen und der Stärkung relevanter Zusammenhänge mit Entwicklung und Erfahrung abgestimmt werden. Jüngste Fortschritte in der MRI-Technologie, wie DTI, bieten ein mögliches Werkzeug, um die Rolle spezifischer Hirnsubstanzen für die Entwicklung des Gehirns und des Verhaltens detaillierter zu untersuchen. Relevant für dieses Papier sind die Neuroimaging-Studien, die die Entwicklung von Faserbahnen mit Verbesserungen der kognitiven Fähigkeiten verbunden haben. Insbesondere wurden Assoziationen zwischen DTI-basierten Messungen der präfrontalen weißen Substanzentwicklung und kognitiver Kontrolle bei Kindern gezeigt. In einer Studie korrelierte die Entwicklung dieser Kapazität positiv mit präfrontal-parietalen Faserbahnen (Nagy, Westerberg & Klingberg, 2004) in Übereinstimmung mit Studien zur funktionellen Bildgebung, die eine differentielle Rekrutierung dieser Regionen bei Kindern im Vergleich zu Erwachsenen zeigen.
Mit einem ähnlichen Ansatz Listonet al. (2005) haben gezeigt, dass sich weiße Substanzbahnen zwischen den präfrontal-basalen Ganglien und den nachtra- genden Faserbahnen über die Kindheit bis ins Erwachsenenalter entwickeln, aber nur jene Bahnen zwischen dem präfrontalen Kortex und den Basalganglien korrelieren mit der Impulskontrolle, gemessen an der Leistung auf einem Go / Nogo Aufgabe. Die präfrontalen Faserbahnen wurden durch Interessensgebiete definiert, die in einer fMRI-Studie mit derselben Aufgabe identifiziert wurden. In beiden Entwicklungs-DTI-Studien wurden die Messungen der Faserstränge mit der Entwicklung korreliert, aber die Spezifität bestimmter Faserbahnen mit kognitiver Leistung wurde durch Dissoziation des jeweiligen Trakts gezeigt (Liston et al., 2005) oder kognitive Fähigkeiten (Nagy et al., 2004). Diese Ergebnisse unterstreichen die Wichtigkeit, nicht nur regionale, sondern auch schaltungstechnische Veränderungen zu untersuchen, wenn Aussagen über altersabhängige Veränderungen neuraler Substrate der kognitiven Entwicklung gemacht werden.
Funktionelle MRI-Studien zur Verhaltens- und Gehirnentwicklung
Obwohl strukturelle Veränderungen, die durch MRI und DTI gemessen wurden, mit Verhaltensänderungen während der Entwicklung in Verbindung gebracht wurden, ist ein direkterer Ansatz zur Untersuchung der Struktur-Funktions-Assoziation, Veränderungen im Gehirn und Verhalten gleichzeitig zu messen, wie bei der fMRT. Die Fähigkeit, funktionelle Veränderungen im sich entwickelnden Gehirn mit MRI zu messen, hat ein signifikantes Potential für den Bereich der Entwicklungswissenschaft. Im Kontext des vorliegenden Papiers bietet fMRI eine Möglichkeit, die Interpretation von jugendlichem Verhalten einzuschränken. Wie bereits erwähnt, spielt die Entwicklung des präfrontalen Kortex eine wichtige Rolle bei der Reifung höherer kognitiver Fähigkeiten wie Entscheidungsfindung und kognitive Kontrolle (Casey, Tottenham & Fossella 2002b; Casey, Trainor ua, 1997). Viele Paradigmen wurden zusammen mit fMRT verwendet, um die neurobiologische Basis dieser Fähigkeiten einzuschätzen, einschließlich der Aufgaben von flanker, Stroop und go / nogo (Casey, Castellanoset al., 1997; Casey, Giedd & Thomas, 2000a; Durston et al., 2003). Insgesamt zeigen diese Studien, dass Kinder bei der Durchführung dieser Aufgaben unterschiedliche, aber häufig größere, diffusere präfrontale Regionen rekrutieren als Erwachsene. Das Aktivitätsmuster innerhalb der Gehirnregionen, die für die Aufgabenleistung zentral sind (dh die mit der kognitiven Leistung korrelieren), wird mit dem Alter fokaler oder feiner abgestimmt, während Bereiche, die nicht mit der Aufgabenleistung korrelieren, in Aktivität mit dem Alter abnehmen. Dieses Muster wurde in beiden Querschnittsbereichen beobachtet (Brown et al., 2005) und Längsschnittstudien (Durston et al., 2006) und über eine Vielzahl von Paradigmen. Obwohl bildgebende Verfahren den Mechanismus solcher Entwicklungsveränderungen (zB dendritische Verzweigung, synaptisches Beschneiden) nicht definitiv charakterisieren können, spiegeln die Befunde die Entwicklung innerhalb und die Verfeinerung von Projektionen zu und von aktivierten Hirnregionen mit Reifung wider und deuten darauf hin, dass diese Veränderungen über einen längeren Zeitraum stattfinden Zeitspanne (Brown et al., 2005; Bunge, Dudukovic, Thomason, Vaidya & Gabrieli, 2002; Casey, Trainor ua, 1997; Casey et al., 2002a; Crone, Donohue, Honomichl, Wendelken & Bunge, 2006; Luna et al., 2001; Moses et al., 2002; Schlaggar et al., 2002; Tamm et al., 2002; Thomas et al., 2004; Turkeltaub, Gareau, Flowers, Zeffiro & Eden, 2003).
Wie kann diese Methodik uns darüber informieren, ob Jugendlichen tatsächlich eine ausreichende kognitive Kontrolle fehlt (impulsiv) oder in ihren Entscheidungen und Handlungen riskant sind? Impulskontrolle, wie sie durch kognitive Kontrollaufgaben wie die go / nogo-Aufgabe gemessen wird, zeigt ein lineares Entwicklungsmuster über Kindheit und Jugend, wie oben beschrieben. Neuere bildgebende Verfahren haben jedoch begonnen, die belohnungsbezogene Verarbeitung zu untersuchen, die spezifisch für die Risikobereitschaft von Jugendlichen ist (Bjork et al., 2004; Ernst et al., 2005; May et al., 2004). Diese Studien konzentrierten sich hauptsächlich auf die Region des Accumbens, eines Teils der Basalganglien, die an der Vorhersage von Belohnung beteiligt sind, und nicht auf die Charakterisierung der Entwicklung dieser Region in Verbindung mit Top-Down-Kontrollregionen (präfrontaler Kortex). Obwohl kürzlich ein Bericht über eine weniger ventrale präfrontale Aktivität bei Jugendlichen im Vergleich zu Erwachsenen während einer monetären Entscheidungsfindung im Hinblick auf das Risikoverhalten veröffentlicht wurde (Eshel, Nelson, Blair, Pine & Ernst, 2007).
Insgesamt haben nur wenige Studien untersucht, wie sich die Entwicklung von Belohnungsschaltkreisen in subkortikalen Regionen (z. B. accumbens) in Verbindung mit der Entwicklung kortikaler präfrontaler Regionen verändert. Darüber hinaus bleibt die Art und Weise, in der diese neuronalen Veränderungen mit der Belohnungssuche, der Impulsivität und dem Risikoverhalten zusammenfallen, relativ unbekannt. Unser neurobiologisches Modell schlägt vor, dass die Kombination von erhöhter Reaktionsfähigkeit auf Belohnungen und Unreife in verhaltenskontrollierenden Bereichen Jugendliche dazu bringen könnte, eher unmittelbare als langfristige Gewinne zu erzielen, was möglicherweise ihre Zunahme an riskanten Entscheidungen und impulsiven Verhaltensweisen erklärt. Die subkortikale (z. B. accumbens) und kortikale (z. B. präfrontale) Entwicklung der Entscheidungsfindung über die Kindheit bis zum Erwachsenenalter nachzuverfolgen, führt zu zusätzlichen Einschränkungen, ob in der Adoleszenz gemeldete Veränderungen spezifisch für diese Entwicklungsperiode sind oder die Reifung widerspiegeln, die in a etwas lineares Muster von der Kindheit bis zum Erwachsenenalter.
Empirische Befunde aus einer aktuellen fMRI-Studie helfen, unser neurobiologisches Modell zu unterstützen, und verfolgen einen Übergang zum Verständnis der Adoleszenz, indem wir Veränderungen vor und nach der Adoleszenz untersuchen. In dieser Studie (Galvan et al., 2006), untersuchten wir Verhaltens- und Nervenreaktionen, um Manipulationen über die gesamte Entwicklung hinweg zu belohnen, wobei wir uns auf Hirnregionen konzentrierten, die an belohnungsbezogenem Lernen und Verhalten in Tieren beteiligt sind (Hikosaka & Watanabe, 2000; Pecina, Cagniard, Berridge, Aldridge & Zhuang, 2003; Schultz, 2006) und bildgebende Verfahren für Erwachsene (zB Knutson, Adams, Fong & Hommer, 2001; O, Doherty, Kringelbach, Rolls, Hornak, Andrews, 2001; Zald et al., 2004) und in Suchtstudien (Hyman & Malenka, 2001; Volkow & Li, 2004). Basierend auf Nagetiermodellen (Laviola et al., 1999; Speer, 2000) und frühere bildgebendeErnst et al., 2005), stellten wir die Hypothese auf, dass Jugendliche im Vergleich zu Kindern und Erwachsenen eine übertriebene Aktivierung des Accumbens zeigten, zusammen mit einer weniger ausgereiften Rekrutierung top-down präfrontaler Kontrollregionen. Neuere Arbeiten, die eine verzögerte funktionelle Konnektivität zwischen diesen präfrontalen und limbischen subkortikalen Regionen im Jugendalter im Vergleich zu Erwachsenen zeigen, bieten einen Mechanismus für das Fehlen einer Top-Down-Kontrolle dieser Regionen (Hase et al., 2007a).
Unsere Ergebnisse stimmten mit Nagetiermodellen überein (Laviola, Macri, Morley-Fletcher & Adriani, 2003) und frühere Bildgebungsstudien (Ernst et al., 2005) was darauf hindeutet, dass accumbens Aktivität gegenüber Belohnungen während der Adoleszenz erhöht ist. Im Vergleich zu Kindern und Erwachsenen zeigten Jugendliche in Erwartung einer Belohnung eine übertriebene accumbens Antwort. Jedoch zeigten sowohl Kinder als auch Jugendliche in präfrontalen Kontrollregionen eine weniger ausgereifte Antwort als Erwachsene. Diese Befunde legen nahe, dass unterschiedliche Entwicklungsverläufe für diese Regionen möglicherweise der Steigerung der Accumbens - Aktivität im Vergleich zu Kindern oder Erwachsenen zugrunde liegen, was wiederum mit den erhöhten impulsiven und riskanten Verhaltensweisen in dieser Entwicklungsphase zusammenhängen könnte (vgl Abb.. 4).

Eine differentielle Rekrutierung von präfrontalen und subkortikalen Regionen wurde in einer Reihe von fMRI-Studien zurCasey et al., 2002b; Monk ua, 2003; Thomas et al., 2004). Typischerweise wurden diese Befunde eher in Bezug auf unreife präfrontale Regionen als auf ein Ungleichgewicht zwischen präfrontaler und subkortikaler regionaler Entwicklung interpretiert. Hinweise auf präfrontale Regionen, um geeignete Maßnahmen in verschiedenen Kontexten zu leiten (Miller & Cohen, 2001) Unreife präfrontale Aktivität könnte eine angemessene Einschätzung zukünftiger Ergebnisse und die Einschätzung von riskanten Entscheidungen behindern und könnte daher weniger Einfluss auf die Bewertung der Prämien haben als die accumbens. Dieses Muster steht im Einklang mit früheren Untersuchungen, die eine erhöhte subkortikale Aktivität im Vergleich zur kortikalen Aktivität zeigen, wenn Entscheidungen durch unmittelbare langfristige Gewinne beeinflusst werden (McClure, Laibson, Loewenstein & Cohen, 2004). Darüber hinaus wurde gezeigt, dass accumbens Aktivität mit fMRT positiv korreliert mit nachfolgenden Risikoverhaltensweisen (Kuhnen & Knutson, 2005). Während der Adoleszenz, im Vergleich zur Kindheit oder zum Erwachsenenalter, kann der unreife ventrale präfrontale Kortex keine ausreichende Top-Down-Kontrolle von stark aktivierten Belohnungsverarbeitungsregionen (z. B. accumbens) bieten, was zu weniger Einfluss von präfrontalen Systemen (orbitofrontaler Kortex) im Vergleich zu Accumbens führt Bewertung.
Warum sollte das Gehirn so programmiert werden?
Die Adoleszenz ist die Übergangszeit zwischen Kindheit und Erwachsenenalter, die oft mit der Pubertät einhergeht. Die Pubertät markiert den Beginn der sexuellen Reifung (Graber & Brooks-Gunn, 1998) und kann durch biologische Marker definiert werden. Die Adoleszenz kann als fortschreitender Übergang ins Erwachsenenalter mit einem nebulösen ontogenetischen Zeitverlauf beschrieben werden (Speer, 2000). Evolutionär gesehen ist die Adoleszenz die Zeit, in der Unabhängigkeitsfähigkeiten erworben werden, um den Erfolg bei Trennung vom Familienschutz zu erhöhen, obwohl die Chancen auf schädliche Umstände (zB Verletzung, Depression, Angst, Drogenkonsum und Sucht (Kelley, Schochet & Landry, 2004). Unabhängigkeitssuchende Verhaltensweisen sind über alle Arten hinweg verbreitet, wie z. B. die Zunahme von Peer-gesteuerten sozialen Interaktionen und die Intensivierung von neuheitssuchenden und risikofreudigen Verhaltensweisen. Psychosoziale Faktoren beeinflussen die Neigung junger Menschen zu riskantem Verhalten. Risikoverhalten ist jedoch das Produkt eines biologisch getriebenen Ungleichgewichts zwischen gesteigerter Neuheits- und Sensationslust in Verbindung mit unreifer "Selbstregulierungskompetenz" (Steinberg, 2004). Unsere neurobiologischen Daten deuten darauf hin, dass dies durch eine unterschiedliche Entwicklung dieser beiden Systeme (limbisch und Kontrolle) geschieht.
Spekulationen würden nahelegen, dass dieses Entwicklungsmuster ein evolutionäres Merkmal ist. Sie müssen sich in risikoreiches Verhalten verwickeln, um Ihre Familie und Ihr Dorf zu verlassen, um einen Partner und Risikobereitschaft zu finden, während die Hormone die Jugendlichen dazu treiben, Sexualpartner zu suchen. In der heutigen Gesellschaft, in der sich die Pubertät auf unbestimmte Zeit ausdehnt, bei Kindern, die bei ihren Eltern leben und eine finanzielle Abhängigkeit haben und die Partner später im Leben wählen, kann diese Entwicklung als unangemessen betrachtet werden.
Es gibt Hinweise auf Arten für erhöhte Neuheitssuche und Risikobereitschaft während der Jugendjahre. Gleichaltrige Gleichaltrige aufzuspüren und mit den Eltern zu kämpfen, die alle dazu beitragen, den Heranwachsenden aus dem Heimatgebiet zur Paarung zu bringen, zeigt sich bei anderen Arten wie Nagetieren, nichtmenschlichen Primaten und einigen Vögeln (Speer, 2000). Im Vergleich zu Erwachsenen zeigen periadoleszente Ratten in einem frei wählbaren Paradigma der Neuheit (Laviola et al., 1999). Neurochemische Belege deuten darauf hin, dass sich das Gleichgewicht im adoleszenten Gehirn zwischen kortikalen und subkortikalen Dopaminsystemen im Verlauf der Adoleszenz zu größeren kortikalen Dopaminspiegeln verschiebt (Speer, 2000). Eine ähnliche langwierige dopaminerge Enervation durch die Adoleszenz bis ins Erwachsenenalter wurde auch im präfrontalen Kortex des nichtmenschlichen Primaten gezeigt (Rosenberg & Lewis, 1995). Daher scheint diese erhöhte scheinbare Risikoübernahme artübergreifend zu sein und wichtige adaptive Zwecke zu haben.
Biologische Prädispositionen, Entwicklung und Risiko
Individuelle Unterschiede in der Impulskontrolle und der Risikobereitschaft werden seit einiger Zeit in der Psychologie erkannt (Benthin, Slovic & Severson, 1993). Vielleicht ist eines der klassischen Beispiele individueller Unterschiede, die in diesen Fähigkeiten in der Literatur der sozialen, kognitiven und entwicklungspsychologischen Forschung berichtet werden, die Verzögerung der Befriedigung (Mischel, Shoda & Rodriguez, 1989). Delay of Gratification wird typischerweise in 3- bis 4-Jahre alten Kleinkindern bewertet. Das Kleinkind wird gefragt, ob es eine kleine Belohnung (ein Keks) oder eine große Belohnung (zwei Kekse) bevorzugen würde. Dem Kind wird dann gesagt, dass der Experimentator den Raum verlässt, um sich auf bevorstehende Aktivitäten vorzubereiten, und erklärt dem Kind, dass, wenn sie auf ihrem Platz bleibt und keinen Keks isst, sie die große Belohnung erhalten wird. Wenn das Kind nicht warten kann oder kann, sollte es eine Glocke läuten, um den Experimentator zu rufen und dadurch die kleinere Belohnung zu erhalten. Sobald klar ist, dass das Kind die Aufgabe versteht, sitzt sie mit den zwei Belohnungen und der Glocke am Tisch. Ablenkungen im Raum sind minimiert, ohne Spielzeug, Bücher oder Bilder. Der Experimentator kehrt nach 15 min zurück, oder nachdem das Kind die Glocke geläutet, die Belohnungen gegessen oder irgendwelche Anzeichen von Stress gezeigt hat. Mischel zeigte, dass sich Kinder typischerweise auf zwei Arten verhalten: (1) sie klingeln fast sofort, um den Keks zu bekommen, was bedeutet, dass sie nur einen bekommen; oder (2) warten sie und optimieren ihre Gewinne und erhalten beide Cookies. Diese Beobachtung deutet darauf hin, dass einige Individuen besser als andere in der Lage sind, Impulse angesichts stark ausgeprägter Anreize zu kontrollieren, und diese Verzerrung kann in der frühen Kindheit entdeckt werden (Mischel et al., 1989) und sie scheinen in der Pubertät und im jungen Erwachsenenalter zu bleiben (Eigsti et al., 2006).
Was könnte individuelle Unterschiede in der optimalen Entscheidungsfindung und im Verhalten erklären? Einige Theoretiker haben postuliert, dass dopaminerge mesolimbische Schaltkreise, die an der Belohnungsverarbeitung beteiligt sind, einem riskanten Verhalten unterliegen. Individuelle Unterschiede in dieser Schaltung, wie allelische Varianten in Dopamin-verwandten Genen, die in subkortikalen Regionen zu wenig oder zu viel Dopamin ergeben, könnten mit der Neigung zu risikoreichem Verhalten in Zusammenhang stehen (O'Doherty, 2004). Es wurde gezeigt, dass der Nucleus Accumbens seine Aktivität unmittelbar vor einer riskanten Auswahl von monetären Risikoparadigmen erhöht (Kuhnen & Knutson, 2005; Matthews et al., 2004; Montague & Berns, 2002) und wie zuvor beschrieben, zeigen Jugendliche übertriebene accumbens Aktivität, um Ergebnisse im Vergleich zu Kindern oder Erwachsenen zu belohnen (Ernst et al., 2005; Galvan et al., 2006). Zusammenfassend legen diese Daten nahe, dass Jugendliche als Gruppe anfälliger für riskante Entscheidungen sind (Gärtner & Steinberg, 2005), aber einige Jugendliche sind anfälliger als andere, riskante Verhaltensweisen einzugehen, wodurch sie potenziell ein größeres Risiko für negative Ergebnisse eingehen. Daher ist es wichtig, die individuelle Variabilität bei der Untersuchung komplexer Beziehungen zwischen Gehirn und Verhalten im Zusammenhang mit der Risikoaufnahme und der Belohnungsverarbeitung in Entwicklungspopulationen zu berücksichtigen.
Um individuelle Unterschiede im Risikoverhalten zu untersuchen, Galvanet al. (2007) untersuchten kürzlich den Zusammenhang zwischen Aktivität in Belohnungs-bezogenen neuronalen Schaltkreisen in Erwartung einer großen monetären Belohnung mit Persönlichkeitsmerkmals-Maßen von Risikobereitschaft und Impulsivität in der Adoleszenz. Funktionelle Magnetresonanztomographie und anonyme Selbsteinschätzungsskalen von Risikoverhalten, Risikowahrnehmung und Impulsivität wurden bei Personen im Alter zwischen 7 und 29 Jahren erworben. Es gab einen positiven Zusammenhang zwischen Accumbens-Aktivität und der Wahrscheinlichkeit, in allen Bereichen riskantes Verhalten einzugehen. Diese Aktivität variierte als eine Funktion der Einschätzungen der Individuen von erwarteten positiven oder negativen Konsequenzen eines solchen Verhaltens. Diejenigen Personen, die riskante Verhaltensweisen als zu schlimmen Folgen führend empfanden, aktivierten die Accumbens weniger zur Belohnung. Dieser Verein wurde größtenteils von den Kindern betrieben, wobei die Erwachsenen die Folgen eines solchen Verhaltens als möglich einschätzen. Impulsivitätsbewertungen waren nicht mit Accumbens-Aktivität assoziiert, sondern eher mit dem Alter. Diese Ergebnisse deuten darauf hin, dass einige Individuen in der Adoleszenz aufgrund von Entwicklungsänderungen eher in Risikoverhalten verwickelt sind, wobei die Variabilität in der Veranlagung eines bestimmten Individuums zu risikoreichem Verhalten und nicht zu einfachen Veränderungen der Impulsivität variiert (vgl Abb.. 5).

Jugendliches Verhalten wurde wiederholt als impulsiv und riskant charakterisiert (Steinberg, 2004, 2007), aber diese Übersicht der bildgebenden Literatur schlägt verschiedene neurobiologische Substrate und unterschiedliche Entwicklungsverläufe für diese Verhaltensweisen vor. Insbesondere ist Impulsivität mit einer unreifen ventralen präfrontalen Entwicklung assoziiert und nimmt allmählich von der Kindheit bis zum Erwachsenenalter ab (Casey, Galvan und andere, 2005). Die negative Korrelation zwischen Impulsivität und Alter in der Studie von Galvanet al. (2007) unterstützt diese Vorstellung. Im Gegensatz dazu ist die Risikobereitschaft mit einem Anstieg der Accum-Kuhnen & Knutson, 2005; Matthews et al., 2004; Montague & Berns, 2002), das ist bei Jugendlichen im Vergleich zu Kindern und Erwachsenen übertrieben (Ernst et al., 2005; Galvan et al., 2006). Daher können Entscheidungen und Verhaltensweisen bei Jugendlichen nicht durch Impulsivität oder langwierige Entwicklung des präfrontalen Kortex allein erklärt werden, da Kinder dann als risikofreudiger eingestuft werden. Die Ergebnisse liefern eine neuronale Grundlage dafür, warum manche Jugendliche einem höheren Risiko ausgesetzt sind als andere, aber sie liefern auch eine Grundlage dafür, wie jugendliches Verhalten sich von Risikogruppen für Kinder und Erwachsene unterscheidet.
Zusammenfassend legen diese Daten nahe, dass zwar Jugendliche als Gruppe als risikofreudig gelten (Gärtner & Steinberg, 2005), einige Jugendliche werden anfälliger als andere zu riskanten Verhaltensweisen neigen, wodurch sie potenziell ein größeres Risiko für negative Ergebnisse. Diese Ergebnisse unterstreichen, wie wichtig es ist, die individuelle Variabilität bei der Untersuchung komplexer Beziehungen zwischen Gehirn und Verhalten im Zusammenhang mit der Risikoaufnahme und der Belohnungsverarbeitung in Entwicklungsgruppen zu berücksichtigen. Darüber hinaus können diese individuellen und entwicklungsbedingten Unterschiede dazu beitragen, die Vulnerabilität bei einigen Personen für Risiken im Zusammenhang mit Substanzkonsum und letztlich Abhängigkeit zu erklären.
Schlussfolgerungen
Human-Imaging-Studien zeigen strukturelle und funktionelle Veränderungen in frontostriatalen Regionen (Giedd et al., 1996, 1999; Jernigan et al., 1991; Sowell et al., 1999; zur Durchsicht, Casey, Galvan und andere, 2005), die parallel zu einer Zunahme kognitiver Kontrolle und Selbstregulation scheinen (Casey, Trainor ua, 1997; Luna & Sweeney, 2004; Luna et al., 2001; Rubia et al., 2000; Steinberg, 2004; Siehe auch Steinberg, 2008, dieses Problem). Diese Veränderungen scheinen eine Verschiebung der Aktivierung präfrontaler Regionen von einer diffusen zu einer stärker fokalen Rekrutierung im Zeitverlauf zu zeigen (Brown et al., 2005; Bunge et al., 2002; Casey, Trainor ua, 1997; Durston et al., 2006; Moses et al., 2002) und erhöhte Rekrutierung von subkortikalen Regionen während der Adoleszenz (Casey et al., 2002a; Durston et al., 2006; Luna et al., 2001). Obwohl bildgebende Verfahren den Mechanismus solcher Entwicklungsveränderungen nicht definitiv charakterisieren können, können diese Veränderungen in Volumen und Struktur die Entwicklung und Verfeinerung von Projektionen zu und von diesen Hirnregionen während der Reifung reflektieren, was auf eine Feinabstimmung des Systems mit der Entwicklung hindeutet.
Zusammenfassend zeigen die hier gewonnenen Ergebnisse, dass ein erhöhtes Risikoverhalten im Jugendalter mit unterschiedlichen Entwicklungsverläufen subkortikaler Lust- und kortikaler Kontrollregionen einhergeht. Diese Entwicklungsveränderungen können durch individuelle Unterschiede in der Aktivität von Belohnungssystemen noch verstärkt werden. Obwohl die Pubertät als eine Zeit charakterisiert wurde, die durch Belohnungssucht und risikofreudiges Verhalten gekennzeichnet war (Gärtner & Steinberg, 2005; Speer, 2000) individuelle Unterschiede in der neuronalen Antworten auf Belohnung, prädisponieren einige Jugendliche zu mehr Risiken als andere, wodurch sie ein höheres Risiko für negative Ergebnisse. Diese Ergebnisse liefern entscheidende Grundlagen, indem sie die verschiedenen Befunde im Zusammenhang mit Risikoverhaltensverhalten im Jugendalter und das Verständnis individueller Unterschiede und Entwicklungsmarker für Neigungen zu negativem Verhalten synthetisieren.
Anerkennungen
Diese Arbeit wurde teilweise durch Zuschüsse des Nationalen Instituts für Drogenmissbrauch R01 DA18879 und des National Institute of Mental Health 1P50 MH62196 unterstützt.
Bibliographie
- Benthin A, Slovic P, Severson H. Eine psychometrische Studie über jugendliche Risikowahrnehmung. Tagebuch der Jugend. 1993;16: 153-168. [PubMed]
- Björk JM, B Knutson, GW Fong, DM Caggiano, Bennett SM, Hommer DW. Incentive-ausgelöste Gehirnaktivierung bei Jugendlichen: Ähnlichkeiten und Unterschiede zu jungen Erwachsenen. Journal of Neuroscience. 2004;24: 1793-1802. [PubMed]
- Björkland DF. Die Rolle des konzeptuellen Wissens bei der Organisationsentwicklung im Kindergedächtnis. In: Brainerd CJ, Pressley M, Herausgeber. Grundlegende Prozesse in der Gedächtnisentwicklung: Fortschritte in der kognitiven Entwicklungsforschung. New York: Springer-Verlag; 1985. pp. 103-142.
- Björkland DF. Wie Alter Änderungen in der Wissensbasis zur Entwicklung von Kindergedächtnis beitragen: Eine interpretative Überprüfung. Entwicklungsüberprüfung. 1987;7: 93-130.
- Bourgeois JP, Goldman-Rakic PS, Rakic P. Synaptogenese im präfrontalen Kortex von Rhesusaffen. Zerebraler Kortex. 1994;4: 78-96. [PubMed]
- Brainerd CJ, Reyna VF. Gedächtnisunabhängigkeit und Gedächtnisinterferenz in der kognitiven Entwicklung. Psychologische Überprüfung. 1993;100: 42-67. [PubMed]
- Brown TT, Lugar HM, Coalson RS, Miezin FM, Petersen SE, Schlaggar BL. Entwicklungsveränderungen in der menschlichen zerebralen Funktionsorganisation für die Wortgenerierung. Zerebraler Kortex. 2005;15: 275-290. [PubMed]
- Bunge SA, Dudukovic NM, Thomason ME, Vaidya CJ, Gabrieli JD. Unreifer Frontallappen Beiträge zur kognitiven Kontrolle bei Kindern: Beweise von fMRI. Neuron. 2002;33: 301-311. [PubMed]
- Fall R. Validierung eines neo-piagetischen Kapazitätskonstrukts. Journal of Experimental Child Psychology. 1972;14: 287-302.
- Fall R. Intellektuelle Entwicklung: Geburt bis zum Erwachsenenalter. New York: Akademische Presse; 1985.
- Casey BJ, Castellanos FX, Giedd JN, Marsh WL, Hamburger SD, Schubert AB. et al. Implikation der rechten frontostriatalen Schaltung in der Response-Inhibition und Aufmerksamkeits-Defizit- / Hyperaktivitätsstörung. Zeitschrift der Amerikanischen Akademie für Kinder- und Jugendpsychiatrie. 1997;36: 374-383. [PubMed]
- Casey BJ, Galvan A, Hase TA. Veränderungen der zerebralen Funktionsorganisation während der kognitiven Entwicklung. Aktuelle Meinung in Neurobiologie. 2005;15: 239-244. [PubMed]
- Casey BJ, Giedd JN, Thomas KM. Strukturelle und funktionelle Gehirnentwicklung und ihre Beziehung zur kognitiven Entwicklung. Biologische Psychologie. 2000a;54: 241-257. [PubMed]
- Casey BJ, Thomas KM, MC Davidson, Kunz K, Franzen PL. Striatale und Hippocampus-Funktion wird mit einer Stimulus-Response-Kompatibilitätsaufgabe entkoppelt. Journal of Neuroscience. 2002a;22: 8647-8652. [PubMed]
- Casey BJ, Thomas KM, walisische TF, Badgaiyan RD, Eccard CH, Jennings JR, et al. Dissoziation von Response-Konflikt, Aufmerksamkeitsauswahl und Erwartung mit funktioneller Magnetresonanztomographie. Proceedings der Nationalen Akademie der Wissenschaften. 2000b;97: 8728-8733.
- Casey BJ, Tottenham N, Fossela J. Klinische, Bildgebung, Läsion und genetische Ansätze zu einem Modell der kognitiven Kontrolle. Entwicklungs-Psychobiologie. 2002b;40: 237-254. [PubMed]
- Casey BJ, Tottenham N., Liston C., Durston S. Imaging des sich entwickelnden Gehirns: Was haben wir über die kognitive Entwicklung gelernt? Trends in der Kognitionswissenschaft. 2005;9: 104-110.
- Casey BJ, Trainor RJ, Orendi JL, Schubert AB, Nyström LE, Giedd JN, et al. Eine funktionelle MRT-Studie der präfrontalen Aktivierung während der Durchführung einer Go-No-Go-Aufgabe. Zeitschrift für Kognitive Neurowissenschaften. 1997;9: 835-847.
- Crone E, Donohue S, Honomichl R, Wendelken C, Bunge S. Hirnregionen, die eine flexible Regelverwendung während der Entwicklung vermitteln. Journal of Neuroscience. 2006;26: 11239-11247. [PubMed]
- Dempster FN. Resistenz gegen Störungen: Entwicklungsveränderungen in einem grundlegenden Verarbeitungsmechanismus. In: Howe ML, Pasnak R, Redakteure. Neue Themen in der kognitiven Entwicklung Band 1: Grundlagen. New York: Springer; 1993. pp. 3-27.
- Diamant A. Entwicklung der Fähigkeit, den Rückruf zu verwenden, um die Handlung zu leiten, wie durch die Leistung von Kindern auf AB angezeigt wird. Entwicklung des Kindes. 1985;56: 868-883. [PubMed]
- Durston S, Davidson MC, Thomas KM, Worden MS, Totten- ham N, Martinez A, et al. Parametrische Manipulation von Konflikten und Response-Wettbewerben mittels schneller ereignisbezogener fMRT. Neuroimage. 2003;20: 2135-2141. [PubMed]
- Durston S, Davidson MC, Totten- ham N, Galvan A, Spicer J, Fos- sella J, et al. Eine Verschiebung von diffuser zu fokaler kortikaler Aktivität mit Entwicklung. Entwicklungswissenschaft. 2006;1: 18-20. [PubMed]
- Durston S, Hülshoff Pol HE, Casey BJ, Giedd JN, Buitelaar JK, van Engeland H. Anatomische MRT des sich entwickelnden menschlichen Gehirns: Was haben wir gelernt? Journal der American Academy of Kinderpsychiatrie. 2001;40: 1012-1020.
- Eaton LK, Kinchen S, Ross J, Hawkins J, Harris WA, Lowry R, et al. Überwachung des Risikoverhaltens von Jugendlichen - USA, 2005, Überwachungszusammenfassungen. Morbiditäts- und Mortalitätswochenbericht. 2006;55: 1-108. [PubMed]
- Eigsti IM, Zayas V., Mischel W., Shoda Y, Ayduk O, Dadlani MB, et al. Vorhersage der kognitiven Kontrolle von der Vorschule bis zur späten Adoleszenz und im jungen Erwachsenenalter. Psychologische Wissenschaft. 2006;17: 478-484. [PubMed]
- Ernst M., Nelson EE, Jazbec S, Mc Clure EB, Monk CS, Leibenluft E, et al. Amygdala und Nucleus accumbens als Reaktion auf Erhalt und Unterlassung von Gewinnen bei Erwachsenen und Jugendlichen. Neuroimage. 2005;25: 1279-1291. [PubMed]
- Eshel N, Nelson EE, Blair RJ, Kiefer DS, Ernst M. Neurale Auswahlsubstrate bei Erwachsenen und Jugendlichen: Entwicklung der ventrolateralen präfrontalen und anterioren cingulären Kortizes. Neuropsychologia. 2007;45: 1270-1279. [PMC freier Artikel] [PubMed]
- Flavell JH, Feach DR, Chinsky JM. Spontane verbale Wiederholung in einer Gedächtnisaufgabe als Funktion des Alters. Entwicklung des Kindes. 1966;37: 283-299. [PubMed]
- Galvan A, Hare TA, CE Parra, Penn J, Voss H, Handschuh G, et al. Eine frühere Entwicklung des Accumbens relativ zum orbitofrontalen Kortex könnte Risikoverhalten bei Jugendlichen zugrunde liegen. Journal of Neuroscience. 2006;26: 6885-6892. [PubMed]
- Galvan A, Hase T, Voss H, Handschuh G, Casey BJ. Risikobereitschaft und Gehirn des Jugendlichen: Wer ist gefährdet? Entwicklungswissenschaft. 2007;10: F8-F14. [PubMed]
- Gärtner M, Steinberg L. Peer Einfluss auf Risikobereitschaft, Risikopräferenz und riskante Entscheidungsfindung in der Adoleszenz und im Erwachsenenalter: Eine experimentelle Studie. Entwicklungspsychologie. 2005;41: 625-635. [PubMed]
- Giedd JN. Strukturelle Magnetresonanztomographie des jugendlichen Gehirns. Annalen der New York Academy of Sciences. 2004;1021: 77-85. [PubMed]
- Giedd JN, Blumenthal J., Jeffries NO, Castellanos FX, Liu H., Zijdenbos A, et al. Hirnentwicklung im Kindes- und Jugendalter: Eine longitudinale MRT-Studie. Nature Neurologie. 1999;2: 861-863.
- Giedd JN, Snell JW, Lange N., Rajapakse JC, Casey BJ, Kozuch PL, et al. Quantitative Magnetresonanztomographie der menschlichen Gehirnentwicklung: Ages 4-18. Zerebraler Kortex. 1996;6: 551-560. [PubMed]
- Gogtay N, Giedd JN, Lusk L, Hayashi KM, Greenstein D, Vaituzis AC, et al. Dynamische Kartierung der menschlichen kortikalen Entwicklung während der Kindheit bis zum frühen Erwachsenenalter. Proceedings der Nationalen Akademie der Wissenschaften der Vereinigten Staaten von Amerika. 2004;101: 8174-8179. [PMC freier Artikel] [PubMed]
- Graber JA, Brooks-Gunn J. Pubertät. In: Blechman EA, Brownell KD, Herausgeber. Verhaltensmedizin und Frauen ein umfassendes Handbuch. New York, NY: Guilford Presse; 1998. pp. 51-58.
- Hase TA, Voss HU, Handschuhmacher GH, Casey BJ. Das jugendliche Gehirn und potentielles Risiko für Angst und Depression. 2007a Zur Veröffentlichung eingereicht.
- Hase TA, Voss HU, Handschuhmacher GH, Casey BJ. Die Konkurrenz zwischen präfrontalen und subkortikalen limbischen Systemen unterliegt der emotionalen Reaktivität während der Adoleszenz. 2007b Zur Veröffentlichung eingereicht.
- Harnisfeger KK, Björkland F. Die Ontogenese der Hemmungsmechanismen: Ein neuer Ansatz zur kognitiven Entwicklung. In: Howe ML, Pasnek R, Herausgeber. Neue Themen in der kognitiven Entwicklung. Vol. 1. New York: Springer-Verlag; 1993. pp. 28-49.
- Hikosaka K, Watanabe M. Verzögerungsaktivität von Orbital- und lateralen präfrontalen Neuronen des Affen, die mit verschiedenen Belohnungen variieren. Zerebraler Kortex. 2000;10: 263-271. [PubMed]
- Huttenlöcher PR. Synaptische Dichte im frontalen Cortex des Menschen - Entwicklungsveränderungen und Alterungseffekte. Hirnforschung. 1979;163: 195-205. [PubMed]
- Hyman SE, Malenka RC. Sucht und das Gehirn: Die Neurobiologie des Zwanges und seine Persistenz. Nature Reviews Neurologie. 2001;2: 695-703.
- Jernigan TL, Zisook S, Heaton RK, Moranville JT, Hesselink JR, Braff DL. Magnetresonanztomographie Abnormitäten in Lentikularkernen und Hirnrinde bei Schizophrenie. Archive der Allgemeinen Psychiatrie. 1991;48: 811-823.
- Keating DP, Bobbitt BL. Individuelle und Entwicklungsunterschiede in den kognitiven Verarbeitungskomponenten der geistigen Fähigkeit. Entwicklung des Kindes. 1978;49: 155-167.
- Kelley AE, Schochet T, Landry C. Annalen der New York Academy of Sciences. 2004;1021: 27-32. [PubMed]
- Knutson B, Adams CM, Fong GW, Hommer D. Die Erwartung einer zunehmenden monetären Belohnung rekrutiert selektiv Nucleus accumbens. Journal of Neuroscience. 2001;21: RC159. [PubMed]
- Kuhnen CM, Knutson B. Die neurale Basis der finanziellen Risikobereitschaft. Neuron. 2005;47: 763-770. [PubMed]
- Laviola G, Adriani W., Terranova ML, Gerra G. Psychobiologische Risikofaktoren für die Anfälligkeit für Psychostimulanzien bei Jugendlichen und Tiermodellen. Neurowissenschaften und Biohavioral Reviews. 1999;23: 993-1010. [PubMed]
- Laviola G, Macri S., Morley-Fletcher S, Adriani W. Zusammenfassung Risikoverhalten bei jugendlichen Mäusen: Psychobiologische Determinanten und frühen epigenetischen Einfluss. Neurowissenschaften und Biohavioral Reviews. 2003;27: 19-31. [PubMed]
- Liston C, Watt R, Tottenham N, Davidson MC, Niogi S, Ulug AM, et al. Die frontostriatale Mikrostruktur moduliert die effiziente Rekrutierung der kognitiven Kontrolle. Zerebraler Kortex. 2005;16: 553-560. [PubMed]
- Luna B, Sweeney JA. Die Entstehung kollaborativer Hirnfunktion: FMRI-Studien zur Entwicklung von Response-Inhibition. Annalen der New York Academy of Sciences. 2004;1021: 296-309. [PubMed]
- Luna B, Thulborn KR, Munoz DP, Merriam EP, Garver KE, Minshw NJ, et al. Die Reifung weit verbreiteter Gehirnfunktionen unterstützt die kognitive Entwicklung. Neuroimage. 2001;13: 786-793. [PubMed]
- Matthews SC, et al. Selektive Aktivierung des Nucleus accumbens während der Risikobereitschaft. Neuroreport. 2004;15: 2123-2127. [PubMed]
- Mai JC, Delgado MR, Dahl RE, Stenger VA, Ryan ND, Fiez JA, et al. Ereignisbezogene funktionelle Magnetresonanztomographie von Belohnungs-bezogenen Schaltkreisen bei Kindern und Jugendlichen. Biologische Psychiatrie. 2004;55: 359-366. [PubMed]
- McClure SM, Laibson DI, Loewenstein G, Cohen JD. Getrennte neurale Systeme schätzen unmittelbare monetäre Belohnungen. Science. 2004;306: 503-507. [PubMed]
- Miller EK, Cohen JD. Eine integrative Theorie der präfrontalen Kortexfunktion. Jahresrückblick der Neurowissenschaften. 2001;24: 167-202.
- Mischel W, Shoda Y, Rodriguez MI. Delay of Befriedigung bei Kindern. Science. 1989;244: 933-938. [PubMed]
- Monk CS, Mc Clure EB, Nelson EE, Zarahn E, Bilder RM, Leibenluft E, et al. Jugendliche Unreife in Aufmerksamkeits-bezogenem Gehirn-Engagement für emotionale Gesichtsausdrücke. Neuroimage. 2003;20: 420-428. [PubMed]
- Montague PR, Berns GS. Neuronale Ökonomie und die biologischen Bewertungssubstrate. Neuron. 2002;36: 265-284. [PubMed]
- Moses P, Roe K, Buxton RB, Wong EC, Frank LR, Stiles J. Funktionelle MRT der globalen und lokalen Verarbeitung bei Kindern. Neuroimage. 2002;16: 415-424. [PubMed]
- Munakata Y, Yerys BE. Alles zusammen jetzt: Wenn Dissoziationen zwischen Wissen und Handeln verschwinden. Pscychologische Wissenschaft. 2001;12: 335-337.
- Nagy Z, Westerberg H, Klingberg T. Die Reifung der weißen Substanz ist mit der Entwicklung kognitiver Funktionen in der Kindheit verbunden. Zeitschrift für Kognitive Neurowissenschaften. 2004;16: 1227-1233. [PubMed]
- O'Doherty J, Kringelbach ML, Rolls ET, Hornak J, Andrews C. Zusammenfassung Belohnung und Bestrafung Darstellungen im menschlichen orbitofrontalen Kortex. Nature Neurosci. 2001;4: 95-102. [PubMed]
- O'Doherty JP. Belohnungsdarstellungen und belohnungsbezogenes Lernen im menschlichen Gehirn: Einblicke aus der Neurobildgebung. Aktuelle Meinungen in der Neurobiologie. 2004;14: 769-776.
- Pascual-Leone JA. Ein mathematisches Modell für den Übergang in Piagets Entwicklungsstadien. Acta Psychologica. 1970;32: 301-345.
- Pecina S, Cagniard B, Berridge KC, Aldridge JW, Zhuang X. Hyperdopaminerge mutierte Mäuse haben ein höheres "Wollen", aber kein "Vorlieben" für süße Belohnungen. Journal of Neuroscience. 2003;23: 9395-9402. [PubMed]
- Reyna VF, Farley F. Risiko und Rationalität in der Entscheidungsfindung von Jugendlichen: Implikationen für Theorie, Praxis und öffentliche Politik. Psychologische Wissenschaft im öffentlichen Interesse. 2006;7: 1-44.
- Rosenberg DR, Lewis DA. Postnatale Reifung der dopaminergen Innervation affiner präfrontaler und motorischer Kortizes: Eine immunhistochemische Tyrosinhydroxylase-Analyse. Das Journal der vergleichenden Neurologie. 1995;358: 383-400. [PubMed]
- Rubia K, Overmeyer S, Taylor E, Brammer M, Williams SC, Simmons A, et al. Funktionelle Frontalisierung mit dem Alter: Kartierung von neuronalen Entwicklungsbahnen mit fMRT. Neurowissenschaften und Biohavioral Reviews. 2000;24: 13-19. [PubMed]
- Schlaggar BL, Braun TT, Lugar HM, Visscher KM, Miezin FM, Petersen SE. Funktionelle neuroanatomische Unterschiede zwischen Erwachsenen und schulpflichtigen Kindern bei der Verarbeitung einzelner Wörter. Science. 2002;296: 1476-1479. [PubMed]
- Schultz W. Verhaltenstheorien und die Neurophysiologie der Belohnung. Jährliche Bewertungen der Psychologie. 2006;57: 87-115.
- Sowell ER, Peterson BS, Thompson PM, Willkommen SE, Henkenius AL, Toga AW. Mapping cortical Veränderung über die menschliche Lebensdauer. Nature Neurologie. 2003;6: 309-315.
- Sowell ER, Thompson PM, Holmes CJ, Jernigan TL, Toga AW. In-vivo-Evidenz für die post-adoleszente Hirnreifung in frontalen und striatalen Regionen. Nature Neurologie. 1999;2: 859-861.
- Sowell ER, Thompson PM, Toga AW. Mapping Veränderungen im menschlichen Kortex über die gesamte Lebensspanne. Neurowissenschaftler. 2004;10: 372-392. [PubMed]
- Speer LP. Das jugendliche Gehirn und altersbedingte Verhaltensauffälligkeiten. Neurowissenschaften und Biohavioral Reviews. 2000;24: 417-463. [PubMed]
- Steinberg L. Risikobereitschaft im Jugendalter: Was ändert sich und warum? Annalen der New York Academy of Sciences. 2004;1021: 51-58. [PubMed]
- Steinberg L. Risikobereitschaft im Jugendalter: Neue Perspektiven aus der Hirn- und Verhaltenswissenschaft. Aktuelle Richtungen in der Psychologischen Wissenschaft. 2007;16: 55-59.
- Steinberg L. Eine sozial-neurowissenschaftliche Perspektive zur Risikobereitschaft von Jugendlichen. Entwicklungsüberprüfung. 2008;28: 78-106. [PMC freier Artikel] [PubMed]
- Tamm L, Menon V, Reiss AL. Reifung der Gehirnfunktion in Verbindung mit Response-Inhibition. Zeitschrift der Amerikanischen Akademie für Kinder- und Jugendpsychiatrie. 2002;41: 1231-1238. [PubMed]
- Thomas KM, RH Hunt, Wiueta N, Sommer T, Durston S, Yang Y, et al. Nachweis von Entwicklungsunterschieden im impliziten Sequenzlernen: Eine FMRI-Studie an Kindern und Erwachsenen. Zeitschrift für Kognitive Neurowissenschaften. 2004;16: 1339-1351. [PubMed]
- Turkeltaub PE, Gareau L, Blumen DL, Zeffiro TA, Eden GF. Entwicklung von neuronalen Mechanismen zum Lesen. Nature Neurologie. 2003;6: 767-773.
- Volkow ND, Li TK. Drogenabhängigkeit: Die Neurobiologie des Verhaltens schief gegangen. Nature Reviews Neurologie. 2004;5: 963-970.
- Yurgelun-Todd D. Emotionale und kognitive Veränderungen während der Pubertät. Aktuelle Meinung in Neurobiologie. 2007;17: 251-257. [PubMed]
- Zald DH, Boileau I, El-Dearedy W, Gunn R, McGlone F, Dichter GS, et al. Dopamin-Übertragung im menschlichen Striatum während monetärer Belohnungsaufgaben. Journal of Neuroscience. 2004;24: 4105-4112. [PubMed]