- 1Abteilung für Biomedizinische Wissenschaften, Sektion für Neurowissenschaften und klinische Pharmakologie, und Kompetenzzentrum für Neurobiologie der Abhängigkeiten, Universität Cagliari, Cagliari, Italien
- 2Abteilung für Lebens- und Umweltwissenschaften, Abteilung für Pharmazeutische, Pharmakologische und Nutrazeutische Wissenschaften, Universität Cagliari, Cagliari, Italien
- 3Institut für Neurowissenschaften, Nationaler Forschungsrat, Sektion Cagliari, Cittadella Universitaria, Cagliari, Italien
Ratten, die Ratten mit hoher (RHA) und niedrig-vermeidender (RLA) Rasse hervorbrachten, die sich für eine schnelle bzw. schnelle Erfassung der aktiven Vermeidungsreaktion in der Shuttle-Box unterscheiden, zeigen Unterschiede in der sexuellen Aktivität, wenn sie in Gegenwart eines Sexualpersonals gebracht werden empfängliche weibliche Ratte. Tatsächlich zeigen RHA-Ratten eine höhere sexuelle Motivation und Kopulationsleistung als RLA-Ratten, die auch nach wiederholter sexueller Aktivität bestehen bleiben. Diese Unterschiede wurden mit einem höheren Tonus des mesolimbischen dopaminergen Systems von RHA-Ratten im Vergleich zu RLA-Ratten korreliert, was durch den höheren Anstieg von Dopamin im Dialysat, der aus dem Nucleus accumbens von RHA erhalten wird, als durch RLA-Ratten während der sexuellen Aktivität nachgewiesen wurde. Diese Arbeit zeigt, dass auch extrazelluläres Dopamin und Noradrenalin (NA) im Dialysat aus dem medialen präfrontalen Kortex (mPFC) männlicher RHA- und RLA-Ratten in Anwesenheit einer unzugänglichen weiblichen Ratte und stärker während der direkten sexuellen Interaktion steigen. Ein solcher Anstieg von Dopamin (und dessen Hauptmetabolit 3,4-Dihydroxyphenylessigsäure (DOPAC)) und NA wurde sowohl bei sexuell naiven als auch bei erfahrenen Tieren gefunden, sie waren jedoch höher: (i) bei RHA als bei RLA-Ratten; und (ii) bei sexuell erfahrenen RHA- und RLA-Ratten als bei ihren naiven Gegenstücken. Schließlich traten die Unterschiede zwischen Dopamin und NA bei der mPFC gleichzeitig mit denen bei sexueller Aktivität auf, da RHA-Ratten sowohl unter sexuell naiven als auch unter erkrankten Bedingungen eine höhere sexuelle Motivation und Kopulationsleistung aufwiesen als RLA-Ratten. Diese Ergebnisse legen nahe, dass auch im mPFC ein höherer dopaminerger Tonus auftritt, zusammen mit einem erhöhten noradrenergen Tonus, der an den verschiedenen Kopulationsmustern beteiligt sein kann, die bei RHA- und RLA-Ratten gefunden werden, wie dies für das mesolimbische dopaminerge System vorgeschlagen wird.
Einleitung
Die Linien der römischen Rasse mit hoher (RHA) und niedriger Vermeidung (RLA) -Zucht, die ursprünglich für die schnelle bzw. schlechte Erfassung der aktiven Vermeidungsreaktion in der Shuttle-Box ausgewählt wurde (Bignami, 1965; Broadhurst und Bignami, 1965; Driscoll und Bättig, 1982; Fernandez-Teruel et al., 2002; Giorgi et al., 2007) zeigen signifikante Unterschiede in der sexuellen Aktivität, wenn sie einer sexuell aufnahmefähigen weiblichen Ratte ausgesetzt werden. Tatsächlich zeigen RHA-Ratten ein höheres Maß an sexueller Motivation als RLA-Ratten, was sich aus der höheren Anzahl von kontaktlosen Erektionen des Penis ergibt, die diese Ratten in Gegenwart einer unzugänglichen rezeptiven Frau zeigten, und bessere Kopulationsleistungen als bei RLA-Ratten durch die signifikanten Unterschiede in zahlreichen Kopulationsparametern, die hauptsächlich im ersten Kopulationsversuch zwischen den beiden Rattenlinien gefunden wurden, aber auch nach fünf Kopulationsversuchen, wenn auch abgeschwächt (Sanna et al., 2014a). Zu den am stärksten gefundenen Unterschieden zwischen RHA- und RLA-Ratten gehört der Prozentsatz der Ratten, die das Anheften und das Intromittieren initiieren, und der im ersten Kopulationstest Ejakulat, 80% der RHA-Ratten gegen 40% der RLA-Ratten (Sanna et al., 2014a). Zahlreiche experimentelle Nachweise deuten darauf hin, dass ein funktionell anderer dopaminerger Tonus an den Kopulationsunterschieden zwischen RHA- und RLA-Ratten beteiligt ist. Tatsächlich wurde festgestellt, dass die verschiedenen Kopulationsmuster von RHA- und RLA-Ratten durch Apomorphin, einen gemischten D1 / D2-Dopamin-Rezeptor-Agonisten, der in Dosen, die das sexuelle Verhalten erleichtern, verabreicht wird, und durch Haloperidol, einen D2-Dopamin-Rezeptor-Antagonisten, unterschiedlich modifiziert werden niedrige Dosen, die das sexuelle Verhalten hemmen (Sanna et al., 2014b). Dementsprechend hat sich gezeigt, dass RLA-Ratten empfindlicher auf die Erleichterung und Hemmung des durch Apomorphin bzw. Haloperidol induzierten Sexualverhaltens reagieren, wie durch die größeren Modifikationen gezeigt wird, die durch die beiden Wirkstoffe induziert werden, vor allem, wenn sie in niedrigeren Dosen in verschiedenen Kopulationsparametern verabreicht werden RLA-Ratten in Bezug auf RHA-Ratten (Sanna et al., 2014b). Wichtiger für diese Studie ist vielleicht, dass die unterschiedlichen Kopulationsmuster von RHA- und RLA-Ratten auch mit Unterschieden in der Aktivität der mesolimbischen dopaminergen Neuronen zusammenhängen, deren Aktivität bekanntermaßen während des Sexualverhaltens ansteigt (Pfaus et al., 1990; Pleim et al., 1990; Pfaus und Phillips, 1991; Damma et al., 1992; Wenkstern et al., 1993; Balfour et al., 2004; Pitcher et al., 2010, 2013; Beloate et al., 2016). Trotz der Tatsache, dass sexuell naive und sexuell erfahrene RHA- und RLA-Ratten im Dialysat aus dem Nucleus Accumbens ähnliche Grundwerte für extrazelluläres Dopamin aufweisen, sind die Konzentrationen an extrazellulärem Dopamin und 3,4-Dihydroxyphenylessigsäure (DOPAC, einer ihrer Hauptmetaboliten) ) wurde festgestellt, dass sie in den Dialysaten, die aus der Schale des Nucleus accumbens von naiven und sexuell erfahrenen RHA- und RLA-Ratten gewonnen werden, sowohl in der antizipatorischen als auch in der konsumatorischen Phase des Sexualverhaltens differentiell zunehmen. Die oben genannten Unterschiede waren stärker ausgeprägt zwischen sexuell naiven RHA- und RLA-Ratten, bestanden jedoch zwischen sexuell erfahrenen RHA- und RLA-Ratten, obwohl sie bei diesen Ratten tendenziell abnahmen, wie bei den Unterschieden im sexuellen Verhalten festgestellt wurde (Sanna et al., 2015).
Die funktionelle Rolle der Zunahme der dopaminergen Aktivität im Nucleus accumbens während der sexuellen Aktivität (entweder in den appetitlichen und konsumatorischen Phasen des Sexualverhaltens) ist nach wie vor Gegenstand der Debatte sowie der Fütterung, die ebenso wie die sexuelle Aktivität eine starke Rolle spielt motivierende Valenz. Obwohl Dopamin im Nukleus accumbens an der Motivation beteiligt ist und mesolimbische dopaminerge Neuronen normalerweise als lohnende Neuronen bezeichnet werden, stützen jüngste Studien in den letzten 15-Jahren die Hypothese, dass mesolimbisches Dopamin nicht an der primären Expression motivierter oder belohnender Verhaltensweisen beteiligt ist. sondern mit Lernen und Gedächtnis von Stimulus-Belohnung-Assoziationen (Agmo et al., 1995; Berridge und Robinson, 1998; Ikemoto und Panksepp, 1999; Pitcher et al., 2013, 2014; Beloate et al., 2016; Salamone et al., 2016). In Übereinstimmung mit dieser Hypothese wurde kürzlich festgestellt, dass die Blockade von Dopaminrezeptoren im Nucleus Accumbens oder die Inaktivierung von dopaminergen Neuronen im ventralen Tegmentbereich die Expression appetitanregender und konsumatorischer Aspekte des Kopulationsverhaltens bei männlichen Ratten nicht verändern kann (Pitcher et al., 2013, 2014; Beloate et al., 2016).
Es kann jedoch nicht ausgeschlossen werden, dass andere Gehirnbereiche Dopamin enthalten, und zwar bei den oben genannten Unterschieden im sexuellen Verhalten zwischen RHA- und RLA-Ratten. Dementsprechend ist bekannt, dass Dopamin sowohl bei den Versuchstieren als auch beim Menschen nicht nur im Nucleus Accumbens (Everitt, 1990; Pfaus et al., 1990; Hull et al., 1991; Pfaus und Everitt, 1995; Melis und Argiolas, 2011), aber auch in anderen Gehirnbereichen, wie dem medialen präoperativen Bereich, dem Hypothalamus und seinen Kernen (dh paraventrikulärer Kern (PVN); Pfaus und Phillips, 1991; Argiolas und Melis, 1995, 2005, 2013; Hull et al., 1995, 1999; Melis und Argiolas, 1995; Melis et al., 2003; Succu et al., 2007; Pfaus, 2010). Ein weiterer Bereich, der Dopamin enthält und möglicherweise eine Rolle im sexuellen Verhalten spielt, ist der mediale präfrontale Kortex (mPFC; Fernández-Guasti et al., 1994; Agmo und Villalpando, 1995; Agmo et al., 1995; Hernández-Gonzáles et al., 1998, 2007; Kakeyama et al., 2003; Balfour et al., 2006; Afonso et al., 2007; Davis et al., 2010; Febo, 2011). Tatsächlich finden sich in diesem Gehirnbereich die Nervenenden der mesokortikalen Dopamin-Neuronen, wobei ihre Zellkörper im ventralen Tegmentbereich als mesolimbische Dopamin-Neuronen lokalisiert sind. Was den Nucleus Accumbens angeht, so ist die genaue Rolle dieses Gehirnbereichs im sexuellen Verhalten noch lange nicht klar. Tatsächlich sind Läsionen des mPFC in der Regel nicht in der Lage, das sexuelle Verhalten männlicher Ratten bei einer sexuell aufnahmefähigen Frau (Fernández-Guasti et al., 1994; Agmo und Villalpando, 1995; Agmo et al., 1995; Hernández-Gonzáles et al., 1998, 2007; Kakeyama et al., 2003; Balfour et al., 2006; Afonso et al., 2007) noch der Ausdruck einer konditionierten Ortspräferenz für sexuelle Belohnung (Davis et al., 2010). Bei mPFC-Läsionen, die das Erscheinungsbild einer konditionierten Ortspräferenz für die sexuelle Belohnung nicht veränderten, wurde jedoch bei den gleichen Tieren die Fähigkeit zur Bildung einer konditionierten Abneigung gegen sexuelle Aktivität in Kombination mit aversiven Stimuli (Davis et al., 2010) und selektiver Zellbrand während des Annäherungsverhaltens einer männlichen Ratte gegenüber einer unzugänglichen sexuell aufnahmefähigen Frau wurden im mPFC von männlichen Ratten gemessen (Febo, 2011). Diese Ergebnisse deuten darauf hin, dass die Aktivierung von mPFC während des Sexualverhaltens eine Rolle bei der Integration externer und interner Informationen für die Ausführung und Kontrolle zielorientierter Verhaltensweisen spielt und nicht als Ausdruck angeborener Reaktionen auf natürliche Verstärker (siehe Goto und Gnade, 2005). Zusammen mit dem Nucleus Accumbens ist das mPFC somit Teil eines komplexen neuronalen Systems, das an der Modulation von motiviertem Verhalten (zielgerichtetes Verhalten) beteiligt ist, das die Integration kognitiver Informationen aus dem mPFC, emotionale Informationen aus der Amygdala und Kontext erfordert. verwandte Informationen aus dem Hippocampus im Nukleus accumbens (Goto und Gnade, 2005).
Experimentelle Beweise deuten darauf hin, dass die Freisetzung von Dopamin im mPFC an der adaptiven Regulierung des motivierten Verhaltens beteiligt ist. Eine Deregulierung dieser Mechanismen spielt vermutlich bei pathologischen oder nicht-adaptiven Zuständen eine Rolle, z. B. bei psychiatrischen Erkrankungen wie Schizophrenie, Aufmerksamkeitsdefizit und hyperaktiven Erkrankungen ( ADHS), Depression (Dunlop und Nemeroff, 2007; Masana et al., 2011) oder Drogenmissbrauch und Spielverhalten (Everitt und Robbins, 2005). Interessanterweise kann die Aktivität von Dopamin, das in der mPFC freigesetzt wird, durch Noradrenalin (NA) beeinflusst werden, das in der mPFC in höheren Mengen als Dopamin vorhanden ist, und insbesondere durch den NA-Transporter (NET), der nicht nur reichlich vorhanden ist Dopamin-Transporter (DAT) in der mPFC (Carboni et al., 1990, 2006; Gresch et al., 1995; Westernik et al., 1998), zeigt aber auch eine noch höhere Affinität zu Dopamin als zu NA (Horn, 1973). Da Dopamin und NA häufig in vielen mPFC-Funktionen zusammenarbeiten, reicht das Arbeitsgedächtnis und die Bildung von Aufmerksamkeitssätzen und die Umstellung auf Umkehrlernen, Antworthemmung und Reaktion auf Stress (vgl Robbins und Arnsten, 2009), so besteht die Möglichkeit, dass Dopamin allein oder zusammen mit NA in der mPFC auch eine Rolle bei den Verhaltensunterschieden zwischen RHA- und RLA-Ratten spielt, einschließlich derjenigen, die im sexuellen Verhalten auftreten.
Um diese Hypothese zu testen, wurde die Aktivität des mesokortikalen dopaminergen Systems und des noradrenergen Systems im mPFC in den zwei RHA- und RLA-Rattenlinien mittels intrazerebraler Mikrodialyse untersucht. Kurz gesagt, Dopamin (und sein Hauptmetabolit DOPAC) und NA wurden in Dialysaten gemessen, die aus den präimbibischen (PrL) und infralimbischen (IL) -Kompartimenten des mPFC von sexuell naiven (z. B. nie einer aufnahmefähigen Frau exponierten) und sexuell erfahrenen RHA und erhalten wurden RLA-Ratten (die z. B. fünf vorläufigen Kopulationstests unterzogen wurden und konstante Copulationsaktivität zeigen), wenn sie in Gegenwart einer unzugänglichen rezeptiven Frau und während der direkten sexuellen Interaktion mittels Hochdruckflüssigkeitschromatographie und elektrochemischer Detektion (HPLC-ECD) gebracht wurden.
Materialen und Methoden
Tiere
Outbred RHA und RLA männliche Ratten (N = 30 für jede Linie, wobei ing300 g zu Beginn der experimentellen Arbeit gewogen wurde) alle von der in 1998 gegründeten Kolonie an der Universität von Cagliari, Italien (Giorgi et al., 2007). Die Verfahren zur selektiven Zucht der sardischen Kolonie wurden bereits ausführlich beschrieben (Giorgi et al., 2005).
Bei allen Versuchen verwendete ovariektomierte Stimulus SD-weibliche Ratten (250 – 300 g zu Beginn der experimentellen Arbeit) wurden von Envigo (San Pietro al Natisone, Italien) erhalten. Die Tiere wurden vier Mal pro Käfig (38 cm × 60 cm × 20 cm) für mindestens 10 Tage vor Beginn der Experimente bei 24 ° C Luftfeuchtigkeit an die Unterbringungseinrichtungen der Abteilung für Biomedizinische Wissenschaften der Universität Cagliari gewöhnt 60%, umgekehrter 12 h Hell / Dunkel-Zyklus (Lichter von 08: 00 h bis 20: 00 h), Wasser und Standardlaborfutter ad libitum. Die Tiere wurden während der Gewöhnungsphase täglich für 1 – 2 min behandelt, um den Manipulationsstress während der Experimente zu begrenzen. Darüber hinaus war der Kontakt mit dem Wartungspersonal der Tierställe auf einen einzigen Begleiter beschränkt, und die Betten in den Käfigen wurden weder am Vortag noch am Tag der Experimente gewechselt. Alle Experimente wurden zwischen 10: 00 h und 18: 00 h durchgeführt. Diese Studie wurde in Übereinstimmung mit den Empfehlungen der Richtlinien der Europäischen Gemeinschaften, der Richtlinie von September 22, 2010 (2010 / 63 / EU) und der italienischen Gesetzgebung (DL March 4, 2014, Nr. 26) durchgeführt. Das Protokoll wurde von der Ethikkommission für Tierversuche der Universität Cagliari genehmigt (Genehmigung Nr. 361 / 2016-PR, April 08, 2016 bis FS).
Experimentelle Gruppen
Es wurden sexuell naive und sexuell erfahrene männliche RHA- und RLA-Ratten verwendet. Sexuell nicht vorkommende Ratten waren Ratten, die niemals einer sexuell aufnahmefähigen Ovariektomie ausgesetzt waren und Estradiol + Progesteron-weiblich waren. sexuell erfahrene Ratten waren Ratten, die bereits fünf aufeinanderfolgende Kopulationstests von 60 min im Abstand von 3-Tagen mit einer aufnahmefähigen Frau (Sanna et al., 2014a,b). Frauen wurden durch Behandlung mit subkutanem Östradiolbenzoat (200 & mgr; g / Ratte in Erdnussöl) und Progesteron (0.5 mg / Ratte in Erdnussöl), 48 h und 6 h vor den Kopulationstests in den Brunst gebracht. Der Östrus wurde durch die May-Grunwald-Giemsa-Färbung und die mikroskopische Untersuchung der Vaginalabstriche 1 h vor den Experimenten überprüft. In Übereinstimmung mit früheren Studien (Sanna et al., 2014a,b, 2015) fünf vorläufige Kopulationstests erwiesen sich als ausreichend, um männliche römische Ratten beider Linien zu zeigen, die ein gleichbleibendes Maß an Kopulationsaktivität aufwiesen: Beispielsweise erfüllten sexuell erfahrene RHA- und RLA-Ratten das Kriterium von mindestens einer Ejakulation, die in jedem der letzten beiden Tests erreicht wurde (Eine RHA-Ratte und zwei RLA-Ratten, die dieses Kriterium nicht erfüllten, wurden in dieser Phase verworfen). Zwei Tage nach diesen vorläufigen Kopulationstests wurden sexuell erfahrene römische Ratten einer stereotaktischen Operation unterzogen, um eine Mikrodialysesonde in das mPFC zu implantieren, wie nachstehend beschrieben (Sanna et al., 2015).
Mikrodialyse in der mPFC während des Sexualverhaltens
Am Tag vor der Mikrodialyse wurden sexuell naive oder erfahrene RHA- und RLA-Ratten in einem stereotaktischen Apparat (Stoelting Co., Wood Dale, IL, USA) unter Isofluran-Anästhesie positioniert (1.5% -2%; Harvard Apparatus, Holliston, MA, USA). und implantiert mit einer vertikalen selbstgebauten Mikrodialysesonde (Dialysemembran ≈3 mm freier Oberfläche); Melis et al., 2003) und einseitig gegen die mPFC-, PrL- und IL-Kompartimente gerichtet (Koordinaten: 3.0 mm anterior und 0.7 mm lateral zu Bregma und 5.5 mm ventral zu Dura; Paxinos und Watson, 2004). Am Tag des Experiments wurden die Tiere während der dunklen Phase des Zyklus in den Paarungskäfig (45 cm × 30 cm × 24 cm) überführt, der sich in einem schalldichten Raum befand, der durch ein schwaches rotes Licht beleuchtet und in einem anderen gehalten wurde kleiner Plexiglas-Käfig (15 cm × 15 cm × 15 cm) mit 25-Löchern (Ø 2 mm) in den vertikalen Wänden für visuelle, olfaktorische und akustische, aber nicht direkte Interaktion. Nach einer Gewöhnungszeit von 2h wurde die Mikrodialysesonde an eine CMA / 100-Mikroinfusionspumpe (Harvard Apparatus, Holliston, MA, USA) mit einem Polyethylenschlauch angeschlossen und mit einer Ringer-Lösung (147 mM NaCl, 3 mM KCl und 1.2 mM) perfundiert CaCl2pH 6.5) bei einer Flussrate von 2.5 μl / min. Nach einer Äquilibrierungsperiode von 2h des Perfusionsmediums mit der extrazellulären Flüssigkeit wurden während des Versuchs alle 37.5-Minuten Aliquots von 15-μl in eisgekühlten Polyethylenröhrchen zur Messung der Konzentration von Dopamin, DOPAC und NA wie beschrieben gesammelt unten. Nach dem Sammeln von mindestens vier Dialysat-Aliquoten wurde eine aufnahmefähige weibliche Ratte in den kleinen Käfig innerhalb des Paarungskäfigs für 30 min eingeführt. Während dieser 30-Minute wurden weitere zwei Dialysat-Aliquots gesammelt. Unter diesen Bedingungen können männliche Ratten nicht direkt mit dem Weibchen interagieren, sondern zeigen kontaktlose Erektionen (siehe unten). Nach dieser Zeit wurde der kleine Käfig entfernt, die Kopulation wurde für 75 min zugelassen, und weitere fünf Dialysat-Aliquots wurden gesammelt. Am Ende dieses Zeitraums wurde das Weibchen dann aus dem Paarungskäfig entfernt und ein zusätzliches Dialysat-Aliquot wurde gesammelt (Pfaus und Everitt, 1995; Melis et al., 2003; Sanna et al., 2015). Während des gesamten Experiments wurden Sexualparameter erfasst, die mit den antizipatorischen und konsumatorischen Phasen des Sexualverhaltens zusammenhängen (siehe unten).
Sexuelles Verhalten
Mehrere Parameter der Sexualmotivation und der Kopulationsleistung, die sich auf die antizipatorischen und konsumatorischen Phasen des Sexualverhaltens bezogen, wurden während des gesamten Experiments von einem Beobachter aufgezeichnet, der die spezifischen experimentellen Bedingungen nicht kannte, z. B. die Linie und den Grad der sexuellen Erfahrung nicht kannte der in diesem Experiment verwendeten Tiere (siehe unten). Kurz gesagt, die Latenzzeit bis zur ersten kontaktlosen Erektion (NCPEL, zeitlich ab Einführung der aufnahmefähigen Frau in den inneren kleinen Käfig) und deren Häufigkeit (NCPEF), die Anzahl der kontaktlosen Erektionen des Penis, die in dem Zeitraum auftreten, in dem sich die Frau befindet im inneren Käfig vorhanden) wurden aufgezeichnet. Diese Pheromon-vermittelten Erektionen des Penis, die bei sexuell potenten männlichen Ratten in Anwesenheit einer unzugänglichen rezeptiven Frau auftreten, werden als wichtiger Index für sexuelle Erregung angesehen (Sachs et al., 1994; Sachs, 2000; Melis et al., 2003). Wenn die sexuelle Interaktion erlaubt war, z. B. während der Kopulation, Latenzzeit zum Montieren und Intromiten (ML und IL, zeitlich von der Entfernung des inneren kleinen Käfigs bis zum ersten Montieren bzw. der ersten Intromission); Häufigkeit des Einbaus und der Intromittierung (MF und IF, Anzahl der Mounts und Intromissions in der ersten Serie der Kopulationsaktivität und während des gesamten Kopulationszeitraums); Latenz bis zur Ejakulation (EL, zeitlich von der ersten Intromission der ersten Serie bis zur Ejakulation); Die Ejakulationshäufigkeit (EF, die Gesamtzahl der Ejakulationen während des Kopulationstests) und das Ejakulationsintervall (PEI, zeitlich von der ersten Ejakulation bis zur nächsten Intromission) wurden aufgezeichnet. Außerdem die kopulatorische Wirksamkeit (CE; Anzahl der Intromissionen einer gegebenen Serie, dividiert durch die Summe der Anzahl der Mounts und der Intromission in derselben Serie) und das Intervall zwischen den Intromissionen (III; das Verhältnis zwischen der Ejakulationslatenz einer bestimmten Serie) und die Anzahl der Intromissionen in dieser Serie) wurden auch für die erste Serie der Kopulationsaktivität berechnet (Sachs und Barfield, 1976; Meisel und Sachs, 1994; Melis et al., 2003; Sanna et al., 2014a,b, 2015).
Bestimmung der Dopamin-, DOPAC- und Noradrenalinkonzentration im Dialysat aus der mPFC
Dopamin-, DOPAC- und NA-Konzentrationen wurden in 20 & mgr; l desselben Dialysat-Aliquots aus der mPFC durch Hochdruckflüssigkeitschromatographie (HPLC) gemessen, die mit einem elektrochemischen Nachweis unter Verwendung einer 4011-Doppelzelle (Coulochem II, ESA, Cambridge, MA, USA) verbunden war bereits beschrieben (Melis et al., 2003). Die Erkennung wurde im Reduktionsmodus bei + 350 und -180 mV durchgeführt. Die HPLC wurde mit einer Supelcosil C18-Säule (7.5 cm × 3.0 mm ID, 3 μm Partikelgröße; Supelco, Supelchem, Mailand, Italien) ausgestattet, eluiert mit 0.06 M Citrat / Acetat, pH 4.2, 20% v / v, 0.1 mM EDTA, 1 μM Triethylamin und 0.03 mM Natriumdodecylsulfat als mobile Phase bei einer Fließgeschwindigkeit von 0.6 ml / min und Raumtemperatur. Die Empfindlichkeit des Assays war 0.125 pg für Dopamin, 0.1 pg für DOPAC und 0.2 pg für NA.
Histologie
Am Ende der Experimente wurden die Ratten durch Enthauptung getötet, das Gehirn sofort vom Schädel entfernt und für 4-12-Tage in 15% wässriges Formaldehyd getaucht. Nach dieser Zeitspanne wurden koronale 40-µm-Hirnschnitte mit einem Gefriermikrotom präpariert, mit Neutralrot angefärbt und mit einem Phasenkontrastmikroskop untersucht. Die Position der Sondenspitze wurde dann in der mPFC lokalisiert, indem der Trakt der Sonde durch eine Reihe von Gehirnschnitten verfolgt wurde (siehe Abbildung 1). Nur Ratten, bei denen der aktive Teil der Dialysemembran korrekt in den PrL- und IL-Kompartimenten des mPFC positioniert war, wurden für die statistische Auswertung der Ergebnisse in Betracht gezogen (eine Ratte aus jeder Versuchsgruppe wurde in dieser Phase verworfen).
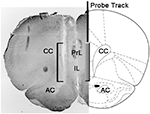 Figure 1. Schematische Darstellung eines koronalen Abschnitts des Rattenhirns, der die Spur der Mikrodialysesonde in den PrL- und IL-Abschnitten des medialen präfrontalen Kortex (mPFC; Paxinos und Watson, 2004). Die eckige Klammer in der Mikrophotographie zeigt den Teil des mit Neutralrot gefärbten Abschnitts, der den aktiven Teil der Dialysemembran der Mikrodialysesonde zeigt. Abkürzungen: PrL, Prelimbic-Bereich; IL, infralimbischer Bereich; AC, anterior Commissura; CC, Corpus Callosum.
Figure 1. Schematische Darstellung eines koronalen Abschnitts des Rattenhirns, der die Spur der Mikrodialysesonde in den PrL- und IL-Abschnitten des medialen präfrontalen Kortex (mPFC; Paxinos und Watson, 2004). Die eckige Klammer in der Mikrophotographie zeigt den Teil des mit Neutralrot gefärbten Abschnitts, der den aktiven Teil der Dialysemembran der Mikrodialysesonde zeigt. Abkürzungen: PrL, Prelimbic-Bereich; IL, infralimbischer Bereich; AC, anterior Commissura; CC, Corpus Callosum.
Statistiken
Statistische Analysen der biochemischen (Dopamin, DOPAC und NA) und Verhaltensdaten (NCPEL und NCPEF, ML, IL und EL, MF, IF und EF und PEI) wurden entweder mit allen Versuchspersonen durchgeführt (wie in Studien an männlichen Ratten traditionell durchgeführt) Kopulationsverhalten) oder Ausschluss von Personen, die während des Mikrodialyse-Experiments nicht zur Ejakulation kopiert wurden. Im ersten Fall, als alle Tiere in die Analysen einbezogen wurden, wurden Tieren, die in der Zeit, in der das Weibchen unzugänglich war oder keine NCPE zeigte, keine NCPE zeigten oder mit dem verfügbaren Weibchen in Ejakulat oder Ejakulat fielen, die entsprechenden Gesamtreichweiten zugewiesen: 1800 s if das Männchen zeigte keine NCPE in der 30-Minute, in der das Weibchen nicht erreichbar war; 900 s für ML und IL, wenn das Männchen nicht mit dem verfügbaren Weibchen verbunden war oder in dieses eingedrungen ist; 1800 s für EL, wenn der Mann die Ejakulation nicht erreicht hat, und 600 s für PEI, wenn der Mann nach der ersten Ejakulation nicht intromitiert wurde. Im zweiten Fall wurden die Tiere, die nicht zur Ejakulation kopiert wurden, von den Analysen ausgeschlossen. Dabei wurde festgestellt, ob die Unterschiede im Sexualverhalten mit den Konzentrationsunterschieden von extrazellulärem Dopamin, DOPAC und NA im mPFC der römischen Rattenlinien während der beiden Phasen sexueller Aktivität in Zusammenhang gebracht werden können, was mögliche verwirrende Interferenzen aufgrund des Einschlusses ausschließt von Probanden, die kein sexuelles Verhalten zeigten, indem sie ihnen feste Werte für die analysierten sexuellen Parameter zuweisen.
Mit ANOVAs wurden mehrere statistische Analysen durchgeführt, um mögliche Unterschiede zwischen den verwendeten Versuchsbedingungen zu erkennen und besser zu charakterisieren. Vor der Durchführung von ANOVAs wurden Datensätze von jeder der verschiedenen experimentellen Variablen auf Homogenität der Varianzen zwischen den vier experimentellen Gruppen (durchgeführt mit allen Tieren oder mit Ratten, die nur zur Ejakulation kopiert wurden) mit dem Test von Bartlett oder Levine untersucht, je nach Fall. Wenn signifikante Unterschiede in den Varianzen gefunden wurden, wurden Datensätze logarithmiert (dh die experimentellen Y-Werte wurden in Log-Y-Werte geändert), auf Homogenität der Varianzen überprüft und anschließend durch ANOVAs analysiert. Kurz gesagt, Verhaltensparameter, die vor (z. B. bei der unzugänglichen Frau) und während der ersten Serie der Kopulationsaktivität (von der ersten Anzucht / Intromission bis zur ersten Anzucht / Intromission nach der ersten Ejakulation) von naiven und sexuell erfahrenen männlichen RHA- und RLA-Ratten erhalten wurden während der Mikrodialyse wurden durch Zweiweg-ANOVAs analysiert, wobei die Rattenlinie und die sexuelle Erfahrung als Subjektfaktoren verwendet wurden (die Mittelwerte der Verhaltensparameter sind in der Tabelle angegeben 1 und für F Werte und Signifikanzniveaus von ANOVA-Analysen in Tabelle 2).
 Tabelle 1. Kopulatorische Parameter, die in der ersten Serie der Kopulationsaktivität gemessen wurden (die mit der ersten Montierung / Intromission beginnt, wenn das Weibchen für den Mann zugänglich gemacht wird und nach dem Ejakulationsintervall mit der ersten Montierung / Intromission der zweiten Serie endet) und berührungslosem Penis Erektionen von sexuell naiven und erfahrenen RHA- und RLA-Ratten.
Tabelle 1. Kopulatorische Parameter, die in der ersten Serie der Kopulationsaktivität gemessen wurden (die mit der ersten Montierung / Intromission beginnt, wenn das Weibchen für den Mann zugänglich gemacht wird und nach dem Ejakulationsintervall mit der ersten Montierung / Intromission der zweiten Serie endet) und berührungslosem Penis Erektionen von sexuell naiven und erfahrenen RHA- und RLA-Ratten.
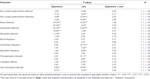 Tabelle 2. F Werte und Signifikanzniveaus der Zweiweg-ANOVA wurden mit den in der Tabelle angegebenen Daten durchgeführt 1 unter Verwendung der Rattenlinie (RHA vs. RLA) und des sexuellen Erfahrungsniveaus (naiv vs. erlebt) als Subjektfaktoren.
Tabelle 2. F Werte und Signifikanzniveaus der Zweiweg-ANOVA wurden mit den in der Tabelle angegebenen Daten durchgeführt 1 unter Verwendung der Rattenlinie (RHA vs. RLA) und des sexuellen Erfahrungsniveaus (naiv vs. erlebt) als Subjektfaktoren.
Zusätzlich wurde eine Gesamtanalyse der von jeder Ratte während der Mikrodialyse erhaltenen Daten durchgeführt, indem zunächst die AUCs berechnet wurden, die durch Auftragen der Werte der Dopamin-, DOPAC- oder NA-Konzentrationen oder der Anzahl der kontaktlosen Erektionen, Mounts, Intromissions und Ejakulationen erhalten wurden Zeit (Beginn von 1 h nach dem Einführen der männlichen Ratte in den Paarungskäfig bis zum Ende des Experiments -180 min, aufgeteilt in Fraktionen von 15 min für die neurochemischen Werte) oder zu dem Zeitpunkt, zu dem das Weibchen in den Paarungskäfig eingeführt wurde für die Verhaltensparameter) und dann durch Vergleich der berechneten Werte durch Zweiweg-ANOVAs unter Verwendung der Rattenlinie und des sexuellen Erfahrungsniveaus als Subjektfaktoren (die Durchschnittswerte der AUCs der neurochemischen und Verhaltensparameter sind in der Tabelle angegeben 4 und für F Werte und Signifikanzniveaus von ANOVA-Analysen in Tabelle 5). Schließlich wurde eine detailliertere Punkt-zu-Punkt-Analyse jedes Datensatzes (dh die Werte der Konzentrationen von Dopamin, DOPAC, NA und die Anzahl der kontaktlosen Erektionen, Mounts, Intromissions und Ejakulation im Verhältnis zur Zeit) nach Fakultät durchgeführt ANOVAs für wiederholte Messungen, unter Verwendung der Rattenlinie und der Ebene der sexuellen Erfahrung zwischen den Subjektfaktoren und der Zeit (dh Dialysatfraktionen) als Subjektfaktor (der F Die Werte und Signifikanzniveaus dieser ANOVA-Analysen sind in der Tabelle angegeben 6). Ähnliche Analysen wurden auch unter Berücksichtigung nur der Grundwerte der neurochemischen Parameter durchgeführt (die letzten vier Aliquots der Dialysate, die vor der Einführung in den Paarungskäfig der rezeptiven Frau gesammelt wurden), deren Durchschnittswerte in der Tabelle angegeben sind 3. Bei der Durchführung der allgemeinen faktoriellen ANOVAs für wiederholte Messungen wurden Interaktionen erster Ordnung, jedoch nicht zweiter Ordnung gefunden, insbesondere Interaktionen zwischen Linie × Zeit und Erfahrung × Zeit für neurochemische Parameter (siehe Tabelle 6), Zwei-Wege-ANOVAs mit der Linie oder dem Niveau der sexuellen Erfahrung als Faktor zwischen Subjektfaktor und Zeit innerhalb des Subjektfaktors wurden anhand dieser Datensätze durch direktes Vergleichen von sexuell naiven oder erfahrenen RHA vs. RLA-Ratten oder sexuell erfahrener vs. naive RHA-Ratten oder sexuell erfahrene vs. naive RLA-Ratten. Die Ergebnisse der Post-hoc- Paarweise Kontraste, die unter Verwendung des Tukey-HSD-Tests für signifikante Wechselwirkungen durchgeführt wurden, die durch diese Zweiweg-ANOVAs nachgewiesen wurden, sind in Abbildung 2 dargestellt 2. In allen anderen Fällen Post-hoc- Vergleiche wurden nicht berichtet, da ANOVAs keine signifikante Interaktion zwischen der Rattenlinie, der sexuellen Erfahrung und der Zeit feststellten. Statistische Analysen wurden alle mit Graph Pad 5 (PRISM, San Diego, Kalifornien, USA) und STATISTICA 12 (Statsoft, Tulsa, OK, USA) durchgeführt, wobei das Signifikanzniveau bei eingestellt war P <0.05.
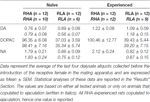 Tabelle 3. Basales Dopamin (DA), 3,4-Dihydroxyphenylessigsäure (DOPAC) und Noradrenalin (NA) im Dialysat aus dem medialen präfrontalen Kortex (mPFC) von sexuell naiven und erfahrenen RHA- und RLA-Ratten.
Tabelle 3. Basales Dopamin (DA), 3,4-Dihydroxyphenylessigsäure (DOPAC) und Noradrenalin (NA) im Dialysat aus dem medialen präfrontalen Kortex (mPFC) von sexuell naiven und erfahrenen RHA- und RLA-Ratten.
 Tabelle 4. Gesamtbewertung der Unterschiede in den DA-, DOPAC- und NA-Konzentrationen sowie im sexuellen Verhalten zwischen sexuell naiven und erfahrenen RHA- und RLA-Ratten durch Analyse der gemittelten AUCs, die aus den in den Abbildungen gezeigten Ergebnissen erhalten wurden 2 machen 3.
Tabelle 4. Gesamtbewertung der Unterschiede in den DA-, DOPAC- und NA-Konzentrationen sowie im sexuellen Verhalten zwischen sexuell naiven und erfahrenen RHA- und RLA-Ratten durch Analyse der gemittelten AUCs, die aus den in den Abbildungen gezeigten Ergebnissen erhalten wurden 2 machen 3.
 Tabelle 5. F Werte und Signifikanzniveaus von Zweiweg-ANOVAs, die mit den in Tabelle angegebenen Daten durchgeführt wurden 4 unter Verwendung der Rattenlinie (RHA vs. RLA) und des sexuellen Erfahrungsniveaus (naiv vs. erlebt) als Subjektfaktoren.
Tabelle 5. F Werte und Signifikanzniveaus von Zweiweg-ANOVAs, die mit den in Tabelle angegebenen Daten durchgeführt wurden 4 unter Verwendung der Rattenlinie (RHA vs. RLA) und des sexuellen Erfahrungsniveaus (naiv vs. erlebt) als Subjektfaktoren.
 Tabelle 6. F Werte und Signifikanzniveaus allgemeiner faktorieller ANOVAs für wiederholte Messungen der Ergebnisse, die in den Abbildungen dargestellt sind 2 machen 3 unter Verwendung der Rattenlinie (L; RHA vs. RLA) und des sexuellen Erfahrungsniveaus (E) (naiv vs. erlebt) als Subjektfaktor und Zeit (T) (Dialysatfraktionen) als Subjektfaktor.
Tabelle 6. F Werte und Signifikanzniveaus allgemeiner faktorieller ANOVAs für wiederholte Messungen der Ergebnisse, die in den Abbildungen dargestellt sind 2 machen 3 unter Verwendung der Rattenlinie (L; RHA vs. RLA) und des sexuellen Erfahrungsniveaus (E) (naiv vs. erlebt) als Subjektfaktor und Zeit (T) (Dialysatfraktionen) als Subjektfaktor.
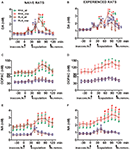 Figure 2. Dopamin (DA) -, DOPAC- und Noradrenalin (NA) -Konzentrationen in den mPFC-Dialysaten von sexuell naiven (AS) und erlebten männliche RHA- und RLA-Ratten (B, D, F) während der sexuellen Aktivität mit einer aufnahmefähigen Frau. Sexuell naive (dh nie zuvor sexuell aufnahmefähige Frauen) und sexuell erfahrene (die fünf Kopulationstests durchliefen) beider Linien mit einer in der mPFC stereotaktisch implantierten Mikrodialysesonde wurden einzeln in den Paarungskäfig gesetzt. Die Mikrodialysesonde wurde mit dem Dialysepuffer perfundiert, wie im Abschnitt "Materialien und Methoden" beschrieben. Nach dem Sammeln von vier Dialysat-Aliquots zur Bestimmung der Basiswerte wurde eine unzugängliche aufnahmefähige Frau in den kleinen Käfig der Paarungsapparatur gestellt (time = 0, inaccess.fe). Nach 30 min wurde der kleine Käfig entfernt und die Kopulation wurde für 75 min (Kopulation) zugelassen, wonach das Weibchen aus dem Paarungskäfig (fe.remov) entfernt wurde. Während des Experiments wurden berührungslose Erektionen und Kopulationsparameter gemessen, und alle 15-Minuten wurden Aliquots des Dialysats gesammelt und auf Dopamin, DOPAC und NA analysiert, wie im Abschnitt „Materialien und Methoden“ beschrieben. Werte sind Mittelwerte ± SEM der Werte, die von allen 12-Ratten pro Gruppe erhalten wurden (RHA_all = durchgezogene grüne Linien, RLA_all = durchgehende braune Linien) oder die nur zur Ejakulation kopiert wurden (RHA_cop = gestrichelte rote Linien; RLA_cop = gestrichelte blaue Linien). Bei erfahrenen RHA-Ratten erreichten alle Tiere die Kopulation und die Werte sind identisch. *P <0.05 in Bezug auf die Grundwerte (keine Frau) der Gruppe (grün für RHA_all; rot für RHA_cop, braun für RLA_all, blau für RLA_cop); #P <0.05 in Bezug auf die entsprechenden Werte der RLA-Gruppe (rot, RHA_all vs. RLA_all; grün, RHA_cop vs. RLA_cop); §P <0.05 in Bezug auf die zeitlich abgestimmten Werte der sexuell naiven Ratten (grün, erfahrener RHA_all vs. naiver RHA_all; rot, erfahrener RHA_cop vs. naiver RHA_cop; braun, erfahrener RLA_all vs. naiver RLA_all; blau, erfahrener RLA_cop vs. naiv RLA_cop) (Zwei-Wege-ANOVAs, die an den angezeigten Daten nach ihrer logarithmischen Transformation durchgeführt wurden, wie im Unterabschnitt „Materialien und Methoden“, „Statistik“, gefolgt von Tukeys HSD-Tests erläutert).
Figure 2. Dopamin (DA) -, DOPAC- und Noradrenalin (NA) -Konzentrationen in den mPFC-Dialysaten von sexuell naiven (AS) und erlebten männliche RHA- und RLA-Ratten (B, D, F) während der sexuellen Aktivität mit einer aufnahmefähigen Frau. Sexuell naive (dh nie zuvor sexuell aufnahmefähige Frauen) und sexuell erfahrene (die fünf Kopulationstests durchliefen) beider Linien mit einer in der mPFC stereotaktisch implantierten Mikrodialysesonde wurden einzeln in den Paarungskäfig gesetzt. Die Mikrodialysesonde wurde mit dem Dialysepuffer perfundiert, wie im Abschnitt "Materialien und Methoden" beschrieben. Nach dem Sammeln von vier Dialysat-Aliquots zur Bestimmung der Basiswerte wurde eine unzugängliche aufnahmefähige Frau in den kleinen Käfig der Paarungsapparatur gestellt (time = 0, inaccess.fe). Nach 30 min wurde der kleine Käfig entfernt und die Kopulation wurde für 75 min (Kopulation) zugelassen, wonach das Weibchen aus dem Paarungskäfig (fe.remov) entfernt wurde. Während des Experiments wurden berührungslose Erektionen und Kopulationsparameter gemessen, und alle 15-Minuten wurden Aliquots des Dialysats gesammelt und auf Dopamin, DOPAC und NA analysiert, wie im Abschnitt „Materialien und Methoden“ beschrieben. Werte sind Mittelwerte ± SEM der Werte, die von allen 12-Ratten pro Gruppe erhalten wurden (RHA_all = durchgezogene grüne Linien, RLA_all = durchgehende braune Linien) oder die nur zur Ejakulation kopiert wurden (RHA_cop = gestrichelte rote Linien; RLA_cop = gestrichelte blaue Linien). Bei erfahrenen RHA-Ratten erreichten alle Tiere die Kopulation und die Werte sind identisch. *P <0.05 in Bezug auf die Grundwerte (keine Frau) der Gruppe (grün für RHA_all; rot für RHA_cop, braun für RLA_all, blau für RLA_cop); #P <0.05 in Bezug auf die entsprechenden Werte der RLA-Gruppe (rot, RHA_all vs. RLA_all; grün, RHA_cop vs. RLA_cop); §P <0.05 in Bezug auf die zeitlich abgestimmten Werte der sexuell naiven Ratten (grün, erfahrener RHA_all vs. naiver RHA_all; rot, erfahrener RHA_cop vs. naiver RHA_cop; braun, erfahrener RLA_all vs. naiver RLA_all; blau, erfahrener RLA_cop vs. naiv RLA_cop) (Zwei-Wege-ANOVAs, die an den angezeigten Daten nach ihrer logarithmischen Transformation durchgeführt wurden, wie im Unterabschnitt „Materialien und Methoden“, „Statistik“, gefolgt von Tukeys HSD-Tests erläutert).
Die Ergebnisse
RHA- und RLA-Ratten zeigen eine unterschiedliche Anzahl von berührungslosen Erektionen und unterschiedliche Muster des Kopulationsverhaltens
In Übereinstimmung mit früheren Studien (Sanna et al., 2014a,b, 2015), trat eine unterschiedliche Anzahl von sexuell naiven männlichen RHA- und RLA-Ratten in sexueller Aktivität auf, als sie zusammen mit einer aufnahmefähigen Frau während der Sammlung von Dialysat-Aliquoten aus der mPFC durch intrazerebrale Mikrodialyse zusammengebracht wurden. Kurz, in dieser Studie kopierten 10 aus 12 sexuell naiven männlichen RHA-Ratten (83%) im ersten Kopulationstest zur Ejakulation, und zwar nur gegen 6 aus 12-naiven RLA-Ratten (50%) während des Mikrodialyse-Experiments. Dieser Unterschied wurde auch bei sexuell erfahrenen männlichen RHA- und RLA-Ratten (nach fünf Kopulationstests) festgestellt, obwohl sie abgeschwächt waren, wobei alle 12-RHA-Ratten während der Mikrodialyse eine Ejakulation gegen 9 aus 12-RLA-Ratten erreichten. Immer in Übereinstimmung mit früheren Studien, auch in dieser Studie zeigten die beiden römischen Rattenlinien unterschiedliche Latenzzeiten und Häufigkeit von kontaktlosen Erektionen des Penis, wenn sie einer unzugänglichen, aufnahmefähigen Frau ausgesetzt wurden, sowie unterschiedliche Muster des Kopulationsverhaltens während der sexuellen Interaktion. Diese Unterschiede wurden entweder bei der Betrachtung der Daten aller Versuchstiere einer bestimmten Gruppe festgestellt, unabhängig davon, ob sie zur Ejakulation kopulierten oder nicht (z. B. indem den Tieren, die das Verhalten nicht zeigten, volle Punktzahlen zugewiesen werden, d. H. Ratten, zu denen keine Kopulation durchgeführt wurde) Ejakulation) oder unter Berücksichtigung der Daten der Tiere, die nur das Verhalten einer bestimmten Gruppe zeigten (z. B. Tiere, die zur Ejakulation kopierten; Tabelle 1). Dementsprechend zeigten statistische Analysen der Werte der kontaktlosen Erektionen (NCPE) und der in der ersten Reihe der Kopulationsaktivität durch bidirektionale ANOVAs gemessenen Kopulationsparameter signifikante Unterschiede zwischen den beiden Rattenlinien, wenn entweder alle experimentellen Ratten oder nur die kopulierenden Ratten betrachtet wurden in den vier experimentellen Gruppen (siehe Tabelle 2). Bei Betrachtung der von allen Versuchstieren erhaltenen Daten war die Anzahl der kontaktlosen Erektionen höher und die Anzahl der NCPEL, ML, IL und PEI war bei RHA-Ratten im Vergleich zu RLA-Ratten signifikant geringer. Weiterhin waren EF und CE höher, während die III bei RHA-Ratten im Vergleich zu RLA-Ratten signifikant kürzer war. Einige der oben genannten Unterschiede zwischen den beiden Linien der römischen Ratte tendierten dazu, mit wiederholten Kopulationstests abzunehmen oder zu verschwinden. Einige dieser Unterschiede waren jedoch nach Stabilisierung des Sexualverhaltens durch wiederholte sexuelle Erfahrungen immer noch vorhanden. Ähnliche Ergebnisse wurden erhalten, wenn nur die Werte der Tiere der vier zur Ejakulation kopulierten Versuchsgruppen mit Ausnahme der EF betrachtet wurden (siehe Tabellen 1, 2).
Basalkonzentrationen von extrazellulärem Dopamin, DOPAC und Noradrenalin in mPFC-Dialysaten von sexuell naiven und erfahrenen RHA- und RLA-Ratten
Unter den vorliegenden experimentellen Bedingungen betrugen die Mengen an Dopamin, DOPAC und NA in den aus der mPFC erhaltenen Dialysaten (z. B. unabhängig davon, ob sie zur Ejakulation kopiert wurden oder nicht) RHA- und RLA-Ratten, 2.32 pg und 2.11 pg für Dopamin. 322.56 pg und 124.42 pg für DOPAC und 6.05 pg bzw. 2.24 pg für NA in 20 & mgr; l Dialysat. Ähnliche Mengen wurden in den Dialysaten gemessen, die aus der mPFC von sexuell erfahrenen RHA- und RLA-Ratten erhalten wurden (Dopamin: 3.73 pg und 3.33 pg, DOPAC: 353.62 pg und 133.32 pg, NA: 7.17 pg und 2.78 pg in RHA- und RLA-Ratten). . Diese Werte zeigen eine Konzentration von ≅0.8-1.2 nM und ≅95-100 nM für extrazelluläres Dopamin bzw. DOPAC und ≅1.8-2.2 nM für extrazelluläre NA im mPFC von RHA-Ratten und eine Konzentration ≅0.8-1.2 nM an und ≅35-40 nM für extrazelluläres Dopamin bzw. DOPAC und ≅0.6-0.9 nM für extrazelluläre NA in der mPFC von RLA-Ratten (Tabelle 3). Die obigen Werte wurden nach einer Äquilibrierungsperiode von 2 h des Dialysepuffers mit der extrazellulären mPFC-Flüssigkeit erhalten. Da die Wiedergewinnung von authentischem Dopamin, DOPAC und NA der Dialysesonden auf nahe 20% geschätzt wurde, können die Konzentrationen von extrazellulärem Dopamin, DOPAC und NA in beiden Linien für Dopamin, ≅4, nahe an ≅5-500 nM liegen und ≅ 200 nM für DOPAC und ≅10 und ≅4 nM für NA in der mPFC von RHA- bzw. RLA-Ratten. Faktorielle ANOVAs für wiederholte Messungen der oben genannten Werte nach der Transformation des Logarithmus zeigten signifikante Unterschiede in den Basalwerten von Dopamin zwischen sexuell naiven und sexuell erfahrenen Ratten (F(1,44,132) = 26.05, P <0.001) und in den Grundwerten von DOPAC (F(1,44,132) = 63.36, P <0.001) und von NA (F(1,44,132) = 42.14, P <0.001) zwischen RHA- und RLA-Ratten (die letzten vier Proben wurden vor der Einführung des Weibchens in den kleinen Käfig entnommen). Ähnliche Werte wurden gefunden, wenn nur Ratten betrachtet wurden, die während des Mikrodialyseexperiments zur Ejakulation kopulierten (Tabelle 3). Auch in diesem Fall zeigten faktorielle ANOVAs für wiederholte Messungen der Werte nach der Logarithmentransformation signifikante Unterschiede in den Basalwerten von Dopamin zwischen sexuell naiven und sexuell erfahrenen Ratten (F(1,33,99) = 26.97, P <0.001) und in den Grundwerten von DOPAC (F(1,33,99) = 42.95, P <0.001) und von NA (F(1,33,99) = 27.63, P <0.001) zwischen RHA- und RLA-Ratten.
Die Konzentrationen von extrazellulärem Dopamin, DOPAC und Noradrenalin in mPFC-Dialysaten aus sexuell naiven und erfahrenen RHA- und RLA-Ratten ändern sich während der sexuellen Aktivität unterschiedlich
Das Vorhandensein der unzugänglichen rezeptiven Frau im inneren kleinen Käfig und die anschließende direkte sexuelle Interaktion erhöhten die Konzentrationen von extrazellulärem Dopamin, DOPAC und NA in den mPFC-Dialysaten, die sowohl von sexuell naiven als auch von erfahrenen männlichen RHA- und RLA-Ratten erhalten wurden zwei Rattenlinien und Erfahrungsniveau, entweder bei der Betrachtung aller Versuchstiere oder nur bei denjenigen, die zur Ejakulation kopulierten (Abbildung 2). In der Tat zeigten bidirektionale ANOVAs der AUCs der Konzentrationen von Dopamin, DOPAC und NA, dass der Gesamtgehalt an Dopamin, DOPAC und NA des gesamten Tests bei RHA-Ratten signifikant höher war als bei RLA-Ratten und sexuell Erfahrung im Vergleich zu naiven Ratten (siehe Tabelle 4 für AUCs-Werte und Tabelle 5 für F Werte und Signifikanzniveau). Diese Unterschiede wurden ferner durch punktweise faktorielle ANOVAs für wiederholte Messungen der Dopamin-, DOPAC- und NA-Mengen der beiden sexuell naiven und erfahrenen Rattenlinien entlang des Experiments bestätigt, die signifikante Haupteffekte von Linie, Erfahrung, Zeit und signifikanter Linie × Zeit zeigten und Erfahrung × Zeit Interaktionen erster Ordnung (siehe Tabelle 6 für F Werte und Signifikanzniveau).
Die Konzentrationen von extrazellulärem Dopamin, DOPAC und Noradrenalin in mPFC-Dialysaten, die aus sexuell naiven RHA- und RLA-Ratten erhalten werden, ändern sich während der sexuellen Aktivität unterschiedlich
Bei sexuell naiven RHA- und RLA-Ratten nahm extrazelluläres Dopamin, jedoch nicht DOPAC, zuerst zu, wenn sie in Anwesenheit der unzugänglichen Frau gebracht wurde, während NA nur bei RHA-Ratten zunahm. Bei naiven RHA-Ratten erhöhte sich das extrazelluläre Dopamin in der ersten 15-Minute der sexuellen Interaktion weiter, wie bei DOPAC und NA festgestellt. Die Zuwächse bei extrazellulärem Dopamin, DOPAC und NA dauerten während der gesamten Kopulationszeit, wobei Dopamin, DOPAC und NA einen Spitzenwert bei 60 min, 75 min bzw. 75 min erreichten, dann extrazelluläres Dopamin und in einem geringeren Ausmaß DOPAC und NA , sank nach Entfernung des Weibchens auf ähnliche Werte wie die basalen.
Auf der anderen Seite trat der erste signifikante Anstieg und Spitzenwert bei extrazellulärem Dopamin, DOPAC und NA bei naiven RLA-Ratten während der ersten 15-Minute der Kopulation auf. Abweichend von RHA-Ratten neigten extrazelluläres Dopamin, DOPAC und NA bei RLA-Ratten zu Werten, die den basalen Werten innerhalb der ersten direkten 30-Wechselwirkung mit der Frau ähnlich waren (siehe Abbildungen 2A, C, E).
Schließlich waren die Zuwächse bei extrazellulärem Dopamin während der Kopulation größer und persistenter bei sexuell naiver RHA als bei RLA-Ratten (siehe Abbildung 2A) während in der Abwesenheit des Weibchens ihre Konzentrationen über die beiden Rattenlinien hinweg ähnlich, jedoch nicht identisch waren (siehe oben und Tabelle 3). Obwohl kein Unterschied zwischen den beiden römischen Linien in der prozentualen Zunahme von DOPAC und in geringerem Maße in den NA-Konzentrationen während der Anwesenheit des aufnahmefähigen Weibchens gefunden wurde, war der absolute Unterschied der DOPAC- und NA-Konzentrationen mehr als doppelt so hoch wurde zwischen den beiden Rattenlinien unter basalen Bedingungen beobachtet (siehe Tabelle 3) und während des gesamten Tests mit der aufnahmefähigen Frau (siehe Abbildungen 2C, E).
Die Konzentrationen von extrazellulärem Dopamin, DOPAC und Noradrenalin in mPFC-Dialysaten, die aus sexuell erfahrenen RHA- und RLA-Ratten erhalten werden, ändern sich während der sexuellen Aktivität unterschiedlich
Wie bei sexuell naiven RHA- und RLA-Ratten gefunden, führte das Vorhandensein der unzugänglichen weiblichen und anschließenden direkten sexuellen Interaktion zu einem Anstieg von extrazellulärem Dopamin und DOPAC im mPFC-Dialysat, das von sexuell erfahrenen männlichen RHA- und RLA-Ratten erhalten wurde. Allerdings wurden auch in diesem Fall Unterschiede in der Rattenlinie festgestellt, entweder bei der Betrachtung aller Versuchstiere oder in geringerem Maße nur bei denjenigen, die zur Ejakulation gelangten (Abb 2). Bei sexuell erfahrenen RHA- und RLA-Ratten trat der erste Anstieg des extrazellulären Dopamins bei der unzugänglichen Frau auf. Danach stiegen die Dopaminkonzentrationen während der Kopulation in beiden Rattenlinien an. Die Dopaminkonzentrationen erreichten ihre Spitzenwerte nach 45-60 min Kopulation und sanken am Ende des Kopulationsversuchs langsam in Richtung der Basalwerte ab (siehe Abbildung 2B). Ähnlich wie bei sexuell naiven Ratten waren die extrazellulären Dopaminkonzentrationen bei sexuell erfahrenen RHA-Ratten höher als bei RLA-Ratten, hauptsächlich in den Aliquoten des Dialysats, die während des zentralen Teils der Kopulationsphase (nach 30-45 min der Kopulation) gesammelt wurden. Die DOPAC - Konzentrationen stiegen während der Anwesenheit der unzugänglichen Frau nur bei RHA - Ratten an, während sie in beiden Rattenlinien während der Kopulation in ähnlichem Maße anstieg (Spitzenwerte bei 75 – 90 min) und tendierten am Ende des Tages zu Basalwerten Kopulationstest (siehe Abbildung 2D). Die NA - Konzentrationen stiegen auch in beiden sexuell erfahrenen Rattenlinien an, nachdem die Frau bei RHA - Ratten 90 min und bei RLA - Ratten 45 min Spitzenwerte erreicht hatte (siehe Abbildung 2F). Bei Abweichungen von Dopamin (siehe oben) wurde ein ähnlicher Unterschied in den Anstiegen der DOPAC- und NA-Konzentrationen bei sexuell erfahrenen Ratten aus beiden Linien festgestellt, wenn alle Tiere im Vergleich zu Tieren betrachtet wurden, die nur die Ejakulation erreichten. Wie bei sexuell naiven Ratten gefunden, wurden, obwohl der prozentuale Anstieg der DOPAC- und NA-Konzentrationen ähnlich war, signifikante Unterschiede in den absoluten Werten von DOPAC und NA zwischen sexuell erfahrenen RHA- und RLA-Ratten während des gesamten Tests (dh vor, während und nach) festgestellt Vorhandensein der aufnahmefähigen Frau), wobei RHA-Ratten höhere Werte als RLA-Ratten zeigen (siehe Tabelle 3 für Grundwerte und Zahlen 2D, F für die Werte entlang des gesamten Tests).
Sexuelle Erfahrung beeinflusst die Veränderungen der Dopamin- und Noradrenalin-Konzentrationen in mPFC-Dialysaten, die von RHA- und RLA-Ratten während der sexuellen Aktivität erhalten werden
Ein Vergleich der Konzentrationen von extrazellulärem Dopamin und NA in sexuell naiven und erfahrenen RHA- und RLA-Ratten zeigte, dass die sexuelle Erfahrung die Konzentration von extrazellulärem Dopamin und in geringerem Maße auch die NA in beiden Rattenlinien beeinflusste, entweder unter Berücksichtigung aller Versuchstiere oder solche, die nur zur Ejakulation kopuliert wurden (Abbildungen 2A, B, E, F). Dementsprechend traten bei den Basalwerten von Dopamin signifikante Unterschiede zwischen sexuell naiven und erfahrenen Ratten beider Linien auf (siehe Tabelle 3) und die Dopaminwerte während der kopulatorischen Aktivität waren im Allgemeinen bei sexuell erfahrenen RHA - und RLA - Ratten im Vergleich zu ihren naiven Gegenstücken höher (siehe Abbildung 2B). Darüber hinaus folgte bei sexuell erfahrenen RHA-Ratten, obwohl der Dopamin-Anstieg, der während der Anwesenheit des unzugänglichen Weibchens gefunden wurde, das gleiche zeitliche Muster, das bei sexuell naiven Ratten beobachtet wurde, folgte, die Unterschiede im zeitlichen Muster während der Kopulation. In diesem Fall wurden in Abweichung von dem, was bei sexuell naiven RHA-Ratten (ein Hauptpeak bei 60 min) beobachtet wurde, zwei Hauptspitzenwerte gefunden, der erste nach 15 min und der zweite nach 45 min der Kopulation. Nach diesem letzten Anstieg tendierten die Dopaminwerte dazu, zu den Basiswerten zurückzukehren (siehe Abbildung 2B).
Ein ähnliches Bild wurde bei sexuell naiven gegenüber erfahrenen RLA-Ratten gefunden. Ähnlich wie bei RHA-Ratten wurde auch bei erfahrenen RLA-Ratten ein zeitliches Muster festgestellt, das durch drei hauptsächliche Zunahmen von extrazellulärem Dopamin gekennzeichnet ist: das erste bei der unzugänglichen Frau und die anderen beiden während der Kopulation, dh nach 15 min und 60 min Kopulation (siehe Abbildungen 2A, B). Im Allgemeinen scheint die sexuelle Erfahrung längerfristige Veränderungen im zeitlichen Muster der Dopaminfreisetzung in beiden Rattenlinien zu bewirken, wenn sie von der sexuell naiven zur erlebten Erkrankung übergeht.
Wie in den Abbildungen gezeigt 2C – FEs wurden nur geringe Unterschiede in der DOPAC- und NA-Konzentration zwischen naiven und erfahrenen Ratten beider Linien festgestellt. Ein nicht signifikanter Trend bei extrazellulärer NA zu höheren Werten bei erfahrenen im Vergleich zu naiven Ratten wurde jedoch bei Basal beobachtet (vor der Einführung der rezeptiven Frau, siehe Tabelle) 3) und in den NA-Gesamtbeträgen, wie aus den AUC-Werten ersichtlich ist (siehe Tabelle 4) berechnet anhand der extrazellulären Konzentrationen des gesamten Tests (vor und während der Anwesenheit der aufnahmefähigen Frau). Schließlich war das zeitliche Muster der NA-Konzentrationen sehr ähnlich, wenn erfahrene Ratten beider Rattenlinien mit ihren naiven Gegenstücken verglichen wurden, was darauf hinweist, dass die sexuelle Erfahrung zu einer allgemeinen Zunahme der extrazellulären NA führen kann und nicht zu einer Veränderung des Wachstumsmusters (siehe Abbildungen) 2E, F).
Änderungen der Konzentrationen von extrazellulärem Dopamin und Noradrenalin in mPFC-Dialysaten, die aus sexuell naiven und erfahrenen RHA- und RLA-Ratten erhalten werden, treten gleichzeitig mit Änderungen des Sexualverhaltens auf
Die Unterschiede in den Konzentrationen von extrazellulärem Dopamin, DOPAC und NA in den aus dem mPFC erhaltenen Dialysaten fanden sich sowohl bei sexuell naiven als auch bei erfahrenen RHA - und RLA - Ratten während des Tests (Abbildung 2) traten zusammen mit Modifikationen bei verschiedenen sexuellen Parametern auf, die während der zwei Hauptphasen der Experimente gemessen wurden (dh für Frauen unzugänglich und für den Mann verfügbar). Dazu gehören unter anderem kontaktlose Erektionen des Penis (Abbildungen 3A, B), Halterungen (Abbildungen 3C, D), Intromissionen (Abbildungen 3E, F) und Ejakulationen (Abbildungen 3G, H). Diese Unterschiede wurden entweder bei der Betrachtung aller Versuchstiere oder bei denjenigen beobachtet, die nur zur Ejakulation führten. Eine vorläufige Analyse der AUC - Werte dieser Parameter durch bidirektionale ANOVAs (siehe Tabelle 4 für AUCs-Werte und Tabelle 5 für F Werte und Signifikanzniveau) gefolgt von einer Punkt-zu-Punkt-Analyse der Werte dieser Parameter entlang des Experiments durch faktorielle ANOVA für wiederholte Messungen zeigte signifikante Haupteffekte der Interaktionen zwischen Linie, Erfahrung, Zeit und signifikanter erster Ordnung Linie × Zeit und Erfahrung × Zeit. und eine signifikante Wechselwirkung zweiter Ordnung für Reittiere (siehe Tabelle 6 für F Werte und Signifikanzniveau). Entsprechend früheren Studien (Sanna et al., 2015): (i) sexuell naive RHA-Ratten zeigten mehr berührungslose Erektionen des Penis, Reittiere, Intromissionen und Ejakulationen als ihre RLA-Kollegen; (ii) sexuell erfahrene RHA-Ratten zeigten eine höhere Anzahl von kontaktlosen Erektionen, Intromissionen und Ejakulationen des Penis als ihre RLA-Gegenstücke; und (iii) sexuell erfahrene Ratten beider Linien und insbesondere RLA-Ratten zeigten mehr berührungslose Erektionen des Penis, Intromissionen und Ejakulationen als ihre sexuell naiven Kollegen. Während bei RHA-Ratten der größte Teil der durch sexuelle Erfahrungen hervorgerufenen Veränderungen im Zeitverlauf statt in der Häufigkeit der Verhaltensparameter auftrat (z. B. erlebte Ratten hauptsächlich in der ersten Testhälfte, während dies bei naiven Ratten der Fall war) ein ähnlicher kopulatorischer Trend während des gesamten Tests), wurde bei RLA-Ratten eine allgemeinere Verbesserung des Sexualverhaltens, hauptsächlich der sexuellen Leistungsfähigkeit, durch sexuelle Erfahrung hervorgerufen, wie durch die Veränderung der Werte von Kopulationsparametern bei erfahrenen RLA-Ratten im Vergleich zu ihrem Verhalten gezeigt wurde naive Kollegen.
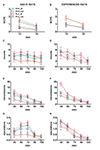 Figure 3. Veränderungen der Anzahl der berührungslosen Erektionen des Penis (NCPE), Reittiere, Intromissionen und Ejakulationen, die von sexuell naiven Personen erfasst wurden (A, C, E, G) und erfahrene RHA- und RLA-Ratten (B, D, F, H) während der Mikrodialyse-Experimente in Abbildung 2. Alle experimentellen Bedingungen waren identisch mit den in der Legende der Figur beschriebenen 2. Werte sind Mittelwerte ± SEM der Werte, die von allen 12-Ratten pro Gruppe erhalten wurden (einschließlich der Werte, denen Vollzeitwerte zugewiesen wurden; RHA = durchgezogene grüne Linien, RLA = durchgehende braune Linien) oder solche, die nur zur Ejakulation (RHA = gestrichelte rote Linien) kopiert wurden ; RLA = gestrichelte blaue Linien). Bei erfahrenen RHA-Ratten erreichten alle Tiere die Kopulation und die Werte sind identisch. Da keine signifikanten Wechselwirkungen zwischen dem Rattenlinienfaktor (RHA vs. RLA), dem Faktor der sexuellen Erfahrung (naiv vs. erlebt) und der Zeit gefunden wurden, wurden die Daten mit Zweiweg-ANOVAs analysiert (siehe Tabelle) 6, Post-hoc- Vergleiche wurden nicht berichtet, wie im Abschnitt „Materialien und Methoden“, „Statistik“ erläutert.
Figure 3. Veränderungen der Anzahl der berührungslosen Erektionen des Penis (NCPE), Reittiere, Intromissionen und Ejakulationen, die von sexuell naiven Personen erfasst wurden (A, C, E, G) und erfahrene RHA- und RLA-Ratten (B, D, F, H) während der Mikrodialyse-Experimente in Abbildung 2. Alle experimentellen Bedingungen waren identisch mit den in der Legende der Figur beschriebenen 2. Werte sind Mittelwerte ± SEM der Werte, die von allen 12-Ratten pro Gruppe erhalten wurden (einschließlich der Werte, denen Vollzeitwerte zugewiesen wurden; RHA = durchgezogene grüne Linien, RLA = durchgehende braune Linien) oder solche, die nur zur Ejakulation (RHA = gestrichelte rote Linien) kopiert wurden ; RLA = gestrichelte blaue Linien). Bei erfahrenen RHA-Ratten erreichten alle Tiere die Kopulation und die Werte sind identisch. Da keine signifikanten Wechselwirkungen zwischen dem Rattenlinienfaktor (RHA vs. RLA), dem Faktor der sexuellen Erfahrung (naiv vs. erlebt) und der Zeit gefunden wurden, wurden die Daten mit Zweiweg-ANOVAs analysiert (siehe Tabelle) 6, Post-hoc- Vergleiche wurden nicht berichtet, wie im Abschnitt „Materialien und Methoden“, „Statistik“ erläutert.
Diskussion
Diese Studie bestätigt und erweitert die Ergebnisse früherer Studien, die zeigen, dass RHA- und RLA-Ratten, die unter aversiven Bedingungen deutlich unterschiedliche Bewältigungsstile aufweisen (Driscoll und Bättig, 1982; Giorgi et al., 2003a; Steimer und Driscoll, 2003) zeigen ausgeprägte Verhaltensmuster bei Anwesenheit einer unzugänglichen rezeptiven Frau und bei klassischen Kopulationsversuchen (Sanna et al., 2014a,b, 2015). Dementsprechend zeigt auch diese Studie, dass sexuell naive RHA-Ratten (die noch nie einer aufnahmefähigen Frau ausgesetzt waren) im Vergleich zu sexuell naiven RLA-Ratten eine höhere sexuelle Motivation und eine bessere sexuelle Leistungsfähigkeit zeigten, z. B. RHA-Ratten eine höhere Anzahl von kontaktlosen Erektionen des Penis induzierte Peniserektionen als Indikator für sexuelle Erregung; Sachs et al., 1994; Sachs, 2000) und verschiedene pro-sexuelle Veränderungen bei verschiedenen Kopulationsparametern, wie in früheren Studien festgestellt (Sanna et al., 2014a,b, 2015). Diese Unterschiede blieben in beiden römischen Rattenlinien nach dem Erwerb sexueller Erfahrung, dh nach Stabilisierung des Sexualverhaltens mit fünf Expositionen und Kopulationstests mit einer aufnahmefähigen Frau, bestehen. Diese Studie zeigt auch zum ersten Mal, dass sowohl bei RHA- als auch bei RLA-Rattenlinien, entweder im naiven oder im erlebten Zustand, berührungslose Erektionen des Penis und sexuelle Interaktion gleichzeitig mit einer Erhöhung der Konzentrationen von extrazellulärem Dopamin (und seinem Hauptmetaboliten DOPAC) auftraten ) und NA in den Dialysaten, die durch intrazerebrale Mikrodialyse aus der mPFC beider Linien der römischen Ratte erhalten wurden. Interessanterweise scheinen diese Erhöhungen von extrazellulärem Dopamin und NA in der mPFC mit Unterschieden entweder im Rattenphänotyp oder im Ausmaß der sexuellen Erfahrung in Zusammenhang zu stehen. Wie im Abschnitt "Ergebnisse" ausführlich gezeigt, zeigten sowohl sexuell unübliche als auch erfahrene RHA-Ratten einen höheren und langanhaltenden Anstieg von extrazellulärem Dopamin und NA im Vergleich zu ihren RLA-Gegenstücken sowohl in der appetitlichen als auch in der konsumatorischen Phase des Sexualverhaltens. Darüber hinaus zeigten sexuell erfahrene Ratten beider römischen Linien in beiden Phasen des Sexualverhaltens im Vergleich zu ihren naiven Gegenstücken einen höheren und lang anhaltenden Anstieg von extrazellulärem Dopamin und NA im mPFC. Schließlich waren alle oben genannten Unterschiede bei extrazellulärem Dopamin und NA in der mPFC anscheinend mit Unterschieden in den Verhaltensparametern des Sexualverhaltens verbunden, z. B. zeigten sexuell erfahrene Ratten beider römischen Linien eine höhere sexuelle Motivation und bessere Kopulationsleistungen im Vergleich zu ihren naiven Gegenstücken und sexuell naive und erfahrene RHA-Ratten zeigten eine höhere sexuelle Motivation und bessere Kopulationsleistungen im Vergleich zu ihren sexuell naiven und erfahrenen RLA-Kollegen.
Was den Anstieg des extrazellulären Dopamins im mPFC-Dialysat während der sexuellen Aktivität anbelangt, trat der erste Anstieg in der ersten 15-Minute nach der Einführung des sexuell aufnahmefähigen Weibchens in den Paarungsapparat auf, als das Weibchen für das Männchen unzugänglich war, was normalerweise der Fall ist in diesem Zustand berührungslose Erektionen. Ein zweiter und größerer Anstieg von extrazellulärem Dopamin trat während der ersten 15-Minute auf, nachdem das Weibchen dem Mann zur Kopulation zugänglich gemacht wurde. Interessanterweise stieg, während im naiven Zustand das extrazelluläre Dopamin hauptsächlich im ersten Teil des Tests anstieg und die Tendenz bestand, im zweiten Teil zu den Basalwerten zurückzukehren, während Dopamin im sexuell erlebten Zustand während des Tests erhöht blieb und Spitzenwerte erreichte nach 45-60 min Kopulation in beiden römischen Rattenlinien.
Abgesehen von den oben genannten Unterschieden bei extrazellulärem Dopamin während der verschiedenen Phasen der sexuellen Aktivität zwischen RHA- und RLA-Ratten im sexuell naiven und erlebten Zustand zeigt diese Studie auch unerwartet wichtige und hochsignifikante Unterschiede in der extrazellulären DOPAC-Konzentration zwischen den beiden römischen Rattenlinien vor (d. H Grundwerte) und nach dem Einführen der aufnahmefähigen Frau in den Paarungsapparat. Dementsprechend wurden bei RHA-Ratten Basalwerte von extrazellulärem DOPAC im mPFC-Dialysat etwa 2.6-fach höher als bei RLA-Ratten gefunden. Dieser Unterschied zwischen RHA- und RLA-Ratten trat bei den sexuell naiven und erlebten Bedingungen trotz sehr geringer Unterschiede in den Basalwerten von extrazellulärem Dopamin in den mPFC-Dialysaten auf, die aus den zwei römischen Rattenlinien unter diesen experimentellen Bedingungen erhalten wurden. Zusammengenommen könnten diese Unterschiede einen unterschiedlichen Dopaminumsatz auf der Ebene der mPFC zwischen den beiden Linien der römischen Ratte anzeigen. Dementsprechend spiegeln die DOPAC-Konzentrationen gewöhnlich die Menge an freigesetztem Dopamin wider, die dann durch dopaminerge Nervenendigungen wiedergewonnen und durch Monoaminooxydase (MAO; DOC) in DOPAC umgewandelt wird. Carlsson, 1975). Die bei RHA-Ratten gefundenen höheren basalen DOPAC-Konzentrationen legen daher nahe, dass im mPFC von RHA-Ratten höhere Dopaminmengen freigesetzt und durch dopaminerge Nervenendigungen wiedererlangt werden, z. B. eine höhere basale Aktivität des mesokortikalen dopaminergen Systems von RHA-Ratten im Vergleich zu RLA Ratten. Ein höherer mesokortikaler dopaminerger Tonus bei RHA-Ratten als bei RLA-Ratten wird auch durch die erhöhten extrazellulären Dopaminkonzentrationen gestützt, die während der sexuellen Aktivität im mPFC-Dialysat sowohl bei sexuell naiven als auch bei erfahrenen RHA-Ratten in Bezug auf die ihrer RLA-Kollegen gefunden wurden. In diesem Zusammenhang ist darauf hinzuweisen, dass ein höherer dopaminerger Tonus zumindest zum Teil für viele der unterschiedlichen und sogar entgegengesetzten Verhaltensmerkmale von RHA- und RLA-Ratten verantwortlich gemacht wird. Dementsprechend sind RHA-Ratten aktive Copers, sehr impulsive, Neuheits- und Sensationssucher und neigen zur Einnahme und zum Missbrauch mehrerer Klassen von Suchtmitteln, während RLA-Ratten reaktive Coper sind, hyperemotional und dazu neigen, depressive Symptome zu entwickeln (Zeier et al., 1978; Giorgi et al., 1994, 2003b, 2007; Corda et al., 1997, 2014; Escorihuela et al., 1999; Steimer und Driscoll, 2003; Lecca et al., 2004; Giménez-Llort et al., 2005; Carrasco et al., 2008; Fattore et al., 2009; Moreno et al., 2010; Coppens et al., 2012; Díaz-Morán et al., 2012; Sabariego et al., 2013; Manzo et al., 2014a,b; Oliveras et al., 2015), einschließlich der höheren sexuellen Motivation und einer besseren Kopulationsleistung von sexuell naiven und erfahrenen RHA-Ratten im Vergleich zu RHA-Ratten (Sanna et al., 2015). Der höhere Anstieg der Konzentrationen von extrazellulärem Dopamin im Dialysat aus dem mPFC von sexuell naiven und erfahrenen RHA-Ratten ähnelt den höheren extrazellulären Dopaminkonzentrationen, die im Dialysat des Nucleus Accumbens von sexuell naiven und erfahrenen RHA-Ratten in Bezug auf ihre RLA-Pendants gefunden wurden (Sanna et al., 2015). Bei Abweichung von der mPFC unterschieden sich die basalen Spiegel von extrazellulärem Dopamin und DOPAC im Dialysat des Nukleus Accumbens sowohl bei sexuell nicht vorkommenden als auch bei erfahrenen RHA- und RLA-Ratten nicht signifikant (Sanna et al., 2015). So kann der höhere mesolimbische dopaminerge Tonus im Nucleus Accumbens von sexuell naiven und erfahrenen RHA-Ratten nur durch die höheren extrazellulären Dopaminkonzentrationen in den Dialysaten aus den Nucleus Accumbens von RHA-Ratten im Vergleich zu RLA-Gegenstücken in Gegenwart des Empfängers abgeleitet werden weiblich und nicht durch eine unterschiedliche basale dopaminerge Aktivität, die durch die höheren und niedrigeren Basalspiegel der DOPAC-Konzentration bei RHA-Ratten bzw. RLA-Ratten nachgewiesen wurde, wie in der vorliegenden Studie im mPFC festgestellt wurde. Dies stimmt auch mit den Ergebnissen früherer Berichte überein, die zeigen, dass extrazelluläre Dopaminspiegel im Dialysat von mPFC von RHA-Ratten höher gefunden wurden als diejenigen von RLA-Ratten, während ähnliche Dopaminspiegel im Dialysat von der Hülle des Nucleus accumbens gefunden wurden von RHA- und RLA-Ratten unter verschiedenen experimentellen Bedingungen (D'Angio et al., 1988; Scatton et al., 1988; Willig et al., 1991; Giorgi et al., 2003a, 2007). Trotz der oben genannten Unterschiede zwischen mPFC und dem Nucleus accumbens scheint die sexuelle Erfahrung im mPFC länger anhaltende Erhöhungen des zeitlichen Musters der Dopaminfreisetzung in beiden römischen Rattenlinien zu bewirken, wenn von der sexuell naiven zu der erlebten Bedingung übergegangen wird, obwohl solche Erhöhungen auftreten waren bei RHA-Ratten normalerweise höher als bei RLA-Ratten. Dies unterscheidet sich etwas von dem, was im Nucleus Accumbens gefunden wurde, wo die sexuelle Erfahrung dazu neigte, extrazelluläres Dopamin bei RHA-Ratten auf den ersten Teil des Kopulationstests zu verschieben, während es im gesamten Kopulationstest bei RLA-Ratten (Sanna et al., 2015).
Nach unserer Kenntnis zeigt diese Studie auch zum ersten Mal, dass nicht nur extrazelluläres Dopamin, sondern auch extrazelluläre NA während der sexuellen Aktivität im Dialysat aus der mPFC von RHA- und RLA-Ratten zunimmt, wie dies bei Dopamin, aber auch in diesem Fall der Fall ist Unterschiede im Zusammenhang mit der römischen Rattenlinie und der sexuellen Erfahrung. Insbesondere im Unterschied zu den basalen Dopaminspiegeln, die im Dialysat der mPFC von sowohl RHA- als auch RLA-Ratten sehr ähnlich waren, waren die basalen Spiegel der extrazellulären NA im Dialysat aus der mPFC von RHA-Ratten signifikant höher (etwa 2,5-fach) ) als die von RLA-Ratten. Die Gründe für diese Unterschiede sind nicht bekannt, aber wie oben für Dopamin und DOPAC erörtert, können diese Ergebnisse darauf hindeuten, dass zumindest im mPFC-Kortex von RHA-Ratten im Vergleich zu RLA-Ratten ein höherer basaler noradrenerger Ton vorliegt. Ein solcher höherer noradrenerger Tonus kann auch an den unterschiedlichen und oft entgegengesetzten Verhaltensmerkmalen der RHA- und RLA-Ratten beteiligt sein, wie oben für Dopamin erörtert. Weitere Unterstützung für einen höheren noradrenergen Tonus bei RHA-Ratten im Vergleich zu RLA-Ratten im mPFC ergibt sich aus den Ergebnissen, die zeigen, dass die Unterschiede bei basalen extrazellulären NA-Spiegeln auch während der sexuellen Aktivität sowohl bei sexuell naiven als auch bei erlebten Zuständen, z. B. bei extrazellulären NA-Spiegeln, bestehen Das mPFC-Dialysat bei RHA-Ratten war bei Exposition gegenüber der unzugänglichen Frau und während des gesamten Kopulationszeitraums viel mehr als bei RLA-Ratten, bei denen die NA-Spiegel nur in den ersten 15-Minuten des Kopulationszeitraums anstiegen, woraufhin die NA-Spiegel wieder auf Basiswerte zurückgingen . Diese Veränderungen der extrazellulären NA-Spiegel wurden sowohl bei sexuell naiven als auch bei erkrankten Zuständen beobachtet, aber der Anstieg der NA-Spiegel war bei sexuell erfahrenen RHA- und RLA-Ratten höher als bei ihren sexuell naiven Kollegen. Sexuelle Erfahrungen induzieren somit offenbar eine weitere Potenzierung der noradrenergen Aktivität in der mPFC von RHA-Ratten und in geringerem Maße von RLA-Ratten, wie bereits für Dopamin diskutiert wurde. Die begleitenden höheren noradrenergen und dopaminergen Töne in der mPFC von RHA-Ratten im Vergleich zu RLA-Ratten verdienen einige Bemerkungen. In der Tat wurde berichtet, dass noradrenerge Aktivität in der mPFC die Freisetzung von Dopamin durch verschiedene Mechanismen beeinflussen kann (siehe z Carboni et al., 1990, 2006; Gresch et al., 1995; Westernik et al., 1998 und Referenzen darin). Eines davon hängt mit der Aktivität des NET zusammen, von dem gezeigt wurde, dass es Dopamin mit einer noch höheren Affinität bindet als NA für Synaptosomen, die aus Homogenaten des PFC erhalten wurden (Horn, 1973). Wenn dies in der mPFC vorkommen würde in vivoDopamin, das im mPFC freigesetzt wurde, konnte nicht nur von dopaminergen, sondern auch von noradrenergen Nervenendigungen mit einer Geschwindigkeit wieder aufgenommen werden, die sogar über der von NA liegt. Dies könnte wiederum zu einer erhöhten Freisetzung von Dopamin aus dopaminergen Endgruppen führen (z. B. zu einem erhöhten dopaminergen Tonus), um die aus dem synaptischen Spalt entfernte Dopaminmenge zu kompensieren; Daher könnte der höhere noradrenerge Ton, der bei RHA-Ratten gefunden wurde, zumindest teilweise zu dem höheren dopaminergen Ton beitragen, der im mPFC von RHA-Ratten im Vergleich zu RLA-Ratten gefunden wurde. Weitere Studien sind erforderlich, um diese Möglichkeit zu überprüfen. Insbesondere der in dieser Studie festgestellte Unterschied der noradrenergen Aktivität in der mPFC zwischen RHA- und RLA-Ratten könnte auch eine Rolle bei ihrer unterschiedlichen Reaktion auf eine antidepressive Behandlung spielen. Tatsächlich werden RHA-Ratten als Modell der Resilienz betrachtet und RLA-Ratten als Modell für die Anfälligkeit für Depressionen. Dementsprechend verbesserte eine akute oder chronische Behandlung mit Antidepressiva wie Desipramin, Fluoxetin und Chlorimipramin die Verhaltensreaktionen im erzwungenen Schwimmtest bei RLA-Ratten signifikant, ohne die Reaktionen von RHA-Ratten zu beeinflussen (Piras et al., 2010, 2014).
Schließlich bestätigt und erweitert diese Studie frühere Ergebnisse, die zeigen, dass der mPFC an der Kontrolle des Sexualverhaltens beteiligt ist, obwohl die genaue Rolle dieses Gehirnbereichs im Sexualverhalten noch lange nicht klar ist (Fernández-Guasti et al., 1994; Agmo und Villalpando, 1995; Agmo et al., 1995; Hernández-Gonzáles et al., 1998, 2007; Kakeyama et al., 2003; Balfour et al., 2006; Afonso et al., 2007; Davis et al., 2010; Febo, 2011). Vor kurzem wurde der selektive Zellabschuss in der mPFC während des Annäherungsverhaltens einer männlichen Ratte gegenüber einer unzugänglichen sexuell aufnahmefähigen Frau gezeigt, wobei ein einziges Aufnahmedemodell für die Aufnahme von Zellen verwendet wurde (Febo, 2011). Interessanterweise werden Neuronen, die während der ersten Exposition des Mannes nicht auf die unzugängliche aufnahmefähige Frau angesprochen haben, während der zweiten Exposition aktiv, als ob die vorherige Erfahrung plastische Veränderungen hervorrufen konnte, die zu einer Veränderung der Verhaltensreaktionen führten. Es wurde jedoch festgestellt, dass Läsionen mit Ibotensäure des mPFC nicht in der Lage waren, das sexuelle Verhalten männlicher Ratten bei einer sexuell aufnahmefähigen Frau zu ändern, noch konnte der Ausdruck einer konditionierten Ortspräferenz für die sexuelle Belohnung festgestellt werden. Die Fähigkeit zur Bildung einer konditionierten Abneigung gegen sexuelle Aktivität in Verbindung mit aversiven Stimuli wurde bei diesen verletzten Tieren jedoch vollständig aufgehoben (Davis et al., 2010). Dies legt nahe, dass die Aktivierung von mPFC während des Sexualverhaltens eine Rolle bei der Integration externer und interner Informationen zur Ausführung und Kontrolle zielorientierter Verhaltensweisen spielt und nicht als Ausdruck angeborener Reaktionen auf natürliche Verstärker (siehe Goto und Gnade, 2005). Wichtiger für diese Arbeit ist, dass mehrere Studien gezeigt haben, dass Gehirnbereiche, die an sexueller Motivation und an sexuellem Verhalten beteiligt sind, wie der Nucleus accumbens, der ventrale Tegmentbereich, der mediale preoptische Bereich, der Bettkern der Stria terminalis, die basolaterale Amygdala und der parvocelluläre subparafaskuläre Thalamuskern erhalten werden vom mPFC während der sexuellen Aktivität (siehe Balfour et al., 2006). Viele dieser Gehirnbereiche sind an einem komplexen neuronalen Kreislauf beteiligt, der an der Kontrolle des Sexualverhaltens beteiligt ist, von der sexuellen Motivation und der Belohnung bis zur sexuellen Leistungsfähigkeit. Dieser Kreislauf umfasst oxytozinergische Neuronen, die aus dem PVN des Hypothalamus (PVN) stammen und auf den ventralen Tegmentalbereich projizieren, den Nucleus accumbens, den Hippocampus, die Amygdala, die PFC, den Bettkern des Stria terminalis, die Medulla oblongata und das Rückenmark, das Mesolimbicum und das Rückenmark Neuronen, die vom ventralen Tegmentalbereich auf den Nucleus accumbens und PFC projizieren, incertohypothalamische dopaminerge Neuronen und glutamatergische Neuronen, die auf lokaler und systemischer Ebene in mehreren Bereichen des Kreislaufs beteiligt sind (siehe Melis und Argiolas, 1995, 2011; Melis et al., 2003, 2007, 2009, 2010; Succu et al., 2007, 2008, 2011). Die Zunahme von extrazellulärem Dopamin (aber auch von NA) in den Dialysaten aus dem mPFC, die während der sexuellen Aktivität zu sehen sind, könnte darauf hinweisen, dass der mPFC ein aktiver Teil dieses Kreislaufs ist, d. H. Mesokortikale dopaminerge Neuronen gemeinsam an der Kontrolle der sexuellen Aktivität beteiligt sind mit noradrenergen, mesolimbischen dopaminergen, oxytocinergischen und glutamatergen Neuronen, obwohl dies für die Expression sexuellen Verhaltens nicht unbedingt erforderlich erscheint (Davis et al., 2010). In Übereinstimmung mit dieser Hypothese zeigt diese Studie, dass die Unterschiede in der Dopamin- und NA-Freisetzung in der mPFC während der sexuellen Aktivität gleichzeitig mit den Unterschieden in der Anzahl der kontaktlosen Erektionen des Penis und Änderungen der Kopulationsparameter auftraten, mit einer höheren Freisetzung von Dopamin und NA während des Wachstums die appetitiven und konsumatorischen Phasen bezogen sich auf eine höhere sexuelle Motivation und bessere Kopulationsleistungen sowohl in den Linien der römischen Ratte als auch in den sexuell naiven und erlebten Zuständen.
Die vorstehende Diskussion basiert hauptsächlich auf der bekannten Zunahme von extrazellulärem Dopamin, die im Nucleus Accumbens von männlichen Ratten während der sexuellen Aktivität auftritt (Pfaus et al., 1990; Pleim et al., 1990; Pfaus und Phillips, 1991; Damma et al., 1992; Wenkstern et al., 1993). Dopamin und andere Neurotransmitter können jedoch unter anderen experimentellen Bedingungen, wie z. B. bei Stress oder bei der Bewältigung des MFC (und des Nucleus Accumbens), freigesetzt werden (Thierry et al., 1976; Fadda et al., 1978), die nicht unbedingt eng mit dem Sexualverhalten zusammenhängen. Man kann daher argumentieren, dass der Dopaminanstieg bei extrazellulärem Dopamin im mPFC (diese Studie) oder im Nucleus Accumbens (Sanna et al., 2015) bezieht sich eher auf den sekundären Stress oder die Bewältigung des Vorhandenseins und / oder der Interaktion mit der sexuell aufnahmefähigen Frau als auf die sexuelle Aktivität. Dies könnte bei RHA- und RLA-Ratten von Bedeutung sein, die deutlich unterschiedliche Bewältigungsstile und eine unterschiedliche Aktivierung der Hypothalamus-Hypophysen-Nebennierenachse als Reaktion auf aversive Zustände aufweisen (RLA-Ratten zeigen eine Aktivierung dieser Achse, die viel höher ist als die von RHA-Ratten; vgl Carrasco et al., 2008; Díaz-Morán et al., 2012). Dies erhöht auch die Möglichkeit, dass Stresshormone (z. B. Corticosteroide) die dopaminerge Aktivität im mPFC und in anderen Gehirnbereichen ebenfalls beeinflussen können. Tatsächlich sind RLA-Ratten reaktive Copers und zeigen ein durch Hypomotilität und Einfrieren charakterisiertes hyperemotionales Verhalten, während RHA-Ratten ein proaktives Bewältigungsverhalten zeigen, das darauf abzielt, die Kontrolle über den Stressor zu erlangen (Driscoll und Bättig, 1982; Willig et al., 1991; Escorihuela et al., 1999; Steimer und Driscoll, 2003; Giorgi et al., 2007). Obwohl es unmöglich ist, vollständig auszuschließen, dass dies bei sexuell naiven Ratten (die zuvor noch nie mit einer aufnahmefähigen Frau interagiert haben) und insbesondere bei sexuell naiven RLA-Ratten (siehe oben) auftreten kann, ist dies unwahrscheinlich. Unter unseren Versuchsbedingungen wird alles getan, um jeglichen Stress zu vermeiden (siehe Abschnitt „Materialien und Methoden“), und die Versuche sind so organisiert, dass die Männchen nicht sofort mit der Frau interagieren, sondern erst nach 30 Minuten Exposition gegenüber ihr , während dessen der gemessene Anstieg von Dopamin viel geringer ist als der, der während der sexuellen Interaktion auftritt. Wenn der Dopaminanstieg, der in der mPFC (und im Nucleus accumbens) von römischen Ratten gefunden wurde (sexuell naive RHA- und RLA-Ratten haben Grundwerte an extrazellulärem Dopamin im Dialysat aus der mPFC und dem Nucleus accumbens, sehr ähnlich), war dies wirklich zweitrangig Stress aufgrund oder Umgang mit dem Vorhandensein / der Interaktion mit dem Weibchen: (i) Der Dopaminanstieg wäre in der ersten Zeitspanne, in der die Männchen in Gegenwart des Weibchens und nicht später gebracht werden, viel höher gewesen. wie während der Kopulation gefunden; und (ii) es wird erwartet, dass der Dopaminanstieg nach dem Erwerb einer stabilen sexuellen Aktivität verschwindet oder stark verringert wird, dh wenn Lernprozesse (einschließlich der Bewältigung von Neuheiten) abgeschlossen sind und bei der Ausführung von Sexualität nur eine untergeordnete Rolle spielen Aktivität, während es im Gegensatz dazu weiterhin auftritt, wenn sexuelle Aktivität wiederholt wird. Mit anderen Worten, extrazelluläres Dopamin im mPFC (und im Nucleus accumbens) nimmt während der Kopulation immer zu, selbst nachdem sexuelles Verhalten gelernt wurde. Weitere Studien sind erforderlich, um die funktionelle Rolle dieses Anstiegs der Dopaminaktivität im mPFC (und im Nucleus accumbens; siehe Abschnitt „Einführung und Referenzen“ darin) zu klären.
Zusammenfassend zeigt diese Studie zum ersten Mal, dass die Anwesenheit einer sexuell aufnahmefähigen Frau und, noch mehr, zu einer Zunahme von extrazellulärem Dopamin und NA im Dialysat des mPFC von sexuell naiven (niemals sexuellen Reizen ausgesetzt) führt ) und sexuell erfahren (die fünf vorläufige Kopulationstests durchlaufen haben und stabile sexuelle Leistungen zeigen) RHA- und RLA-Ratten, die deutlich unterschiedliche Bewältigungsstile als Reaktion auf aversive Bedingungen und unterschiedliche Muster des Kopulationsverhaltens bei einer sexuell aufnahmefähigen Frau aufweisen. Dementsprechend wurden Dopamin- und NA-Konzentrationen im Dialysat von sexuell naiven und erfahrenen RHA-Ratten im Vergleich zu ihren RLA-Gegenstücken sowohl in der antizipatorischen als auch in der konsumatorischen Phase der sexuellen Aktivität höher gefunden. Diese Ergebnisse können zum Teil auf einen dopaminergen und noradrenergen Tonus im mPFC von RHA-Ratten zurückzuführen sein, der höher ist als der von RLA-Ratten, wie für Dopamin im Nucleus accumbens berichtet (Sanna et al., 2015). Darüber hinaus wurden extrazelluläres mPFC-Dopamin und NA in sexuell erfahrenen RHA und in geringerem Maße auch RLA-Ratten im Vergleich zu ihren sexuell naiven Gegenstücken in basalen Bedingungen sowie in den appetitlichen und konsumatorischen Phasen des Sexualverhaltens höher gefunden. Dies deutet darauf hin, dass sexuelle Erfahrungen plastische Prozesse induzieren, die die Dopamin- und NA-Neurotransmission in der mPFC weiter verstärken, wie sie für Dopamin im Nucleus accumbens beider Linien der römischen Ratte gefunden werden (Sanna et al., 2015). Die oben genannten Unterschiede in der dopaminergen und noradrenergen Neurotransmission in der mPFC der beiden römischen Linien können nicht nur in den verschiedenen Mustern des Sexualverhaltens eine Rolle spielen, sondern auch in den unterschiedlichen und oft entgegengesetzten Verhaltensmerkmalen, die diese beiden Rattenlinien kennzeichnen.
Autorenbeiträge
FS, AA, MRM, OG und MGC haben das Projekt entworfen. Die Daten von Sexualverhalten und Mikrodialyse-Experimenten wurden von FS und JB entworfen, durchgeführt und analysiert. MAP, OG und MGC haben römische Ratten ausgewählt und gezüchtet. FS, AA, MRM, OG und MGC betreuten die Studie. FS, AA, MRM, OG und MGC verfassten das Manuskript. Alle Autoren diskutierten die Ergebnisse und kommentierten das Manuskript.
Förderung
Diese Arbeit wurde teilweise durch Zuschüsse des italienischen Ministeriums für Universität und Forschung (MIUR) (Wissenschaftliche Unabhängigkeit junger Forscher, SIR 2014, Code-Nr. RBSI14IUX7) an FS von der Autonomen Region Sardinien (ARS) (LR 7 / 2007) unterstützt , "Förderung der wissenschaftlichen Forschung und technologischen Innovation in Sardinien", Europäischer Sozialfonds, 2007-2013, Projekt-Code-Nr. CRP-59842) an OG und von der Universität Cagliari an AA, MRM, FS, OG und MGC.
Interessenkonflikt
Die Autoren erklären, dass die Untersuchung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als möglicher Interessenkonflikt ausgelegt werden könnten.
Anerkennungen
Dr. Barbara Tuveri, Universität von Cagliari, für Tierhaltung und -pflege.
Bibliographie
Afonso, VM, Sison, M., Lovic, V., und Fleming, AS (2007). Mediale präfrontale Kortexläsionen bei der weiblichen Ratte beeinflussen das sexuelle und mütterliche Verhalten und ihre sequentielle Organisation. Verhalten Neurosc 121, 515-526. doi: 10.1037 / 0735-7044.121.3.515
Agmo, A. und Villalpando, A. (1995). Zentralnervöse Stimulanzien fördern das sexuelle Verhalten bei männlichen Ratten mit medialen präfrontalen Kortexläsionen. Gehirn Res. 696, 187–193. doi: 10.1016/0006-8993(95)00853-i
Agmo, A., Villalpando, A., Picker, Z. und Fernández, H. (1995). Läsionen des medialen präfrontalen Kortex und des Sexualverhaltens bei der männlichen Ratte. Gehirn Res. 696, 177–186. doi: 10.1016/0006-8993(95)00852-h
Argiolas, A. und Melis, MR (1995). Neuromodulation der Peniserektion: Überblick über die Rolle von Neurotransmittern und Neuropeptiden. Prog. Neurobiol. 47, 235–255. doi: 10.1016/0301-0082(95)00020-8
Argiolas, A. und Melis, MR (2005). Zentrale Kontrolle der Peniserektion: Rolle des paraventrikulären Kerns des Hypothalamus. Prog. Neurobiol. 76, 1-21. doi: 10.1016 / j.pneurobio.2005.06.002
Argiolas, A. und Melis, MR (2013). Neuropeptide und zentrale Kontrolle des Sexualverhaltens von der Vergangenheit bis zur Gegenwart: eine Überprüfung. Prog. Neurobiol. 108, 80-107. doi: 10.1016 / j.pneurobio.2013.06.006
Balfour, ME, Brown, JL, Yu, L. und Coolen, LM (2006). Mögliche Beiträge von Efferenzen aus dem medialen präfrontalen Kortex zur neuronalen Aktivierung nach sexuellem Verhalten bei männlichen Ratten. Neuroscience 137, 1259-1276. doi: 10.1016 / j.neuroscience.2005.11.013
Balfour, ME, Yu, L. und Coolen, LM (2004). Sexuelles Verhalten und sexuelle Umweltmerkmale aktivieren das mesolimbische System bei männlichen Ratten. Neuropsychopharmakologie 29, 718-730. doi: 10.1038 / sj.npp.1300350
Beloate, LN, Omrani, A., Adan, RA, Webb, IC und Coolen, LM (2016). Die Aktivierung der ventralen tegmentalen Dopaminzellen während des Sexualverhaltens der männlichen Ratte reguliert die Neuroplastizität und die Kreuzsensibilisierung von D-Amphetamin nach Geschlechtsabstinenz. J. Neurosci. 36, 9949-9961. doi: 10.1523 / JNEUROSCI.0937-16.2016
Berridge, K. und Robinson, T. (1998). Welche Rolle spielt Dopamin bei der Belohnung: hedonische Wirkung, Belohnungslernen oder Incentivierung? Gehirn Res. Rev. 28, 309–369. doi: 10.1016/s0165-0173(98)00019-8
Bignami, G. (1965). Auswahl nach hohen Raten und niedrigen Vermeidungsraten bei der Ratte. Anim. Verhalten 13, 221–227. doi: 10.1016/0003-3472(65)90038-2
Broadhurst, PL und Bignami, G. (1965). Korrelative Wirkungen der psychogenetischen Selektion: eine Studie der römischen Hoch- und Niedrigvermeidungsstämme von Ratten. Verhalten Res. Ther. 3, 273–280. doi: 10.1016/0005-7967(64)90033-6
E. Carboni, A. Silvagni, C. Vacca und G. Di Chiara (2006). Die kumulative Wirkung der Blockade von Noradrenalin und Dopamin-Trägern auf extrazelluläres Dopamin steigt in der Schale des Nucleus accumbens, im Bettkern der Stria terminalis und im präfrontalen Kortex. J. Neurochem. 96, 473-481. doi: 10.1111 / j.1471-4159.2005.03556.x
E. Carboni, GL Tanda, Frau R. und G. Di Chiara (1990). Die Blockade des Noradrenalin-Trägers erhöht die extrazellulären Dopaminkonzentrationen im präfrontalen Cortex: Nachweis der Aufnahme von Dopamin in vivo von noradrenergen Terminals. J. Neurochem. 55, 1067–1070. doi: 10.1111/j.1471-4159.1990.tb04599.x
Carlsson, A. (1975). "Rezeptorvermittelte Kontrolle des Dopaminstoffwechsels" in Prä- und post-synaptische Rezeptoren, Hrsg. E. Usdin und WE Bunney (New York, NY: Marcel Deker), 49 – 65.
Carrasco, J., Márquez, C., Nadal, R., Tobeña, A., Fernández-Teruel, A. und Armario, A. (2008). Charakterisierung der zentralen und peripheren Komponenten der Hypothalamus-Hypophysen-Nebennierenachse in den Inzuchtstämmen der römischen Ratte. Psychoneuroendokrinologie 33, 437-445. doi: 10.1016 / j.Stimme.2008.01.001
Coppens, CM, de Boer, SF, Steimer, T. und Koolhaas, JM (2012). Impulsivität und aggressives Verhalten bei römischen Hoch- und Niedrigvermeidungsratten: Grundlinienunterschiede und sozialer Stress bei Jugendlichen induzierten Veränderungen. Physiol. Verhalten 105, 1156 – 1160. doi: 10.1016 / j.physbeh.2011.12.013
MG Corda, D. Lecca, G. Piras, G. Di Chiara und O. Giorgi (1997). Biochemische Parameter der dopaminergen und GABAergen Neurotransmission im ZNS von römischen Hochvermeidungsratten und römischen Niedrigvermeidungsratten. Behav. Genet. 27, 527-536. doi: 10.1023 / A: 1021452814574
MG Corda, G. Piras, MA Piludu und O. Giorgi (2014). Unterschiedliche Auswirkungen des freiwilligen Ethanolverbrauchs auf den Dopaminausstoß im Nucleus accumbens von römischen Ratten mit hoher und niedriger Vermeidungsrate: eine Verhaltens- und Gehirnmikrodialyse-Studie. World J. Neurosci. 4, 279 – 292. doi: 10.4236 / wjns.2014.43031
Dahlstrom, A. und Fuxe, K. (1964). Nachweis für das Vorhandensein von Monoamin-haltigen Neuronen im zentralen Nervensystem. I. Demonstration von Monoaminen in den Zellkörpern von Hirnstammneuronen. Acta Physiol. Scand. Suppl. 62, 1-54.
G. Damsma, J. Pfaus, D. Wenkstern, A. Phillips und H. Fibiger (1992). Sexuelles Verhalten erhöht die Dopaminübertragung im Nucleus accumbens und im Striatum männlicher Ratten: Vergleich mit Neuheit und Fortbewegung. Verhalten Neurosc 106, 181-191. doi: 10.1037 / 0735-7044.106.1.181
D'Angio, M., Serrano, A., Driscoll, P. und Scatton, B. (1988). Stressbelastende Umweltreize erhöhen die extrazellulären DOPAC-Spiegel im präfrontalen Kortex hypoemotionaler (römischer Hochvermeidung), nicht jedoch hyperemotionaler (römischer Niedrigvermeidungsratten). ein in vivo Voltammetrische Studie. Gehirn Res. 451, 237–247. doi: 10.1016/0006-8993(88)90768-8
Davis, JF, Loos, M., Di Sebastiano, AR, Brown, JL, Lehman, MN, und Coolen, LM (2010). Läsionen des medialen präfrontalen Kortex führen bei männlichen Ratten zu unpassendem Sexualverhalten. Biol. Psychiatrie 67, 1199-1204. doi: 10.1016 / j.biopsych.2009.12.029
S. Díaz-Morán, M. Palència, C. Mont-Cardona, T. Cañete, G. Blázquez, E. Martínez-Membrives et al. (2012). Bewältigungsstil und Stresshormonreaktionen bei genetisch heterogenen Ratten: Vergleich mit den römischen Rattenstämmen. Verhalten Gehirn Res. 228, 203-210. doi: 10.1016 / j.bbr.2011.12.002
Driscoll, P. und Bättig, K. (1982). "Verhaltens -, emotionale und neurochemische Profile von Ratten, die aufgrund extremer Unterschiede bei der aktiven Zweiwegevermeidung ausgewählt wurden" Genetik des Gehirnsed. I. Lieblich (Amsterdam: Elsevier), 95 – 123.
Dunlop, BW und Nemeroff, CB (2007). Die Rolle von Dopamin in der Pathophysiologie von Depressionen. Bogen. Gen. Psychiatrie 64, 327-337. doi: 10.1001 / archpsy.64.3.327
Escorihuela, RM, Fernández-Teruel, A., Gil, L., Aguilar, R., Tobeña, A. und Driscoll, P. (1999). Inbred römische Ratten mit hohem und niedrigem Ausmass: Unterschiede bei Angstzuständen, Suche nach Neuheiten und Verhalten in der Shuttlebox. Physiol. Verhalten 67, 19–26. doi: 10.1016/S0031-9384(99)00064-5
Everitt, BJ (1990). Sexuelle Motivation: Eine neuronale und Verhaltensanalyse der Mechanismen, die den Appetitivitäts- und Kopulationsreaktionen männlicher Ratten zugrunde liegen. Neurosc Biobehav. Rev. 14, 217–232. doi: 10.1016/s0149-7634(05)80222-2
Everitt, BJ und Robbins, TW (2005). Neuronale Verstärkungssysteme für Drogenabhängigkeit: von Handlungen über Gewohnheiten zu Zwängen. Nat. Neurosc 8, 1481-1489. doi: 10.1038 / nn1579
F. Fadda, A. Argiolas, MR Melis, AH Tissari, PL Onali und Gessa, GL (1978). Stressinduzierter Anstieg der 3,4-Dihydroxyphenylessigsäure (DOPAC) in der Großhirnrinde und n.accumbens: Umkehrung durch Diazepam. Leben Sci. 23, 2219–2224. doi: 10.1016/b978-0-08-023768-8.51934-4
Fattore, L., Piras, G., Corda, MG und Giorgi, O. (2009). Die römischen Rattenlinien mit hohem und niedrigem Vermeidungsgrad unterscheiden sich in Bezug auf den Erwerb, die Aufrechterhaltung, das Aussterben und die Wiedereinsetzung intravenöser Kokainselbstverabreichung. Neuropsychopharmakologie 34, 1091-1101. doi: 10.1038 / npp.2008.43
Febo, M. (2011). Präfrontaler Zellbrand bei männlichen Ratten während der Annäherung an sexuell aufnahmefähige Frauen: Wechselwirkungen mit Kokain. Synapse 65, 271-277. doi: 10.1002 / syn.20843
A. Fernández-Guasti, I. Omaña-Zapata, M. Luján und M. Condés-Lara (1994). Aktionen der Ischiasnervenligatur auf das Sexualverhalten sexuell erfahrener und unerfahrener männlicher Ratten: Auswirkungen der Frontpoldekortikation. Physiol. Verhalten 55, 577–581. doi: 10.1016/0031-9384(94)90119-8
Fernández-Teruel, A., Driscoll, P., Gil, L., Aguilar, R., Tobeña, A. und Escorihuela, RM (2002). Dauerhafte Auswirkungen der Umweltanreicherung auf die Suche nach Neuheit, Saccharin- und Ethanolzufuhr in zwei Rattenlinien (RHA / Verh und RLA / Verh), die sich in ihrem Anreizverhalten unterscheiden. Pharmacol. Biochem. Verhalten 73, 225–231. doi: 10.1016/s0091-3057(02)00784-0
L. Giménez-Llort, T. Cañete, M. Guitart-Masip, A. Fernández-Teruel und A. Tobeña (2005). Zwei unterscheidbare Apomorphin-induzierte Phänotypen bei römischen Ratten mit hohem und niedrigem Ausmass .. Physiol. Verhalten 86, 458 – 466. doi: 10.1016 / j.physbeh.2005.07.021
Giorgi, O., Lecca, D., Piras, G. und Corda, MG (2005). Differenzielle Aktivierung der Dopaminfreisetzung im Kern und Schalenkern nach akuten oder wiederholten Amphetamin-Injektionen: eine vergleichende Studie in den römischen Rattenlinien mit hohem oder niedrigem Ausmass. Neuroscience 135, 987-998. doi: 10.1016 / j.neuroscience.2005.06.075
Giorgi, O., Lecca, D., Piras, G., Driscoll, P. und Corda, MG (2003a). Dissoziation zwischen mesokortikaler Dopaminfreisetzung und Angstverhalten in zwei psychogenetisch ausgewählten Linien von Ratten, die sich in Bewältigungsstrategien gegenüber aversiven Bedingungen unterscheiden. EUR. J. Neurosci. 17, 2716-2726. doi: 10.1046 / j.1460-9568.2003.02689.x
Giorgi, O., Piras, G., Lecca, D., Hansson, S., Driscoll, P. und Corda, MG (2003b). Differentielle neurochemische Eigenschaften der zentralen serotonergen Übertragung bei römischen Ratten mit hohem oder niedrigem Ausmass. J. Neurochem. 86, 422-431. doi: 10.1046 / j.1471-4159.2003.01845.x
O. Giorgi, M. Orlandi, M. Escorihuela, P. Driscoll, D. Lecca und D. Corda (1994). GABAergetische und dopaminerge Übertragung im Gehirn von römischen Hochvermeidungsratten und römischen Niedrigvermeidungsratten. Gehirn Res. 638, 133–138. doi: 10.1016/0006-8993(94)90642-4
Giorgi, O., Piras, G. und Corda, MG (2007). Die psychogenetisch ausgewählten römischen Rattenlinien mit hohem und niedrigem Vermeidungsgrad: Ein Modell zur Untersuchung der individuellen Anfälligkeit für Drogenabhängigkeit. Neurosc Biobehav. Rev. 31, 148-163. doi: 10.1016 / j.neubiorev.2006.07.008
Goto, Y. und Grace, AA (2005). Dopaminerge Modulation des limbischen und kortikalen Triebs des Nucleus Accumbens zielgerichteten Verhaltens. Nat. Neurosc 8, 805-812. doi: 10.1038 / nn1471
Gresch, PJ, Sved, AF, Zigmond, MJ und Finlay, JM (1995). Lokaler Einfluss von endogenem Noradrenalin auf extrazelluläres Dopamin im medialen präfrontalen Cortex der Ratte. J. Neurochem. 65, 111-116. doi: 10.1046 / j.1471-4159.1995.65010111.x
Hernández-Gonzáles, M., Guevara, MA, Cervantes, M., Morali, G. und Corsi-Cabrera, M. (1998). Charakteristische Frequenzbereiche des kortiko-frontalen EEGs während der sexuellen Interaktion der männlichen Ratte als Ergebnis einer faktoriellen Analyse. J. Physiology 92, 43–50. doi: 10.1016/s0928-4257(98)80022-3
Hernández-Gonzáles, M., Prieto-Beracoechea, Kalifornien, Arteaga-Silva, M. und Guevara, MA (2007). Unterschiedliche Funktionalität des medialen und orbitalen präfrontalen Kortex während einer sexuell motivierten Aufgabe bei Ratten. Physiol. Verhalten 90, 450 – 458. doi: 10.1016 / j.physbeh.2006.10.006
Horn, AS (1973). Struktur-Aktivitäts-Beziehungen für die Hemmung der Katecholaminaufnahme von noradrenergen und dopaminergen Neuronen in Rattenhirnhomogenaten in Synaptosomen. Br. J. Pharmacol. 47, 332–338. doi: 10.1111/j.1476-5381.1973.tb08331.x
Hull, EM, Du, J., Lorrain, DS und Matuszewich, L. (1995). Extrazelluläres Dopamin im medialen präoperativen Bereich: Auswirkungen auf die sexuelle Motivation und hormonelle Kontrolle der Kopulation. J. Neurosci. 15, 7465-7471.
EM Hull, DS Lorrain, Du, J., Matuszewich, L., Lumley, LA, Putnam, SK, et al. (1999). Hormon-Neurotransmitter-Interaktionen bei der Kontrolle des Sexualverhaltens. Verhalten Gehirn Res. 105, 105–116. doi: 10.1016/s0166-4328(99)00086-8
Hull, EM, Weber, MS, Eaton, RC, Dua, R., Markowski, VP, Lumley, L., et al. (1991). Dopaminrezeptoren im ventralen Tegmentbereich beeinflussen die motorischen, aber nicht die motivierenden oder reflexiven Komponenten der Kopulation bei männlichen Ratten. Gehirn Res. 554, 72–76. doi: 10.1016/0006-8993(91)90173-S
Ikemoto, S. und Panksepp, J. (1999). Die Rolle des Nukleus accumbens Dopamin im motivierten Verhalten: eine einigende Interpretation mit besonderem Bezug zur Belohnungssuche. Gehirn Res. Rev. 31, 6–41. doi: 10.1016/S0165-0173(99)00023-5
M. Kakeyama, H. Sone, Y. Miyabara und C. Tohyama (2003). Die perinatale Exposition gegenüber 2,3,7,8-Tetrachlordibenzo-p-dioxin verändert die aktivitätsabhängige Expression von BDNF-mRNA im Neocortex und das Sexualverhalten männlicher Ratten im Erwachsenenalter. Neurotoxikologie 24, 207–217. doi: 10.1016/S0161-813x(02)00214-0
Lecca, D., Piras, G., Driscoll, P., Giorgi, O. und Corda, MG (2004). Eine differenzierte Aktivierung des Dopaminausstoßes in der Hülle und im Kern des Nucleus accumbens hängt mit den motorischen Reaktionen auf Suchtmedikamente zusammen: einer Gehirndialysestudie bei römischen Ratten mit hohem oder niedrigem Ausmass. Neuropharmacology 46, 688-699. doi: 10.1016 / j.neuropharm.2003.11.011
Manzo, L., Gómez, MJ, Callejas-Aguilera, JE, Donaire, R., Sabariego, M., Fernández-Teruel, A., et al. (2014a). Beziehung zwischen Ethanolpräferenz und Sensation / Suche nach Neuem. Physiol. Verhalten 133, 53 – 60. doi: 10.1016 / j.physbeh.2014.05.003
Manzo, L., Gómez, MJ, Callejas-Aguilera, JE, Fernández-Teruel, A., Papini, MR und Torres, C. (2014b). Anti-Angst-Selbstmedikation durch Anreizverlust bei Ratten. Physiol. Verhalten 123, 86 – 92. doi: 10.1016 / j.physbeh.2013.10.002
M. Masana, A. Bortolozzi und F. Artigas (2011). Selektive Verbesserung der mesokortikalen dopaminergen Übertragung durch noradrenerge Medikamente: therapeutische Möglichkeiten bei Schizophrenie. Int. J. Neuropsychopharmacol. 14, 53-68. doi: 10.1017 / s1461145710000908
Meisel, RL und Sachs, BD (1994). "Die Physiologie des männlichen Sexualverhaltens" in Die Physiologie der FortpflanzungVol. 2, 2nd Edn., Herausgeber E. Knobil und J. Neil (New York, NY: Raven Press), 3-96.
Melis, MR und Argiolas, A. (1995). Dopamin und Sexualverhalten. Neurosc Biobehav. Rev. 19, 19–38. doi: 10.1016/0149-7634(94)00020-2
Melis, MR und Argiolas, A. (2011). Zentrale Kontrolle der Erektion des Penis: eine erneute Untersuchung der Rolle von Oxytocin und seiner Wechselwirkung mit Dopamin und Glutaminsäure bei männlichen Ratten. Neurosc Biobehav. Rev. 35, 939-955. doi: 10.1016 / j.neubiorev.2010.10.014
Melis, MR, Melis, T., Cocco, C., Succu, S., Sanna, F., Pillolla, G., et al. (2007). Oxytocin, das in den ventralen tegmentalen Bereich injiziert wird, induziert die Erektion des Penis und erhöht extrazelluläres Dopamin im Nucleus accumbens und Paraventricularnucleus des Hypothalamus männlicher Ratten. EUR. J. Neurosci. 26, 1026-1035. doi: 10.1111 / j.1460-9568.2007.05721.x
Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., et al. (2010). Oxytocin induziert die Erektion des Penis, wenn es in das ventrale Subiculum injiziert wird: die Rolle von Stickstoffmonoxid und Glutaminsäure. Neuropharmacology 58, 1153-1160. doi: 10.1016 / j.neuropharm.2010.02.008
Melis, MR, Succu, S., Mascia, MS, Cortis, L. und Argiolas, A. (2003). Extrazelluläres Dopamin nimmt im paraventrikulären Kern von männlichen Ratten während der sexuellen Aktivität zu. EUR. J. Neurosci. 17, 1266-1272. doi: 10.1046 / j.1460-9568.2003.02558.x
Melis, MR, Succu, S., Sanna, F., Boi, A. und Argiolas, A. (2009). Oxytocin, das in das ventrale Subiculum oder den posteromedialen kortikalen Kern der Amygdala injiziert wird, induziert die Erektion des Penis und erhöht die extrazellulären Dopaminspiegel im Nucleus accumbens von männlichen Ratten. EUR. J. Neurosci. 30, 1349-1357. doi: 10.1111 / j.1460-9568.2009.06912.x
Moreno, M., Cardona, D., Gómez, MJ, Sánchez-Santed, F., Tobeña, A., Fernández-Teruel, A., et al. (2010). Charakterisierung der Impulsivität in den römischen Rattenstämmen mit hohem und niedrigem Ausmass: Verhaltens- und neurochemische Unterschiede. Neuropsychopharmakologie 35, 1198-1208. doi: 10.1038 / npp.2009.224
Oliveras, I., Río-Álamos, C., Cañete, T., Blázquez, G., Martínez-Membrives, E., Giorgi, O., et al. (2015). Die Prepulse-Hemmung prognostiziert die Leistung des räumlichen Arbeitsgedächtnisses bei römischen Inzucht-Ratten mit hohem und niedrigem Vermeidungsgrad und bei genetisch heterogenen NIH-HS-Ratten: Relevanz für die Untersuchung präoperativer und kognitiver Anomalien bei Schizophrenie. Vorderseite. Verhalten Neurosc 9: 213. doi: 10.3389 / fnbeh.2015.00213
Paxinos, G. und Watson, C. (2004). Das Rattengehirn in stereotaktischen Koordinaten, 4th Edn, New York: Akademische Presse.
Pfaus, JG (2010). Dopamin: Männchen dabei helfen, sich mindestens 200 Millionen Jahre lang zu paaren: theoretischer Kommentar zu Kleitz-Nelson et al. (2010). Verhalten Neurosc 124, 877-880. doi: 10.1037 / a0021823
Pfaus, JG, Damsma, G., Nomikos, GG, Wenkstern, DG, Blaha, CD, Phillips, AG, et al. (1990). Sexuelles Verhalten verbessert die zentrale Dopaminübertragung bei männlichen Ratten. Gehirn Res. 530, 345–348. doi: 10.1016/0006-8993(90)91309-5
Pfaus, JG und Everitt, BJ (1995). "Die Psychopharmakologie des Sexualverhaltens" in Psychopharmakologie: Die vierte Generation des Fortschritts, Herausgeber FE Bloom und DJ Kupfer (New York, NY: Raven Press), 742 – 758.
Pfaus, JG und Phillips, AG (1991). Die Rolle von Dopamin bei antizipatorischen und konsumatorischen Aspekten des Sexualverhaltens bei männlichen Ratten. Verhalten Neurosc 105, 727-747. doi: 10.1037 / 0735-7044.105.5.727
G. Piras, O. Giorgi und MG MG (2010). Auswirkungen von Antidepressiva auf die Leistung im erzwungenen Schwimmtest von zwei psychogenetisch ausgewählten Rattenlinien, die sich in den Bewältigungsstrategien gegenüber aversiven Bedingungen unterscheiden. Psychopharmakologie 211, 403–414. doi: 10.1007/s00213-010-1904-x
G. Piras, Piludu, MA, Giorgi, O. und Corda, MG (2014). Auswirkungen von chronischen Antidepressiva-Behandlungen in einem mutmaßlichen genetischen Modell der Anfälligkeit (römische Ratten mit geringer Vermeidung) und Resistenz (römische Ratten mit hoher Vermeidung) gegen stressinduzierte Depressionen. Psychopharmakologie 231, 43–53. doi: 10.1007/s00213-013-3205-7
Pitchers, KK, Frohmader, KS, Vialou, V., Mouzon, K., Nestler, EJ, Lehman, MN, et al. (2010). ΔFosB im Nucleus Accumbens ist entscheidend für die Verstärkung der sexuellen Belohnung. Gene Gehirn Behav. 9, 831–840. doi: 10.1111/j.1601-183X.2010.00621.x
Pitchers, KK, Coppens, CM, Beloate, LN, Fuller, J., Van, S., Frohmader, KS, et al. (2014). Die endogene Opioid-induzierte Neuroplastizität von dopaminergen Neuronen im ventralen Tegmentbereich beeinflusst die natürliche und die Opiatbelohnung. J. Neurosci. 34, 8825-8836. doi: 10.1523 / JNEUROSCI.0133-14.2014
Pitchers, KK, Vialou, V., Nestler, EJ, Laviolette, SR, Lehman, MN, und Coolen, LM (2013). Natürliche und medikamentöse Belohnungen wirken auf übliche neuronale Plastizitätsmechanismen mit ΔFosB als Schlüsselmediator. J. Neurosci. 33, 3434-3442. doi: 10.1523 / JNEUROSCI.4881-12.2013
E. Pleim, J. Matochik, R. Barfield und S. Auerbach (1990). Korrelation der Dopaminfreisetzung im Nucleus Accumbens mit männlichem Sexualverhalten bei Ratten. Gehirn Res. 524, 160–163. doi: 10.1016/0006-8993(90)90507-8
Robbins, TW und Arnsten, AFT (2009). Die Neuropsychopharmakologie der Fronto-Exekutivfunktion: monoaminerge Modulation. Ann. Rev. Neurosci. 32, 267 – 287. doi: 10.1146 / annurev.neuro.051508.135535
M. Sabariego, I. Morón, M. Gómez, R. Donaire, A. Tobeña, A. Fernández-Teruel et al. (2013). Incentive-Verlust und Hippocampus-Genexpression in Inzucht-Ratten mit hohem RHA-I- und RLA-I-Ratten. Verhalten Gehirn Res. 257, 62-70. doi: 10.1016 / j.bbr.2013.09.025
Sachs, BD (2000). Kontextuelle Ansätze für die Physiologie und Klassifizierung von Erektionsfunktionen, erektiler Dysfunktion und sexueller Erregung. Neurosc Biobehav. Rev. 24, 541–560. doi: 10.1016/S0149-7634(00)00022-1
Sachs, BD, Akasofu, K., Citro, JK, Daniels, SB und Natoli, JH (1994). Die berührungslose Stimulation von Brunstweibchen bewirkt bei Ratten eine Erektion des Penis. Physiol. Verhalten 55, 1073–1079. doi: 10.1016/0031-9384(94)90390-5
Sachs, BD und Barfield, RJ (1976). Funktionsanalyse des maskulinen Kopulationsverhaltens bei der Ratte. Adv. Zucht. Behav. 7, 91–154. doi: 10.1016/s0065-3454(08)60166-7
Salamone, JD, Pardo, M., Yohn, SE, López-Cruz, L., San Miguel, N. und Correa, M. (2016). Mesolimbic Dopamin und die Regulierung motivierten Verhaltens. Curr. Oben. Verhalten Neurosc 27, 231–257. doi: 10.1007/7854_2015_383
Sanna, F., Corda, MG, Melis, MR, Piludu, MA, Giorgi, O., und Argiolas, A. (2014a). Männliche römische Hoch- und Niedrigvermeidungsratten weisen unterschiedliche Muster des Kopulationsverhaltens auf: Vergleich mit Sprague-Dawley-Ratten. Physiol. Verhalten 127, 27 – 36. doi: 10.1016 / j.physbeh.2014.01.002
Sanna, F., Piludu, MA, Corda, MG, Argiolas, A., Giorgi, O., und Melis, MR (2014b). Dopamin ist an den unterschiedlichen Mustern des Kopulationsverhaltens von römischen Hoch- und Niedrigvermeidungsratten beteiligt: Studien mit Apomorphin und Haloperidol. Pharmacol. Biochem. Verhalten 124, 211 – 219. doi: 10.1016 / j.pbb.2014.06.012
Sanna, F., Piludu, MA, Corda, MG, Melis, MR, Giorgi, O., und Argiolas, A. (2015). Beteiligung von Dopamin an den Unterschieden im Sexualverhalten zwischen römischen Hoch- und Niedrigvermeidungsratten: eine intrazerebrale Mikrodialyse-Studie. Verhalten Gehirn Res. 281, 177-186. doi: 10.1016 / j.bbr.2014.12.009
B. Scatton, M. D'Angio, P. Driscoll und A. Serrano (1988). Ein in vivo Voltammetrische Studie zur Reaktion mesokortikaler und mesoakkumbens dopaminerger Neuronen auf Umgebungsreize bei Rattenstämmen mit unterschiedlichem Emotionalitätsgrad. Ann. NY Acad. Sci. 537, 124–137. doi: 10.1111/j.1749-6632.1988.tb42101.x
Steimer, T. und Driscoll, P. (2003). Unterschiedliche Stressreaktionen und Bewältigungsstile bei psychogenetisch ausgewählten Ratten mit hoher RHA- und RLA-Vermeidung: Verhaltens-, neuroendokrine und entwicklungspolitische Aspekte. Stress 6, 87-100. doi: 10.1080 / 1025389031000111320
Succu, S., Sanna, F., Argiolas, A. und Melis, MR (2011). In das ventrale Subculum des Hippocampus injiziertes Oxytocin induziert bei männlichen Ratten die Erektion des Penis, indem es die glutamatergische Neurotransmission im ventralen Tegmentbereich erhöht. Neuropharmacology 61, 181-188. doi: 10.1016 / j.neuropharm.2011.03.026
Succu, S., Sanna, F., Cocco, C., Melis, T., Boi, A., Ferri, GL, et al. (2008). Oxytocin induziert die Erektion des Penis, wenn es in den ventralen Tegmentbereich von männlichen Ratten injiziert wird: die Rolle von Stickstoffmonoxid und von cyclischem GMP. EUR. J. Neurosci. 28, 813-821. doi: 10.1111 / j.1460-9568.2008.06385.x
S. Succu, F. Sanna, T. Melis, A. Boi, A. Argiolas und MR MR Melis (2007). Die Stimulierung von Dopaminrezeptoren im paraventrikulären Kern des Hypothalamus männlicher Ratten induziert die Erektion des Penis und erhöht das extrazelluläre Dopamin im Nucleus accumbens: Beteiligung von zentralem Oxytocin. Neuropharmacology 52, 1034-1043. doi: 10.1016 / j.neuropharm.2006.10.019
Thierry, AM, Tassin, JP, Blanc, G. und Glowinski, J. (1976). Selektive Aktivierung des mesokortikalen DA-Systems durch Stress. Natur 263, 242-244. doi: 10.1038 / 263242a0
Wenkstern, D., Pfaus, J. und Fibiger, H. (1993). Die Dopaminübertragung nimmt im Nucleus Accumbens von männlichen Ratten während der ersten Exposition gegenüber sexuell aufnahmefähigen weiblichen Ratten zu. Gehirn Res. 618, 41–46. doi: 10.1016/0006-8993(93)90426-N
Westernik, BHC, De Boer, P., De Vries, JB und Long, S. (1998). Antipsychotika induzieren ähnliche Wirkungen auf die Freisetzung von Dopamin und Noradrenalin im medialen präfrontalen Kortex des Rattenhirns. EUR. J. Pharmacol. 361, 27–33. doi: 10.1016/s0014-2999(98)00711-0
Willig, F., M'Harzi, M., Bardelay, C., Viet, D. und Delacour, J. (1991). Römische Stämme als psychogenetisches Modell zur Untersuchung des Arbeitsgedächtnisses: Verhaltens- und biochemische Daten. Pharmacol. Biochem. Verhalten 40, 7–16. doi: 10.1016/0091-3057(91)90313-q
Schlüsselwörter: Sexualverhalten, Dopamin, Noradrenalin, mPFC, Mikrodialyse, RHA- und RLA-Ratten
Zitieren: Sanna F, Bratzu J, Piludu MA, Corda MG, Melis MR, Giorgi O und Argiolas A (2017), Dopamin, Noradrenalin und Unterschiede im sexuellen Verhalten zwischen römischen Ratten mit hoher und niedriger Avoidance: Eine Mikrodialysestudie im medialen präfrontalen Cortex . Vorderseite. Behav. Neurosci. 11: 108. doi: 10.3389 / fnbeh.2017.00108
Erhalten: 22 Dezember 2016; Akzeptiert: 19 darf 2017;
Veröffentlicht: 07 Juni 2017.
 Fabrizio Sanna
Fabrizio Sanna Jessica Bratzu
Jessica Bratzu Maria A. Piludu
Maria A. Piludu Maria G. Corda
Maria G. Corda Maria R. Melis
Maria R. Melis Osvaldo Giorgi
Osvaldo Giorgi Antonio Argiolas
Antonio Argiolas