KOMMENTARE: Ein Rückblick des Spitzenforschers auf Fettleibigkeit und Nahrungssucht.
Volume 69, Ausgabe 4, 24 Februar 2011, Seiten 664-679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Bewertung
Paul J. Kenny1, ,
1 Labor für Verhaltens- und Molekulare Neurowissenschaften, Abteilung für Molekulare Therapeutika, The Scripps Research Institute, Jupiter, FL 33458, USA
________________________________________
Nahrung wird konsumiert, um das Energiegleichgewicht auf homöostatischem Niveau zu halten. Darüber hinaus wird schmackhaftes Essen wegen seiner hedonischen Eigenschaften unabhängig vom Energiestatus konsumiert. Ein solcher belohnungsbedingter Konsum kann dazu führen, dass die Kalorienzufuhr die Anforderungen übersteigt, und er wird als Hauptursache für die rapide Zunahme der Fettleibigkeit in den Industrieländern angesehen. Verglichen mit homöostatischen Mechanismen der Fütterung ist viel weniger darüber bekannt, wie hedonische Systeme im Gehirn die Nahrungsaufnahme beeinflussen. Interessanterweise kann übermäßiger Konsum von schmackhafter Nahrung neuroadaptive Reaktionen in Gehirn-Belohnungsschaltungen auslösen, die Drogen ähnlich sind. Darüber hinaus können ähnliche genetische Schwachstellen in Belohnungssystemen des Gehirns die Prädisposition für Drogenabhängigkeit und Fettleibigkeit erhöhen. Hier werden die jüngsten Fortschritte in unserem Verständnis der Schaltkreise des Gehirns, die hedonische Aspekte des Fressverhaltens regulieren, überprüft. Auch neue Erkenntnisse, die darauf hindeuten, dass Adipositas und Drogensucht gemeinsame hedonische Mechanismen haben, werden ebenfalls in Betracht gezogen.
________________________________________
Haupttext
"Es gibt keine aufrichtigere Liebe als die Liebe zum Essen."
-George Bernard Shaw
Einleitung
Fettleibigkeit, definiert als Body Mass Index (BMI) von> 30, ist eine Erkrankung, bei der die Adipositas ungewöhnlich hoch ist und aus Hyperphagie oder verminderter Stoffwechselrate resultieren kann (O'Rahilly, 2009). Übermäßige Adipositas ist ein Hauptrisikofaktor für Herz-Kreislauf-Erkrankungen, Krebs, Typ-2-Diabetes und stimmungsbedingte Störungen, wobei übergewichtige Personen häufig unter sozialer Stigmatisierung leiden ([Bean et al., 2008], [Centers for Disease Control and Prevention, 2009]). und [Luppino et al., 2010]). Nach Angaben des Center for Disease Control (CDC) beliefen sich die Ausgaben für die Gesundheitsversorgung im Zusammenhang mit Fettleibigkeit in den USA zwischen 1998 und 2000 auf rund 213 Milliarden US-Dollar. Darüber hinaus können 300,000 Todesfälle in den USA pro Jahr auf Krankheiten im Zusammenhang mit Übergewicht und Adipositas zurückgeführt werden (Allison et al., 1999), wobei Adipositas die zweithäufigste Ursache für vermeidbare Todesfälle nach dem Tabakkonsum ist. Trotzdem steigt die Prävalenz von Fettleibigkeit in westlichen Gesellschaften weiterhin dramatisch an. Aktuelle Schätzungen gehen davon aus, dass mehr als 30% der Erwachsenen in den USA fettleibig sind (Flegal et al., 2010).
Die meisten Konzeptualisierungen der Fütterungsregulation schlagen vor, dass zwei parallele Systeme interagieren, um die Nahrungsaufnahme zu beeinflussen ([Hommel et al., 2006], [Lutter und Nestler, 2009] und [Morton et al., 2006]). Das homöostatische System umfasst hormonelle Regulatoren von Hunger, Sättigung und Adipositas, wie Leptin, Ghrelin und Insulin, die auf die Schaltkreise des Hypothalamus und des Hirnstamms einwirken, um die Fütterung zu stimulieren oder zu hemmen, um ein angemessenes Niveau der Energiebilanz aufrechtzuerhalten. Funktionsstörungen in Komponenten des homöostatischen Systems, wie angeborener Leptinmangel, können zu einem anhaltenden positiven Energiehaushalt und zur Entwicklung von Fettleibigkeit führen ([Campfield et al., 1995], [Halaas et al., 1995] und [Pelleymounter] et al., 1995]). Die Mechanismen, durch die hormonelle Regulatoren von Hunger und Sättigung auf Hypothalamus- und Hirnstammschaltungen einwirken, um die Energiehomöostase aufrecht zu erhalten, wurden an anderer Stelle ausführlich beschrieben, und Leser, die sich für dieses Thema interessieren, werden auf die vielen exzellenten Reviews zu diesem Thema verwiesen (z. B. [Abizaid et al., 2006a] und [Gao und Horvath, 2007]).
Neben den Stoffwechselsystemen spielen auch Gehirnbelohnungssysteme eine wichtige Rolle für das Fütterungsverhalten ([Lutter und Nestler, 2009] und [Saper et al., 2002]). Im Allgemeinen werden mild schmeckende Lebensmittel nicht zu viel gegessen, wohingegen schmackhafte Lebensmittel häufig auch nach Erfüllung des Energiebedarfs konsumiert werden. Der einfache Zugang zu schmackhaften, energiedichten Nahrungsmitteln wird als ein Hauptrisikofaktor für Fettleibigkeit in der Umwelt angesehen (Volkow und Wise, 2005), und der übermäßige Konsum von schmackhaften Nahrungsmitteln wird als ein Hauptfaktor angesehen, der zum jüngsten Anstieg der Fettleibigkeit beiträgt ([Finkelstein et al., 2005], [Hill et al., 2003] und [Swinburn et al., 2009]). In der Tat ist das Erhalten der angenehmen Wirkung von schmackhaftem Essen eine starke motivierende Kraft, die bei bestimmten Personen homöostatische Signale außer Kraft setzen kann ([Shomaker et al., 2010], [Sunday et al., 1983] und [Zheng et al., 2009]). . Wenn Ratten die Wahl haben, bevorzugen sie überwiegend eine kalorienfreie Saccharinlösung, anstatt sich intravenöse Kokaininfusionen selbst zu verabreichen (Lenoir et al., 2007). Darüber hinaus setzen sich gut genährte Ratten freiwillig extremer Kälte (–15 ° C), schädlichen Hitzeschmerzen oder aversivem Fußschock aus, um schmackhafte Lebensmittel wie Shortcake, Fleischpastete, Erdnussbutter, Coca-Cola, M & M-Bonbons und Schokolade zu erhalten Chips oder Joghurttropfen, selbst wenn weniger schmackhaftes Standardfutter frei verfügbar ist ([Cabanac und Johnson, 1983], [Foo und Mason, 2005] und [Oswald et al., 2010]). Diese Ergebnisse zeigen, wie intensiv Makronährstoffe in schmackhaften Lebensmitteln die Belohnungssysteme des Gehirns unabhängig von ihrem Kalorienwert stimulieren können ([Wang et al., 2004a] und [Wang et al., 2004b]) und wie hoch die Motivation sein kann, schmackhafte Lebensmittel zu konsumieren auch ohne homöostatischen Energiebedarf. Missbrauchsdrogen wie Kokain oder Nikotin können in ähnlicher Weise ein hohes Maß an Konsumverhalten hervorrufen, obwohl sie keinen Kalorien- oder Nährwert haben. In der Tat wurde aufgrund der vielen Ähnlichkeiten zwischen übermäßigem Essen bei Fettleibigkeit und übermäßigem Drogenkonsum bei Sucht (Volkow und Wise, 2005) argumentiert, dass Fettleibigkeit als Hirnstörung betrachtet und als diagnostische Kategorie in die kommende fünfte Ausgabe aufgenommen werden sollte des diagnostischen und statistischen Handbuchs für psychische Störungen (DSM-V) ([Devlin, 2007] und [Volkow und O'Brien, 2007]). Im Vergleich zu homöostatischen Mechanismen des Fütterungsverhaltens ist viel weniger darüber bekannt, wie genau hedonische Systeme die Nahrungsaufnahme beeinflussen. In ähnlicher Weise bleibt der Einfluss von intrinsischen oder ernährungsbedingten Veränderungen auf die Reaktionsfähigkeit von Belohnungssystemen des Gehirns und wie diese Effekte zu übermäßigem Essen und Fettleibigkeit beitragen, unklar. Im Folgenden werden aktuelle Daten zusammengefasst, die Fortschritte in unserem Verständnis der hedonischen Mechanismen des Essens und ernährungsbedingte Veränderungen der Belohnungsaktivität des Gehirns aufzeigen, die zur Entwicklung von Fettleibigkeit beitragen können
Aktivierung von Brain Reward Systems als Reaktion auf schmackhafte Lebensmittel: Wechselwirkungen mit hormonellen Regulatoren der Energiebilanz
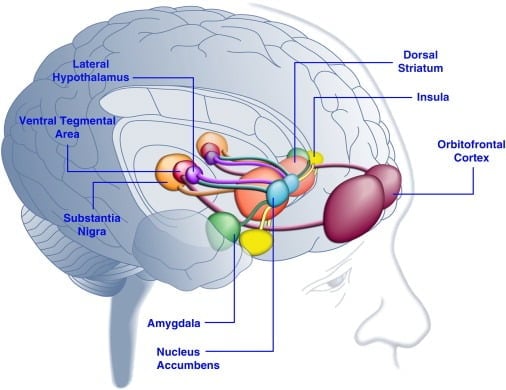
Der Verzehr schmackhafter Nahrung kann die Stimmung bei Menschen verbessern ([Dallman et al., 2003] und [Macht and Mueller, 2007]) und die Etablierung einer konditionierten Präferenz für Versuchstiere unterstützen ([Imaizumi et al., 2001] and [ Sclafani et al., 1998]). Diese Effekte hängen wahrscheinlich mit der Stimulation von Belohnungssystemen im Gehirn durch wohlschmeckende Nahrung zusammen (Abbildung 1). In der Tat haben bildgebende Untersuchungen am menschlichen Gehirn gezeigt, dass Lebensmittel- und Lebensmittel-assoziierte visuelle oder olfaktorische Signale kortikolimbische und meso accumbens Gehirnkreisläufe aktivieren können, insbesondere die orbitofrontalen Kortex- (OFS), Insula-, Amygdala-, Hypothalamus-, Striatum- und Mittelhirnregionen einschließlich des ventralen Tegmentalbereichs (VTA) und der Substantia nigra (SN) ([Bragulat et al., 2010], [Pelchat et al., 2004], [Schur et al., 2009] und [Simmons et al., 2005] ). Das Striatum, die Insula, der anteriore cinguläre Kortex und die Mittelhirnstrukturen kodieren den subjektiven Wert von Belohnungen, unabhängig von ihrer Art (zB Nahrung, Geschlecht, monetäre Belohnung), im Einklang mit einer Rolle dieses neuronalen Netzwerks in allgemeiner hedonischer Repräsentation (Sescousse et al. , 2010). Im Gegensatz dazu scheint das OFC eine besonders prominente Rolle in Repräsentationen zu spielen, die sich auf den Wert bestimmter Belohnungsarten beziehen, einschließlich schmackhafter Nahrung ([Man et al., 2009], [Rolls, 2008] und [Sescousse et al., 2010]). ). Hunger kann die schmackhafte nahrungsmittelinduzierte Aktivierung von kortikolimbischen und Mittelhirnregionen beim Menschen verstärken (LaBar et al., 2001). Zum Beispiel war die Intensität der Aktivierung des ventralen Striatums, der Amygdala, der Insula und des OFC als Reaktion auf kalorienreiche schmackhafte Nahrung viel größer, wenn menschliche Subjekte hungrig statt gut genährt waren (Goldstone et al., 2009). Dies steht im Einklang mit der Tatsache, dass Zeiten von Hunger und Diäten die selbstberichteten Bewertungen der "Macht" schmackhafter Nahrung und des Verlangens nach "verlockender" Nahrung erhöhen ([Hofmann et al., 2010] und [Rolls et al., 1983]). ). Umgekehrt kann Überfütterung neuronale Reaktionen auf schmackhafte Nahrung reduzieren, insbesondere im Inselrinde und Hypothalamus (Cornier et al., 2009). Daher wird der hedonische Wert der Nahrung durch den Stoffwechselzustand beeinflusst, was darauf hindeutet, dass Regulatoren des Metabolismus wie Leptin und Ghrelin die Aktivität von hedonischen Systemen im Gehirn beeinflussen können. In Übereinstimmung mit dieser Ansicht wurden menschliche Subjekte mit Leptin oder dem aus dem Darm stammenden postprandialen Faktorpeptid YY3-36 (PYY) ([Batterham et al., 2007] und [Farooqi et al., 2007]) oder solchen, die sich einer Magenauftreibung unterzogen hatten, behandelt Nachahmung von Mahlzeiten (Wang et al., 2008), hatte die Aktivität in belohnungsbezogenen Hirnregionen reduziert. Umgekehrt zeigen hyperphagische menschliche Patienten mit angeborenem Leptinmangel erhöhte Aktivität im insulären Kortex und Striatum als Reaktion auf Nahrungsbilder ([Baicy et al., 2007] und [Farooqi et al., 2007]). Bei diesen Personen schwächte die Leptin-Substitutionstherapie die verstärkte insulare und striatale Aktivität ab und senkte das selbst gemachte Verlangen nach Nahrung ([Baicy et al., 2007] und [Farooqi et al., 2007]). Die Leptin-Behandlung blockiert auch die lohnenden Eigenschaften von Saccharose bei Ratten mit Nahrungsrestriktion ähnlich dem Dopamin-Rezeptor-Antagonisten α-Flupenthixol (Figlewicz et al., 2001). Darüber hinaus werden Leptinrezeptoren auf Dopaminneuronen des Mittelhirns in der VTA und SN exprimiert (Figlewicz et al., 2003), was darauf hindeutet, dass Leptin hedonische Aspekte des Nahrungsaufnahmeverhaltens durch Modulation der mesostriatalen Dopaminübertragung beeinflussen kann. In Bestätigung dieser Möglichkeit inhibierten Leptin-Infusionen in die VTA die Aktivität von Dopamin-Neuronen und verringerten die Nahrungsaufnahme bei Ratten (Hommel et al., 2006; siehe auch Krügel et al., 2003). Umgekehrt erhöhte der Knockdown von Leptinrezeptoren in der VTA die Nahrungsaufnahme, verstärkte lokomotorische Aktivität und erhöhte Präferenz für schmackhafte Nahrung bei Ratten (Hommel et al., 2006). Leptin übt daher einen hemmenden Einfluss auf die Mesoaccumbens-Dopamintransmission aus, ein Neurotransmittersystem, das stark an Belohnung und Motivation, aber weniger an Energiehomöostase beteiligt war ([de Araujo et al., 2010] und [Vucetic and Reyes, 2010]). Kürzlich wurde gezeigt, dass das Hunger-Hormon Ghrelin ([Kojima et al., 1999] und [Nakazato et al., 2001]) die Aktivierung von hedonischen Systemen im Gehirn als Reaktion auf Nahrungsreize potenziert (Malik et al. , 2008). Insbesondere verbesserte Ghrelin die Aktivierung von OFC, Amygdala, Insula, Striatum, VTA und SN als Reaktion auf Bilder von hoch schmackhafter Nahrung bei übergewichtigen Individuen (Malik et al., 2008). Bei Ratten übt Ghrelin eine stimulierende Wirkung auf Mittelhirn-Dopaminsysteme ([Abizaid et al., 2006b], [Jerlhag et al., 2006] und [Jerlhag et al., 2007]) aus und erhöht den Belohnungswert von schmackhafter Nahrung (Perello et al., 2010).
Abbildung 1. Bereiche des menschlichen Gehirns, die als Reaktion auf schmackhafte Lebensmittel oder mit Lebensmitteln verbundene Hinweise aktiviert wurden. Es wird angenommen, dass der orbitofrontale Kortex und die Amygdala Informationen codieren, die sich auf den Belohnungswert von Lebensmitteln beziehen ([Baxter und Murray, 2002], [Holland und Gallagher, 2004], [Kringelbach et al., 2003], [O'Doherty et al. , 2002] und [Rolls, 2010]). Die Insula verarbeitet Informationen zum Geschmack von Lebensmitteln und ihrer hedonischen Bewertung ([Balleine und Dickinson, 2000] und [Small, 2010]). Der Nucleus accumbens und das dorsale Striatum, die dopaminergen Input aus dem ventralen tegmentalen Bereich und der Substantia nigra erhalten, regulieren die Motivations- und Anreizeigenschaften von Lebensmitteln ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi et al., 2007], [Malik et al., 2008] und [Söderpalm und Berridge, 2000]). Der laterale Hypothalamus kann die Belohnungsreaktionen auf schmackhafte Lebensmittel regulieren und das Verhalten bei der Nahrungssuche fördern (Kelley et al., 1996). Diese Gehirnstrukturen wirken auf konzertierte Weise, um das Lernen über die hedonischen Eigenschaften von Lebensmitteln zu regulieren, die Aufmerksamkeit und die Bemühungen auf die Erlangung von Lebensmittelbelohnungen zu verlagern und den Anreizwert von Umweltreizen zu regulieren, die die Verfügbarkeit von Lebensmittelbelohnungen vorhersagen (Dagher, 2009). Aus Gründen der Übersichtlichkeit sind nicht alle Verbindungen zwischen diesen Strukturen dargestellt.
Ähnliche Gehirnregionen werden durch wohlschmeckende Nahrung im Rattenhirn aktiviert, wie sie beim Menschen aktiviert werden, wie durch die Expression von unmittelbaren frühen Genen (IEG) wie c-fos, arc oder zif268 gemessen wird. In der Tat aktiviert schmackhafte Nahrung das dorsale und ventrale Striatum, VTA, lateralen Hypothalamus (LH) sowie zentrale und basolaterale Kerne der Amygdala und Belohnungs-verwandten kortikalen Strukturen in Ratten ([Angeles-Castellanos et al., 2007], [Park und Carr, 1998] und [Schiltz et al., 2007]). Interessanterweise war die Fos-Immunoreaktivität in der lateralen und medialen Habenula bei Ratten nach dem Verzehr von schmackhaftem Futter (LHb) (Park und Carr, 1998) tatsächlich verringert. Bei nichtmenschlichen Primaten wird das LHb durch aversive Reize oder das Weglassen von erwarteten Belohnungen aktiviert und durch die Lieferung einer schmackhaften Saftbelohnung (Matsumoto und Hikosaka, 2007) gehemmt. Darüber hinaus hemmt LHb-Aktivität Belohnung-bezogene mesoaccumbens Dopamin-enthaltende Neuronen durch einen indirekten Weg, der den rostromedialen tegmentalen Kern (RMTg) mit einbezieht (Jhou et al., 2009). Die habenuläre Aktivität steht daher in einem umgekehrten Zusammenhang mit der Nahrungs-Hedonik, was darauf hindeutet, dass der Habenular-Komplex das nicht-homöostatische Essen beeinflussen kann. Tatsächlich wurde kürzlich gezeigt, dass die Aktivierung von LHb den Saccharoseverbrauch bei Ratten verringert, wohingegen Läsionen von LHb das Saccharose-Suchverhalten erhöhen (Friedman et al., 2011). Wenn man bedenkt, dass der Habenularkomplex klein und schwierig zu identifizieren und funktionell in Menschen zu modellieren ist (Salas et al., 2010), könnte dies erklären, warum Änderungen der habäularen Aktivität in humanen Bildgebungsstudien als Antwort auf schmackhaftes Essen nicht berichtet wurden.
Hirnschaltkreise, die das hedonische Essen regulieren: Dopaminsysteme des Mittelhirns
Der Mesoaccumbens-Dopamin-Weg wird bei Menschen und Labortieren als Reaktion auf schmackhafte Lebensmittel oder auf appetitliche Lebensmittel bezogene Hinweise aktiviert, und Leptin, Ghrelin und andere Regulatoren des Appetits beeinflussen die Aktivität in diesem System. Dies legt nahe, dass Mittelhirn-Dopaminsysteme eine wichtige Rolle beim wohlschmeckenden Lebensmittelkonsum spielen. Der vielleicht deutlichste Hinweis darauf, dass die Dopaminübertragung im Mittelhirn die schmackhafte Nahrungsaufnahme beim Menschen beeinflusst, ist die Tatsache, dass Parkinson-Patienten, bei denen Dopamin-haltige Neuronen im Mittelhirn degeneriert sind, tendenziell weniger Nahrung zu sich nehmen als nicht betroffene Personen (Nirenberg und Waters, 2006). Darüber hinaus kann die Behandlung von PD-Patienten mit Dopaminrezeptoragonisten einen zwanghaften Verzehr von schmackhaften Nahrungsmitteln auslösen ([Dagher und Robbins, 2009] und [Nirenberg und Waters, 2006]). Tatsächlich können Dopaminrezeptoragonisten selbst bei Nicht-PD-Individuen hedonisches Überessen induzieren (Cornelius et al., 2010). Bei Tieren stimulieren schmackhafte Saccharoselösungen die Dopaminübertragung in der NAc (Hernandez und Hoebel, 1988), ein Effekt, der mit Bildgebungsstudien des menschlichen Gehirns übereinstimmt (Small et al., 2003). Unter Verwendung der Fast-Scan-Cyclovoltammetrie wurde gezeigt, dass Hinweise, die die Abgabe einer Saccharosebelohnung oder die unerwartete Abgabe von Saccharose vorhersagen, eine Dopaminübertragung in NAc hervorrufen ([Roitman et al., 2004] und [Roitman et al., 2008]). Ferner hatte die unerwartete Abgabe schädlicher Chininlösungen den gegenteiligen Effekt und verringerte die akkumbale Dopaminübertragung (Roitman et al., 2008). Schließlich zeigen Mäuse, bei denen das Enzym Tyrosinhydroxylase (TH) inaktiviert wurde, was zu einem Dopaminmangel führt, immer noch eine deutliche Präferenz für Saccharose- (oder Saccharin-) Lösungen im Vergleich zu Wasser, verbrauchen jedoch weniger Gesamtmengen der Saccharose als Kontrollmäuse ( Cannon and Palmiter, 2003). Dies legt nahe, dass Mäuse mit Dopaminmangel immer noch Saccharose-Schmackhaftigkeit nachweisen können und diese Lösungen Wasser vorziehen, aber nicht in der Lage sind, den Verbrauch von schmackhaften Lösungen aufrechtzuerhalten. Es wurde daher vorgeschlagen, dass die Übertragung von Mesoaccumbens-Dopamin die Motivationsaspekte des Fütterungsverhaltens reguliert, die an der Lebensmittelbeschaffung beteiligt sind, und dass andere Neurotransmittersysteme wahrscheinlich hedonische Aspekte des schmackhaften Lebensmittelkonsums regulieren.
Gehirnschaltkreise, die das hedonische Essen regulieren: Striatohypothalamische Systeme
Die Infusion von μ-Opioidrezeptor-Agonisten wie [D-Ala2-N-Me-Phe4-gly-ol5] -Enkephalin (DAMGO) in den NAc stimuliert das Nahrungsverhalten bei Ratten mit ad libitum-Zugang zu Nahrung (dh nicht-homöostatische Fütterung) ( [Peciña und Berridge, 2005] und [Zhang et al., 1998]). Umgekehrt verringern Opioid-Rezeptor-Antagonisten, die in den NAc infundiert sind, den Konsum von bevorzugten Nahrungsmitteln, ohne die Aufnahme von weniger schmackhaften Alternativen zu beeinflussen (Kelley et al., 1996). Diese Daten stimmen mit der Ansicht überein, dass striatale Opioidsysteme die hedonischen Eigenschaften von schmackhafter Nahrung regulieren. Die Schalenregion der NAc und insbesondere hedonische "hot spots" in der rostrodorsalen Region der medialen Schale ([Peciña und Berridge, 2005] und [Peciña et al., 2006b]) spielen eine besonders wichtige Rolle bei der nicht-homöostatischen Fütterung. Da die Aktivierung des μ-Opioidrezeptors zu einer Hemmung der Aktivität der medianen stacheligen Neuronen im NAc führt, wurde vorgeschlagen, dass die NAc-Schale einen tonisch hemmenden Einfluss auf den Verzehr schmackhafter Nahrungsmittel ausübt (Kelley et al., 2005). In Übereinstimmung mit dieser Sicht stimulieren inhibitorische GABAA- oder GABAB-Rezeptoren ([Basso und Kelley, 1999] und [Stratford und Kelley, 1997]) oder blockieren exzitatorische ionotrope Glutamat-Rezeptoren (Maldonado-Irizarry et al., 1995) in der NAc-Schale erhöht den Verzehr von Lebensmitteln. In ähnlicher Weise erhöht eine exzitotoxische Läsion der NAc-Schale auch den Nahrungsverbrauch und erhöht die Empfindlichkeit gegenüber Nahrungsmittelbelohnung ([Johnson et al., 1996] und [Maldonado-Irizarry und Kelley, 1995]). Insbesondere wird der Konsum von energiereichem, wohlschmeckendem Essen bevorzugt durch diese Manipulationen ausgelöst ([Basso und Kelley, 1999], [Kelley et al., 2005] und [Zhang et al., 1998]).
Angesichts des großen Einflusses der akkumulierten Signalisierung auf die hedonische Ernährung verwendeten Thompson und Swanson (2010) ein Schaltkreis-Tracing-Verfahren, um genau die anatomischen Netzwerke zu identifizieren, durch die der NAc den schmackhaften Nahrungskonsum beeinflussen kann. In diesen eleganten Studien erhielten Ratten zwei nicht überlappende Injektionen von anterograden / retrograden Tracern (COINs genannt) an Stellen der NAc-Schale, die den Verzehr schmackhafter Nahrungsmittel stark beeinflussen, und afferente / efferente Verbindungen wurden identifiziert. Es wurde gezeigt, dass fütterungsbezogene Stellen in der NAc inhibitorische Projektionen vorherrschend auf das vordere LH und ventrale Pallidum (VP) ausdehnen (Thompson und Swanson, 2010). Im Gegensatz zum Rest des NAc, der dicht zur VTA projiziert, projizieren lebensmittelbedingte hedonische Hotspots in der NAc-Schale auf den interfaszikulären Kern (IFN), eine Struktur, die neben der VTA liegt und dopaminerge Projektionen in reziproker Weise wieder ausbreitet NAc-Shell (Thompson und Swanson, 2010). Weiterhin projiziert das anteriore LH zum LHb (Thompson und Swanson, 2010), was wiederum nahelegt, dass der Habenular-Komplex eine Rolle in der Nahrungsmittel-Hedonik spielt (Friedman et al., 2011).
Die obigen Daten zeigen, dass das LH prominenten inhibitorischen Input von Stellen in NAc erhält, die einen tonisch inhibitorischen Einfluss auf den Verzehr von genießbaren Nahrungsmitteln ausüben. Die LH hat auch funktionelle Konnektivität mit anderen kortikalen und limbischen Gehirnstellen, die mit der Organisation und Steuerung des Verhaltens zur Gewinnung schmackhafter Nahrung (Abbildung 1), wie OFC, Insula und Amygdala, befasst sind. Wichtig ist, dass die Inaktivierung des LH die stimulatorischen Effekte von NAc-Manipulationen auf die Nahrungsaufnahme aufhebt ([Maldonado-Irizarry et al., 1995] und [Will et al., 2003]). Darüber hinaus verstärkt die Inaktivierung der NAc-Hülle die Aktivität der LH-Neuronen, insbesondere LH-Neuronen, die das Neuropeptid Hypocretin (auch bekannt als Orexin) synthetisieren, gemessen durch Fos-Immunreaktivität ([Baldo et al., 2004] und [Stratford und Kelley, 1999] ]). Tatsächlich aktiviert die Infusion des μ-Opioidrezeptor-Agonisten DAMGO in die NAc-Schale hypocretinhaltige Neuronen im Hypothalamus (Zheng et al., 2007), und die Unterbrechung der Hypocretinübertragung in VTA hebt die schmackhafte Nahrungsaufnahme auf, die durch Intra-NAc-DAMGO-Infusionen ausgelöst wird (Zheng et al., 2007). Daher üben hedonische Hotspots in der NAc-Schale einen tonischen hemmenden Einfluss auf LH-Neuronen und insbesondere hypocretinhaltige Neuronen aus (Louis et al., 2010), wodurch der Konsum von schmackhafter Nahrung begrenzt wird. Die Unterbrechung dieses akkumulierten "Stopp-Signals" zum Beispiel durch eine verstärkte Opioid-Rezeptor-Signalgebung führt zu einer erhöhten LH-Aktivität, die den nicht-homöostatischen Konsum von schmackhafter Nahrung antreibt (Abbildung 2).
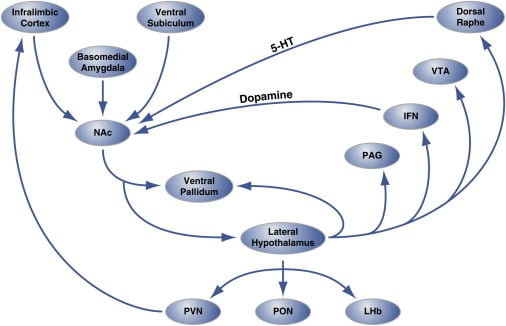
Abbildung 2. Circuit-Level Organisation von Hedonic "Hot Spots" in Nucleus Accumbens Shell, die Hedonic Essen regulieren
Die Schalenregion des Nucleus accumbens (NAc) wird von kortikalen und limbischen Hirnregionen innerviert und projiziert auf den lateralen Hypothalamus und das ventrale Pallidum. Der laterale Hypothalamus wiederum ragt ebenfalls zum ventralen Pallidum und auch zum PAG-, IFN-, VTA- und dorsalen Raphe-Kern. Das IFN und dorsale Raphe erweitern dopaminerge bzw. serotonerge Projektionen zurück zum NAc. Der laterale Hypothalamus innerviert auch thalamische (PVN und PON) und epithalamische (LHb) Strukturen. Nicht dargestellt sind die kleinen Projektionen vom lateralen Hypothalamus zu septalen Hirnarealen. 5-HT, Serotonin; IFN, interfaszikulärer Kern; LHb, laterale Habenula; PON, präoptischer Kern; PVN, paraventrikulärer Nucleus des Thalamus; VTA, ventrales Tegmentum. Abbildung wurde mit freundlicher Genehmigung von Thompson und Swanson (2010) angepasst.
Hirnschaltkreise, die die hedonische Ernährung regulieren: Striatopallidale Systeme
Neben dem LH projizieren NAc-Shell-Neuronen auch auf den VP (Abbildung 2). In einer interessanten Reihe von Experimenten wurde gezeigt, dass akkumulierte Projektionen zu VP und LH dissoziierbare Aspekte des nicht-homöostatischen Essens regulieren können (Smith und Berridge, 2007). DAMGO-Infusionen in entweder die NAc-Schale oder VP erhöhten orofaziale Reaktionen auf Saccharoselösungen, die vermutlich "liebende" Reaktionen bei Ratten widerspiegeln (dh Palatabilitätsreaktion) und auch erhöhten Nahrungsverbrauch (Smith und Berridge, 2007). Infusionen von Naloxon in entweder NAc oder VP verringerten faziale Reaktionen auf Saccharose, was darauf hindeutet, dass eine synchronisierte Opioidübertragung in NAc und VP notwendig ist, um mit Informationen in Zusammenhang stehende Nahrungsmittelverträglichkeit zu verarbeiten. Naloxon, das in den NAc infundiert wurde, aber nicht VP, verringerte das nicht - homöostatische Essen (Smith und Berridge, 2007), was darauf hindeutet, dass nicht - homeostatisches Essen unabhängig von dieser NAc → VP - Konnektivität stattfindet und stattdessen wahrscheinlich auf dem NAc → LH - Signalweg beruht Berridge, 2007] und [Taha et al., 2009]). Übereinstimmend mit der Vorstellung, dass Aspekte des nicht-homöostatischen Verzehrs dissoziiert werden können, haben Einzel-Einheiten-Aufzeichnungen gezeigt, dass eine Population von NAc-Neuronen selektiv Informationen bezüglich der relativen Verstärkungseigenschaften von Nahrungsmitteln (dh Schmackhaftigkeit) kodiert (Taha and Fields, 2005) . Bei den gleichen Ratten schienen Veränderungen in der Aktivität einer zweiten Population von NAc-Neuronen mit der Initiation des Nahrungsaufnahmeverhaltens (Taha and Fields, 2005) übereinzustimmen.
Gehirnschaltkreise, die hedonisches Essen regulieren: Amygdalare Systeme
Die Annahme, dass Aspekte des nicht-homöostatischen Verzehrs dissoziierbar sind, die Naloxon-Infusionen in die NAc-Schale oder VP, aber nicht die basolaterale Amygdala (BLA), verringerten die Schmackhaftigkeit von Saccharoselösungen (Wassum et al., 2009). Wenn jedoch die μ-Opioidrezeptorantagonisten Naloxon oder CTOP in die BLA infundiert wurden, aber nicht in die NAc-Schale oder VP, gab es eine deutliche Abschwächung der erhöhten Motivation, auf Saccharoselösungen zu reagieren, die typischerweise in einem hungrigen Zustand beobachtet wurden [Wassum et al ., 2011] und [Wassum et al., 2009]). Dies legt nahe, dass die Anreizeigenschaften von Saccharose durch Amygdala-Schaltkreise reguliert werden. Insgesamt zeigen die obigen Ergebnisse, dass verschiedene Aspekte des hedonischen Essens, wie die Verarbeitung von Informationen in Bezug auf Lebensmittelschmackhaftigkeit, Annäherungsverhalten und Erhöhungen des Anreizwertes von schmackhafter Nahrung in hungrigen Tieren, durch diskrete Mikroschaltkreise im Kontext von a differenziell reguliert werden größere kortikolimbisch-striatopallidal-hypothalamisch-thalamokortikale Schaltung (Figur 2).
Machen Adaptationen in Hirn-Hedoneschaltungen zwanghaftes Essen?
Die funktionelle Relevanz von hedonischen Hotspots in der NAc-Schale und ihr Einfluss auf breitere ernährungsbedingte Schaltkreise im Gehirn wurden von Kelley et al. (2005). Sie stellen die Hypothese auf, dass der NAc-Shell-→ LH-Weg zusammen mit stromaufwärts und stromabwärts gelegenen regulatorischen Gehirnregionen (Fig. 2) einem "Sentinel" -Zweck dient (Kelley et al., 2005). Konkret schlagen sie vor, dass selbst bei hungrigen Tieren, wenn der Antrieb zum Fressen stark ist, die Fähigkeit, das Fressverhalten zu beenden, bei Bedrohungen aus der Umwelt beibehalten werden muss (Kelley et al., 2005). Daher kann die Aktivierung von NAc-Shell-Neuronen und die gleichzeitige Hemmung von LH-Neuronen die laufende Fütterung unterbrechen und das Umschalten des Verhaltens auf geeignetere adaptive Reaktionen wie Einfrieren oder Entkommen erleichtern (Kelley et al., 2005). Wenn dies tatsächlich der Fall ist, ist es wichtig zu untersuchen, ob dieser NAc-Shell → LH-Kontrollweg durch übermäßigen Verzehr schmackhafter Nahrungsmittel oder durch genetische Faktoren, die die Adipositasanfälligkeit beeinflussen, beeinträchtigt wird. Vor diesem Hintergrund haben unser Labor und andere kürzlich berichtet, dass ein übermäßiger Verzehr kalorienreicher Nahrung mit dem Auftreten eines zwanghaften Fressverhaltens bei Ratten in Verbindung gebracht wird (Johnson und Kenny, 2010, [Latagliata et al., 2010] und [Oswald et al., 2010]). Insbesondere fanden wir heraus, dass schmackhafte Nahrungsaufnahme bei adipösen Ratten resistent gegen Störungen durch einen aversiven konditionierten Stimulus war, der ein negatives Ergebnis vorhersagte (elektrischer Fußschock) (Johnson und Kenny, 2010). Daher wird es wichtig sein zu testen, ob Defizite im NAc-Shell → LH-Kontrollpfad, die durch übermäßiges Essen ausgelöst werden, zumindest teilweise zu dem auffälligen Versagen von übergewichtigen und adipösen Individuen beitragen, Informationen über die schädlichen Konsequenzen ihres Konsumverhaltens zu verwenden, um ihre Nahrungsaufnahme zu moderieren .
Altered Brain Reward Aktivität bei Adipositas: Human Brain Imaging Studies
Das Erhalten der stimulierenden Wirkungen von schmackhafter Nahrung auf Belohnungssystemen des Gehirns wird als wichtiger Motivationsfaktor angesehen, der zum Überessen beiträgt. Daher ist eine wichtige Frage, ob Veränderungen in der Belohnungsfunktion des Gehirns zur Entwicklung von Fettleibigkeit beitragen können. Eine intuitive Vorhersage ist, dass eine verbesserte konstitutive Reaktionsfähigkeit von Belohnungssystemen des Gehirns auf schmackhaftes Essen zu Überernährung und Gewichtszunahme führen würde. Übereinstimmend mit dieser Hypothese zeigen Personen mit einem hohen Maß an Trait-Belohnungs-Sensitivität eine erhöhte Aktivität in Gehirnregionen, die an Nahrungsmittelbelohnung beteiligt sind, einschließlich NAc, Amygdala, OFC und VP, bei Kontakt mit schmackhaften Lebensmitteln wie Schokoladenkuchen und Pizza (Beaver et al. , 2006). Übergewichtige Personen zeigen in ähnlicher Weise eine erhöhte Aktivierung von Belohnungsschaltungen im Gehirn als Reaktion auf schmackhafte Nahrungsmittel oder mit Nahrungsmitteln assoziierte Hinweise im Vergleich zu mageren Kontrollen ([Gautier et al., 2000], [Karhunen et al., 1997] und [Rothemund et al., 2007] ]). Ein hohes Maß an Trait-Belohnungs-Sensitivität korrelierte auch mit erhöhtem Körpergewicht bei menschlichen Probanden ([Davis et al., 2004] und [Franken und Muris, 2005]). Es ist jedoch wichtig, dass übergewichtige Frauen (BMI> 30) ein höheres Maß an Anhedonie (dh eine verminderte Empfindlichkeit gegenüber Belohnungen) als übergewichtige Frauen (BMI> 25 <30) aufwiesen (Davis et al., 2004). In ähnlicher Weise haben Stice und Mitarbeiter (2008b) gezeigt, dass adipöse jugendliche Mädchen eine erhöhte Aktivierung der Insula und anderer kortikaler Hirnregionen als Reaktion auf schmackhaftes Essen oder Essen-assoziierte Hinweise im Vergleich zu mageren Kontrollpersonen hatten, aber diese Aktivierung der Caudate-Bereich der Striatum in Reaktion auf das schmackhafte Essen war umgekehrt mit BMI in den übergewichtigen Probanden korreliert. Darüber hinaus hatten Frauen, die über einen 6-Monat zugenommen hatten, einen deutlichen Rückgang der striatalen Aktivität als Reaktion auf schmackhaftes Essen während dieses Zeitraums verglichen mit Frauen, die nicht an Gewicht zugenommen hatten (Stice et al., 2010a). Wenn all dies zusammengenommen wird, scheint es, dass Hypersensitivität von Belohnungsschaltungen ein Individuum für Überessen und Gewichtszunahme prädisponieren kann (Stice et al., 2010b). Wenn jedoch die Gewichtszunahme zunimmt, können Defizite in der Aktivität spezifischer Komponenten des Belohnungssystems des Gehirns, insbesondere des Striatums, auftreten. Es wurde vorgeschlagen, dass die Entstehung dieses Zustandes der Belohnungs-Hyposensitivität den Überkonsum von schmackhafter Nahrung aufrechterhalten kann, um solche Belohnungsdefizite zu überwinden ([Stice et al., 2008a] und [Wang et al., 2002]). Daher scheint zu wenig oder zu viel Futterbelohnung die Anfälligkeit für Überessen und Fettleibigkeit zu erhöhen (Stoeckel, 2010). Ein attraktiver konzeptioneller Rahmen, um diese scheinbar gegensätzlichen Standpunkte in Einklang zu bringen, ist, dass kortikolimbische Bereiche, die an der Organisation des Verhaltens zur Erzielung von Nahrungsbelohnungen beteiligt sind, bei übergewichtigen Personen und solchen, die für Fettleibigkeit prädisponiert sind, hyperaktiv werden. Umgekehrt können striatale Hirnareale, die die tatsächliche Genusserfahrung durch hedonisches Essen verarbeiten, bei diesen Individuen allmählich weniger funktionell werden. Es wird daher erwartet, dass der relative Motivationswert von schmackhafter Nahrung während der Entwicklung von Fettleibigkeit zunimmt, während gleichzeitig der hedonische Wert, der durch den Verzehr schmackhafter Nahrung erhalten wird, abnimmt.
Altered Brain Reward Aktivität bei Adipositas: Nagetier-Studien
Die Auswirkungen von schmackhaftem Nahrungsverbrauch auf Belohnungssysteme des Gehirns wurden direkt in Labortieren unter Verwendung des Belohnungs-Stimulations-Belohnungs (BSR) -Verfahrens bewertet. Es ist bekannt, dass die Elektrostimulation der LH, die tonische hemmende Inputs von akkumulierten hedonischen Hotspots erhält (Abbildung 2), sehr lohnend ist und Ratten werden hart daran arbeiten, diese Hirnregion selbst zu stimulieren (Markou und Frank, 1987) ). Zusätzlich zum Unterstützen des Eigenstimulationsverhaltens kann die elektrische Stimulation von LH auch intensive Phasen des Fressverhaltens auslösen (Margules and Olds, 1962), und es wurde vorgeschlagen, dass die lohnenden Eigenschaften der LH-Stimulation mit der intrinsischen Rolle davon in Verbindung gebracht werden können Gehirnstandort in den appetitiven und motivierenden Eigenschaften von Lebensmitteln (Margules und Olds, 1962). In Übereinstimmung mit dieser Sichtweise erhöhen Hunger und Gewichtsverlust die Empfindlichkeit von Ratten gegenüber dem belohnenden Wert der LH-Selbststimulation ([Blundell und Herberg, 1968], [Carr und Simon, 1984] und [Margles und Olds, 1962]), ein Effekt das kann durch intrazerebroventrikuläre Infusion von Leptin blockiert werden (Fulton et al., 2000). Umgekehrt wird die elektrische Eigenstimulation des LH bei gesättigten Tieren gehemmt (Wilkinson und Peele, 1962). In der Tat, Überfütterung von Ratten durch intragastrische Ernährungssonde (Hoebel und Teitelbaum, 1962), Magenaufblähung oder intravenöse Glucagon-Infusion, die postprandiale Sättigung nachahmt ([Hoebel, 1969], [Hoebel und Balagura, 1967] und [Mount und Hoebel, 1967] ), dämpfen alle für die LH-Stimulation. In der Tat reagieren Ratten, die zuvor kräftig für die Belohnung der LH-Stimulation geantwortet haben, so, als ob diese Stimulation nach Nahrungsaufnahme oder Entwicklung von Fettleibigkeit aversiv wäre (Hoebel und Thompson, 1969). Daher erhöht chronische Nahrungsrestriktion und Gewichtsverlust, während Überfütterung verringert, die Empfindlichkeit der Belohnung-bezogenen Websites in der LH. Die Empfindlichkeit von LH-Neuronen gegenüber einer lohnenden elektrischen Selbststimulation könnte daher wichtige Einblicke in die Funktionsweise von Schaltkreisen im Gehirn liefern, die hedonische Reaktionen auf Nahrung steuern.
Da der leichte Zugang zu energiereichem, schmackhaftem Essen und der daraus resultierende Überkonsum als Hauptfaktor für die Adipositas angesehen wird (Volkow und Wise, 2005), nutzte unser Labor kürzlich das BSR-Verfahren zur Beurteilung der Gehirnbelohnungsaktivität bei Ratten mit erweitertem Zugang zu schmackhaften Nahrungsmitteln . Insbesondere haben wir das Ansprechen auf die elektrische Stimulation der LH bei Ratten, die ad libitum Zugang zu Ernährungsfutter allein oder Futter in Kombination mit 18-23 hr täglicher Zugang zu einer schmackhaften Diät hatten, aufgezeichnet. Diese Diät bestand aus Käsekuchen, Speck, Wurst und anderen appetitlichen Lebensmitteln (Johnson und Kenny, 2010). Wir fanden heraus, dass Ratten mit erweitertem Zugang zu der schmackhaften Nahrung schnell signifikante Mengen an Gewicht aufwiesen und ein sich progressiv verschlechterndes Gehirn-Belohnungsdefizit zeigten (was sich als verminderte Reaktionsfähigkeit auf lohnende LH-Stimulation niederschlägt) (Johnson und Kenny, 2010; Figur 3). Dies deutet darauf hin, dass die Entwicklung von Diät-induzierter Adipositas mit einer allmählichen Abnahme der Ansprechbarkeit von Belohnungsstellen in der LH (Johnson und Kenny, 2010) verbunden ist. Defizite bei der Belohnungssignalisierung wurden auch bei adulten Ratten berichtet, die zuvor während der Adoleszenz unbegrenzten Zugang zu Saccharose oder fettreicher Nahrung hatten ([Teegarden et al., 2009], [Vendruscolo et al., 2010a] und [Vendruscolo et al., 2010b]). Diese Wirkungen bei Ratten erinnern an die verringerte striatale Aktivierung als Antwort auf die oben beschriebene Nahrungsmittelbelohnung bei menschlichen Versuchspersonen, wenn sie über einen 6-Monat zugenommen haben (Stice et al., 2010a; siehe Fig. 4). Solche ernährungsinduzierten Belohnungsdefizite bei übergewichtigen Ratten und möglicherweise bei Menschen, die an Gewicht zunehmen, spiegeln wahrscheinlich eine Gegenadaptivantwort in Nahrungsmittelbelohnungsschaltungen wider, um deren Überstimulation durch wohlschmeckende Nahrung entgegenzuwirken (Johnson und Kenny, 2010). Ein wichtiger Aspekt dieses Befundes ist, dass ähnliche Defizite in der Belohnungsfunktion auch bei Ratten gefunden werden, die Kokain oder Heroin überkonsumieren ([Ahmed et al., 2002], [Kenny et al., 2006] und [Markou und Koob, 1991]; Abbildung 3). Tatsächlich wurde die Hypothese aufgestellt, dass eine drogeninduzierte Belohnungsdysfunktion zum Übergang vom kontrollierten zum unkontrollierten Drogenkonsum beitragen kann, indem sie eine neue Quelle der Motivation für den Konsum des Medikaments schafft, um den anhaltenden Zustand verringerter Belohnung zu mildern (Ahmed und Koob) , 2005] und [Koob und Le Moal, 2008]). Daher ist es möglich, dass Defizite in der Empfindlichkeit von Belohnungsstellen in der LH durch Überernährung die langfristige Persistenz von schmackhaftem Nahrungskonsum bei übergewichtigen Ratten durch eine Verschiebung der Ernährungspräferenz in Richtung Nahrung mit höherer hedonischer Wirkung erhöhen, um den anhaltenden negativen Zustand zu lindern Belohnung.
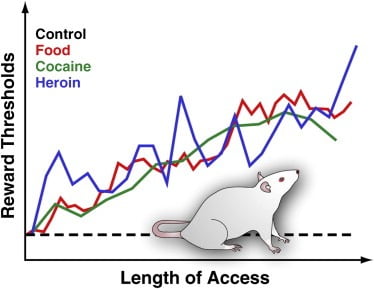
Abbildung 3. Belohnungsschwellen bei Ratten mit erweitertem täglichen Zugang zu schmackhaftem Essen, Kokain oder Heroin
Um Belohnungsschwellen zu messen, wird eine stimulierende Elektrode chirurgisch in den lateralen Hypothalamus von Ratten implantiert, eine Region, in der die elektrische Stimulation stark lohnend ist und intensive Anfälle von Nahrungsaufnahme auslösen kann. Nach der Erholung dürfen die Tiere diese Region durch Drehen eines Rades selbst stimulieren. Nachdem ein stabiles Selbststimulationsverhalten festgestellt wurde, wird die minimale Stimulationsintensität bestimmt, die das Selbststimulationsverhalten aufrechterhält (dh die Belohnungsschwelle). Dieser Belohnungsschwellenwert stellt ein operatives Maß für die Aktivität des Belohnungssystems dar. Die Belohnungsschwellen bleiben stabil und unverändert bei Kontrollratten, die Zugang zu Standard-Laborfutter haben und die nicht naiv sind. Die Schwellen steigen jedoch bei Ratten mit einem erweiterten täglichen Zugang zu einer energiedichten schmackhaften Nahrung, die aus schmackhaften Nahrungsmitteln besteht (z. B. Käsekuchen, Speck, Schokolade usw.), allmählich an. In ähnlicher Weise erhöhen sich die Belohnungsschwellenwerte bei Ratten, die den täglichen Zugang zu intravenösem Kokain oder Heroininfusionen verlängert haben. Eine erhöhte Belohnungsschwelle wird so interpretiert, dass sie eine verringerte Empfindlichkeit des Belohnungssystems des Gehirns widerspiegelt. Diese Effekte legen nahe, dass ein übermäßiger Konsum von schmackhafter Nahrung und damit einhergehender Gewichtszunahme tiefgreifende Defizite in der Gehirnbelohnung hervorrufen kann, ähnlich denen, die durch übermäßigen Konsum von Suchtmitteln hervorgerufen werden
Abbildung 4. Striatale Plastizität bei AdipositasGewichtszunahme ist mit einer verminderten striatalen Aktivierung als Reaktion auf schmackhafte Nahrungsmittel, wie durch fMRT gemessen, und niedrigeren Mengen an striataler Dopamin D2 Rezeptor (D2R) Verfügbarkeit bei Menschen assoziiert (siehe Text für Details).
Mangelhafte Dopamin D2 Rezeptor Signaling in Adipositas
Mehrere kürzlich veröffentlichte Berichte haben mögliche Mechanismen aufgezeigt, durch die Belohnungsdefizite als Reaktion auf den übermäßigen Verzehr schmackhafter Lebensmittel während der Entwicklung von Fettleibigkeit auftreten können. Wie oben erwähnt, hatten Frauen, die über einen 6-Monat zugenommen hatten, einen deutlichen Rückgang der striatalen Aktivität als Reaktion auf schmackhaftes Essen über diesen Zeitraum im Vergleich zu Frauen, die nicht an Gewicht zugenommen hatten (Stice et al., 2010a; Abbildung 4). Nüchterne Personen, die ihre Lieblingsmahlzeit bis zur Sättigung essen durften, wiesen geringere Bindungsraten des Dopamin-D2-Rezeptors (D2R) -Antagonist Raclopride im Striatum (Small et al., 2003) auf, was darauf hindeutet, dass die D2R-Signalisierung als Reaktion auf schmackhaften Nahrungskonsum abnimmt. In der Tat haben adipöse Individuen niedrigere Striatum-D2R-Verfügbarkeit im Vergleich zu mageren Kontrollen (Barnard et al., 2009), [Stice et al., 2008a] und [Wang et al., 2001]; Figur 4), wohingegen Gewichtsverlust bei adipösen Patienten ist eine erhöhte striatale D2R-Dichte assoziiert (Wang et al., 2008). Wenn man bedenkt, dass die striatale Dopamin-Übertragung eine Schlüsselrolle bei der Regulierung hedonischer Ernährung spielt, könnte eine adaptive Abnahme der D2R-Signalisierung zu einer reduzierten Ansprechbarkeit des Striatums auf schmackhafte Nahrung bei übergewichtigen Personen beitragen. Um diese Möglichkeit zu testen, untersuchten Small und Mitarbeiter die Aktivität in Belohnungskreisen des Gehirns als Antwort auf einen schmackhaften Milchshake bei Kontrollpersonen und solchen, die das TaqIA-A1-Allel trugen (Felsted et al., 2010). Der TaqIA-Restriktionsfragmentlängenpolymorphismus liegt stromabwärts vom D2R-Gen (Neville et al., 2004), und Individuen, die das A1-Allel des Polymorphismus tragen, weisen zwischen 30% -40% weniger striatale D2Rs auf als diejenigen, die das Allel nicht tragen ([Jönsson et al., 1999], [Ritchie und Noble, 2003] und [Stice et al., 2010b]). Darüber hinaus haben A1-Allelträger auch einen reduzierten Glucosestoffwechsel in striatalen und kortikalen Hirnbereichen, die an hedonischen Reaktionen auf Nahrung beteiligt sind (Jönsson et al., 1999). Individuen, die das TaqIA A1-Allel beherbergen, sind in adipösen Populationen überrepräsentiert ([Barnard et al., 2009], [Stice et al., 2008a] und [Wang et al., 2001]). Darüber hinaus erhöht das A1-Allel auch die Anfälligkeit für Alkohol-, Opioid- und psychomotorische Stimulanzien ([Lawford et al., 2000], [Noble et al., 1993] und [Noble et al., 2000]). Es wurde gefunden, dass Mittelhirnbereiche, die wahrscheinlich die VTA und SN umfassen, die dopaminerge Eingabe in das Striatum bereitstellen, als Antwort auf einen schmackhaften Milchshake bei Kontrollpersonen aktiviert wurden (Felsted et al., 2010). Umgekehrt war die Aktivität an diesen Hirnstellen tatsächlich als Reaktion auf Futterbelohnung in den A1-Allelträgern (Felsted et al., 2010) verringert. Ähnliche inverse Antworten in der Gehirnaktivierung zwischen A1-Allelträgern und Nichtträgern wurden auch in thalamischen und kortikalen Gehirnstellen nachgewiesen (Felsted et al., 2010). Diese Daten sind in hohem Maße konsistent mit einer Schlüsselrolle für D2Rs bei der Regulierung der mesostriatalen Reaktion auf schmackhaftes Essen. Stice und Kollegen (2008a) fanden eine inverse Korrelation zwischen BMI und Aktivierung des Striatums (Caudate und Putamen) als Antwort auf schmackhaften Schokoladenmilchshake bei menschlichen Patienten. Darüber hinaus war diese inverse Beziehung am deutlichsten bei Individuen, die das TaqIA-A1-Allel trugen (Stice et al., 2008a). Zukünftige Gewichtszunahme bei diesen Personen, gemessen 1 Jahr nach der ersten Bildgebung, zeigte, dass das Ausmaß der striatalen Aktivierung als Reaktion auf schmackhafte Nahrung negativ mit der Gewichtszunahme bei Probanden mit dem A1-Allel korrelierte und positiv in den Nicht-A1-Allel-Probanden korrelierte ( Stice et al., 2008a). In einer Folgestudie wurde berichtet, dass das Ausmaß der Striatum-Aktivierung als Reaktion auf das imaginäre Essen von schmackhafter Nahrung im Gegensatz zu seinem tatsächlichen Konsum umgekehrt mit der Gewichtszunahme im folgenden Jahr bei Patienten mit dem A1-Allel, aber positiv korrelierte korreliert in Nicht-A1-Allel-Subjekten (Stice et al., 2010b). Diese Ergebnisse deuten darauf hin, dass D2Rs striatale Reaktion auf schmackhaftes Essen regulieren und dass verminderte D2R-Signale, die durch Gewichtszunahme oder genetische Faktoren induziert werden, die Anfälligkeit für Fettleibigkeit erhöhen können.
Mangelhafte D2R-Signalgebung trägt zu Belohnungsdefiziten bei Adipositas bei
Ähnlich wie die herabregulierten striatalen D2R-Spiegel bei übergewichtigen Menschen, sind die D2R-Spiegel auch bei Mäusen und Ratten erniedrigt, die eine schmackhafte Diät erhalten (z. B. [Colantuoni et al., 2001], [Geiger et al., 2009] und [Johnson und Kenny , 2010]) und bei genetisch zu Adipositas prädisponierten Ratten (Zucker-Ratten) (Thanos et al., 2008). Unser Labor hat direkt die Rolle der gestörten Striatum-Dopamin-Übertragung im Allgemeinen untersucht und insbesondere die D2R-Signalgebung bei den suchtartigen Belohnungsdefiziten, die bei Ratten während der Entwicklung von Fettleibigkeit auftreten, verringert (siehe Abbildung 5). Insbesondere testeten wir die Auswirkungen der Verringerung der Expression von striatalen D2Rs in Ratten mit viral-vermittelten RNA-Interferenz, dann BSR Schwellenwerte, wenn Ratten Zugang zu Chow nur oder Chow in Kombination mit 18-23 hr täglichen Zugang zu einem schmackhaften hochenergetischen hatte Diät (dh eine Cafeteria-Diät) (Johnson und Kenny, 2010). Wir fanden heraus, dass die Reaktion auf die belohnende LH-Stimulation fast augenblicklich nach der Aufnahme in die Cafeteria-Diät in den D2R-Knockdown-Ratten (Johnson und Kenny, 2010; Abbildung 5) abnahm. Ein Absinken der striatalen D2R-Spiegel beschleunigt daher schnell das Entstehen einer Belohnungs-Hypofunktionalität bei Ratten mit erweitertem Zugang zu hoch schmackhafter Nahrung, ein Prozess, der bei Kontrollratten mit erweitertem Zugang zu schmackhafter Ernährung typischerweise viele Wochen benötigt. Der Knockdown von striatalen D2Rs bei Ratten mit Zugang zu Futter reagierte jedoch nicht auf eine LH-Stimulation, was darauf hindeutet, dass eine verminderte striatale D2R-Signalgebung mit anderen ernährungsinduzierten adaptiven Reaktionen in Belohnungsschaltungen des Gehirns interagiert, um eine Belohnungs-Hyposensitivität auszulösen. Zusätzlich zu den erniedrigten D2R-Spiegeln werden auch andere Aspekte der striatalen dopaminergen Übertragung in den Gehirnen adipöser Ratten verändert. Zum Beispiel haben Sprague-Dawley-Ratten mit selektiver Selektivität zur schnellen Gewichtszunahme bei einer energiereichen Ernährung (Adipositas-neigende Ratten) niedrigere basale und evozierte Dopaminspiegel im NAc als Ratten, die resistent gegen Gewichtszunahme sind (Adipositas-resistente Ratten) (Geiger et al., 2008; siehe auch Rada et al., 2010). Die Adipositas-anfälligen Ratten weisen auch verringerte Dopamin-Biosynthese- und Speicherungsmechanismen auf, was nahe legt, dass ein Versagen bei der Produktion und Freisetzung von Dopamin zu Defiziten bei der Striatum-Dopamin-Übertragung bei fettleibigen Ratten beiträgt (Geiger et al., 2008). Ratten, die Adipositas durch Überkonsum einer schmackhaften, energiereichen Diät entwickelten, wiesen im NAc niedrigere basale und evozierte Dopaminspiegel auf als Ratten, die nur Zugang zu Standardfutter hatten ([Davis et al., 2008] und [Geiger et al. 2009]). Wichtig war, dass eine Mahlzeit mit Standardfutter ausreichend war, um die Dopaminspiegel in der NAc der Kontrollratten zu erhöhen, wohingegen nur die hoch schmackhaften Nahrungsmittel ausreichten, um eine akkumulierte Dopaminfreisetzung in den adipösen Ratten auszulösen, die einen ausgedehnten Zugang zu dem schmackhaften Futter hatten (Geiger et al., 2009). Diese Ergebnisse zeigen, dass die Entwicklung von Adipositas bei Ratten mit einer Dysfunktion der mesostriatalen Dopamin-Übertragung assoziiert ist, am deutlichsten bei striatalen D2Rs, und dass defizientes D2R-Signal zur Entstehung von Belohnungsdefiziten während der Entwicklung von Fettleibigkeit bei Ratten beiträgt. Dies steht im Einklang mit der Tatsache, dass die Herunterregulation striataler D2Rs eine bemerkenswerte neuroadaptive Reaktion auf Gewichtszunahme beim Menschen ist (Barnard et al., 2009, [Stice et al., 2008a] und [Wang et al., 2001]). und diese defiziente striatale D2R-Signalgebung kann striatale Reaktionen auf hedonische Nahrung in menschlichen Subjekten abstumpfen, wodurch das Individuum für zukünftige Gewichtszunahme prädisponiert wird ([Stice et al., 2008a] und [Wang et al., 2001]).
Abbildung 5. D2-Dopaminrezeptoren, Belohnungsstörung und Zwanghaftigkeit bei Fettleibigkeit - Der Abbau von Dopamin-D2-Rezeptoren (D2R) im Rattenstriatum beschleunigt das Auftreten von Belohnungsstörungen und zwanghaftem Essen bei Ratten mit erweitertem Zugang zu schmackhafter Nahrung.
Mangelhafte D2R-Signalisierung kann zwanghaftes Essen bei Adipositas auslösen
Adipositas ist durch Überernährung gekennzeichnet, die trotz eines ausdrücklichen Wunsches, Konsum und Wissen über die tiefgreifenden negativen gesundheitlichen und sozialen Folgen anhaltenden übermäßigen Konsums einzuschränken, bestehen bleibt (Booth et al., 2008, Delin et al., 1997 und Puhl et al., 2008]). Dies wird durch die Tatsache veranschaulicht, dass viele adipöse Patienten potenziell gefährlichen bariatric (Magenbypass) Operation unterzogen werden, um ihr Gewicht zu kontrollieren (Yurcisin et al., 2009), aber häufig Rückfall zu übermäßiges Essen, obwohl die Operation subjektive Bewertungen von Hunger reduziert und reduziert Fähigkeit, große Mengen an Nahrungsmitteln zu konsumieren ([Kalarchian et al., 2002] und [Saunders, 2001]). Drogenabhängigkeit ist in ähnlicher Weise definiert als ein Verlust der Hemmungskontrolle über den Drogenkonsum und die Beharrlichkeit in der Gewohnheit, trotz des Bewusstseins über die möglicherweise verheerenden gesundheitlichen, sozialen oder finanziellen Folgen (DSM-IV; American Psychiatric Association, 1994). Daher sind Adipositas und Drogenabhängigkeit die Kennzeichen von Zwangsstörungen insofern, als es einen auffälligen Fehler gibt, Informationen über zukünftige schädliche Konsequenzen zu verwenden, um den Konsum und die Persistenz des Konsums trotz der Verfügbarkeit von weniger schädlichen alternativen Verhaltensweisen zu moderieren.
Die zwanghafte Medikamenteneinnahme wurde operativ bei Nagetieren als Konsum definiert, der resistent gegen Unterdrückung durch Bestrafung oder Umweltreize ist, die eine Bestrafung vorhersagen ([Pelloux et al., 2007] und [Vanderschuren und Everitt, 2004]). Perioden mit erweitertem Zugang zu Kokain und anderen Missbrauchsdrogen können das Auftreten von zwanghaften Drogenkonsumverhalten bei Ratten auslösen ([Ahmed und Koob, 1998], [Deroche-Gamonet et al., 2004] und [Vanderschuren und Everitt, 2004] ). In der Tat zeigen Ratten mit einer Vorgeschichte von ausgedehntem Kokainkonsum eine Aufnahme, die störungsresistent ist durch einen aversiv konditionierten Stimulus (CS), der ein negatives Ergebnis vorhersagt (dh ein Licht, das die Abgabe eines aversiven Fußschocks vorhersagt) ([Belin et al., 2008]). und [Vanderschuren und Everitt, 2004]). Umgekehrt kann die gleiche aversive CS die Reaktionen auf das Drogen-Suchverhalten bei Ratten mit relativ begrenztem Zugang zu dem Medikament drastisch verringern. In Anbetracht der Ähnlichkeiten zwischen zwanghaftem Drogenkonsum bei Abhängigkeit und Überernährung bei Adipositas haben wir kürzlich untersucht, ob adipöse Ratten schmackhaftes Essen zwanghaft konsumieren und wenn striatale D2Rs in diesem Prozess eine Rolle spielen (Johnson und Kenny, 2010). Wir fanden heraus, dass adipöse Ratten, die schon lange Zugang zu schmackhaftem Essen hatten, auch in Gegenwart eines schädlichen CS (ein leichter Hinweis), der die Abgabe eines aversiven Fußschocks voraussagte (Johnson und Kenny, 2010), schmackhaftes Essen aßen. Im Gegensatz dazu unterbrach derselbe aversive CS den schmackhaften Nahrungskonsum bei mageren Ratten mit sehr geringer Exposition gegenüber energiereichem schmackhaftem Futter. Der schmackhafte Verzehr von Lebensmitteln kann daher bei adipösen Ratten genauso zwanghaft werden wie der Konsum von Kokain zwanghaft werden kann. Übereinstimmend mit dieser Interpretation der Daten verbrachten Mäuse, die zuvor Zugang zu einer wohlschmeckenden fettreichen Diät hatten, mehr Zeit in einer aversiven Umgebung (hell erleuchtet), um die schmackhaftere Nahrung zu erhalten als Mäuse ohne vorherige Erfahrung mit der Diät (Teegarden und Bale , 2007). Aus Angst vor Prädation sind hell erleuchtete offene Arenen sehr aversiv gegenüber Mäusen (Suarez und Gallup, 1981). Mäuse werden daher resistent gegen die potentiell negativen Konsequenzen ihres Nahrungssuchverhaltens und riskieren eine Prädation, um schmackhafte Nahrung zu erhalten, selbst wenn weniger wohlschmeckende Nahrung zu einem weitaus geringeren Risiko verfügbar ist.
Interessanterweise ist das A1-Allel des TaqIA-Polymorphismus, das zu einer verringerten striatalen D2R-Dichte (Noble, 2000) und einer abgestumpften Striatumaktivierung als Reaktion auf schmackhaftes Essen führt (Stice et al., 2008a), ebenfalls mit Lerndefiziten assoziiert, die solche Handlungen vermeiden negative Konsequenzen (Klein et al., 2007). Es ist genau diese Art des Versagens, Informationen zu verwenden, die sich auf zukünftige negative Folgen von Überernährung beziehen, die zur Entwicklung von zwanghaftem Essen bei übergewichtigen Personen beitragen können. Wir fanden heraus, dass das Auftreten von zwanghaftem Essen bei Ratten mit Zugang zu schmackhafter Nahrung nach striatalem D2R-Knockdown dramatisch beschleunigt wurde (Johnson und Kenny, 2010). Tatsächlich zeigten Ratten mit striatalem D2R-Knockdown, der zuvor nur 14-Tage mit erweitertem Zugang zu energiereichem, schmackhaftem Futter hatte, einen schmackhaften Nahrungskonsum, der durch eine aversive CS resistent war (Johnson und Kenny, 2010; Abbildung 5). Jedoch war diese 14-Tag-Periode einer begrenzten Exposition gegenüber der schmackhaften Nahrung nicht ausreichend, zwanghaftes Essen bei Kontrollratten (Johnson und Kenny, 2010) zu induzieren. Diese Ergebnisse legen nahe, dass bei adipösen Ratten eine suchtähnliche, zwanghafte Aufnahme schmackhafter Nahrung auftreten kann. Darüber hinaus beschleunigt der defiziente striatale D2R-Signalweg, der das Auftreten von Belohnungs-Hyposensitivität als Reaktion auf den Überkonsum schmackhafter Nahrungsmittel beschleunigt, das Auftreten von zwanghaftem Essen (Abbildung 5).
Wechselwirkungen zwischen D2Rs und Hormonellen Regulatoren der Energiebilanz bei Adipositas
Exogenes Leptin, das in die VTA verabreicht wird, hemmt das Mesoaccumbens-Dopamin-Transmissions- und -Fütterungsverhalten ([Hommel et al., 2006] und [Krügel et al., 2003]). Zusätzlich zu seiner akuten inhibitorischen Wirkung auf Mittelhirn-Dopamin-Systeme gibt es einen akkumulierenden Beweis, dass tonische Leptin-Signalgebung auch notwendig sein kann, um angemessene Mengen an mesostriataler Dopamin-Signalgebung aufrechtzuerhalten. Flier und Kollegen fanden heraus, dass ob / ob-Mäuse niedrigere Niveaus an Tyrosinhydroxylase in Dopaminneuronen des Mittelhirns hatten, einem Schlüsselenzym in der Biosynthese von Dopamin (Fulton et al., 2006). Zusätzlich hatten ob / ob-Mäuse die evozierte Dopaminfreisetzung in den NAc reduziert (Fulton et al., 2006) und die somato-dendritischen vesikulären Speicher von Dopamin in VTA und SN verringert (Roseberry et al., 2007). Diese Mängel in der Dopaminproduktion und Signaltransduktionsmaschinerie in ob / ob-Mäusen wurden durch Behandlung mit Leptin korrigiert ([Fulton et al., 2006] und [Pfaffley et al., 2010]). Tatsächlich war Leptin, das nur in das LH infundiert wurde, ausreichend, um die dysfunktionale Dopaminübertragung in ob / ob-Mäusen (Leintinger et al., 2009) zu korrigieren, was nahelegt, dass die Leptinrezeptor-exprimierenden Zellen in dem LH entsprechende Dopamin-Signalisierungsmengen aufrechterhalten. Zusätzlich zu verminderter Produktion und Freisetzung von Dopamin tendierten ob / ob-Mäuse auch dazu, geringere Mengen an D2R-Expression im Striatum aufzuweisen (Pfaffly et al., 2010). Darüber hinaus senkte exogene Leptinbehandlung unter einem Regime, das zur Entwicklung von Unempfindlichkeit gegenüber Leptinsignalisierung führt (dh Leptinresistenz), die striatalen D2R-Spiegel in Wildtypmäusen merklich (Pfaffly et al., 2010). Übergewichtige Ratten entwickeln Leptinresistenz in der VTA ([Matheny et al., 2011] und [Scarpace et al., 2010]) und haben auch niedrigere TH-Spiegel in VTA, verminderte Dopaminfreisetzung im Striatum und reduzierte striatale D2R-Spiegel (Geiger et al., 2008). Zusammengefasst zeigen diese Daten, dass Leptin komplexe Wirkungen auf Dopaminsysteme des Mittelhirns hat. Auf der einen Seite übt die akute Aktivierung von Leptinrezeptoren in der VTA eine hemmende Wirkung auf die Dopaminübertragung von Mesoaccumbens aus und kann das Fressverhalten hemmen ([Hommel et al., 2006] und [Krügel et al., 2003]). Andererseits ist die Leptin-Signalgebung im Mittelhirn notwendig, um eine angemessene Dopaminproduktion und Signalübertragung aufrechtzuerhalten, und genetische Defizite bei der Leptinsignalisierung oder die Entwicklung einer Leptinresistenz bei Fettleibigkeit stört Mesoaccumbens-Dopaminsysteme zutiefst. Daher ist es eine interessante Möglichkeit, dass die Entwicklung von Leptinresistenz in dopaminergen Neuronen des Mittelhirns während der Entwicklung von Adipositas eine zentrale Rolle bei der Unterbrechung der striatalen D2R-Signaltransduktion spielen könnte, die die Entstehung von suchtähnlicher Belohnungsdysfunktion und zwanghaftem Überessen anregt (Abbildung 5) in adipösen Ratten.
Zusätzlich zu den komplexen Auswirkungen der Leptin-Signalübertragung auf die mesostriatale dopaminerge Transmission gibt es eine Reihe von Belegen dafür, dass D2Rs wiederum die Leptinsignalisierung regulieren können. Der D2R-Agonist Bromocriptin reduziert die zirkulierenden Leptinspiegel (Doknic et al., 2002, Kok et al., 2006 und Mastronardi et al., 2001), was darauf hindeutet, dass D2Rs einen hemmenden Einfluss auf die Leptinspiegel ausüben. Darüber hinaus haben Mäuse mit Nullmutation im D2R-Gen im Hypothalamus eine verstärkte Leptin-Signalübertragung und sind empfindlicher gegenüber den anorektischen Wirkungen von Leptin (Kim et al., 2010). Es ist bekannt, dass die Leptinspiegel während der Entwicklung von Fettleibigkeit (Hyperleptinämie) zunehmen, gleichzeitig aber die Empfindlichkeit gegenüber Leptinsignalisierung (dh Leptinresistenz) abnimmt (Hamilton et al., 1995). Daher ist es eine interessante Möglichkeit, dass eine Abnahme der striatalen D2R-Signalisierung während der Entwicklung von Adipositas eine kompensatorische Reaktion auf übermäßigen Verzehr von schmackhafter Nahrung und Gewichtszunahme darstellt, die zirkulierende Leptinspiegel erhöht und ihre Signalisierungseffizienz erhöht, um die Entwicklung von Leptinresistenz zu überwinden. Eine solche Wirkung kann die inhibitorischen Wirkungen von Leptin auf striatale Systeme verstärken, die die Ansprechbarkeit auf schmackhaftes Essen regulieren ([Farooqi et al., 2007], [Fulton et al., 2006] und [Hommel et al., 2006]), wodurch sie wirken hedonische Reaktionen auf schmackhaftes Essen abzuschwächen. Zusammen mit der oben beschriebenen regulatorischen Rolle von Leptin bei D2R scheint es, dass die Leptin- und D2R-Signalgebung in reziproker Weise gekoppelt werden kann, um homöostatische und hedonische Aspekte des Nahrungsaufnahmeverhaltens zu regulieren.
Dysregulierte Gehirn-Stress-Systeme bei Adipositas
Die Leptin-Signalübertragung im Mittelhirn bewirkt eine Regulierung der mesoaccumbienden Dopamin-Übertragung und die Reaktion auf hedonisches Essen. Neuronen in der VTA, die Leptinrezeptoren exprimieren, projizieren jedoch nur spärlich auf NAc und zeigen stattdessen prominentere Projektionen zum zentralen Kern der Amygdala (CeA) (Leshan et al., 2010). Im Zusammenhang mit dem Fütterungsverhalten ist bekannt, dass die CeA die inhibitorischen Effekte schädlicher Umweltreize auf den Nahrungskonsum reguliert (Petrovich et al., 2009). Insbesondere Läsionen der CeA, aber nicht basolateralen Amygdala (BLA), beseitigen die inhibitorischen Effekte eines Fußschock-gepaarten konditionierten Stimulus auf die Fütterung, was darauf hindeutet, dass die CeA entscheidend für die inhibitorische Kontrolle über das Fressverhalten ist. Petrovich et al., 2009). Übergewichtige Ratten oder nicht-adipöse Ratten mit striatalem D2R-Knockdown und Zugang zu schmackhaften Nahrungsmitteln konsumieren weiterhin schmackhaftes Essen zwanghaft in Gegenwart einer aversiven CS. Diese Wirkungen sind auffallend ähnlich zu der Störung der Reaktivität gegenüber einer aversiven CS in CeA-läsionierten Ratten (Petrovich et al., 2009). Daher ist es wichtig zu bestimmen, ob Veränderungen in der CeA-Aktivität, möglicherweise als Folge einer striatalen D2R-Herunterregulierung oder der Entwicklung von Leptinresistenz im Mittelhirn, zur Entstehung von zwanghaftem Essen bei fettleibigen Ratten beitragen.
Neben der Regulierung der Auswirkungen schädlicher Umweltreize auf das Fütterungsverhalten kann die CeA auch eine Schlüsselrolle beim stressbedingten hedonischen Essen spielen. Beim Menschen motiviert Stress stark zur Auswahl und zum Verzehr von energiedichten, schmackhaften Lebensmitteln, unabhängig vom Kalorienbedarf ([Gluck et al., 2004], [Kandiah et al., 2006] und [O'Connor et al., 2008]). und Fettleibigkeit ist mit einer erhöhten stressbedingten Glukokortikoidsekretion verbunden ([Björntorp und Rosmond, 2000] und [la Fleur, 2006]). Umwelt- und Sozialstressoren induzieren bei Nagetieren und Affen auch eine Hyperphagie von energiedichten schmackhaften Nahrungsmitteln, wobei schmackhafte Nahrungsaufnahme möglicherweise die nachteiligen Auswirkungen von Stress abschwächt ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et al., 2004] und [Wilson et al., 2008]). Darüber hinaus kann das stressauslösende Medikament Yohimbin zuvor ausgelöschte schmackhafte Nahrungssuchreaktionen (Drücken des Hebels) bei Ratten wiederherstellen, ein Effekt, der durch den Corticotropin-Releasing-Faktor-1 (CRF-1) -Rezeptorantagonisten Antalarmin abgeschwächt wird (Ghitza et al., 2006) ). Es ist wichtig darauf hinzuweisen, dass die genauen Auswirkungen von Stress auf den Lebensmittelkonsum bei Menschen und Labortieren von der Art und Größe des Stressors, der Art des zum Verzehr verfügbaren Lebensmittels (schmackhaft gegenüber langweilig), dem Körpergewicht und dem Geschlecht (Dallman) abhängen , 2010).
Mäuse mit erweitertem Zugang zu einer schmackhaften, fettreichen Diät hatten eine verminderte Expression des Stresshormons CRF in der CeA (Teegarden und Bale, 2007). Umgekehrt hatten Mäuse, die sich von der schmackhaften Diät "entziehen", eine erhöhte CRF-Expression in der CeA (Teegarden und Bale, 2007). Dieser letztere Effekt ist der erhöhten CRF-Expression in CeA sehr ähnlich, die bei Ratten nachgewiesen wurde, die sich von allen Hauptdrogen des Missbrauchs zurückziehen (Koob, 2010). Da ein weiterer Drogenkonsum diese aversive neurobiologische Reaktion auf den Drogenentzug normalisieren kann, wurde die Hypothese aufgestellt, dass eine hyperaktive CRF-Übertragung in CeA und anderen limbischen Strukturen die Entwicklung eines zwanghaften Drogenkonsums erleichtern könnte (Koob und Zorrilla, 2010). Übereinstimmend mit dieser Ansicht verbrachten Mäuse, die sich aus schmackhaftem energiereichem Futter, das erhöhte CRF-Spiegel in CeA aufwies, signifikant mehr Zeit in einer aversiven (hell erleuchteten) Umgebung, um schmackhafteres Essen zu erhalten als Mäuse ohne vorherige Erfahrung mit dem Essen obwohl weniger schmackhaft war in einer nonversive (dunkel beleuchteten) Umgebung (Teegarden und Bale, 2007). Mäuse werden daher resistent gegen die potentiell negativen Konsequenzen ihres Nahrungssuchverhaltens und riskieren die Prädation, schmackhafte Nahrung zu erhalten, selbst wenn weniger schmackhafte Nahrung zu einem viel geringeren Risiko verfügbar ist, teilweise um die CRF-Übertragung in der CeA zu dämpfen (Teegarden und Bale, 2007). Mehrere weitere Beweise unterstützen eine Rolle bei der Übertragung von CNI bei Zwangsernährung. Eine aktuelle Studie untersuchte insbesondere die Auswirkungen des CRF-1-Rezeptor-Antagonisten R121919 auf den Verzehr von Nahrungsmitteln bei Ratten, die sich einer zyklischen Futtervariation unterziehen, bei der sie Zugang zu Standard-Chow 5-Tagen pro Woche und Zugang zu einer schmackhaften Zuckerdiät 2 Tage pro Tag hatten Woche (Cottone et al., 2009). Nach den 7-Wochen dieser zyklischen Futtervariation dämpfte R121919 den übermäßigen Verzehr der äußerst schmackhaften Ernährung und erhöhte den Konsum von blassem Futter (Cottone et al., 2009). Darüber hinaus waren die CRF-Expressionsspiegel in der CeA bei den Ratten im Zyklus während des Entzugs aus der schmackhaften Diät erhöht, kehrten jedoch nach erneuter Exposition gegenüber der schmackhaften Diät (Cottone et al., 2009) auf die Ausgangswerte zurück. Schließlich war die CRF-Regulation der GABAergen Transmission in der CeA bei den im Kreislauf genommenen Ratten erhöht, die im Vergleich zu Kontrollratten, die zuvor nur Zugang zu blassem Futter hatten, einen Rückzug von der schmackhaften Diät einging, was sich in der Tatsache widerspiegelt, dass R121919 das GABAerge inhibitorische postsynaptische Potential inhibierte CeA-Schnitte von den zyklierten Ratten in einer Konzentration, die die Übertragung in Scheiben von den Kontrollratten nicht veränderte (Cottone et al., 2009). Interessanterweise wurde ein ähnlicher Effekt von CRF auf die GABAerge Transmission in CeA auch bei Ratten beobachtet, die sich einer chronischen Ethanolexposition aussetzen (Roberto et al., 2010). Schließlich bilden die CeA, der Bettnukleus der Stria terminalis (BNST) und die NAc-Schale eine größere zusammenhängende Struktur, die "erweiterte Amygdala" genannt wird. Die Infusion von CRF in die NAc-Schale an Stellen, die hedonisches Essen stimulieren, erhöht die motivationale Salienz einer Umwelt Stichwort, das zuvor mit der Verfügbarkeit von schmackhaften Lebensmitteln gepaart worden war (Peciña et al., 2006a). Stress kann daher die Ausprägung von Nahrungs-gepaarten Umweltreizwerten durch Modulation der Aktivität von NAc-Hüllenneuronen verstärken. Zusammenfassend legen diese Ergebnisse nahe, dass exzessiver Konsum schmackhafter Nahrung oder Drogen missbrauchähnliche neuroadaptive Reaktionen in extrahypothalamischen Stresswegen im Gehirn induzieren können, die zu zwanghaften Konsumverhalten beitragen können.
Schlussfolgerungen
In letzter Zeit wurden große Fortschritte bei der Identifizierung von Gehirnsystemen erzielt, die an den hedonischen Wirkungen von schmackhaften Lebensmitteln beteiligt sind, sowie bei den Anpassungen, die in diesen Schaltkreisen als Reaktion auf den übermäßigen Verbrauch von schmackhaften Lebensmitteln und die Gewichtszunahme auftreten. Es fällt auf, dass ähnliche Gehirnsysteme und gemeinsame Anpassungsreaktionen als Reaktion auf den Konsum von schmackhaften Lebensmitteln und Suchtmitteln ausgelöst werden. Insbesondere der übermäßige Konsum von schmackhaften Lebensmitteln oder Drogen führt zu ähnlichen Defiziten bei der Reaktionsfähigkeit von Gehirnbelohnungssystemen. Schmackhafte Lebensmittel und Suchtmittel führen zu Defiziten bei der Übertragung von striatalem Dopamin und der Expression von striatalen D2Rs. Schmackhafte Nahrung und Suchtmittel lösen auch die Entstehung eines zwanghaften Konsumverhaltens bei Nagetieren aus und lösen extrahypothalamische Stressreaktionen aus. Schließlich können häufige genetische Schwachstellen in Belohnungssystemen des Gehirns Menschen für übermäßiges Essen und Fettleibigkeit sowie für Drogenkonsum und Sucht prädisponieren. Aufgrund dieser und anderer Ähnlichkeiten zwischen Fettleibigkeit und Drogenabhängigkeit wurde argumentiert, dass Fettleibigkeit als diagnostische Kategorie in das bevorstehende DSM-V aufgenommen werden sollte ([Devlin, 2007] und [Volkow und O'Brien, 2007]). ). Vor diesem Hintergrund werden kritische Bereiche für die zukünftige Forschung die weitere Untersuchung der möglichen neurobiologischen Überschneidungen zwischen zwanghaftem Überessen und Drogenkonsum umfassen. Zum Beispiel wird es wichtig sein zu testen, ob Fettleibigkeit mit der Entwicklung eines gewohnheitsähnlichen Konsumverhaltens zusammenhängt, das aus der Plastizität des dorsalen Striatum resultiert, genauso wie die Drogenabhängigkeit mit dem striatalen Umbau und dem Auftreten einer gewohnheitsähnlichen Drogensuche zusammenhängen kann Verhalten ([Everitt und Robbins, 2005], [Hollander et al., 2010] und [Kasanetz et al., 2010]). Auch kortikale Hirnregionen, die an der exekutiven Kontrolle und Entscheidungsfindung (dh dem präfrontalen Kortex) und an der interozeptiven Verarbeitung (Inselkortex) beteiligt sind, sind stark an der Drogenabhängigkeit beteiligt ([Everitt et al., 2008], [Fineberg et al., 2010) ], [Koob und Volkow, 2010] und [Naqvi und Bechara, 2009]), über ihre genaue Rolle bei zwanghaftem Essen und Fettleibigkeit ist jedoch wenig bekannt, z. B. ([Nair et al., 2011] und [Volkow et al. , 2009]). Zusammengenommen stützen die oben besprochenen Daten die Annahme, dass Fettleibigkeit und Drogenabhängigkeit aus ähnlichen neuroadaptiven Reaktionen in Belohnungsschaltungen des Gehirns resultieren können, und legen nahe, dass bekannte Suchtmechanismen einen heuristischen Rahmen für das Verständnis von Fettleibigkeit bieten können.
Anerkennungen
Der Autor wird durch Zuschüsse des Nationalen Instituts für Drogenmissbrauch (NIDA) unterstützt. Der Autor ist Paul Johnson und Christie Fowler für wertvolle Einsichten und Kommentare zum Manuskript dankbar. Dies ist die Handschrift Nummer 21042 von The Scripps Research Institute.
Bibliographie
1.
o Abizaid et al., 2006a
A. Abizaid, Q. Gao, TL Horvath
o Gedanken für Essen: Gehirnmechanismen und periphere Energiebilanz
o Neuron, 51 (2006), S. 691-702
o
2.
o Abizaid et al., 2006b
A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschöp et al.
o Ghrelin moduliert die Aktivität und die synaptische Eingangsorganisation der Dopaminneuronen des Mittelhirns und fördert gleichzeitig den Appetit
o J. Clin. Invest., 116 (2006), S. 3229-3239
o
3.
o Ahmed und Koob, 1998
o SH Ahmed, GF Koob
o Übergang von moderater zu übermäßiger Medikamentenaufnahme: Änderung des hedonischen Sollwerts
o Wissenschaft, 282 (1998), pp. 298-300
o
4.
o Ahmed und Koob, 2005
o SH Ahmed, GF Koob
o Übergang zur Drogenabhängigkeit: Ein negatives Verstärkungsmodell basierend auf einer allostatischen Abnahme der Belohnungsfunktion
o Psychopharmakologie (Berl.), 180 (2005), S. 473-490
o
5.
Ahmed et al., 2002
SH Ahmed, PJ Kenny, GF Koob, A. Markou
o Neurobiologische Evidenz für hedonische Allostase im Zusammenhang mit eskalierendem Kokainkonsum
o Nat. Neurosci., 5 (2002), S. 625-626
o
6.
o Allison et al., 1999
DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItallie
o Jährliche Todesfälle aufgrund von Fettleibigkeit in den Vereinigten Staaten
o JAMA, 282 (1999), S. 1530-1538
o
7.
o American Psychiatric Association, 1994
o Amerikanische Psychiatrische Vereinigung
o Diagnostisches und statistisches Handbuch psychischer Störungen
o (4. Auflage) American Psychiatric Association, Washington, DC (1994)
o
8.
Angeles-Castellanos et al., 2007
M. Angeles-Castellanos, J. Mendoza, C. Escobar
o Eingeschränkte Fütterungspläne Phasenverschiebung tägliche Rhythmen von c-Fos und Protein Per1 Immunoreaktivität in kortikolimbischen Regionen in Ratten
o Neurowissenschaften, 144 (2007), pp. 344-355
o
9.
Baicy et al., 2007
K. Baicy, ED London, J. Monterosso, ML Wong, T. Delibasi, A. Sharma, J. Licinio
o Leptin-Ersatz verändert die Reaktion des Gehirns auf Nahrungsmittelsignale bei genetisch Leptin-defizienten Erwachsenen
o Proc. Natl. Acad. Sci. USA, 104 (2007), S. 18276-18279
o
10
o Baldo et al., 2004
o BA Baldo, L. Gual-Bonilla, K. Sijapati, RA Daniel, CF Landry, AE Kelley
o Aktivierung einer Subpopulation von Orexin / Hypocretin-haltigen hypothalamischen Neuronen durch GABAA-Rezeptor-vermittelte Inhibition der Nucleus accumbens-Schale, jedoch nicht durch Exposition gegenüber einer neuartigen Umgebung
o Eur. J. Neurosci., 19 (2004), S. 376-386
o
11
o Balleine und Dickinson, 2000
o BW Balleine, A. Dickinson
o Die Wirkung von Läsionen des Inselcortex auf die instrumentelle Konditionierung: Beweis für eine Rolle im Anreizgedächtnis
o J. Neurosci., 20 (2000), S. 8954-8964
o
12
Barnard et al., 2009
B. Barnard, EP Noble, T. Ritchie, J. Cohen, DJ Jenkins, G. Turner-McGrievy, L. Gloede, AA Green, H. Ferdowsian
o D2 Dopaminrezeptor Taq1A Polymorphismus, Körpergewicht und diätetische Aufnahme bei Typ 2 Diabetes
o Ernährung, 25 (2009), pp. 58-65
o
13
o Basso und Kelley, 1999
AM Basso, AE Kelley
o Futter induziert durch GABA (A) -Rezeptorstimulation im Nucleus accumbens shell: Regionale Kartierung und Charakterisierung von Makronährstoffen und Geschmackspräferenz
o Verhalten Neurosci., 113 (1999), S. 324-336
o
14
o Batterham et al., 2007
RL Batterham, DH Ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
o PYY Modulation von kortikalen und hypothalamischen Hirnarealen prognostiziert das Nahrungsverhalten beim Menschen
o Natur, 450 (2007), S. 106-109
o
15
o Baxter und Murray, 2002
o MG Baxter, EA Murray
o Die Amygdala und Belohnung
o Nat. Rev. Neurosci., 3 (2002), S. 563-573
o
16
o Bean et al., 2008
o MK Bean, K. Stewart, ME Olbrisch
o Adipositas in Amerika: Implikationen für klinische und Gesundheitspsychologen
o J. Clin. Psychol. Med. Einstellungen, 15 (2008), S. 214-224
o
17
o Beaver ua, 2006
o JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o Individuelle Unterschiede im Belohnungsverhalten sagen neuronale Reaktionen auf Nahrungsbilder voraus
o J. Neurosci., 26 (2006), S. 5160-5166
o
18
o Belin et al., 2008
D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o Hohe Impulsivität sagt den Wechsel zu zwanghaftem Kokainkonsum voraus
o Wissenschaft, 320 (2008), pp. 1352-1355
o
19
o Berridge, 1996
o KC Berridge
o Essen Belohnung: Brain Substrate des Wollens und Mögens
o Neurosci. Biobehav. Rev., 20 (1996), S. 1-25
o
20
o Berridge, 2009
o KC Berridge
o 'Liking' und 'wollen' Essen Belohnungen: Brain Substrate und Rollen bei Essstörungen
o Physiol. Verhalten, 97 (2009), pp. 537-550
o
21
o Björntorp und Rosmond, 2000
P. Björntorp, R. Rosmond
o Fettleibigkeit und Cortisol
o Ernährung, 16 (2000), pp. 924-936
o
22
o Blundell und Herberg, 1968
o JE Blundell, LJ Herberg
Relative Effekte von Ernährungsdefizit und Deprivationsperiode auf die Rate der elektrischen Selbststimulation des lateralen Hypothalamus
o Natur, 219 (1968), S. 627-628
o
23
o Booth et al., 2008
ML Stand, RL Wilkenfeld, DL Pagnini, SL Stand, LA King
o Wahrnehmung von Jugendlichen zu Übergewicht und Adipositas: Das Gewicht der Meinungsstudie
o J. Paediatr. Kindergesundheit, 44 (2008), pp. 248-252
o
24
o Bragulat et al., 2010
B. Bragulat, M. Dzemidzic, C. Bruno, CA Cox, T. Talavage, RV Considine, DA Kareken
o Essensbezogene Geruchssignale von Gehirn-Belohnungskreisen während des Hungers: Eine Pilot-fMRI-Studie
o Fettleibigkeit, Silver Spring, MD (2010)
o
25
o Cabanac und Johnson, 1983
M. Cabanac, KG Johnson
o Analyse eines Konflikts zwischen Schmackhaftigkeit und Erkältung bei Ratten
o Physiol. Verhalten, 31 (1983), pp. 249-253
o
26
o Campfield et al., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o Rekombinantes Maus-OB-Protein: Anzeichen für ein peripheres Signal, das Adipositas und zentrale neuronale Netzwerke verbindet
o Wissenschaft, 269 (1995), pp. 546-549
o
27
o Cannon und Palmiter, 2003
CM Cannon, RD Palmiter
o Belohnung ohne Dopamin
o J. Neurosci., 23 (2003), S. 10827-10831
o
28
o Carr und Simon, 1984
o KD Carr, EJ Simon
o Potenzierung der Belohnung durch Hunger ist Opioid-vermittelt
o Gehirn Res., 297 (1984), pp. 369-373
o
29
o Zentren für Krankheitskontrolle und Prävention, 2009
o Zentren für Krankheitskontrolle und -prävention (2009). US-Adipositas-Trends (Atlanta: Zentren für Krankheitskontrolle und Prävention).
o
30
o Colantuoni et al., 2001
C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, GJ Schwartz, TH Moran, BG Hoebel
o Übermäßige Zuckeraufnahme verändert die Bindung an Dopamin- und Mu-Opioid-Rezeptoren im Gehirn
o Neuroreport, 12 (2001), S. 3549-3552
o
31
Cornelius et al., 2010
o JR Cornelius, M. Tipp- mann-Peikert, NL Slocumb, CF Frerichs, MH Silber
o Impulskontrollstörungen bei Verwendung von dopaminergen Wirkstoffen beim Restless-Legs-Syndrom: Eine Fall-Kontroll-Studie
o Schlaf, 33 (2010), pp. 81-87
o
32
o Cornier et al., 2009
o MA Cornier, AK Salzberg, DC Endlich, DH Bessesen, DC Rojas, JR Tregellas
o Die Auswirkungen von Überfütterung auf die neuronale Reaktion auf visuelle Nahrungsreize bei dünnen und übergewichtigen Personen
o PLoS ONE, 4 (2009), p. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33
o Cottone et al., 2009
o P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis et al.
o CRF-Systemrekrutierung vermittelt die dunkle Seite des zwanghaften Essens
o Proc. Natl. Acad. Sci. USA, 106 (2009), S. 20016-20020
o
34
o Dagher, 2009
o A. Dagher
o Die Neurobiologie des Appetits: Hunger als Sucht
o Int. J. Obes. (Lond.), 33 (Zusatz 2) (2009), S. S30-S33
o
35
o Dagher und Robbins, 2009
A. Dagher, TW Robbins
o Persönlichkeit, Sucht, Dopamin: Erkenntnisse aus der Parkinson-Krankheit
o Neuron, 61 (2009), S. 502-510
o
36
o Dallman, 2010
o MF Dallman
o Stress-induzierte Fettleibigkeit und das emotionale Nervensystem
o Trends Endocrinol. Metab., 21 (2010), S. 159-165
o
37
o Dallman et al., 2003
MF Dallman, N. Pecoraro, SF Akana, SE La Fleur, F. Gomez, H. Houshyar, ME Bell, S. Bhatnagar, KD Laugero, S. Manalo
o Chronischer Stress und Fettleibigkeit: Eine neue Sichtweise von "comfort food"
o Proc. Natl. Acad. Sci. USA, 100 (2003), S. 11696-11701
o
38
o Dallman et al., 2006
MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
o Glukokortikoide, chronischer Stress und Fettleibigkeit
o Prog. Gehirnres., 153 (2006), pp. 75-105
o
39
o Davis et al., 2004
C. Davis, S. Strachan, M. Berkson
o Empfindlichkeit gegenüber Belohnung: Implikationen für Überessen und Übergewicht
o Appetit, 42 (2004), pp. 131-138
o
40
o Davis et al., 2008
JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o Exposition gegenüber erhöhten Nahrungsfettwerten vermindert die psychostimulierende Belohnung und den mesolimbischen Dopaminumsatz bei der Ratte
o Verhalten Neurosci., 122 (2008), S. 1257-1263
o
41
o de Araujo et al., 2010
o IE de Araujo, X. Ren, JG Ferreira
o Metabolic Sensing im Gehirn Dopamin-Systeme
o Ergebnisse Probl. Cell Differ., 52 (2010), S. 69-86
o
42
o Delin et al., 1997
CR Delin, JM Watts, JL Saebel und PG Anderson
o Essverhalten und die Erfahrung von Hunger nach Magen-Bypass-Operation bei krankhafter Fettleibigkeit
O Obes. Surg., 7 (1997), S. 405-413
o
43
o Deroche-Gamonet et al., 2004
V. Deroche-Gamonet, D. Belin, PV Piazza
o Nachweis für suchtähnliches Verhalten bei der Ratte
o Wissenschaft, 305 (2004), pp. 1014-1017
o
44
Devlin, 2007
O MJ Devlin
o Gibt es in DSM-V einen Platz für Fettleibigkeit?
o Int. J. Essen. Disord., 40 (Ergänzung) (2007), S. S83-S88
o
45
o Doknic et al., 2002
M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
o Dopaminerge Tonus und Fettleibigkeit: Ein Einblick von Prolaktinomas mit Bromocriptin behandelt
o Eur. J. Endocrinol., 147 (2002), S. 77-84
o
46
o Everitt und Robbins, 2005
BJ Everitt, TW Robbins
o Neuronale Verstärkungssysteme für Drogenabhängigkeit: Von Handlungen über Gewohnheiten zu Zwängen
o Nat. Neurosci., 8 (2005), S. 1481-1489
o
47
Everitt et al., 2008
BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o Überprüfung. Neurale Mechanismen, die der Vulnerabilität unterliegen, zwanghafte Drogensuchtgewohnheiten und Sucht zu entwickeln
o Philos. Trans. R. Soc. Lond. B Biol. Sci., 363 (2008), S. 3125-3135
o
48
o Farooqi et al., 2007
o IS Farooqi, E. Bullmore, J. Keogh, J. Gillard, S. O'Rahilly, PC Fletcher
o Leptin reguliert striatale Regionen und menschliches Essverhalten
o Wissenschaft, 317 (2007), p. 1355
o
49
o Felsted et al., 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Klein
o Genetisch bedingte Unterschiede in der Reaktion des Gehirns auf eine primäre Futterbelohnung
o J. Neurosci., 30 (2010), S. 2428-2432
o
50
o Figlewicz et al., 2001
o DP Figlewicz, MS Higgins, SB Ng-Evans, PJ Havel
o Leptin kehrt die Saccharose-konditionierte Präferenz in Ratten mit Nahrungsrestriktion um
o Physiol. Verhalten, 73 (2001), pp. 229-234
o
51
o Figlewicz et al., 2003
o DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o Expression von Rezeptoren für Insulin und Leptin im ventralen Tegmentum / Substantia nigra (VTA / SN) der Ratte
o Gehirn Res., 964 (2003), pp. 107-115
o
52
o Fineberg et al., 2010
o NA Fineberg, MN Potenza, SR Chamberlain, HA Berlin, L. Menzies, A. Bechara, BJ Sahakian, TW Robbins, ET Bullmore, E. Hollander
o Untersuchung von zwanghaften und impulsiven Verhaltensweisen, von Tiermodellen bis zu Endophänotypen: Eine Erzählung
o Neuropsychopharmakologie, 35 (2010), S. 591-604
o
53
o Finkelstein et al., 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
o Ökonomische Ursachen und Folgen von Fettleibigkeit
o Annu. Rev. Öffentliche Gesundheit, 26 (2005), pp. 239-257
o
54
o Flegal et al., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o Prävalenz und Trends bei Adipositas bei Erwachsenen in den USA, 1999-2008
o JAMA, 303 (2010), S. 235-241
o
55
o Foo und Mason, 2005
H. Foo, P. Mason
o Sensorische Unterdrückung während der Fütterung
o Proc. Natl. Acad. Sci. USA, 102 (2005), S. 16865-16869
o
56
o Franken und Muris, 2005
o IH Franken, P. Muris
o Individuelle Unterschiede in der Belohnungsempfindlichkeit hängen mit dem Verlangen nach Nahrung und dem relativen Körpergewicht bei gesunden Frauen zusammen
o Appetit, 45 (2005), pp. 198-201
o
57
o Friedman et al., 2011
A. Friedman, E. Lax, Y. Dikshtein, L. Abraham, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
o Die elektrische Stimulation der lateralen Habenula erzeugt eine inhibitorische Wirkung auf die Selbstverabreichung von Sucrose
o Neuropharmakologie, 60 (2011), S. 381-387
o
58
o Fulton et al., 2000
o S. Fulton, B. Woodside, P. Shizgal
o Modulation der Belohnungsschaltung des Gehirns durch Leptin
o Wissenschaft, 287 (2000), pp. 125-128
o
59
o Fulton et al., 2006
o S. Fulton, P. Pissios, RP Manchon, L. Stiles, L. Frank, EN Pothos, E. Maratos-Flier, JS Flier
o Leptin-Regulation des Mesoaccumbens-Dopaminweges
o Neuron, 51 (2006), S. 811-822
o
60
o Gao und Horvath, 2007
Q. Gao, TL Horvath
o Neurobiologie der Fütterung und Energieaufwand
o Annu. Rev. Neurosci., 30 (2007), S. 367-398
o
61
o Gautier et al., 2000
o JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tatarani
o Differenzielle Reaktionen des Gehirns auf Sättigung bei fettleibigen und schlanken Männern
o Diabetes, 49 (2000), S. 838-846
o
62
o Geiger et al., 2008
o BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, EG Kokkotou, EN Pothos
o Nachweis für defekte mesolimbische Dopamin-Exozytose bei Adipositas-gefährdeten Ratten
o FASEB J., 22 (2008), S. 2740-2746
o
63
o Geiger et al., 2009
o BM Geiger, M. Haburcak, NM Avena, MC Moyer, BG Hoebel, EN Pothos
o Defizite der mesolimbischen Dopamin-Neurotransmission bei diätetischer Fettleibigkeit bei Ratten
o Neurowissenschaften, 159 (2009), pp. 1193-1199
o
64
o Ghitza et al., 2006
o UE Ghitza, SM Grau, DH Epstein, KC Reis, Y. Shaham
o Neuropsychopharmakologie
o Das anxiogene Medikament Yohimbin stellt die schmackhafte Nahrungssuche in einem Ratten-Rückfallmodell wieder her: Eine Rolle von CRF (1) -Rezeptoren, 33 (2006), pp. 2188-2196
o
65
o Gluck et al., 2004
o MICH Gluck, A. Geliebter, J. Hung, E. Yahav
o Cortisol, Hunger und Verlangen, nach einem kalten Stresstest bei übergewichtigen Frauen mit Essattacken zu essen
o Psychosoma. Med., 66 (2004), S. 876-881
o
66
o Goldstone et al., 2009
AP Goldstone, CG Prechtl de Hernandez, JD Biber, K. Muhammed, C. Croese, G. Bell, G. Durighel, E. Hughes, AD Waldman, G. Frost, JD Bell
o Fasten verzerrt das Belohnungssystem des Gehirns gegenüber kalorienreichen Lebensmitteln
o Eur. J. Neurosci., 30 (2009), S. 1625-1635
o
67
o Halaas et al., 1995
o JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o Gewichtsreduzierende Wirkung des vom adipösen Gen kodierten Plasmaproteins
o Wissenschaft, 269 (1995), pp. 543-546
o
68
o Hamilton et al., 1995
BS Hamilton, D. Paglia, AY Kwan, M. Deitel
o Erhöhte adipöse mRNA-Expression in Omentalfettzellen von massiv übergewichtigen Menschen
o Nat. Med., 1 (1995), S. 953-956
o
69
o Hernandez und Hoebel, 1988
o L. Hernandez, BG Hoebel
o Futterbelohnung und Kokain erhöhen extrazelluläres Dopamin im Nucleus accumbens, gemessen durch Mikrodialyse
o Leben Sci., 42 (1988), pp. 1705-1712
o
70
o Hill et al., 2003
o JO Hill, HR Wyatt, GW Reed, JC Peters
o Fettleibigkeit und die Umwelt: Wohin gehen wir von hier?
o Wissenschaft, 299 (2003), pp. 853-855
o
71
o Hoebel, 1969
o BG Hoebel
o Fütterung und Selbststimulation
o Ann. NY Acad. Sci., 157 (1969), S. 758-778
o
72
o Hoebel und Balagura, 1967
o BG Hoebel, S. Balagura
o Selbststimulation des lateralen Hypothalamus, modifiziert durch Insulin und Glucagon
o Physiol. Verhalten, 2 (1967), pp. 337-340
o
73
o Hoebel und Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Hypothalamische Kontrolle der Fütterung und Selbststimulation
o Wissenschaft, 135 (1962), pp. 375-377
o
74
o Hoebel und Thompson, 1969
sch 100 100 sch sch sch 100 sch sch sch sch sch sch sch sch sch sch sch sch sch sch sch sch sch sch sch dieser sch sch dieser sch sch sch dieser 100 sch sch sch dieser sch sch sch sch dieser 100 sch 100 dieser
o Abneigung gegen laterale hypothalamische Stimulation durch intragastrische Ernährung oder Fettleibigkeit
o J. Comp. Physiol. Psychol., 68 (1969), pp. 536-543
o
75
o Hofmann et al., 2010
o W. Hofmann, GM van Koningsbruggen, W. Ströbe, S. Ramanathan, H. Aarts
o So wie das Vergnügen sich entfaltet: Hedonische Reaktionen auf verlockendes Essen
o Psychol. Sci., 21 (2010), S. 1863-1870
o
76
o Holland und Gallagher, 2004
o PC Holland, M. Gallagher
o Amygdala-frontale Interaktionen und Belohnungserwartung
o Curr. Meinung. Neurobiol., 14 (2004), S. 148-155
o
77
Hollander et al., 2010
o JA Hollander, HI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahless- ted, MD Conkright, PJ Kenny
o Striatale microRNA kontrolliert die Aufnahme von Kokain durch CREB-Signalgebung
o Natur, 466 (2010), S. 197-202
o
78
o Hommel et al., 2006
JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
o Leptin-Rezeptor-Signalgebung im Mittelhirn Dopamin-Neuronen regelt die Fütterung
o Neuron, 51 (2006), S. 801-810
o
79
o Imaizumi et al., 2001
M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o Bevorzugung von fettreichen Lebensmitteln bei Mäusen: Bratkartoffeln im Vergleich zu gekochten Kartoffeln
o Appetit, 36 (2001), pp. 237-238
o
80
o Jerlhag et al., 2006
E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
o Ghrelin stimuliert lokomotorische Aktivität und akkumulierten Dopamin-Überlauf über zentrale cholinerge Systeme in Mäusen: Implikationen für seine Beteiligung an der Belohnung des Gehirns
o Süchtiger. Biol., 11 (2006), S. 45-54
o
81
o Jerlhag et al., 2007
E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
o Die Verabreichung von Ghrelin in tegmentale Bereiche stimuliert die lokomotorische Aktivität und erhöht die extrazelluläre Konzentration von Dopamin im Nucleus accumbens
o Süchtiger. Biol., 12 (2007), S. 6-16
o
82
o Jhou et al., 2009
TC Jhou, HL Felder, MG Baxter, CB Saper, PC Holland
o Der rostromediale Tegmental Nucleus (RMTg), ein GABAergic, der zu den Dopaminneuronen des Mittelhirns afferent ist, kodiert für aversive Reize und hemmt motorische Reaktionen
o Neuron, 61 (2009), S. 786-800
o
83
o Johnson und Kenny, 2010
o PM Johnson, PJ Kenny
o Dopamin-D2-Rezeptoren bei suchtähnlicher Belohnungsdysfunktion und zwanghaftem Essen bei adipösen Ratten
o Nat. Neurosci., 13 (2010), S. 635-641
o
84
o Johnson et al., 1996
o PI Johnson, MA Parente, JR Stellar
o NMDA-induzierte Läsionen des Nucleus accumbens oder des ventralen Pallidums erhöhen die Belohnungswirkung von Nahrung gegenüber Ratten, die an Ratten erkrankt sind
o Gehirn Res., 722 (1996), pp. 109-117
o
85
o Jönsson et al., 1999
o ZB Jönsson, MM Nöthen, F. Grünhage, L. Farde, Y. Nakashima, P. Propping, GC Sedvall
o Polymorphismen im Dopamin-D2-Rezeptor-Gen und ihre Beziehungen zur striatalen Dopaminrezeptordichte gesunder Probanden
o Mol. Psychiatrie, 4 (1999), pp. 290-296
o
86
o Kalarchian et al., 2002
o MA Kalarchian, MD Marcus, GT Wilson, EW Labouvie, RE Brolin, LB LaMarca
o Binge-Eating unter Magen-Bypass-Patienten bei Langzeit-Follow-up
O Obes. Surg., 12 (2002), S. 270-275
o
87
o Kandiah et al., 2006
J. Kandiah, M. Yake, J. Jones, M. Meyer
o Stress beeinflusst Appetit und Komfort Essen Präferenzen bei College-Frauen
o Nutr. Res., 26 (2006), S. 118-123
o
88
o Karhunen ua, 1997
o LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o Regionaler zerebraler Blutfluss während der Nahrungsaufnahme bei übergewichtigen und normalgewichtigen Frauen
o Gehirn, 120 (1997), pp. 1675-1684
o
89
o Kasanetz ua, 2010
F. Kasanetz, V. Deroche-Gamonet, N. Berson, E. Balado, M. Lafourcade, O. Manzoni, PV Piazza
o Der Übergang zur Sucht ist mit einer anhaltenden Beeinträchtigung der synaptischen Plastizität verbunden
o Wissenschaft, 328 (2010), pp. 1709-1712
o
90
o Kelley et al., 1996
o AE Kelley, EP Bless, CJ Swanson
o Untersuchung der Wirkungen von Opiat-Antagonisten, die in den Nucleus Accumbens bei Fütterung und Saccharose-Trinken bei Ratten infundiert wurden
o J. Pharmacol. Exp. Ther., 278 (1996), S. 1499-1507
o
91
o Kelley et al., 2005
AE Kelley, BA Baldo, WE Pratt, MJ Will
o Kortikostriatal-Hypothalamus Schaltung und Nahrungsmotivation: Integration von Energie, Aktion und Belohnung
o Physiol. Verhalten, 86 (2005), pp. 773-795
o
92
o Kenny et al., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o Conditioned Entzug treibt Heroinkonsum und verringert Belohnungsempfindlichkeit
o J. Neurosci., 26 (2006), S. 5894-5900
o
93
Kim et al., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sun, JH Baik
o Verstärkte hypothalamische Leptinsignalisierung bei Mäusen, denen Dopamin-D2-Rezeptoren fehlen
o J. Biol. Chem., 285 (2010), S. 8905-8917
o
94
o Klein et al., 2007
T. Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o Genetisch bedingte Unterschiede beim Lernen von Fehlern
o Wissenschaft, 318 (2007), pp. 1642-1645
o
95
o Kojima et al., 1999
o M. Kojima, H. Hosoda, Y. Datum, M. Nakazato, H. Matsuo, K. Kangawa
o Ghrelin ist ein Wachstumshormon freisetzendes acyliertes Peptid aus dem Magen
o Natur, 402 (1999), S. 656-660
o
96
o Kok et al., 2006
P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o Aktivierung von Dopamin D2-Rezeptoren senkt zirkadiane Leptinkonzentrationen bei übergewichtigen Frauen
o J. Clin. Endocrinol. Metab., 91 (2006), S. 3236-3240
o
97
o Koob, 2010
o GF Koob
o Die Rolle von CRF und CRF-verwandten Peptiden auf der dunklen Seite der Sucht
o Gehirn Res., 1314 (2010), pp. 3-14
o
98
o Koob und Le Moal, 2008
GF Koob, M. Le Moal
o Sucht und das Gehirn-Anti-Reward-System
o Annu. Rev. Psychol., 59 (2008), S. 29-53
o
99
o Koob und Volkow, 2010
o GF Koob, ND Volkow
o Neurokreislauf der Sucht
o Neuropsychopharmakologie, 35 (2010), S. 217-238
o
100
o Koob und Zorrilla, 2010
o GF Koob, EP Zorrilla
o Neurobiologische Mechanismen der Sucht: Fokus auf Corticotropin-Releasing-Faktor
o Curr. Meinung. Untersuchung. Drogen, 11 (2010), pp. 63-71
o
101
o Kringelbach et al., 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o Die Aktivierung des menschlichen orbitofrontalen Cortex zu einem flüssigen Nahrungsmittelreiz korreliert mit seiner subjektiven Annehmlichkeit
O Cereb. Cortex, 13 (2003), S. 1064-1071
o
102
o Krügel et al., 2003
o U. Krügel, T. Schraft, H. Kittner, W. Kieß, P. Illes
o Basal und Fütterung-evozierte Dopamin-Freisetzung in der Ratte Nucleus Accumbens ist durch Leptin deprimiert
o Eur. J. Pharmacol., 482 (2003), S. 185-187
o
103
o la Fleur, 2006
o SE la Fleur
o Die Wirkung von Glucocorticoiden auf das Fressverhalten bei Ratten
o Physiol. Verhalten, 89 (2006), pp. 110-114
o
104
o LaBar et al., 2001
o KS LaBar, DR Gitelman, TB Parrish, Kim YH, AC Nobre, MM Mesulam
o Hunger moduliert selektiv die kortikolimbische Aktivierung zu Nahrungsreizen beim Menschen
o Verhalten Neurosci., 115 (2001), S. 493-500
o
105
o Latagliata et al., 2010
o EC Latagliata, E. Patron, S. Puglisi-Allegra, R. Ventura
o Nahrungssuche trotz schädlicher Folgen erfolgt unter präfrontaler kortikaler noradrenerger Kontrolle
o BMC Neurosci., 11 (2010), p. 15
o
106
o Lawford et al., 2000
B. BR Lawford, RM Young, EP Noble, J. Sargent, J. Rowell, S. Shafdorth, X. Zhang, T. Ritchie
o Die D (2) -Dopaminrezeptor A (1) -Allel und Opioidabhängigkeit: Zusammenhang mit Heroinverwendung und Reaktion auf Methadonbehandlung
o Bin. J. Med. Genet., 96 (2000), S. 592-598
o
107
o Leininger et al., 2009
GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong et al.
o Leptin wirkt über Leptinrezeptor-exprimierende laterale hypothalamische Neuronen, um das mesolimbische Dopaminsystem zu modulieren und die Fütterung zu unterdrücken
o Zellmetab., 10 (2009), S. 89-98
o
108
o Lenoir et al., 2007
M. Lenoir, F. Serre, L. Cantin, SH Ahmed
o Intensive Süße übertrifft die Kokain-Belohnung
o PLoS ONE, 2 (2007), p. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109
o Leshan et al., 2010
RL Leshan, DM Opland, GW Louis, GM Lein- ninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
o Ventrale Tegmentalbereich-Leptinrezeptor-Neuronen projizieren spezifisch und regulieren Kokain- und Amphetamin-regulierte Transkriptneuronen der ausgedehnten zentralen Amygdala
o J. Neurosci., 30 (2010), S. 5713-5723
o
110
o Louis et al., 2010
o GW Louis, GM Lein- ninger, CJ Rhodes, MG Myers Jr.
o Direkte Innervation und Modulation von Orexin-Neuronen durch laterale hypothalamische LepRb-Neuronen
o J. Neurosci., 30 (2010), S. 11278-11287
o
111
o Luppino et al., 2010
FS Luppino, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
o Übergewicht, Fettleibigkeit und Depression: eine systematische Überprüfung und Meta-Analyse von Längsschnittstudien
o Bogen Gen. Psychiatrie, 67 (2010), pp. 220-229
o
112
o Lutter und Nestler, 2009
o M. Lutter, EJ Nestler
o Homöostatische und hedonische Signale interagieren bei der Regulierung der Nahrungsaufnahme
o J. Nutr., 139 (2009), S. 629-632
o
113
o Macht und Müller, 2007
o M. Macht, J. Mueller
o Sofortige Effekte von Schokolade auf experimentell induzierte Stimmungszustände
o Appetit, 49 (2007), pp. 667-674
o
114
o Maldonado-Irizarry und Kelley, 1995
o CS Maldonado-Irizarry, AE Kelley
o Exzitotoxische Läsionen der Kern- und Schalenregion des Nucleus accumbens stören die Regulation des Körpergewichts und die motorische Aktivität der Ratte differentiell
o Gehirn Res. Bull., 38 (1995), S. 551-559
o
115
o Maldonado-Irizarry et al., 1995
o CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o Glutamat-Rezeptoren im Nucleus accumbens kontrollieren das Nahrungsaufnahmeverhalten über den lateralen Hypothalamus
o J. Neurosci., 15 (1995), S. 6779-6788
o
116
o Malik et al., 2008
S. Malik, F. McGlone, D. Bedrossian, A. Dagher
o Ghrelin moduliert die Gehirnaktivität in Bereichen, die das appetitive Verhalten kontrollieren
o Zellmetab., 7 (2008), S. 400-409
o
117
o Mann et al., 2009
o MS Man, HF Clarke, AC Roberts
o Die Rolle des orbitofrontalen Kortex und des medialen Striatums bei der Regulation präpotenter Reaktionen auf Nahrungsbelohnungen
O Cereb. Cortex, 19 (2009), S. 899-906
o
118
o Margles und Olds, 1962
DL Margules, J. Olds
o Identische "Fütterungs-" und "belohnende" Systeme im lateralen Hypothalamus von Ratten
o Wissenschaft, 135 (1962), pp. 374-375
o
119
o Markou und Frank, 1987
A. Markou, RA Frank
o Die Auswirkungen der Platzierung von Operanten und Elektroden auf die Dauerantwortfunktionen der Selbststimulationszüge
o Physiol. Verhalten, 41 (1987), pp. 303-308
o
120
o Markou und Koob, 1991
A. Markou, GF Koob
o Postcocaine anhedonia. Ein Tiermodell für den Entzug von Kokain
o Neuropsychopharmakologie, 4 (1991), S. 17-26
o
121
o Mastronardi et al., 2001
CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o Die Lipopolysaccharid-induzierte Leptin-Freisetzung ist neural gesteuert
o Proc. Natl. Acad. Sci. USA, 98 (2001), S. 14720-14725
o
122
Matheny et al., 2011
M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o Regionsspezifische ernährungsinduzierte und Leptin-induzierte zelluläre Leptinresistenz umfasst den ventralen Tegmentbereich bei Ratten
o Neuropharmakologie (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 in der Presse. Online veröffentlicht im November 5, 2010
o
123
o Matsumoto und Hikosaka, 2007
o M. Matsumoto, O. Hikosaka
o Laterale Habenula als Quelle für negative Belohnungssignale in Dopamin-Neuronen
o Natur, 447 (2007), S. 1111-1115
o
124
o Morton et al., 2006
o GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
o Kontrolle des zentralen Nervensystems auf Nahrungsaufnahme und Körpergewicht
o Natur, 443 (2006), S. 289-295
o
125
o Montieren und Hoebel, 1967
G. Mount, BG Hoebel
o Laterale Hypothalamus-Selbststimulation: Selbstbestimmte Schwelle erhöht durch Nahrungsaufnahme
o Psychon. Sci., 9 (1967), S. 265 – 266
o
126
o Nair et al., 2011
SG Nair, BM Navarre, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o Rolle dorsaler medialer präfrontaler Kortex-Dopamin-Rezeptoren der D1-Familie beim Rückfall zu einer fettreichen Nahrungssuche, die durch das anxiogene Medikament Yohimbin hervorgerufen wird
o Neuropsychopharmakologie, 36 (2011), S. 497-510
o
127
o Nakazato et al., 2001
M. Nakazato, N. Murakami, Y. Date, M. Kojima, H. Matsuo, K. Kangawa, S. Matsukura
o Eine Rolle für Ghrelin bei der zentralen Regulierung der Fütterung
o Natur, 409 (2001), S. 194-198
o
128
Naqvi und Bechara, 2009
NH Naqvi, A. Bechara
o Die verborgene Insel der Sucht: Die Insula
o Trends Neurosci., 32 (2009), S. 56 – 67
o
129
Neville et al., 2004
MJ Neville, EC Johnstone, RT Walton
o Identifizierung und Charakterisierung von ANKK1: Ein neuartiges Kinasegen, das eng mit DRD2 in der Chromosomenbande 11q23.1 verbunden ist
o Hum. Mutat., 23 (2004), S. 540 – 545
o
130
o Nirenberg und Waters, 2006
o MJ Nirenberg, C. Waters
o Zwanghaftes Essen und Gewichtszunahme im Zusammenhang mit der Verwendung von Dopaminagonisten
o Umzug Unord., 21 (2006), S. 524 – 529
o
131
o Edel, 2000
o EP Noble
o Sucht und ihr Belohnungsprozess durch Polymorphismen des D2-Dopaminrezeptor-Gens: Eine Überprüfung
o Eur. Psychiatrie, 15 (2000), S. 79 – 89
o
132
o Noble et al., 1993
o EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, MD J. Sheridan Anglin et al.
o Allelassoziation des D2-Dopaminrezeptor-Gens mit der Kokainabhängigkeit
o Drogenabhängigkeit., 33 (1993), pp. 271-285
o
133
o Noble et al., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
o Haplotypen am DRD2-Locus und schwerer Alkoholismus
o Bin. J. Med. Genet., 96 (2000), S. 622-631
o
134
o O'Connor et al., 2008
o DB O'Connor, F. Jones, M. Conner, B. McMillan, E. Ferguson
o Auswirkungen von täglichem Ärger und Essstil auf das Essverhalten
o Gesundheitspsychol., 27 (1, Suppl) (2008), S. S20-S31
o
135
O'Doherty et al., 2002
JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Neurale Antworten während der Vorwegnahme einer primären Geschmacksbelohnung
o Neuron, 33 (2002), S. 815-826
o
136
o O'Rahilly, 2009
o S. O'Rahilly
o Die Humangenetik beleuchtet die Wege zu Stoffwechselerkrankungen
o Natur, 462 (2009), S. 307-314
o
137
o Oswald et al., 2010
o KD Oswald, DL Murdaugh, VL König, MM Boggiano
o Motivation für schmackhaftes Essen trotz der Konsequenzen in einem Tiermodell von Essattacken
o Int. J. Essen. Unordnung. (2010) http://dx.doi.org/10.1002/eat.20808 in Druck. Online veröffentlicht Februar 22, 2010
o
138
o Park und Carr, 1998
o TH Park, KD Carr
o Neuroanatomische Muster von fos-ähnlicher Immunoreaktivität, induziert durch eine schmackhafte Mahlzeit und Mahlzeit-gepaarte Umgebung in Kochsalz- und Naltrexon-behandelten Ratten
o Gehirn Res., 805 (1998), pp. 169-180
o
139
o Peciña und Berridge, 2005
o S. Peciña, KC Berridge
o Hedonischer Hot Spot im Nucleus accumbens shell: Wo verursachen Mu-Opioide eine erhöhte hedonische Wirkung der Süße?
o J. Neurosci., 25 (2005), S. 11777-11786
o
140
o Peciña et al., 2006a
o S. Peciña, J. Schulkin, KC Berridge
o Nucleus accumbens Corticotropin-Releasing-Faktor erhöht cue-ausgelöste Motivation für Saccharose Belohnung: Paradox positive Anreizeffekte bei Stress?
o BMC Biol., 4 (2006), p. 8
o
141
o Peciña et al., 2006b
o S. Peciña, KS Smith, KC Berridge
o Hedonische Hotspots im Gehirn
o Neurowissenschaftler, 12 (2006), pp. 500-511
o
142
o Pecoraro et al., 2004
o N. Pecoraro, F. Reyes, F. Gómez, A. Bhargava, MF Dallman
o Chronischer Stress fördert schmackhafte Ernährung, die Zeichen von Stress reduziert: Feedforward und Feedback-Effekte von chronischem Stress
o Endokrinologie, 145 (2004), pp. 3754-3762
o
143
o Pelchat et al., 2004
ML Pelchat, A. Johnson, R. Chan, J. Valdez, JD Ragland
o Bilder der Begierde: Nahrungssüchtige Aktivierung während der fMRT
o Neuroimage, 23 (2004), S. 1486-1493
o
144
o Pelleymounter et al., 1995
o MA Pelleymounter, MJ Cullen, MB Baker, R. Hecht, D. Winters, T. Boone, F. Collins
o Effekte des fettleibigen Genprodukts auf die Körpergewichtsregulation in ob / ob-Mäusen
o Wissenschaft, 269 (1995), pp. 540-543
o
145
o Pelloux et al., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Zwanghafte Drogentherapie durch Ratten unter Strafe: Auswirkungen der Drogenentnahme
o Psychopharmakologie (Berl.), 194 (2007), S. 127-137
o
146
o Perello et al., 2010
M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Woloszyn, M. Yanagisawa, M. Lutter, JM Zigman
o Ghrelin erhöht den lohnenden Wert einer fettreichen Diät in einer Orexin-abhängigen Weise
o Biol. Psychiatrie, 67 (2010), pp. 880-886
o
147
o Petrovich et al., 2009
GD Petrowitsch, CA Ross, P. Mody, PC Holland, M. Gallagher
o Zentral, aber nicht basolateral, Amygdala ist entscheidend für die Kontrolle der Nahrungsaufnahme durch aversive erlernte Hinweise
o J. Neurosci., 29 (2009), S. 15205-15212
o
148
o Pfaffly et al., 2010
J. Pfaffly, M. Michaelides, GJ Wang, JE Pessin, ND Volkow, PK Thanos
o Leptin erhöht die D2-Rezeptorbindung des striatalen Dopamins in Leptin-defizienten adipösen (ob / ob) Mäusen
o Synapse, 64 (2010), S. 503-510
o
149
Puhl et al., 2008
RM Puhl, CA Moos-Racusin, MB Schwartz, KD Brownell
o Gewicht Stigmatisierung und Bias-Reduktion: Perspektiven von übergewichtigen und adipösen Erwachsenen
o Gesundheitserziehung Res., 23 (2008), S. 347-358
o
150
Rada et al., 2010
P. Rada, ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
o Reduziertes Accumbens-Dopamin bei Sprague-Dawley-Ratten, die zur Überfettung einer fettreichen Ernährung neigen
o Physiol. Verhalten, 101 (2010), pp. 394-400
o
151
o Ritchie und Noble, 2003
T. Ritchie, EP Noble
o Assoziation von sieben Polymorphismen des D2-Dopaminrezeptorgens mit Gehirnrezeptor-Bindungseigenschaften
o Neurochem. Res., 28 (2003), S. 73-82
o
152
Roberto et al., 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
o Die Freisetzung von Corticotropin-Releasing-Faktor-induzierter Amygdala-gamma-aminobuttersäure spielt eine Schlüsselrolle in der Alkoholabhängigkeit
o Biol. Psychiatrie, 67 (2010), pp. 831-839
o
153
Roitman et al., 2004
o MF Roitman, GD Stuber, PE Phillips, RM Wightman, RM Carelli
o Dopamin wirkt als Untermodulator für die Nahrungssuche
o J. Neurosci., 24 (2004), S. 1265-1271
o
154
Roitman et al., 2008
o MF Roitman, RA Wheeler, RM Wightman, RM Carelli
o Chemische Reaktionen in Echtzeit im Nucleus accumbens unterscheiden lohnende und aversive Reize
o Nat. Neurosci., 11 (2008), S. 1376-1377
o
155
o Rollen, 2008
o ET Rollen
o Funktionen des orbitofrontalen und prägenualen cingulären Kortex in Geschmack, Geruchssinn, Appetit und Emotion
o Acta Physiol. Hung., 95 (2008), S. 131-164
o
156
o Rollen, 2010
o ET Rollen
o Geschmack, Geruchs- und Lebensmittelstruktur belohnen Verarbeitung im Gehirn und Fettleibigkeit
o Int. J. Obes. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 im Druck. Online veröffentlicht August 3, 2010
o
157
o Rolls et al., 1983
o ET Rollen, BJ Rollen, EA Rowe
o Sensorisch-spezifische und motivationsspezifische Sättigung für den Anblick und Geschmack von Essen und Wasser im Menschen
o Physiol. Verhalten, 30 (1983), pp. 185-192
o
158
o Roseberry et al., 2007
o AG Roseberry, T. Maler, GP Mark, JT Williams
o Verringerte vesikuläre somatodendritische Dopaminvorräte in Leptin-defizienten Mäusen
o J. Neurosci., 27 (2007), S. 7021-7027
o
159
Rothemund et al., 2007
o R. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Differenzielle Aktivierung des dorsalen Striatums durch hochkalorische visuelle Nahrungsreize bei übergewichtigen Personen
o Neuroimage, 37 (2007), S. 410-421
o
160
Salas et al., 2010
R. Salas, P. Baldwin, M. de Biasi, PR Montague
o BOLD Antworten auf negative Belohnung Vorhersagefehler in menschlichen habenula
o Vorderseite. Summen. Neurosci., 4 (2010), p. 36
o
161
o Saper et al., 2002
CB Saper, TC Chou, JK Elmquist
o Die Notwendigkeit zu füttern: homöostatische und hedonische Kontrolle des Essens
o Neuron, 36 (2002), S. 199-211
o
162
o Saunders, 2001
R. Saunders
o Zwanghaftes Essen und Magenbypass-Operation: Was hat Hunger damit zu tun?
O Obes. Surg., 11 (2001), S. 757-761
o
163
Scarpace et al., 2010
PJ Scarpace, M. Matheny, Y. Zhang
o Wheel Running eliminiert die Präferenz für Fettgewebe und verbessert die Leptin-Signalgebung im ventralen Tegmentum
o Physiol. Verhalten, 100 (2010), pp. 173-179
o
164
o Schiltz et al., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Nahrungsassoziierte Hinweise ändern die funktionelle Konnektivität des Vorderhirns, wie sie mit der unmittelbaren frühen Gen- und Proenkephalin-Expression beurteilt wird
o BMC Biol., 5 (2007), p. 16
o
165
o Schur et al., 2009
o EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o Die Aktivierung in der Energieregulierung und in den Belohnungszentren des Gehirns durch Nahrungssignale variiert mit der Wahl des visuellen Reizes
o Int. J. Obes. (Lond.), 33 (2009), S. 653-661
o
166
o Sclafani et al., 1998
A. Sclafani, RJ Bodnar, AR Delamater
o Pharmakologie von Nahrungsbedingten Präferenzen
o Appetit, 31 (1998), p. 406
o
167
o Sescousse et al., 2010
G. Sescousse, J. Redouté, JC Dreher
o Die Architektur der Belohnungswertkodierung im orbitofrontalen Kortex des Menschen
o J. Neurosci., 30 (2010), S. 13095-13104
o
168
o Shomaker et al., 2010
LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, MK Crocker, AH Ali et al.
o Essen in Abwesenheit von Hunger bei Jugendlichen: Aufnahme nach einer großen Mahlzeit im Vergleich zu einer standardisierten Mahlzeit
o Bin. J. Clin. Nutr., 92 (2010), S. 697-703
o
169
o Simmons et al., 2005
o WK Simmons, A. Martin, LW Barsalou
o Bilder von appetitlichen Lebensmitteln aktivieren Geschmackskorrekturen für Geschmack und Belohnung
O Cereb. Cortex, 15 (2005), S. 1602-1608
o
170
o Klein, 2010
o DM Klein
o Schmecken Sie die Darstellung in der menschlichen Insula
o Gehirnstruktur. Funktion., 214 (2010), S. 551-561
o
171
o Klein et al., 2003
o DM Klein, M. Jones-Gotman, A. Dagher
o Fütterungsinduzierte Dopaminfreisetzung im dorsalen Striatum korreliert mit den Mahlzeiten-Annehmlichkeitseinstufungen bei gesunden menschlichen Freiwilligen
o Neuroimage, 19 (2003), S. 1709-1715
o
172
o Smith und Berridge, 2007
KS Smith, KC Berridge
o Opioider limbischer Kreislauf zur Belohnung: Interaktion zwischen hedonischen Hotspots des Nucleus accumbens und des ventralen Pallidums
o J. Neurosci., 27 (2007), S. 1594-1605
o
173
o Söderpalm und Berridge, 2000
o AH Söderpalm, KC Berridge
o Nahrungsaufnahme nach Diazepam, Morphin oder Muscimol: Mikroinjektionen im Nucleus accumbens shell
o Pharmacol. Biochem. Verhalten, 66 (2000), pp. 429-434
o
174
o Stice et al., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Klein
o Die Beziehung zwischen Fettleibigkeit und abgestumpfter striataler Reaktion auf Nahrung wird durch TaqIA A1-Allel gemildert
o Wissenschaft, 322 (2008), pp. 449-452
o
175
o Stice et al., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Klein
o Relation der Belohnung von Nahrungsaufnahme und erwarteter Nahrungsaufnahme zu Fettleibigkeit: Eine funktionelle Magnetresonanztomographie-Studie
o J. Abnorm. Psychol., 117 (2008), pp. 924-935
o
176
o Stice et al., 2010a
E. Stice, S. Yokum, K. Blum, C. Bohon
o Gewichtszunahme ist mit reduzierter striataler Reaktion auf schmackhaftes Essen verbunden
o J. Neurosci., 30 (2010), S. 13105-13109
o
177
o Stice et al., 2010b
E. E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o Belohnungsschaltungs-Reaktionsfähigkeit auf Nahrung sagt zukünftige Zunahme der Körpermasse voraus: Moderierende Effekte von DRD2 und DRD4
o Neuroimage, 50 (2010), S. 1618-1625
o
178
o Stöckel, 2010
o Stöckel, LE (2010). Das Goldilocks Prinzip der Adipositas. Wissenschaftlicher Amerikaner. Juni 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-Goldilocks-Principle-Bipositas.
o
179
o Stratford und Kelley, 1997
o TR Stratford, AE Kelley
o GABA im Nucleus Accumbens Shell beteiligt sich an der zentralen Regulation des Fressverhaltens
o J. Neurosci., 17 (1997), S. 4434-4440
o
180
o Stratford und Kelley, 1999
o TR Stratford, AE Kelley
o Nachweis einer funktionellen Beziehung zwischen der Nucleus accumbens Schale und dem lateralen Hypothalamus, die die Kontrolle des Fressverhaltens ermöglicht
o J. Neurosci., 19 (1999), S. 11040-11048
o
181
o Suarez und Gallup, 1981
o SD Suarez, GGJ Gallup
o Eine ethologische Analyse des Offenfeldverhaltens bei Ratten und Mäusen
o Lernen. Motiv., 12 (1981), S. 342-363
o
182
o Sonntag et al., 1983
o SR Sonntag, SA Sanders, G. Collier
o Schmackhaftigkeit und Essensmuster
o Physiol. Verhalten, 30 (1983), pp. 915-918
o
183
Swinburn et al., 2009
B. Swinburn, G. Sacks, E. Ravussin
o Eine erhöhte Nahrungsmittelversorgung ist mehr als ausreichend, um die US-Epidemie der Fettleibigkeit zu erklären
o Bin. J. Clin. Nutr., 90 (2009), S. 1453-1456
o
184
o Taha und Felder, 2005
o SA Taha, HL Felder
o Kodierung von Schmackhaftigkeit und Appetitverhalten durch unterschiedliche neuronale Populationen im Nucleus accumbens
o J. Neurosci., 25 (2005), S. 1193-1202
o
185
o Taha et al., 2009
o SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Felder
o Konvergente, nicht serielle, striatale und pallidale Schaltkreise regulieren die Opioid-induzierte Nahrungsaufnahme
o Neurowissenschaften, 161 (2009), pp. 718-733
o
186
o Teegarden und Ballen, 2007
o SL Teegarden, TL Ballen
o Verringerung der Präferenz für die Ernährung führt zu erhöhter Emotionalität und erhöhtem Risiko für einen Rückfall in die Ernährung
o Biol. Psychiatrie, 61 (2007), pp. 1021-1029
o
187
o Teegarden et al., 2009
o SL Teegarden, AN Scott, TL Bale
o Eine frühzeitige Exposition gegenüber einer fettreichen Ernährung fördert langfristige Veränderungen der Ernährungsgewohnheiten und der zentralen Belohnungssignale
o Neurowissenschaften, 162 (2009), pp. 924-932
o
188
Thanos et al., 2008
o PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o Eine Nahrungsmittelrestriktion erhöht den Dopamin-D2-Rezeptor (D2R) in einem Rattenmodell der Adipositas, wie mit in-vivo-muPET-Bildgebung ([11C] Racloprid) und in-vitro ([3H] -Spiperon) -Autoradiographie beurteilt, deutlich
o Synapse, 62 (2008), S. 50-61
o
189
o Thompson und Swanson, 2010
RH Thompson, LW Swanson
o Hypothesis-getriebene strukturelle Konnektivitätsanalyse unterstützt Netzwerk über hierarchisches Modell der Gehirnarchitektur
o Proc. Natl. Acad. Sci. USA, 107 (2010), S. 15235-15239
o
190
o Vanderschuren und Everitt, 2004
o LJ Vanderschuren, BJ Everitt
o Drogensucht wird nach längerer Kokain-Selbstverwaltung zwanghaft
o Wissenschaft, 305 (2004), pp. 1017-1019
o
191
o Vendruscolo et al., 2010a
o LF Vendruscolo, AB Gueye, M. Darnaudéry, SH Ahmed, M. Cador
o Zuckerüberkonsum während der Adoleszenz verändert selektiv die Motivation und die Belohnungsfunktion bei erwachsenen Ratten
o PLoS ONE, 5 (2010), p. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192
o Vendruscolo et al., 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o Reduzierter Alkoholkonsum bei erwachsenen Ratten, die während der Adoleszenz Saccharose ausgesetzt waren
o Neuropharmakologie, 59 (2010), S. 388-394
o
193
o Volkow und O'Brien, 2007
o ND Volkow, CP O'Brien
o Probleme für DSM-V: Sollte Adipositas als eine Störung des Gehirns enthalten sein?
o Bin. J. Psychiatrie, 164 (2007), pp. 708-710
o
194
o Volkow und Weise, 2005
o ND Volkow, RA Wise
o Wie kann Drogenabhängigkeit uns helfen, Fettleibigkeit zu verstehen?
o Nat. Neurosci., 8 (2005), S. 555-560
o
195
o Volkow et al., 2009
ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan
o Inverse Assoziation zwischen BMI und präfrontalen Stoffwechselaktivität bei gesunden Erwachsenen
o Fettleibigkeit (Silver Spring), 17 (2009), pp. 60-65
o
196
o Vucetic und Reyes, 2010
o Z. Vucetic, TM Reyes
o Zentraler dopaminerger Kreislauf, der Nahrungsaufnahme und Belohnung steuert: Auswirkungen auf die Regulation von Fettleibigkeit
Wiley Interdiscip. Rev. Syst. Biol. Med., 2 (2010), S. 577-593
o
197
Wang et al., 2001
GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o Gehirn Dopamin und Fettleibigkeit
o Lanzette, 357 (2001), pp. 354-357
o
198
Wang et al., 2002
o GJ Wang, ND Volkow, JS Fowler
o Die Rolle von Dopamin bei der Nahrungsmotivation beim Menschen: Implikationen für Fettleibigkeit
o Expertenmeinung. Ther. Ziele, 6 (2002), pp. 601-609
o
199
Wang et al., 2004a
o GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
o Die Exposition gegenüber appetitiven Nahrungsreizen aktiviert das menschliche Gehirn deutlich
o Neuroimage, 21 (2004), S. 1790-1797
o
200
Wang et al., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o Ähnlichkeit zwischen Adipositas und Drogenabhängigkeit, beurteilt anhand der neurofunktionellen Bildgebung: eine Konzeptstudie
o J. Süchtiger. Dis., 23 (2004), S. 39-53
o
201
Wang et al., 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
o Magenaufblähung aktiviert Sättigungsschaltung im menschlichen Gehirn
o Neuroimage, 39 (2008), S. 1824-1831
o
202
Wassum et al., 2009
KM Wassum, SB Ostlund, NT Maidment, BW Balleine
o Distinct Opioid-Schaltungen bestimmen die Schmackhaftigkeit und die Erwünschtheit von Belohnung Ereignisse
o Proc. Natl. Acad. Sci. USA, 106 (2009), S. 12512-12517
o
203
Wassum et al., 2011
KM Wassum, IC Cely, BW Balleine, NT Maidment
o μ-Opioidrezeptor-Aktivierung in der basolateralen Amygdala vermittelt das Lernen von Zunahmen, aber nicht vom Anreizwert einer Futterbelohnung
o J. Neurosci., 31 (2011), S. 1591-1599
o
204
o Wilkinson und Peele, 1962
o HA Wilkinson, TL Peele
o Modifikation der intrakraniellen Selbststimulation durch Hunger Sättigung
o Bin. J. Physiol., 203 (1962), S. 537-540
o
205
o Will et al., 2003
o MJ Will, EB Franzblau, AE Kelley
o Nucleus accumbens Mu-Opioide regulieren die Aufnahme einer fettreichen Diät über die Aktivierung eines verteilten Hirnnetzwerks
o J. Neurosci., 23 (2003), S. 2882-2888
o
206
Wilson et al., 2008
ME Wilson, J. Fischer, A. Fischer, V. Lee, RB Harris, TJ Bartness
o Quantifizierung der Nahrungsaufnahme bei sozial untergebrachten Affen: Auswirkungen des sozialen Status auf den Kalorienverbrauch
o Physiol. Verhalten, 94 (2008), pp. 586-594
o Artikel PDF (553 K) |
Datensatz in Scopus anzeigen
| Zitiert von in Scopus (22)
207
Yurcisin et al., 2009
o BM Yurcisin, MM Gaddor, EJ DeMaria
o Adipositas und bariatrische Chirurgie
o Clin. Brust Med., 30 (2009), pp. 539-553, ix
o
208
Zhang et al., 1998
M. Zhang, BA Gosnell, AE Kelley
o Die Aufnahme von fettreicher Nahrung wird selektiv durch Stimulation des Opioidrezeptors im Nucleus accumbens verstärkt
o J. Pharmacol. Exp. Ther., 285 (1998), S. 908-914
o Aufzeichnung in Scopus anzeigen
| Zitiert von in Scopus (148)
209
o Zheng ua, 2007
H. Zheng, LM Patterson, HR Berthoud
o Orexin-Signalgebung im ventralen Tegmentum ist erforderlich für einen fettreichen Appetit, der durch Opioid-Stimulation des Nucleus accumbens induziert wird
o J. Neurosci., 27 (2007), S. 11075-11082
o Aufzeichnung in Scopus anzeigen
| Zitiert von in Scopus (64)
210
o Zheng ua, 2009
H. Zheng, NR Lenard, AC Shin, HR Berthoud
o Appetite Control und Energiebilanzregulierung in der modernen Welt: Belohnungsgetriebenes Gehirn überschreibt Sättigungssignale
o Int. J. Obes. (Lond.), 33 (Zusatz 2) (2009), S. S8-S13
o Aufzeichnung in Scopus anzeigen
| Zitiert von in Scopus (34)