Wissenschaftliche Berichte Volumen 9, Artikelnummer: 16918 (2019)
Abstrakt
Übermäßiger Saccharosekonsum löst suchtähnliches Verlangen aus, das die Adipositas-Epidemie untermauern kann. Opioide und Dopamin vermitteln die wohltuende Wirkung von Drogenmissbrauch und natürlichen Belohnungen durch Reize wie schmackhafte Lebensmittel. Wir untersuchten die Auswirkungen von Saccharose mithilfe der PET-Bildgebung mit [11C] Carfentanil (μ-Opioidrezeptoragonist) und [11C] Racloprid (Dopamin-D2 / 3-Rezeptor-Antagonist) bei sieben weiblichen anästhesierten Göttinger Minischweinen. Dann gaben wir den Minischweinen an 12 aufeinanderfolgenden Tagen eine Stunde lang Zugang zu Saccharoselösung und führten 24 Stunden nach dem endgültigen Zugang zu Saccharose erneut eine Bildgebung durch. In einer kleineren Stichprobe von fünf Minipigs führten wir eine zusätzliche [11C] Carfentanil-PET-Sitzung nach der ersten Saccharose-Exposition. Wir berechneten voxelweise Bindungspotentiale (BPND) unter Verwendung des Kleinhirns als Region der nicht verschiebbaren Bindung, analysierte Unterschiede mit statistischen nicht parametrischen Kartierungen und führte eine regionale Analyse durch. Nach 12 Tagen Saccharose-Zugang wird BPND der beiden Tracer waren in Striatum, Nucleus accumbens, Thalamus, Amygdala, cinguliertem Cortex und präfrontalem Cortex signifikant zurückgegangen, was mit einer Herunterregulierung der Rezeptordichten vereinbar war. Nach einmaliger Exposition gegenüber Saccharose fanden wir eine verminderte Bindung von [11C] Carfentanil im Nucleus accumbens und im cingulären Kortex im Einklang mit der Opioidfreisetzung. Die geringere Verfügbarkeit von Opioid- und Dopaminrezeptoren könnte das Suchtpotential erklären, das mit der Einnahme von Saccharose verbunden ist.
Einleitung
Fünf Prozent der Weltbevölkerung sind klinisch fettleibig1. Fettleibigkeit ist ein Kennzeichen des metabolischen Syndroms und wird mit Typ-2-Diabetes, Herz-Kreislauf-Erkrankungen, Atemwegserkrankungen sowie dem Risiko für Depressionen und möglicherweise Demenz in Verbindung gebracht2. Der erhöhte Verbrauch von energiedichten Nahrungsmitteln hat die physiologische Unterscheidung zwischen homöostatischem Hunger, der auf Nahrungsentzug folgt, und hedonischem Hunger oder "Verlangen", das ohne Entzug auftritt, übertrieben3,4. Da die homöostatische Regulation allein den gegenwärtigen Anstieg der Fettleibigkeit nicht erklären kann, ist es obligatorisch, die Wirkung der süchtig machenden Eigenschaften von hoch schmackhaften Nahrungsmitteln auf die Belohnungs- und Genussmechanismen des Gehirns zu testen.
Der Konsum von Saccharose ist mit Fettleibigkeit verbunden, und Saccharose wird zunehmend als Suchtmittel angesehen5. Einige Ergebnisse stehen im Widerspruch zu dieser Behauptung, da es schwierig ist, nicht schmackhaften Lebensmittelkonsum von hedonischen Lebensmittelreaktionen zu trennen und den süchtig machenden Inhaltsstoff in verarbeiteten Lebensmitteln sowie die verschiedenen Mechanismen zu bestimmen, durch die Lebensmittel die Schaltkreise des Gehirns über natürliche Pfade verändern6. In bestimmten Situationen führt die Einnahme von Saccharose jedoch zu Belohnungen und Begierden, die in ihrer Größe mit denen von Suchtmitteln vergleichbar sind und zu Überkonsum und eventuellem Übergewicht führen6,7.
Hunger ist mit „Wollen“ verbunden, das in einer Reihe von Belohnungssituationen eng mit den Auswirkungen der dopaminergen Neurotransmission zusammenhängt8Es bleibt jedoch unklar, wie die Wirkung von Dopamin (DA) als Reaktion auf zwanghaftes Essen moduliert wird. Der Verzehr von schmackhaften Nahrungsmitteln hängt mit dem „Liken“ zusammen, das in erster Linie durch das endogene Opioidsystem, insbesondere den μ-Opioidrezeptor (μOR), vermittelt wird.9,10Dies kann bei einer Deregulierung zu einem Überkonsum führen. In diesem Bericht testen wir die Behauptung, dass Saccharose zu einer Opioid- und Dopaminfreisetzung führt, die die Verfügbarkeit von μOR- und DA D2 / 3-Rezeptoren senkt. Die Verfügbarkeit ist ein Index für die Anzahl der nicht besetzten Rezeptoren, die für die Tracerbindung verfügbar sind, und unterscheidet im Prinzip nicht zwischen Ligandenbelegung und Rezeptordichte11.
Das Einsetzen von zwanghaftem Essen hängt von mehreren Faktoren ab, und Kausalstudien am Menschen werfen ethische Fragen auf. Die Mehrzahl der Studien befasst sich daher mit dem Fütterungsverhalten bei Ratten12. Obwohl Ratten einen „süßen Zahn“ haben, unterscheiden sich ihre homöostatischen Mechanismen, die für die Gewichtszunahme, den Stoffwechsel und die Art der Fettansammlung wichtig sind, erheblich von denen des Menschen. Das Göttinger Minipig ist ein großes Allesfresser-Tier mit einem gut entwickelten gyrencephalen Gehirn, das mit ausreichender Auflösung abgebildet werden kann. Seine gut definierten subkortikalen und präfrontalen kortikalen Regionen13 ermöglichen eine direktere Übersetzung in die menschliche Gehirnfunktion. Hier verwenden wir die Positronenemissionstomographie (PET) zum Testen in vivo Verfügbarkeit von μOR und DA D2 / 3 in einem Minipig-Modell der subchronischen Saccharoseexposition. In einer kleineren Stichprobe untersuchten wir die unmittelbaren Auswirkungen auf die μOR-Belegung nach der ersten Exposition gegenüber Saccharose. Schließlich testeten wir die Beziehung zwischen den Änderungen der Rezeptorverfügbarkeit der beiden Tracer.
Die Ergebnisse
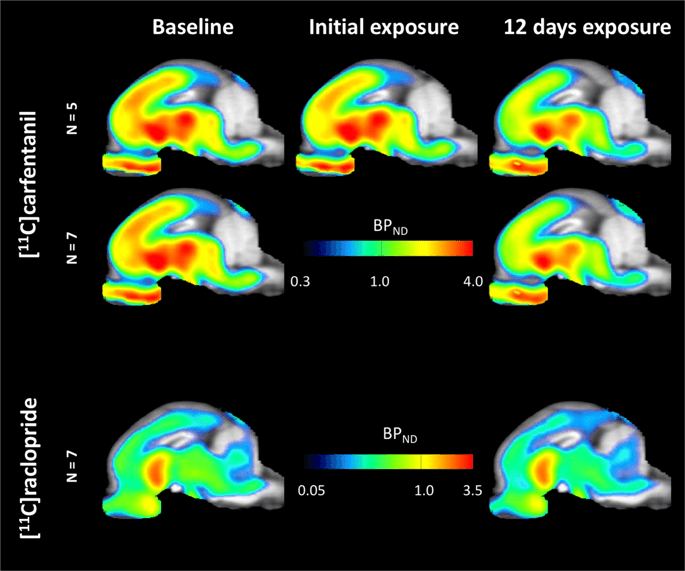
Durchschnittliche Parameterkarten von [11C] Carfentanil und [11C] Racloprid-Bindungspotential (BPND) sind in Abb. 1. Analyse der Veränderungen, die nach der ersten Saccharoseexposition bei fünf Minipigs im Vergleich zum Ausgangswert und einen Tag nach dem Zwölften aufgetreten sindth Der Saccharose-Zugang bei sieben Minischweinen im Vergleich zum Ausgangswert wurde mithilfe der Permutationstheorie und der nicht regional beschränkten Ganzhirnanalyse untersucht, die für Proben dieser Größe die bevorzugte Methode war14.
Durchschnittliches voxelweises nicht verschiebbares Bindungspotential (BPND) Karten überlagern MRT-Bilder in sagittaler Ansicht. Daten werden präsentiert für [11C] Carfentanil BPND der 5 zu Studienbeginn abgebildeten Minischweine nach anfänglicher Saccharoseexposition und nach 12 Tagen Saccharoseexposition (obere Reihe). [11C] Carfentanil BPND Von allen 7 zu Studienbeginn und nach 12 Tagen Saccharose-Zugang abgebildeten Minischweinen sind in der mittleren Reihe dargestellt. [11C] Racloprid BPND Von allen 7 zu Studienbeginn und nach 12 Tagen Saccharosezugang abgebildeten Minischweinen sind in der unteren Reihe gezeigt. Beachten Sie, dass die Farbskala exponentiell ist, um die [11C] Racloprid BPND in extrastriatalen Regionen.
Anfängliche Saccharose-Exposition
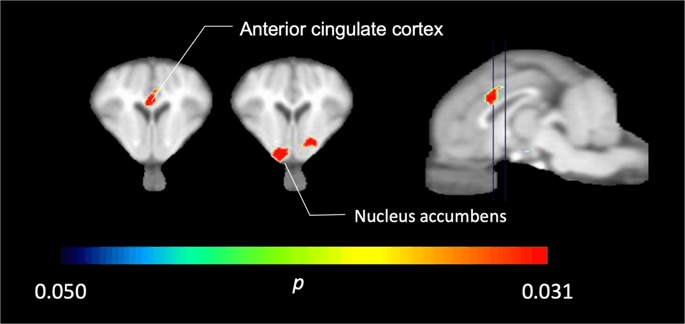
In den fünf mit [11C] Carfentanil zu Studienbeginn und unmittelbar nach der ersten Saccharoseexposition fanden wir eine signifikant verringerte Tracerbindung im vorderen cingulären Kortex und im Nucleus accumbens als Reaktion auf Saccharose, dargestellt in Farbe in Abb. 2, was p <0.05 anzeigt. Wir konnten in beiden Bereichen eine um bis zu 14% verringerte Tracerbindung im Vergleich zum Ausgangswert feststellen.
Signifikante Abnahmen in [11C] Carfentanil BPND nach der ersten Saccharosewasserexposition im Vergleich zum Ausgangswert (n = 5). Nur Voxel mit signifikanten (p <0.05) Abnahmen werden als farbige Bereiche gezeigt, die auf T1-gewichtete MRT-Schnitte in Höhe des vorderen cingulären Kortex (links) und des Nucleus accumbens (Mitte) eines stereotaktischen Minipig-Hirnatlas projiziert werden. Beachten Sie, dass das mit 5 Tieren erreichbare maximale Signifikanzniveau 2 beträgt-5 0.031 (siehe Farbbalken). Die Daten werden an koronalen Schnitten des Schweinehirns in den auf dem Sagittalbild (rechts) angegebenen Konzentrationen präsentiert.
12 Tage Saccharose-Zugang
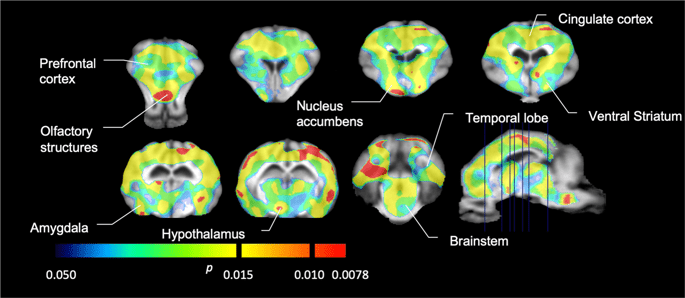
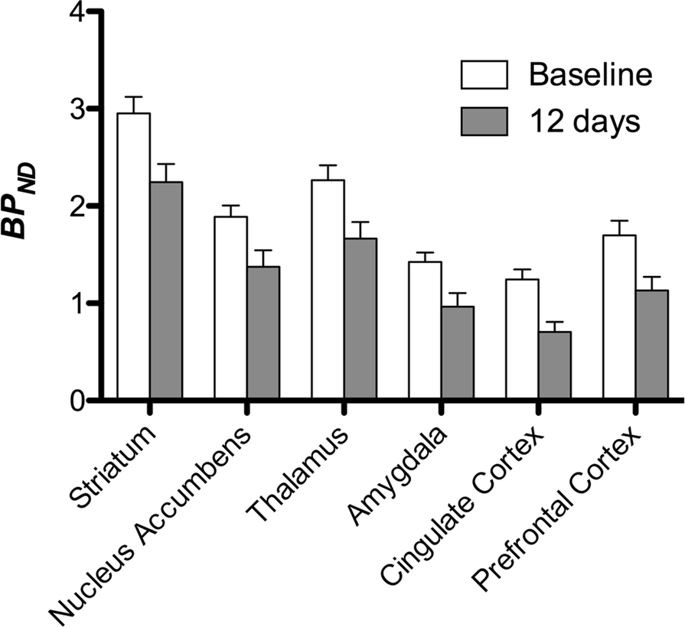
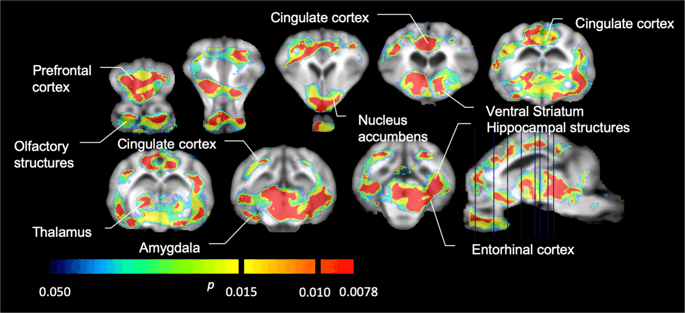
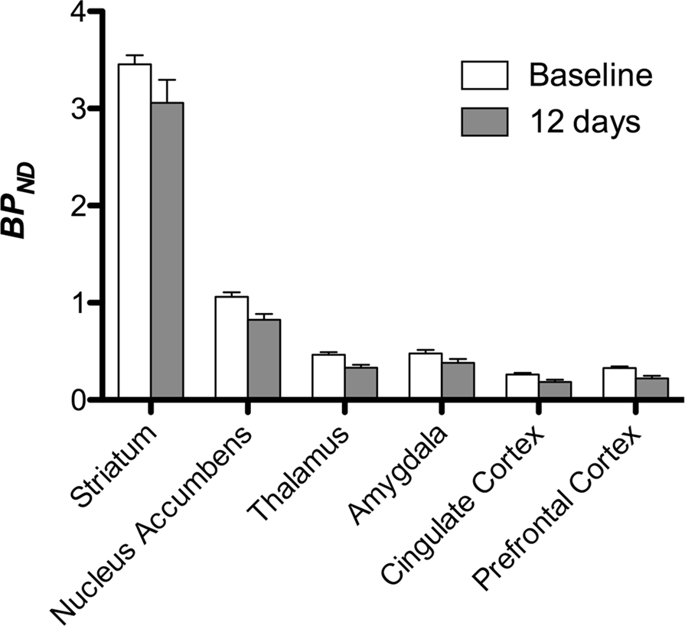
Wir führten dann die Analyse von sieben Minischweinen durch, die mit [11C] Carfentanil zu Studienbeginn und nach 12-tägigem Zugang zu Saccharose und zeigte bei Saccharose-exponierten Tieren im Vergleich zu Studienbeginn eine signifikant verringerte Tracerbindung. Die am stärksten betroffenen Regionen sind in Abb. XNUMX rot dargestellt. 3 (p <0.01) und umfassen Teile der Geruchsstrukturen, des Nucleus accumbens / ventralen Striatum und des temporalen Kortex / Lappens, gefolgt von gelb dargestellten Bereichen (p <0.015), die Teile des präfrontalen Kortex, des cingulären Kortex, der Amygdala und des Hirnstamms enthielten . Um BP zu erhaltenND Englisch: eur-lex.europa.eu/LexUriServ/LexUri...XNUMX: EN: HTML Wir führten eine regionale Analyse durch und bewerteten die prozentuale Veränderung. Dabei ermittelten wir Mittelwerte für jede Region zu Studienbeginn und nach Saccharose - Verbrauch (Abb. 4).
Signifikante Abnahmen in [11C] Carfentanil-Bindungspotential (BPND) zwischen dem Ausgangswert und nach 12 Tagen Exposition gegenüber Saccharosewasser (n = 7). Die Voxel mit signifikanten (p <0.05) Abnahmen werden als farbige Bereiche gezeigt, die auf T1-gewichtete MRT-Schnitte aus einem stereotaktischen Minipig-Hirnatlas projiziert werden. Die Daten werden auf koronalen Hirnschnitten in den auf dem Sagittalbild (unten rechts) angegebenen Werten dargestellt. Beachten Sie, dass das mit 7 Tieren erreichbare maximale Signifikanzniveau 2 beträgt-7 ≈ 0.0078 (siehe Farbbalken).
Wir verwendeten [11C] Racloprid als Tracer für DA D2 / 3 - Rezeptoren in striatalen und extrastriatalen Hirnregionen bei Minischweinen zu Studienbeginn und nach 12 Tagen Saccharosezugang (Abb. 1). Wir fanden eine verringerte Tracerbindung bei Tieren, die Saccharose ausgesetzt waren, im Vergleich zum Ausgangswert mit den größten Effekten (p <0.01) in Bereichen des präfrontalen Kortex, des Nucleus accumbens / ventralen Striatum, des cingulierten Kortex, der Amygdala, des Thalamus, des Mesencephalons, der Hippocampusregionen und der Riechbereiche (Feige. 5). Daten aus der regionalen Analyse sind in Abb. 6.
Signifikante Abnahmen in [11C] Racloprid-Bindungspotential (BPND) zwischen dem Ausgangswert und nach 12 Tagen Exposition gegenüber Saccharosewasser (n = 7). Die Voxel mit signifikanten (p <0.05) Abnahmen werden als farbige Bereiche gezeigt, die auf T1-gewichtete MRT-Schnitte aus einem stereotaktischen Minipig-Hirnatlas projiziert werden. Die Daten werden an koronalen Schnitten des Schweinehirns in den auf dem Sagittalbild (unten rechts) angegebenen Werten dargestellt. Beachten Sie, dass das mit 7 Tieren erreichbare maximale Signifikanzniveau 2 beträgt-7 ≈ 0.0078 (siehe Farbbalken).
Korrelationen zwischen [11C] Racloprid und []11C] Carfentanil-Daten
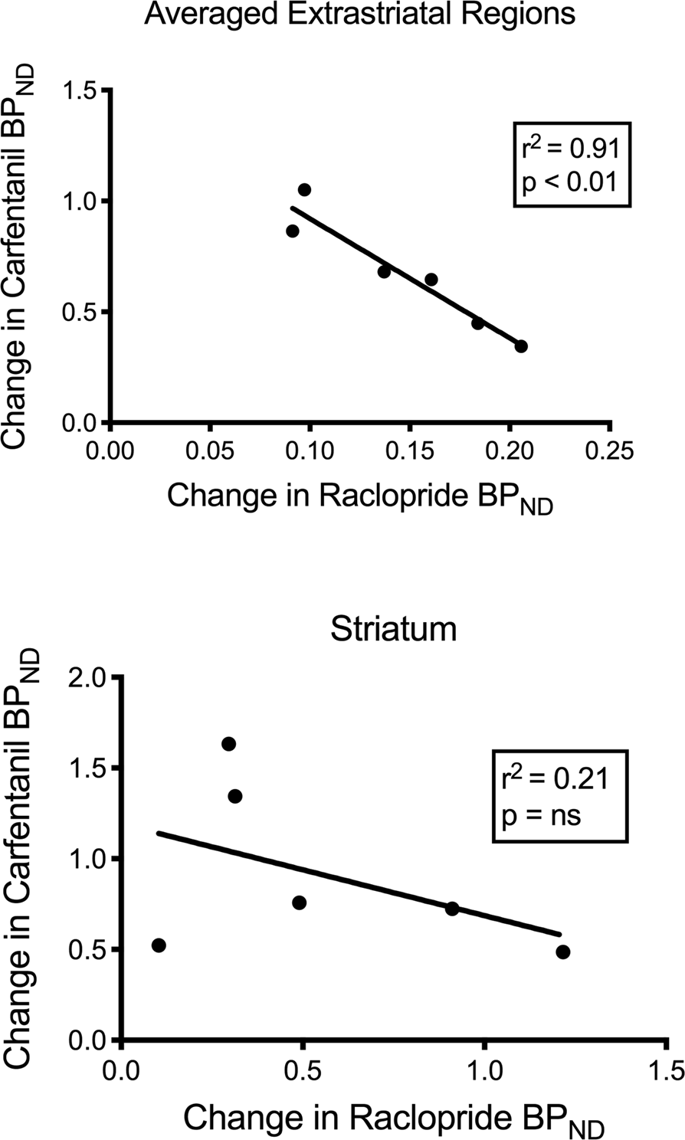
Wir haben die mögliche Korrelation zwischen [11C] Racloprid und []11C] Carfentanil-Werte von BPND in striatalen und nichtstriatalen Regionen bei Minischweinen zu Studienbeginn und nach 12-tägiger Saccharoseaufnahme, ohne dass Assoziationen beobachtet wurden. Wir testeten dann, ob die Abnahme der Tracerbindung korreliert war, und verglichen die Veränderungen des BlutdrucksND zum [11C] Racloprid mit den Veränderungen des BPND zum [11C] Carfentanil nur bei den Minipigs mit niedrigerem BlutdruckND beider Tracer nach Saccharoseaufnahme (n = 6). Wir fanden signifikante negative Korrelationen in gemittelten extrastriatalen (r2 = 0.91, p <0.01), jedoch nicht in striatalen Regionen (Abb. 7).
Korrelationen zwischen vor minus nach Rückgang von [11C] Racloprid und []11C] Carfentanil-Bindungspotentiale (BPND) bei Minipigs mit verminderter Tracerbindung nach Saccharoseaufnahme (n = 6). Es werden Daten aus den gemittelten extrastriatalen Regionen (oben) und dem Striatum (unten) dargestellt. Der Bestimmungskoeffizient (r2) und die p-Werte werden für jedes Diagramm angezeigt.
Diskussion
Wir haben die Auswirkungen eines wiederholten intermittierenden Zugangs zu Saccharose auf die Opioid- und DA-Neurotransmission im Gehirn von Säugetieren bestimmt. Längsrichtung in vivo Die PET-Bildgebung der μOR- und DA D2 / 3-Rezeptoren ergab eine verringerte Rezeptorverfügbarkeit im gesamten Belohnungskreislauf, einschließlich des Nucleus accumbens, des präfrontalen Kortex und des anterioren cingulären Kortex. Die Ergebnisse zeigen deutlich, dass Saccharose die Belohnungsmechanismen auf ähnliche Weise beeinflusst wie Drogenmissbrauch.
Es ist bekannt, dass die Aufnahme von Saccharose als schmackhafte Substanz DA freisetzt und bei Nagetieren eine Abhängigkeit hervorruft15, wobei gezeigt wurde, dass Saccharose bei Nagetieren in bestimmten Zusammenhängen noch angenehmer ist als Kokain. Daher arbeiten Nagetiere auch ohne Nahrungsentzug intensiver an der Gewinnung von Saccharose als an Kokain5. Die Wirkungen von Saccharose werden jedoch sowohl durch das homöostatische System als auch durch hedonische Belohnungskreise reguliert16,17 Dies kann die Unterscheidung zwischen ernährungsphysiologischen und hedonistischen Aspekten der Saccharosewirkung vermitteln18. Wir entschieden uns für einen Tagesplan von einer Stunde, um das „Binging“ zu fördern, da frühere Studien an Ratten in einem intermittierenden Zeitplan eine höhere Aufnahme während der ersten Stunde des täglichen Zugangs gezeigt hatten15,19. Verhaltensstudien zur Nahrungsaufnahme zielen häufig auf Tiere mit Nahrungsmittelbeschränkung ab, aber das Design muss nicht unbedingt dieselben neuronalen Mechanismen widerspiegeln, die bei Fettleibigkeit aktiv sind. Schweine in der vorliegenden Studie waren nicht auf Nahrungsmittel beschränkt und erhielten neben dem Zugang zu Saccharose die üblichen Mengen ihrer normalen Nahrung.
Opioidrezeptoren (OR) sind im Gehirn weit verbreitet, insbesondere in Strukturen, von denen bekannt ist, dass sie Ess- und Belohnungsprozesse modulieren20. Es hat sich gezeigt, dass OPs für die lohnenden und rezidivierenden Wirkungen von Kokain wichtig sind21,22,23,24. Bindungsänderungen wurden auch mit den homöostatischen Reaktionen auf das Essen und dem Genuss von schmackhaftem Essen in Verbindung gebracht25. Insbesondere hängt das „Mögen“ von Lebensmitteln mit dem endogenen Opioidsystem, insbesondere dem μOR, zusammen9,10 in der Schale des Nucleus accumbens und des ventralen Pallidums26. Infusionen eines μOR-Agonisten in bestimmte Teile des Nucleus accumbens und des ventralen Pallidums verstärken das „Liking“ -Verhalten, einschließlich Zungenvorsprüngen und Pfoten lecken, nach einer erhöhten schmackhaften Nahrungsaufnahme27,28,29. Weitere Hinweise auf Opioidsignale bei der Verarbeitung der hedonischen Regulation stammen von μOR-Antagonisten, die den Verzehr von wohlschmeckendem Futter in beiden Fällen dämpfen ad libitumTiere mit Futter- und Lebensmittelbeschränkungen, jedoch mit geringerem Einfluss auf die Aufnahme von nicht schmackhaften Standardpellets30,31. Beim Menschen verringern μOR-Antagonisten die kurzfristige Nahrungsaufnahme und verringern die Angenehmheit von schmackhaften Nahrungsmitteln32,33,34. Opioidsignale in der basolateralen Amygdala tragen auch dazu bei, dass Lebensmittel „fehlen“, indem sie die Belohnungssuche und den Anreizwert von Lebensmitteln modulieren35.
Mit [11C] Carfentanil erhielten wir Bilder der Tracer-Bindung, die sowohl auf μOR-Spiegel als auch auf die Freisetzung endogener Opioide im Gehirn ansprechen36,37. Wir stellten einen sofortigen Verlust der μOR-Verfügbarkeit in Bereichen des Nucleus accumbens und des anterioren cingulären Kortex, spezifischen Gehirnregionen des Belohnungswegs, nach anfänglichem Verbrauch von Saccharose durch fünf Minischweine fest, was mit einer endogenen Opioidfreisetzung vereinbar ist. Frühere Studien haben gezeigt, dass schmackhaftes Essen zu Lustgefühlen führen kann38 durch Stimulierung der Opioidfreisetzung. Nach 12 Tagen Saccharose-Zugang beobachteten wir einen Rückgang [11C] Carfentanil-Bindung, die mehrere mögliche Erklärungen hat39 einschließlich endogener Opioidfreisetzung und Bindung an μOR, μOR-Internalisierung als Ergebnis einer erhöhten Opioidbindung und einer erhöhten DA D2 / 3-Rezeptoraktivierung, was zu einer heterologen Desensibilisierung von μOR führt40.
Zur Untermauerung der vorliegenden Ergebnisse [11C] Carfentanil-Studien an Patienten mit Bulimie41Fettleibigkeit42,43,44und Essstörung45, zeigen eine verminderte Rezeptorverfügbarkeit. Dies sind jedoch chronische Zustände, während die Minischweine nur 12 Tage lang Saccharose erhielten. In einer Studie zum akuten Fütterungsverhalten bei gesunden Männern führte die Fütterung zu einer robusten und weit verbreiteten endogenen zerebralen Opioidfreisetzung, sowohl in Gegenwart als auch in Abwesenheit von Hedonie, was darauf hindeutet, dass die Opioidfreisetzung metabolische und homöostatische sowie hedonische Reaktionen widerspiegelt25. Diese Studie bildete zusammen mit einer anderen die Patienten nach einer flüssigen Mahlzeit mit Schokoladengeschmack ab44, ist direkt relevant für die akute Untersuchung von fünf Minipigs nach der ersten Saccharoseexposition, unterscheidet sich jedoch von der subchronischen Saccharoseexposition über 12 Tage, bei der die verringerte Rezeptorverfügbarkeit eher auf wiederholte Überstimulation und gleichzeitige Herunterregulierung von μOR zurückzuführen ist.
Der präfrontale Kortex ist wichtig für die Entscheidungsfindung und die Wertschätzung von Gegenständen. Daher kann das μOR im präfrontalen Kortex für die veränderte Bewertung der Lebensmittelqualität verantwortlich sein, die das Suchtpotenzial von Lebensmitteln erhöhen kann. Wir haben eine verminderte Bindung im präfrontalen Kortex festgestellt, was mit früheren Studien übereinstimmt, die zeigten, dass eine fettreiche Ernährung die Konzentration von μOR-mRNA im präfrontalen Kortex senkt46 und dass die Infusion eines μOR-Agonisten in die präfrontale Kortikalis die Aufnahme von Süßspeisen erhöht47. Es stellt sich jedoch erneut die Frage, ob die fettreiche Ernährung eine chronischere Erkrankung ist, die mit größerer Wahrscheinlichkeit eine Herunterregulierung des Rezeptors bewirkt, als dies bei der kurzfristigen Fütterung mit Saccharose der Fall ist Auch nach 12 Tagen Saccharose.
DA wurde in Belohnungen von Drogen und Verhalten verwickelt. Es wurde festgestellt, dass chronischer Kokainkonsum die DA-Signalübertragung hemmt48. DA D1- und D2 / 3-Rezeptorwerte werden durch Nikotin im Schweinehirn verändert49und bei nichtmenschlichen Primaten mit Kokainmissbrauch in der Vorgeschichte50Dies steht im Einklang mit der Herunterregulierung von D2 / 3-Rezeptoren im Gehirn menschlicher Kokainsüchtiger51,52. In Bezug auf Drogenmissbrauch wurde gezeigt, dass Saccharose DA D1-Rezeptoren hochreguliert19 und erhöhen Sie die DA-Version53Dies stärkt die Rolle von DA, wenn es darum geht, in Bezug auf schmackhafte Lebensmittel „zu wollen“. Frühere PET-Studien haben eine Abnahme der Verfügbarkeit von DA D2 / 3-Rezeptoren bei krankhafter Fettleibigkeit im Vergleich zum Durchschnittsgewicht gezeigt54,55in der Größenordnung ähnlich wie bei drogenabhängigen Patienten56und bei Tieren mit Adipositas-Modellen57. In Nagerstudien fördert der Abbau des D2 / 3-Rezeptors im Striatum die Entwicklung von Zwangsfutter bei Ratten mit Zugang zu wohlschmeckendem Futter57.
Unsere Beobachtungen einer verminderten D2 / 3-Rezeptorverfügbarkeit des Schweins können auf einen erhöhten DA-Spiegel als Reaktion auf die mit der Saccharoseaufnahme verbundene Anreizwirkung hinweisen, da DA als Teil des Mangels an Drogen und anderen lustvollen Aktivitäten freigesetzt wird52,58,59,60. Da die Schweine während der Bildgebung anästhesiert wurden und innerhalb von 24 Stunden keine Saccharose erhalten hatten, verringerte sich der D2 / 3-BlutdruckND Wahrscheinlicher ist eine Verringerung der Anzahl der Rezeptoren als Reaktion auf einen längeren Anstieg der DA-Freisetzung an jedem der 12 Tage nach dem Zugang zu Saccharose. Die Reduktion kann die Belohnungsschwellen des Gehirns erhöhen, was mit einer Herunterregulierung der DA-D2-Rezeptoren im Striatum zusammenhängt. Dies könnte die erhöhte Anfälligkeit für Drogenmissbrauch erklären, die in früheren Studien an Ratten bei übermäßigem Verzehr von Saccharose beobachtet wurde und zu einer Kreuzsensibilisierung gegen Kokain, einer Hyperaktivität nach niedrig dosiertem Amphetamin, einem erhöhten Alkoholkonsum bei Verzicht auf Saccharose und einer Toleranz gegenüber analgetischen Wirkungen von Opiaten führte6.
Eine frühere Studie über Fettleibigkeit am Göttinger Minischwein identifizierte einen verminderten zerebralen Blutfluss im Nucleus accumbens, im ventralen tegmentalen Bereich (VTA) und im präfrontalen Kortex mit der Einzelphotonen-Emissions-Computertomographie (SPECT) des Gehirns61. In Übereinstimmung mit diesen Befunden beobachteten wir eine verminderte DA D2 / 3-Bindung in der Ventroforebrain-Region, die den Nucleus accumbens enthält, und im präfrontalen Kortex. Die extrazellulären DA-Spiegel im Nucleus accumbens sind nach Saccharoseaufnahme bei sich frei bewegenden Ratten, die einer Mikrodialyse unterzogen werden, um das Dreifache erhöht62. Bei saccharoseabhängigen Tieren kann die wiederholte Aufnahme von Saccharose zur Freisetzung von DA aus der Hülle des Nucleus accumbens führen63. Tiere, die mit eingeschränkter Nahrung mit eingeschränktem Zugang zu Saccharose gefüttert wurden, wiesen eine geringere DA-D2-Rezeptorbindung in der Nucleus-accumbens-Schale und im dorsalen Striatum auf64. Eine eingeschränkte Ernährung mit hohem Fett- und Saccharosegehalt kann zu einer anhaltenden Herunterregulierung der D1- und D2-Rezeptor-mRNA im Nucleus accumbens führen65. Eine Mikrodialysestudie der Wirkungen schmackhafter Lebensmittel ergab eine erhöhte DA-Freisetzung im Nucleus accumbens und im präfrontalen Kortex, als das Lebensmittel noch als neu galt. Sobald sich die Ratten an das neue Futter gewöhnt hatten, war die erhöhte Freisetzung im Nucleus accumbens, nicht jedoch im präfrontalen Kortex, abgestumpft66. Die unterschiedliche Anfälligkeit für Gewöhnung und Konditionierung der Aktivität in zwei Regionen erklärt möglicherweise die stärkere Zunahme des präfrontalen Kortex als bei Nucleus accumbens von Minipigs, die derselben schmackhaften Substanz ausgesetzt waren und nach zwölf Tagen an Neuheit verloren haben. Da wir jedoch keine Minischweine mit [11C] Racloprid nach der ersten Saccharoseverabreichung, diese Erklärung ist spekulativ.
Der präfrontale Kortex moduliert die exekutive Funktion, Entscheidungsfindung und Selbstkontrolle67. Eine gestörte DA-Neurotransmission im präfrontalen Kortex beeinträchtigt die Modulation der Belohnungsverarbeitung, was auf eine Beeinträchtigung der Exekutivfunktion und Entscheidungsfähigkeit bei übergewichtigen Personen hindeutet68,69. Darüber hinaus korrelierte eine humane PET-Studie einen verminderten frontalen Kortexstoffwechsel mit einer verminderten striatalen D2-Bindung bei Adipositas70. Hier finden wir eine verringerte Verfügbarkeit von D2 / 3-Rezeptoren im präfrontalen Cortex, einschließlich des orbitofrontalen Cortex von Schweinen, die dem Saccharose-Regime ausgesetzt waren.
Dopaminerge Neuronen der VTA senden Projektionen an den Hippocampus und die Amygdala, wo sie das gewohnheitsmäßige Verhalten unterstützen71 und Vermittlung der Kodierung und Wiedergewinnung der Konditionierung zum Arzneimittel72,73 und Essen Hinweise74,75. Die Bildgebung des menschlichen Gehirns hat eine Aktivierung des Hippocampus als Reaktion auf Heißhunger und Verkostung von Lebensmitteln gezeigt76. In Übereinstimmung mit unseren Erkenntnissen über eine verringerte Verfügbarkeit von Hippocampus- und Amygdalar-D2 / 3-Rezeptoren als Reaktion auf Saccharose wurde die Kartierung des menschlichen Gehirns mit [18F] Fallyprid zeigte eine Kokain-Cue-induzierte DA-Freisetzung in Amygdala und Hippocampus77. In Gehirnen von Nagetieren löste die Exposition gegenüber Kokain eine DA-Freisetzung in der Amygdala aus78Veränderungen des Amygdala-DA-Spiegels beeinflussten das Verhalten bei der Suche nach Kokain79.
In einer Studie an adipösen Personen wurde der Zusammenhang zwischen D2 / 3 und μOR-Verfügbarkeiten, von denen bekannt ist, dass sie in striatalen Regionen von schlanken Personen bestehen, im ventralen Striatum gestört80. Wir haben die Werte von BP verglichenND der beiden Tracer, um zu testen, ob die Daten diesen Effekt reproduzieren. Im Gegensatz zu schlanken Menschen hatten die gegenwärtigen Gehirne von Schweinen keine Korrelation zwischen den BP-WertenND der beiden Tracer zu Studienbeginn oder nach Exposition gegenüber Saccharose. Wir testeten dann, ob die Tiere mit der größten Abnahme der Tracer-Racloprid-Bindung auch die größte Abnahme der Tracer-Carfentanil-Bindung aufweisen würden. Stattdessen fanden wir eine negative Korrelation in den gemittelten extrastriatalen Regionen, was darauf schließen lässt, dass Tiere mit der größten Änderung des Bindungspotentials von Tracer-Racloprid hatte die geringste Veränderung des Bindungspotentials von Tracer-Carfentanil. Die umgekehrte Beziehung zwischen den Änderungen legt nahe, dass die Auswirkungen der Saccharoseaufnahme auf die Verfügbarkeit der jeweiligen Rezeptoren in entgegengesetzte Richtungen reguliert werden. Es ist bekannt, dass übermäßiger Konsum von schmackhaften Nahrungsmitteln oder Drogen durch Mangel oder Gefallen oder durch beides verursacht werden kann60,81. Es ist möglich, dass das Ausmaß des von Dopamin getriebenen Wunsches das Ausmaß des von Opioiden getriebenen Wunsches negiert oder umgekehrt. Jüngste Erkenntnisse deuten auf die Rolle der GABA hinA Rezeptoren in den VTA- und cholinergen Terminals im Striatum und möglicherweise im Cortex, die als Schalter zwischen dopaminabhängigen und dopaminunabhängigen Mechanismen der Opioidwirkung fungieren82,83 Dies könnte die Reziprozität von Dopamin- und Opioideffekten in den hier bestimmten extrastriatalen Regionen von Schweinen erklären.
Ein Nachteil von PET, auch bei vergleichsweise großen Tieren, ist die begrenzte räumliche Auflösung der Tomographie, die sich auf die Ergebnisse kleiner Gehirnregionen auswirkt, die an Verhaltensweisen im Zusammenhang mit Lebensmitteln beteiligt sind. Trotz dieser Bedenken [11Die Bindung von C] Racloprid wurde zuvor sowohl in striatalen als auch in extrastriatalen Regionen aufgezeichnet84,85,86,87. Die Verwendung von [11C] Racloprid zur Markierung des gleichen Rezeptortyps wirft keine Bedenken hinsichtlich möglicher Affinitätsunterschiede auf, die sich auf die Verwendung separater Tracer für die gleichen Rezeptoren in verschiedenen Regionen auswirken können. Jüngste Studien enthielten Aufzeichnungen über die extrastriatale Bindung von [11C] Racloprid. Alakurtti et al. fanden eine gute Reproduzierbarkeit der Messungen der striatalen Raclopridbindung im Striatum bei nur guter bis mäßiger Reproduzierbarkeit im Kortex85. In einer späteren Studie, Svensson et al. erörterte mehrere Probleme, die die Verwendung von [11C] Racloprid als Marker für extrastriatale D2 / 3-Rezeptoren in einer Studie an gesunden Menschen, einschließlich schlechter Reproduzierbarkeit im Kortex und begrenzter Abnahme der extrastriatalen Bindung im frontalen Kortex als Reaktion auf ein D2 / 3-Blockierungsmittel88. Die Test-Retest-Vergleiche ergaben Variabilitäten von 4–7% im Striatum und 13–59% in kortikalen Regionen, aber die Zeit zwischen den Untersuchungen betrug im Gegensatz zu den informativeren 20–1 Tagen der meisten Studien durchschnittlich 2 Tage. Möglicherweise hatten einige Faktoren im Leben dieser Probanden Zeit, die Ergebnisse zu beeinflussen. In der Tat zeigen wir hier, dass die bloße Zugabe von Saccharose zu einer Morgenroutine für 12 Tage die zwei Wochen später erhaltenen Bindungsmaßnahmen beeinflusst haben kann. Andere Faktoren, wie das Spielen von Videospielen, das Einkaufen, das Eingehen neuer romantischer Beziehungen und sexueller Aktivitäten, der Konsum von Drogen oder das Ändern von Ernährung und Bewegung, können den extrastriatalen Dopaminspiegel beeinflussen und möglicherweise die Datenmengen stark variieren. Die aktuelle Studie an Minischweinen führte eine gut kontrollierte Regelung ein, wobei die einzige Variable das Fehlen oder Vorhandensein von Saccharose im Futter war. In diesem Zusammenhang wiesen die Daten von sieben Tieren in relevanten extrastriatalen Regionen eine ausreichend geringe Variabilität auf, um eine statistisch signifikante Verringerung der Bindung als Reaktion auf Saccharose zu identifizieren.
Eine Einschränkung der aktuellen Studie ist der Einsatz von Anästhetika, die zur Sicherstellung der Immobilität während der Studie erforderlich sind in vivo Bildgebung von Tieren. Die Wirkungen spezifischer Anästhetika und ihre Wechselwirkungen mit Arzneimitteln oder anderen Interventionen können die Bindung von Radioliganden stören89,90. Ketamin ist ein Antiglutamatergikum mit schneller antidepressiver Wirkung in subanästhetischen Dosen91,92,93, die nicht striatal reduzieren [11C] Raclopridbindung beim Menschen94. Es wurde jedoch festgestellt, dass S-Ketamin die Bindungsverfügbarkeit von Dopamin-D2 / 3-Rezeptoren im Striatum von bewussten nicht-menschlichen Primaten verringert95. Isofluran ist ein gängiges Anästhetikum in der Tier-PET. In früheren Studien fanden wir eine striatale Akkumulation von [11C] SCH23390, ein Radioligand der Dopamin-D1-Rezeptoren, der bei mit Isofluran anästhesierten Minischweinen signifikant höher ist als bei Propofol, was darauf hindeutet, dass die dopaminerge Neurotransmission anfällig für Narkoseeffekte ist96. In der aktuellen Studie wurden alle Minischweine zu beiden Zeitpunkten unter Ketaminvorbehandlung und Isoflurananästhesie abgebildet, was die vorliegenden Vergleiche gültig machte.
Zusammenfassung
Übermäßiger Verzehr von schmackhaften Nahrungsmitteln kann sowohl zu einer Abhängigkeit führen als auch zu einer Folge davon mit direkten Folgen für die Gesundheit durch Fettleibigkeit. Wir testeten die Behauptung, dass Opioide und Dopamin Belohnungen vermitteln, die sowohl für das Überleben als auch für den Drogenmissbrauch wichtig sind. Minischweine mit intermittierendem Zugang zu einer Saccharoselösung an 12 aufeinanderfolgenden Tagen zeigten eine verminderte Verfügbarkeit von Dopamin D2 / 3 und μ-Opioidrezeptoren in Hirnregionen im striatalen und extrastriatalen Bereich verbraucht werden. Die anfängliche einmalige Exposition gegenüber Saccharose stimmte mit der Opioidfreisetzung in belohnend aktiven Hirnregionen überein. Die Veränderungen der Opioid- und Dopaminverfügbarkeit erklären das Suchtpotential von übermäßig konsumierter Saccharose.
Materialen und Methoden
Tierethik
Diese Studie wurde von der dänischen Aufsichtsbehörde für Tierversuche genehmigt und reguliert. Alle Versuche wurden gemäß der Richtlinie 2010/63 / EU des Europäischen Parlaments und des Rates zum Schutz von Tieren für wissenschaftliche Zwecke und den ARRIVE-Richtlinien durchgeführt. Wir verwendeten sieben 6 Monate alte weibliche Göttinger Minischweine (Ellegaard, Dalmose, Dänemark). Den Minipigs wurde eine Pelletdiät (2 dl, XNUMX-mal täglich, Special Diets Services, Aarhus, Dänemark) mit Leitungswasser zur Verfügung gestellt ad libitum. Die Umgebungstemperatur betrug 20–22 ° C, die relative Luftfeuchtigkeit 50–55%, und die Luft wurde achtmal pro Stunde gewechselt.
Intermittierender Saccharose-Verbrauch
Wir haben sieben Minischweine mit [11C] Racloprid und []11C] Carfentanil zu Studienbeginn und erneut einen Tag nach 12 aufeinanderfolgenden Tagen Saccharosewasserexposition. Die Saccharoseexposition bestand aus einer Stunde Saccharose (Saccharose, Dansukker, Kopenhagen, Dänemark) Wasserzugang (500 Gramm Saccharose in 2 Litern Wasser) täglich während eines Zeitraums von 12 Tagen. Die Menge der Saccharoseaufnahme wurde aufgezeichnet und alle Minischweine verbrauchten an jedem Tag 2 Liter. Wir haben auch fünf gleiche Minischweine mit [11C] Carfentanil, 30 Minuten nach dem ersten Saccharosezugang, um die akute Opioidfreisetzung zu untersuchen.
Die Minischweine nahmen nach der 13.6-tägigen Saccharoseexposition, die signifikant höher war (einseitiger t-Test, p <), durchschnittlich 25.4% Körpergewicht von 0.73 kg (± 28.9 SEM) zu Studienbeginn auf 0.69 kg (± 12 SEM) zu Studienbeginn zu 0.001) als die Erhöhungen, die bei einer Stichprobe von Kontroll-Minischweinen beobachtet wurden, die in früheren Studien erhalten wurden, in denen das Gewicht im gleichen Entwicklungszeitraum im Durchschnitt nur um 4.9% zunahm.
Gehirn-PET-Bildgebung
Wir fasteten Schweine über Nacht mit freiem Zugang zu Wasser vor der Bildgebung. Wir haben Minischweine wie zuvor beschrieben vorbehandelt und anästhesiert97 und liegend in ein PET / CT-Gerät (Siemens Biograph 64 Truepoint PET) gelegt. Wir führten vor jeder PET-Erfassung einen CT-Scan mit niedriger Dosis durch, um die anatomischen Daten zu bestimmen und die Abschwächung der PET-Emissionsdaten zu korrigieren. Wir verabreichten intravenös [11C] Racloprid zu Studienbeginn (360 ± 18 MBq, spezifische Aktivität 77 ± 76 GBq / μmol, injizierte Masse 0.12 ± 0.08 μg / kg) und nach 12 Tagen Saccharose (374 ± 54 MBq, spezifische Aktivität 127 ± 85 GBq / μmol), eingespritzte Masse 0.06 ± 0.05 μg / kg) und [11C] Carfentanil zu Studienbeginn (377 ± 43 MBq, spezifische Aktivität 311 ± 195 GBq / μmol, injizierte Masse 0.03 ± 0.02 μg / kg) und nach 12 Tagen Saccharose (337 ± 71 MBq, spezifische Aktivität 177 ± 157 GBq / μmol), injizierte Masse (0.06 ± 0.08 μg / kg) über die Ohrvene in 10 ml Kochsalzlösung während der ersten Minute eines 90-minütigen Scans. Wir haben PET-Daten mit TrueX 3D OSEM (3 Iterationen, 21 Teilmengen), einer 256 × 256 × 109-Matrix und einem 2-mm-Gauß-Filter unter Verwendung einer Zeitrahmenstruktur von 5 × 60, 3 × 300, 4 × 600 rekonstruiert 2 × 900 Sekunden (insgesamt 14 Bilder, 90 Minuten). Zu Studienbeginn und nach 12 Tagen Saccharose wurden die beiden Tracer aufgrund der Halbwertszeit von [11C] PET-Tracer. Nach Abschluss der letzten PET-Sitzung haben wir die Minischweine unter Vollnarkose durch eine intravenöse Überdosis Pentobarbital (100 mg / kg) eingeschläfert.
Quantitative Analysen und Statistiken
Wir haben Vorverarbeitungsschritte mit PMOD 3.7 (PMOD Technologies Ltd, Zürich, Schweiz) durchgeführt. Um die stereotaktischen Transformationsparameter aus zeitgemittelten PET-Bildern zu definieren, verwendeten wir ligandenspezifische Templates. Wir haben die generierten Transformationsmatrizen und Warping-Felder auf die entsprechenden dynamischen PET-Zeitreihen angewendet. Wir haben parametrische Bilder von [11C] Racloprid-Bindungspotential (BPND) mittels der multilinearen Referenzgewebemethode von Ichise et al98. Wir haben eine maßgeschneiderte Maske des Kleinhirns erstellt, die die Vermis ausschließt, um die Radioaktivität des Kleinhirngewebes im Laufe der Zeit in einem Bereich mit vernachlässigbarer DA D2 / 3-Rezeptordichte zu erhalten. Wir haben parametrische Bilder von [11C] Carfentanil unter Verwendung einer Implementierung des Logan-Referenzgewebemodells99,100 mit t * = 30 min Studien von [11C] Carfentanil-Bindung im menschlichen Gehirn haben den Occipitalcortex als Referenzregion verwendet36; In Übereinstimmung mit den Zeitaktivitätskurven war jedoch bei Schweinen die nicht verschiebbare Bindung im Kleinhirn geringer als im Occipitalcortex101. Wir haben daher in der vorliegenden Studie das Kleinhirn als Referenzregion ausgewählt.
statistische Analyse
Wir haben die Karten einer voxelweisen Analyse mit Statistical Non-Parametric Mapping (SnPM v13.01, http://warwick.ac.uk/snpm) SPM-Toolbox, die eine nichtparametrische Permutationstheorie verwendet, um einen Rahmen für statistische Inferenz zu schaffen, ein Ansatz, der sich aufgrund der strengen Kontrolle falsch positiver Ergebnisse für kleine Stichproben bewährt14 und wie zuvor beschrieben angewendet102. Ein Experte für Schweine-Neuroanatomie (DO) verglich die resultierenden Bilder mit einer Signifikanzschwelle von 5% mit einem hochauflösenden Göttinger Minipig-Atlas103,104 Regionen mit vermindertem DA D2 / 3 und μOR BP zu definieren und zu markierenND vom Ausgangswert bis zum Zustand nach Saccharose. Anschließend führten wir eine ROI-Analyse (Region-of-Interest) durch, um den BP zu extrahierenND Werte spezifischer Regionen, die aufgrund der SnPM-Analyse von Interesse waren, einschließlich Striatum, Nucleus accumbens, Thalamus, Amygdala, cingulierter Cortex und präfrontaler Cortex. Es wurden keine zusätzlichen Statistiken zur ROI-Analyse durchgeführt, da diese Regionen mit SnPM bereits als signifikant befunden wurden.
Bibliographie
- 1.
Smyth, S. & Heron, A. Diabetes und Fettleibigkeit: die Zwillingsepidemien. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL und Curtin, LR Prävalenz und Trends bei Fettleibigkeit bei Erwachsenen in den USA, 1999–2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA. et al. Dopamin für das „Wollen“ und Opioide für das „Mögen“: Ein Vergleich von übergewichtigen Erwachsenen mit und ohne Essattacken. Fettleibigkeit (Silver Spring) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Fettleibigkeit und das Nahrungsumfeld: Nahrungsenergiedichte und Diätkosten. Amerikanische Zeitschrift für Präventivmedizin 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Intensive Süße übertrifft die Kokainbelohnung. PLoS ONE 2e698 https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In Neurowissenschaften im 21. Jahrhundert (Hrsg. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Weiterentwicklungen in der Neurobiologie von Lebensmitteln und Sucht: Update zum Stand der Wissenschaft. Ernährung 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M.In Vergnügen des Gehirns (Hrsg. Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Von der Geschmacks-Hedonik zum Motivationsantrieb: zentrale Mu-Opioid-Rezeptoren und Essattacken. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10
Berridge, KC Food-Belohnung: Hirnsubstrate zum Wollen und Mögen. Neurowissenschaften und Biobehavioral Reviews 20, 1-25 (1996).
- 11
A. Gjedde, DF Wong, P. Rosa-Neto & P. Cumming Kartierung von Neurorezeptoren bei der Arbeit: Zur Definition und Interpretation von Bindungspotentialen nach 20 Jahren Fortschritt. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12
Avena, NM, Bocarsly, ME & Hoebel, BG Tiermodelle für Zucker- und Fettanfälle: Beziehung zu Nahrungssucht und erhöhtem Körpergewicht. Methoden Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13
Jelsing, J. et al. Die präfrontale Kortikalis im Göttinger Minipig-Gehirn definiert durch neuronale Projektionskriterien und Cytoarchitektur. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14
Nichols, TE & Holmes, AP Nichtparametrische Permutationstests für das funktionelle Neuroimaging: ein Primer mit Beispielen. Hum Gehirn Mapp 15, 1-25 (2002).
- 15
Avena, NM, Rada, P. & Hoebel, BG Hinweise auf Zuckersucht: Verhaltens- und neurochemische Auswirkungen einer intermittierenden, übermäßigen Zuckeraufnahme. Neurowissenschaften und Biobehavioral Reviews 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16
Alonso-Alonso, M. et al. Belohnungssystem für Lebensmittel: aktuelle Perspektiven und zukünftiger Forschungsbedarf. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Saccharose-Selbstverabreichung und ZNS-Aktivierung bei der Ratte. Am J Physiol Regul Integr Comp Physiol 300R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18
Tellez, LA et al. Getrennte Schaltkreise kodieren die hedonischen und Nährwerte von Zucker. Natur Neurowissenschaften 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19
Colantuoni, C. et al. Übermäßige Zuckeraufnahme verändert die Bindung an Dopamin- und Mu-Opioid-Rezeptoren im Gehirn. Neuroreport 12, 3549-3552 (2001).
- 20
Pert, CB, Kuhar, MJ und Snyder, SH Opiatrezeptor: Autoradiographische Lokalisation im Gehirn von Ratten. Proc Natl Acad Sci USA 73, 3729-3733 (1976).
- 21
Soderman, AR & Unterwald, EM Kokainbelohnung und Hyperaktivität bei Ratten: Stellen der Modulation des Mu-Opioidrezeptors. Neuroscience 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22
Ward, SJ, Martin, TJ und Roberts, DC Beta-Funaltrexamin beeinflusst die Selbstverabreichung von Kokain bei Ratten, die auf ein progressives Verhältnis der Verstärkung reagieren. Pharmakologie, Biochemie und Verhalten 75, 301-307 (2003).
- 23
Schroeder, JA et al. Eine Rolle für Mu-Opioidrezeptoren bei der kokaininduzierten Aktivität, Sensibilisierung und Belohnung bei der Ratte. Psychopharmakologie 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Die durch Kokain induzierte Wiederherstellung erfordert eine endogene Stimulation der Mu-Opioid-Rezeptoren im ventralen Pallidum. Das Journal der Neurowissenschaften: die offizielle Zeitschrift der Society for Neuroscience 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25
Tuulari, JJ et al. Fütterung setzt körpereigene Opioide beim Menschen frei. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26
Smith, KS & Berridge, KC Limiotischer Opioidkreislauf zur Belohnung: Wechselwirkung zwischen hedonischen Hotspots von Nucleus accumbens und ventralem Pallidum. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27
Pecina, S. & Berridge, KC Die Opioidstelle in der Hülle des Nucleus accumbens vermittelt das Essen und die hedonische "Vorliebe" für Lebensmittel: Karte basierend auf Fos-Federn mit Mikroinjektion. Brain Res. 863, 71-86 (2000).
- 28
Zhang, M. & Kelley, AE Die Aufnahme von Saccharin-, Salz- und Ethanollösungen wird durch Infusion eines Mu-Opioid-Agonisten in den Nucleus accumbens erhöht. Psychopharmakologie 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29
Zhang, M., Gosnell, BA & Kelley, AE Die Aufnahme von fettreichen Nahrungsmitteln wird selektiv durch die Stimulation des Mu-Opioidrezeptors im Nucleus accumbens verstärkt. Das Journal für Pharmakologie und experimentelle Therapeutika 285, 908-914 (1998).
- 30
Levine, AS, Weldon, DT, Grace, M., Cleary, JP und Billington, CJ Naloxone blockieren den Teil der Fütterung, der durch den süßen Geschmack bei Ratten mit eingeschränktem Futter gesteuert wird. Am J Physiol 268R248–252 (1995).
- 31
Glas, MJ, Billington, CJ & Levine, AS Opioide und Nahrungsaufnahme: verteilte funktionelle Nervenbahnen? Neuropeptide 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32
Fantino, M., Hosotte, J. & Apfelbaum, M. Ein Opioid-Antagonist, Naltrexon, reduziert die Präferenz für Saccharose beim Menschen. Am J Physiol 251R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33
Arbisi, PA, Billington, CJ & Levine, AS Die Wirkung von Naltrexon auf die Geschmackserkennungs- und Erkennungsschwelle. Appetit 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxone, ein Opiatblocker, reduziert den Verzehr von süßen fettreichen Lebensmitteln bei fettleibigen und mageren weiblichen Essattacken. Am J Clin Nutr 61, 1206-1212 (1995).
- 35
Wassum, KM, Ostlund, SB, Maidment, NT und Balleine, BW Unterschiedliche Opioid-Schaltkreise bestimmen die Schmackhaftigkeit und die Wünschbarkeit von Belohnungsereignissen. Proc Natl Acad Sci USA 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36
Colasanti, A. et al. Endogene Opioidfreisetzung im Belohnungssystem des menschlichen Gehirns durch akute Amphetamingabe. Biol Psychiatry 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37
Mick, ich. et al. Amphetamin-induzierte endogene Opioidfreisetzung im menschlichen Gehirn, nachgewiesen mit [11C] Carfentanil-PET: Replikation in einer unabhängigen Kohorte. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38
Yeomans, MR & Gray, RW-Opioidpeptide und die Kontrolle des menschlichen Aufnahmeverhaltens. Neurowissenschaften und Biobehavioral Reviews 26, 713-728 (2002).
- 39
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Woraus man lernen kann in vivo opioiderge Hirnbildgebung? Eur J Schmerz 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40
Unterwald, EM & Cuntapay, M. Dopamin-Opioid-Wechselwirkungen im Rattenstriatum: eine modulatorische Rolle für Dopamin-D1-Rezeptoren bei der Delta-Opioidrezeptor-vermittelten Signaltransduktion. Neuropharmacology 39, 372-381 (2000).
- 41
Benscherif, B. et al. Regionale Mu-Opioid-Rezeptorbindung in der Inselrinde ist bei Bulimia nervosa vermindert und korreliert umgekehrt mit dem Fastenverhalten. Zeitschrift für Nuklearmedizin: offizielle Veröffentlichung der Society of Nuclear Medicine 46, 1349-1351 (2005).
- 42
Karlsson, HK et al. Fettleibigkeit ist mit einer verminderten Verfügbarkeit von Mu-Opioiden, aber unveränderten Dopamin-D2-Rezeptoren im Gehirn verbunden. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43
Karlsson, HK et al. Der Gewichtsverlust nach einer bariatrischen Operation normalisiert die Opioidrezeptoren des Gehirns bei krankhafter Fettleibigkeit. Mol Psychiatrie 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF und Zubieta, JK Endogene Opioidmechanismen sind an Fettleibigkeit und Gewichtsverlust beim Menschen beteiligt. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45
Majuri, J. et al. Dopamin- und Opioid-Neurotransmission bei Verhaltensabhängigkeiten: Eine vergleichende PET-Studie zu pathologischem Glücksspiel und Essattacken. Neuropsychopharmakologie 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46
Vucetic, Z., Kimmel, J. & Reyes, TM Chronische fettreiche Ernährung treibt die postnatale epigenetische Regulation des Mu-Opioid-Rezeptors im Gehirn an. Neuropsychopharmakologie: offizielle Veröffentlichung des American College of Neuropsychopharmacology 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47
Mena, JD, Sadeghian, K. & Baldo, BA Induktion von Hyperphagie und Kohlenhydrataufnahme durch Mu-Opioid-Rezeptor-Stimulation in umschriebenen Regionen der Frontalrinde. Das Journal der Neurowissenschaften: die offizielle Zeitschrift der Society for Neuroscience 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48
Park, K., Volkow, ND, Pan, Y. & Du, C. Chronisches Kokain dämpft die Dopaminsignalisierung während der Kokainvergiftung und bringt D1 über die D2-Rezeptorsignalisierung aus dem Gleichgewicht. Das Journal der Neurowissenschaften: die offizielle Zeitschrift der Society for Neuroscience 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49
Cumming, P. et al. Auswirkungen von akutem Nikotin auf die Hämodynamik und Bindung von [11C] Racloprid an Dopamin-D2,3-Rezeptoren im Schweinehirn. NeuroImage 19, 1127-1136 (2003).
- 50
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ und Friedman, DP Wirkung der Selbstverabreichung von Kokain auf Dopamin-D2-Rezeptoren bei Rhesusaffen. Synapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51
Volkow, ND et al. Kokain-Cues und Dopamin im Striatum dorsalis: Mechanismus des Verlangens nach Kokain. Das Journal der Neurowissenschaften: die offizielle Zeitschrift der Society for Neuroscience 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52
Wong, DF et al. Erhöhte Belegung von Dopaminrezeptoren im menschlichen Striatum während des durch Queue ausgelösten Kokainverlangens. Neuropsychopharmakologie 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53
Hajnal, A., Smith, GP & Norgren, R. Orale Saccharosestimulation erhöht das Accumbens-Dopamin bei der Ratte. Am J Physiol Regul Integr Comp Physiol 286R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Abbildung der Rolle von Dopamin bei Drogenmissbrauch und Sucht. Neuropharmacology 56(Beilage 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55
Wang, GJ et al. Gehirn Dopamin und Fettleibigkeit. Lanzette 357, 354-357 (2001).
- 56
Wang, GJ, Volkow, ND, Thanos, PK und Fowler, JS Ähnlichkeit zwischen Fettleibigkeit und Drogenabhängigkeit, wie durch neurofunktionelle Bildgebung bewertet: eine Konzeptüberprüfung. Zeitschrift für Suchtkrankheiten 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57
Johnson, PM & Kenny, PJ Dopamin-D2-Rezeptoren bei suchtähnlicher Belohnungsstörung und zwanghaftem Essen bei fettleibigen Ratten. Natur Neurowissenschaften 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58
Berridge, KC & Kringelbach, ML Affektive Neurowissenschaften des Vergnügens: Belohnung bei Mensch und Tier. Psychopharmakologie 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59
Berridge, KC & Kringelbach, ML Vergnügungssysteme im Gehirn. Neuron 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60
Schultz, W. Prädiktives Belohnungssignal von Dopamin-Neuronen. J Neurophysiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Veränderungen der Gehirnaktivität nach einer durch Ernährung verursachten Fettleibigkeit. Fettleibigkeit 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62
Hajnal, A. & Norgren, R. Accumbens Dopaminmechanismen bei der Saccharoseaufnahme. Brain Res. 904, 76-84 (2001).
- 63
Rada, P., Avena, NM & Hoebel, BG Tägliches Zuckern setzt wiederholt Dopamin in der Accumbens-Schale frei. Neuroscience 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64
Bello, NT, Lucas, LR und Hajnal, A. Wiederholter Saccharosezugang beeinflusst die Dopamin-D2-Rezeptordichte im Striatum. Neuroreport 13, 1575-1578 (2002).
- 65
Alsio, J. et al. Die Expression des Dopamin-D1-Rezeptor-Gens nimmt im Nucleus accumbens bei längerer Exposition gegenüber schmackhafter Nahrung ab und unterscheidet sich je nach ernährungsbedingtem Phänotyp der Fettleibigkeit bei Ratten. Neuroscience 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66
Bassareo, V. & Di Chiara, G. Unterschiedlicher Einfluss assoziativer und nichtassoziativer Lernmechanismen auf die Reaktion der präfrontalen und akkumbalen Dopaminübertragung auf Nahrungsreize bei Ratten, die ad libitum gefüttert werden. J Neurosci 17, 851-861 (1997).
- 67
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Unausgeglichene neuronale Schaltkreise bei Sucht. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68
Brogan, A., Hevey, D. & Pignatti, R. Magersucht, Bulimie und Fettleibigkeit: gemeinsame Entscheidungsdefizite bei der Iowa Gambling Task (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Entscheidungsdefizite und übermäßiges Essen: ein Risikomodell für Fettleibigkeit. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70
Volkow, ND et al. Niedrige Dopamin-Striatal-D2-Rezeptoren sind bei adipösen Personen mit dem präfrontalen Metabolismus assoziiert: Mögliche Faktoren, die dazu beitragen. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71
Der zentrale Kern von Lingawi, NW & Balleine, BW Amygdala interagiert mit dem dorsolateralen Striatum, um den Erwerb von Gewohnheiten zu regulieren. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72
Grant, S. et al. Aktivierung von Gedächtnisschaltungen während des durch das Stichwort ausgelösten Kokainverlangens. Proc Natl Acad Sci USA 93, 12040-12045 (1996).
- 73
Childress, AR et al. Limbische Aktivierung während des Cue-induzierten Kokainverlangens. Am J Psychiatry 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74
Mahler, SV & Berridge, KC Was und wann soll man "wollen"? Amygdala-basierte Fokussierung von Incentive Salience auf Zucker und Sex. Psychopharmakologie 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75
Koob, GF & Volkow, ND Neurobiologie der Sucht: eine Analyse der Neurokreisläufe. Lancet Psychiatrie 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76
Haase, L., Cerf-Ducastel, B. & Murphy, C. Kortikale Aktivierung als Reaktion auf reine Geschmacksreize während der physiologischen Zustände von Hunger und Sättigung. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77
Fotos, A. et al. Kokain-Cue-induzierte Dopaminfreisetzung in Amygdala und Hippocampus: Eine hochauflösende PET [(1) (8) F] -Fallyprid-Studie bei kokainabhängigen Teilnehmern. Neuropsychopharmakologie 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78
Weiss, F. et al. Kontrolle des Verhaltens bei der Suche nach Kokain durch medikamentenassoziierte Stimuli bei Ratten: Auswirkungen auf die Wiederherstellung der Dopaminspiegel bei Amygdala und Nucleus accumbens, die auf erloschene Operanten ansprechen und extrazellulär sind. Proc Natl Acad Sci USA 97, 4321-4326 (2000).
- 79
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dopamin D1- oder D2-Rezeptorantagonismus innerhalb der basolateralen Amygdala verändert den Erwerb von Kokain-Cue-Assoziationen, die für die Cue-induzierte Wiederherstellung der Kokainsuche notwendig sind, unterschiedlich. Neuroscience 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80
Tuominen, L. et al. Aberrante mesolimbische Dopamin-Opiat-Wechselwirkung bei Adipositas. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81
Schultz, W. Verhaltensdopaminsignale. Trends Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82
Ting, AKR & van der Kooy, D. Die Neurobiologie der Opiatmotivation. Kaltes Frühling Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83
Mamaligas, AA, Cai, Y. & Ford, CP Nikotin- und Opioidrezeptorregulation der durch striatalen Dopamin-D2-Rezeptor vermittelten Übertragung. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84
Nomur, Y. et al. Altersbedingte Abnahme der Verfügbarkeit von Dopamin-D2 / 3-Rezeptoren gemessen mit [C-11] -Racloprid in nicht-striatalen Regionen des menschlichen Gehirns: Vergleich von vier Methoden. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85
Alakurtti, K. et al. Langzeit-Test-Retest-Zuverlässigkeit der Bindung von Dopamin-D2 / 3-Rezeptoren in Striatal- und Extrastriatal-Zellen: Studie mit [(11) C] -Racloprid und hochauflösendem PET. J Cereb Blutfluss Metab 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86
Piccini, P., Pavese, N. & Brooks, DJ Endogene Dopaminfreisetzung nach pharmakologischen Herausforderungen bei der Parkinson-Krankheit. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87
Sawamoto, N. et al. Kognitive Defizite und striatofrontale Dopaminfreisetzung bei Parkinson. Gehirn 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88
Svensson, JE et al. Gültigkeit und Zuverlässigkeit der extrastriatalen [(11) C] Racloprid-Bindungsquantifizierung im lebenden menschlichen Gehirn. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89
Tsukada, H. et al. Isoflurananästhesie verstärkt die Hemmwirkung von Kokain und GBR12909 auf den Dopamintransporter: PET-Studien in Kombination mit Mikrodialyse im Affengehirn. Brain Res. 849, 85-96 (1999).
- 90
Hassun, W. et al. PET-Studie zur [11C] Raclopridbindung im Striatum der Wachkatze: Auswirkungen von Anästhetika und Rolle des zerebralen Blutflusses. Europäische Zeitschrift für Nuklearmedizin und molekulare Bildgebung 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Die Rolle von Ketamin bei behandlungsresistenter Depression: eine systematische Übersicht. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92
Berman, RM et al. Antidepressive Wirkung von Ketamin bei depressiven Patienten. Biol Psychiatry 47, 351-354 (2000).
- 93
Browne, CA & Lucki, I. Antidepressive Wirkungen von Ketamin: Mechanismen, die schnell wirkenden neuen Antidepressiva zugrunde liegen. Vorderes Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94
Alto, S. et al. Ketamin verringert die Bindung des Dopamin-D2-Rezeptors im Menschen nicht. Psychopharmakologie 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. Reduktion der Dopamin-D2 / 3-Rezeptorbindung im Striatum nach einmaliger Verabreichung von Esketamin, jedoch nicht von R-Ketamin: ein PET Studie bei bewussten Affen. Eur Arch Psychiatrie Clin Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96
Alstrup, AK et al. Auswirkungen von Anästhesie und Spezies auf die Aufnahme oder Bindung von Radioliganden in vivo im Göttinger Minipig. BioMed-Forschung international 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97
Lillethorup, TP et al. Monoaminerge PET-Längsbildgebung der chronischen Proteasomhemmung bei Minipigs. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98
Ichise, M., Toyama, H., Innis, RB & Carson, RE Strategien zur Verbesserung der Schätzung von Neurorezeptorparametern durch lineare Regressionsanalyse. J Cereb Blutfluss Metab 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99
Logan, J. et al. Verteilungsvolumenverhältnisse ohne Blutentnahme aus der grafischen Analyse von PET-Daten. J Cereb Blutfluss Metab 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Quantifizierung von Mu-Opioid-Rezeptoren im Gehirn mit [11C] Carfentanil: Referenzgewebemethoden. Nucl Med Biol 30, 177-186 (2003).
- 101
Panksepp, J. & Bishop, P. Eine autoradiographische Karte der (3H) -Diprenorphinbindung im Rattenhirn: Auswirkungen sozialer Interaktion. Brain Res Bull 7, 405-410 (1981).
- 102
Landau, AM et al. Die elektrokrampfartige Stimulation beeinflusst die Bindung von [(11) C] MDL100,907 an kortikale und subkortikale 5HT2A-Rezeptoren im Schweinehirn unterschiedlich. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Das Telencephalon des Göttinger Minipigs, der Cytoarchitektur und der kortikalen Oberflächenanatomie. Hirnstruktur-Funktion 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Histologischer Online-Atlas des Göttinger Minipig-Gehirns. Heliyon 5e01363 https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Danksagung
Die Studie wurde mit einem „AU Ideas Project Development Grant“ der Universität Aarhus an AML finanziert. Wir sind dankbar für die technische Unterstützung durch die Mitarbeiter des PET-Zentrums der Aarhus University Hospital und der Aarhus University Farm bei der Behandlung der Tiere. Wir danken Professor Morten Kringelbach, Professor Jørgen Scheel-Kruger und Associate Professor Arne Møller für die Unterstützung bei der Initiierung dieser Studien.
Ethikerklärungen
Konkurrierende Interessen
Die Autoren erklären keine konkurrierenden Interessen.
Zusätzliche Informationen
Verlagsnotiz Springer Nature bleibt hinsichtlich der gerichtlichen Ansprüche in veröffentlichten Karten und institutionellen Verbindungen neutral.
Rechte und Berechtigungen
Open Access Dieser Artikel unterliegt den Bestimmungen einer Creative Commons Attribution 4.0 International-Lizenz. Diese Lizenz gestattet die Verwendung, Weitergabe, Anpassung, Verteilung und Vervielfältigung in beliebigen Medien oder Formaten, sofern Sie dem / den ursprünglichen Autor (en) und der Quelle die entsprechende Quellenangabe machen Verknüpfen Sie mit der Creative Commons-Lizenz und geben Sie an, ob Änderungen vorgenommen wurden. Die Bilder oder anderes Material von Drittanbietern in diesem Artikel sind in der Creative Commons-Lizenz des Artikels enthalten, sofern in einem Kreditrahmen für das Material nichts anderes angegeben ist. Wenn das Material nicht in der Creative Commons-Lizenz des Artikels enthalten ist und Ihre beabsichtigte Verwendung nicht durch gesetzliche Bestimmungen gestattet ist oder die zulässige Verwendung überschreitet, müssen Sie die Genehmigung direkt vom Inhaber des Urheberrechts einholen. Besuchen Sie, um eine Kopie dieser Lizenz anzuzeigen http://creativecommons.org/licenses/by/4.0/.