Vorderseite. Behav. Neurosci., 02 April 2014 |
Carla Kalkhoven1, Cor Sennef1, Ard Peeters1 und Ruud van den Bos2*
- 1Chardon Pharma, Herpen, Niederlande
- 2Institut für Organismische Tierphysiologie, Fakultät für Naturwissenschaften, Radboud University Nijmegen, Nijmegen, Niederlande
Huntington-Krankheit (HD) ist eine genetisch bedingte, neurodegenerative Erkrankung, die Striatumneuronen des indirekten Weges gezielt beeinflusst, was zu einem fortschreitenden Rückgang der Muskelkoordination und den Verlust der emotionalen und kognitiven Kontrolle. Interessanterweise beinhaltet die Prädisposition für pathologisches Glücksspiel und andere Abhängigkeiten Störungen in denselben kortiko-striatalen Kreisläufen, die auch bei der Huntington-Krankheit betroffen sind, und zeigt ähnliche auf Desinhibition bezogene Symptome, einschließlich veränderter Empfindlichkeit gegenüber Strafen und Belohnungen, Impulsivität und Unfähigkeit, langfristige Vorteile in Betracht zu ziehen über kurzfristige Belohnungen. Beide HD-Patienten und pathologische Spieler zeigen auch ähnliche Leistungsdefizite auf riskante Entscheidungs Aufgaben, wie die Iowa Gambling Task (IGT). Diese Ähnlichkeiten legen nahe, dass Huntington-Patienten eine wahrscheinliche Risikogruppe für Glücksspielprobleme sind. Solche Probleme wurden jedoch nur gelegentlich bei Huntington-Patienten beobachtet. In diesem Beitrag wollen wir das Risiko eines pathologischen Glücksspiels in HD, sowie die zugrunde liegenden neurobiologischen Mechanismen charakterisieren. Gerade mit dem Aufkommen leicht zugänglicher Glücksspiele im Internet ist es wichtig, diese Risiken zu verstehen und dem Patienten eine angemessene Unterstützung zu bieten. Auf der Grundlage neuropathologischer und verhaltensbezogener Erkenntnisse schlagen wir vor, dass Huntington-Patienten keine erhöhte Tendenz haben, nach Risiken zu suchen und mit dem Glücksspiel zu beginnen, dass sie jedoch eine erhöhte Wahrscheinlichkeit haben, eine Sucht zu entwickeln, sobald sie an Glücksspielen teilnehmen. Daher sollten aktuelle und zukünftige Entwicklungen der Internet-Glücksspielmöglichkeiten und der damit verbundenen Süchte besonders für gefährdete Gruppen wie Huntington-Patienten mit Vorsicht betrachtet werden.
Einleitung
Huntington-Krankheit (HD) ist eine genetisch bedingte neurodegenerative Erkrankung, in autosomal-dominant vererbt. Die Krankheit wird durch progressive motorische, kognitive und Verhaltenssymptome gekennzeichnet, die in der Regel zwischen 30 und 50 Jahre alt, und führen zu einem vorzeitigen Tod in 10-20 Jahre nach Ausbruch der Krankheit hervor. HD wird durch eine Mutation im Huntingtin-Gen (HTT) verursacht, die zu Proteinaggregation führt, Deregulierung verschiedenen zellulärer Prozesse, und schließlich zum Zelltod. Neuronaler Degeneration tritt zunächst selektiv in das Striatum (Nucleus caudatus und Putamen), wo sie cortico-striatalen Bahnen auswirkt, die motorischen und kognitiven Funktionen steuern dienen (Reiner et al., 2011; Vonsattel et al., 2011). Am Motor Ebene dieser degenerative Prozess wird als desorganisiert Bewegungen (Chorea) ausgedrückt, während die kognitiven / Verhaltensebene Patienten ein „Executive dysfunction syndrome“ angezeigt wird, umfasst unter anderem Impulsivität, schlechte Risikobewertung und die Unfähigkeit, einen schlechten Verlauf zu stoppen von Aktion (Hamiltonet al., 2003; Duff et al., 2010b). Ähnliche Verhaltens- und kognitive Symptome zeigen sich im Suchtverhalten im Zusammenhang mit Substanzen oder Aktivitäten (Newman, 1987; Rosenblatt, 2007; Iacono et al., 2008). Daher kann davon ausgegangen werden, dass HD-Patienten das Risiko haben, Abhängigkeiten zu entwickeln. Entscheidungsfindungsparadigmen in Labors haben in der Tat zu Defiziten bei riskanten Entscheidungsfindungen bei Patienten mit fortgeschrittener Huntington-Krankheit (z. B. Stout et al., 2001) und pathologisches Glücksspiel wurde übrigens in dieser Patientengruppe beobachtet (De Marchi et al., 1998). Diese Befunde sind jedoch selten und überraschenderweise haben nur wenige Studien die Symptome und Folgen von Verhaltensinhibition bei der Huntington-Krankheit direkt untersucht.
In diesem Beitrag werden wir argumentieren, dass Huntington-Patienten eine Risikogruppe für die Entwicklung problematischer Glücksspiele darstellen können. Erstens ist problematisches Glücksspiel dadurch gekennzeichnet, dass die Probanden trotz finanzieller, persönlicher oder beruflicher Probleme nicht mehr mit dem Spielen aufhören können. Aufgrund von neurobiologischen Störungen und Verhaltenssymptomen scheint die Fähigkeit, das Spielverhalten zu stoppen, bei Huntington-Patienten vermindert oder nicht vorhanden. Zweitens aufgrund der liberaleren Einstellung zum Glücksspiel und der zunehmenden Möglichkeiten des legalen und illegalen Glücksspiels im Internet (siehe z. Griffiths, 2003), können wir davon ausgehen, dass das Auftreten von Glücksspielproblemen in den nächsten Jahren zunehmen wird. Eine erhöhte Zugänglichkeit kann insbesondere ein Risiko für schutzbedürftige Gruppen wie HD-Patienten darstellen, die zuvor noch keinem solchen Risiko ausgesetzt waren.
Im Allgemeinen können veränderte äußere Bedingungen und Behandlungsmethoden unerwartete und unerwünschte Auswirkungen auf das Patientenverhalten haben, insbesondere bei komplexen neurologischen Erkrankungen. Solche Effekte werden leicht übersehen, wenn Verhaltensauffälligkeiten nicht regelmäßig neu bewertet werden. Dies kann am besten durch den Fall der Parkinson-Krankheit veranschaulicht werden, wo die Einführung einer medikamentösen Behandlung mit Dopaminagonisten zu Impulskontrollstörungen wie zwanghaftem Glücksspiel, Einkaufen, Essen und Hypersexualität führte, die durch Überstimulation des mesolimbischen dopaminergen Systems verursacht wurden (Dodd et al., 2005; Witjas et al., 2012; Weintraub et al., 2013). Diese Nebenwirkungen wurden jedoch erst Jahre nach der Einführung von Dopamin-Agonisten-Therapien in Kombination mit gesellschaftlichen Veränderungen im Zusammenhang mit (der Verfügbarkeit von) Einkaufsmöglichkeiten, dem Verzehr von Nahrungsmitteln, Sexualität, Internet und Glücksspielen erkannt. Dieses Beispiel zeigt, dass die Neubewertung von Risikofaktoren wichtig ist, um Patienten angesichts einer sich verändernden Umgebung eine wirksame Behandlung und Anleitung bieten zu können.
Hier untersuchen wir das Krankheitsprofil der Huntington Krankheit in Bezug auf Sucht, Glücksspielprobleme und Entscheidungsdefizite. Im Abschnitt HD: Neuropathologie, Symptome und VerlaufDas Fortschreiten der Symptome der Huntington-Krankheit wird im Zusammenhang mit Störungen in kortiko-striatalen Kreisläufen, die mit dem Lernen von Aufgaben befasst sind, der Empfindlichkeit gegenüber Bestrafung und der kognitiven / impulsabhängigen Steuerung diskutiert. Im Abschnitt Risikobereitschaft und pathologisches Spielverhalten in HDDas neurobiologische Profil von Huntington-Patienten wird im Zusammenhang mit Glücksspielen und etablierten Risikobereitschafts- und Entscheidungstests wie der Iowa Gambling Task (IGT) und der Cambridge Gambling Task (CGT) diskutiert. Im Abschnitt DiskussionWir werden diskutieren, wie eine Charakterisierung von Glücksspielrisiken dazu führen kann, dass HD-Patienten und ihre Betreuer empfohlen werden, wie mit diesem Problem umzugehen ist und welche Situationen am besten vermieden werden. Unser Ziel ist es auch, noch unbeantwortete Fragen zu identifizieren, die als Ausgangspunkt für zukünftige Untersuchungen zum Auftreten und Risiko von Glücksspielproblemen bei Huntington-Patienten dienen können.
HD: Neuropathologie, Symptome und Verlauf
Neurobiologische Krankheitsmechanismen
HD wird durch eine instabile Wiederholung von CAG (Trinukleotid; Cytosin-Adenin-Guanin) in der kodierenden Region des HTT-Gens verursacht, was zur Produktion von mutiertem Huntingtin-Protein (Htt) mit einer erweiterten Polyglutamin-Streckung (PolyQ) führt.MacDonald et al., 1993). Die Anzahl der Trinukleotid-Wiederholungen ist invers mit dem Alter des Beginns der Erkrankung korreliert (Snell et al., 1993; Stine et al., 1993). Die Mehrzahl der HD-Patienten hat 40-55-Wiederholungen, die eine typische Erkrankung des Erwachsenenbeginns verursachen, während Expansionen von mehr als 70-Wiederholungen zu einer juvenilen Erkrankung führen. Personen mit weniger als 35-CAG-Wiederholungen im HTT-Gen entwickeln keine HD. Obwohl die genauen Mechanismen der Huntington-Pathogenese nicht bekannt sind und hier nicht im Detail diskutiert werden können, umfassen sie die Bildung von Proteinaggregaten durch polyQ-expandiertes Htt sowie die Interaktion von mutiertem Htt mit zahlreichen Proteinen, die am Energiestoffwechsel, Protein und Vesikel beteiligt sind Transport und Regulation der Gentranskription (Li und Li, 2004; Jones und Hughes, 2011). Die daraus resultierende Deregulierung dieser zellulären Prozesse führt schließlich zu einer neuronalen Degeneration durch Mechanismen, die Excitotoxizität und Apoptose beinhalten.
Die neuronale Degeneration beschränkt sich zunächst auf die Basalganglien, wo die mittleren stacheligen Neuronen im Striatum (Nucleus caudatus und Putamen) spezifisch betroffen sind (Vonsattel und DiFiglia, 1998; Kassubek et al., 2004). Das Striatum erhält seinen hauptsächlichen exzitatorischen (glutamatergen) Input aus kortikalen Bereichen, während es seinen dopaminergen Input aus der Substantia nigra erhält. Das Striatum hat zwei hauptsächliche inhibitorische (GABA-ergische) Ausgänge: einen direkten und einen indirekten Weg (Abbildung 1A). Striatale Neuronen des direkten Weges projizieren auf den internen Globus pallidus (GPi), der wiederum hemmende Projektionen auf den Thalamus hat. Der Thalamus führt zu der hauptsächlichen Erregung des Cortex. In der Tat hemmt die Aktivierung des direkten Striatalweges die GPi-Aktivität, was wiederum die thalamokortikale Aktivität hemmt, wodurch Bewegung und kognitive Funktionen erleichtert werden. Der indirekte Striatalweg projiziert dagegen auf den externen GP (GPe), der wiederum inhibitorische Projektionen an den Nucleus subthalamicus (STN) sendet. Das STN sendet erregende Projektionen an das GPi. Dementsprechend hemmt die Aktivierung des indirekten striatalen Pfads das STN, wodurch das GPi aktiviert werden kann, was wiederum die thalamokortikale Aktivität hemmt, die Bewegung und kognitive Funktionen unterdrückt. Adaptives Verhalten resultiert aus einem (empfindlichen) Aktivitätsgleichgewicht auf direktem und indirektem Weg. Die Pathologie auf dem indirekten Weg ist der Schlüssel zu HD und stört das Gleichgewicht bei der striatalen Kontrolle, was zu einem Verlust der hemmenden Kontrolle über die Motorik und das motorische Verhalten führt (Abbildung 1B; Albinet al., 1989; Alexander und Crutcher, 1990).
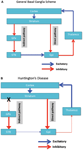
Abbildung 1. (EIN) Vereinfachtes Schema der Organisation von Corticobasalganglienetzwerken (kortikale, striatale, pallidale und thalamische Bereiche), die die direkten und indirekten Wege in normalen Gehirnen zeigen. (B) Die spezifische Degeneration des indirekten Wegs (X) in der Huntington-Krankheit führt zu einer Abnahme der inhibitorischen Kontrolle der kortikalen Funktionen. GPe: externer Globus pallidus; GPi: interner Globus pallidus; STN: subthalamischer Kern. Rot: inhibitorische (GABA) Wege Blau: Erregungswege (Glutamat).
Cortico-Basalganglien-Kreisläufe, die Verbindungen zwischen kortikalen Bereichen, Striatalbereichen, Pallidalbereichen und Thalamusbereichen umfassen, sind parallel organisiert und erfüllen verschiedene Funktionen bei der Organisation des Verhaltens. Da es viele hervorragende Bewertungen zur Anatomie und Funktion dieser Schaltkreise gibt (z. B. Alexander ua, 1986, 1990; Alexander und Crutcher, 1990; Yin und Knowlton, 2006; Verny et al., 2007; Yinet al., 2008; Haber und Knutson, 2010; Sesack und Gnade, 2010), heben wir hier nur einige Punkte hervor, die unserer Überprüfung förderlich sind. Erstens gibt es grob gesagt eine dorsale bis ventrale topographische Organisation sowohl im kortikalen als auch im striatalen Bereich. Somit sind die dorsalen präfrontalen Bereiche mit dorsalen Striatalbereichen assoziiert, während die ventraleren präfrontalen Bereiche mit mehr ventralen Striatalbereichen (einschließlich des Nucleus accumbens) assoziiert sind. Zweitens können grob drei funktional verschiedene Schaltungen beschrieben werden. Die sensomotorische Schaltung umfasst das sensomotorische Striatum (Putamen) und sensomotorische Kortikale, die mit der Ausführung des Motorverhaltens verbunden sind. Der assoziative / kognitive Kontrollkreis umfasst den dorsolateralen präfrontalen Kortex, den anterioren cingulären Kortex und das assoziative Striatum (Caudat-Kern). Diese Schaltung ist besonders für das Funktionieren von Führungskräften relevant, dh sie ist an der kognitiven Kontrolle, Planung und dem Arbeitsgedächtnis beteiligt. Darüber hinaus ist es an der Förderung eines langfristigen adaptiven Verhaltens beteiligt, indem instrumentelles Verhalten, dh Sequenzen von Verhaltenshandlungen, die in Interaktion mit der Umgebung gelernt werden, verstärkt oder gestoppt (bestraft) wird (Kravitz et al., 2012; Paton und Louie, 2012). Der limbische Kreislauf umfasst den orbitofrontalen Kortex, den ventromedialen präfrontalen Kortex, Amygdala und das limbische Striatum (Nucleus Accumbens). Diese Schaltung ist besonders relevant für die Bewertung des affektiven Wertes von Reizen, um die erwartete Belohnung oder Bestrafung eines kommenden Reizes, einer Entscheidung oder eines Ereignisses, der emotionalen Kontrolle und des adaptiven (emotionalen) Lernens (O'Doherty et al., 2001; Rushworth et al., 2007; van den Bos ua, 2013b, 2014).
Pathologie bei der Huntington-Krankheit wird sowohl im Putamen- als auch im Caudat-Kern beobachtet (Vonsattel und DiFiglia, 1998; Kassubek et al., 2004; Vonsattel, 2008; Vonsattel et al., 2011; Hadzi et al., 2012). In beiden Strukturen folgt die Atrophie einem charakteristischen Muster, das in den Regionen dorsal und kaudal beginnt und sich im Verlauf der Erkrankung in Richtung ventraler und rostraler Regionen bewegt (Vonsattel und DiFiglia, 1998; Kassubek et al., 2004; Vonsattel, 2008). In einigen Studien wurde jedoch auch eine frühe Atrophie im Nucleus accumbens und Globus pallidus beobachtet (van den Bogaard et al., 2011; Sánchez-Castañeda et al., 2013). Während Störungen im sensomotorischen Kreislauf (Putamen) mit den motorischen Symptomen zusammenhängen können, können Störungen im assoziativen / kognitiven Steuerkreislauf (Nucleus caudate) mit Exekutivfunktionsstörungen zusammenhängen und beispielsweise Defizite im Arbeitsgedächtnis bei frühen Huntington-Patienten verursachen (Lawrence et al., 1996; Bonelli und Cummings, 2007; Wolf ua, 2007). Störungen im limbischen Kreislauf, z. B. aufgrund einer vorzeitigen Atrophie im Nucleus accumbens, können mit Apathie und Depression zusammenhängen (Bonelli und Cummings, 2007; Unschuld et al., 2012). Eine progressive Atrophie im Striatum kann zu einer sukzessiven Dysfunktion kortiko-striataler Schaltkreise führen. Zum Beispiel ist der ventrale Caudatkern auch Teil des Orbitofrontalkreislaufs, der mit fortschreitender Krankheit betroffen ist. Die Funktionsstörung dieser Schaltung hängt mit der Enthemmung des Verhaltens zusammen (Bonelli und Cummings, 2007). Schließlich kann sich die Degeneration auf andere Gehirnbereiche ausdehnen, einschließlich anderer Teile der Basalganglien (Pallidalbereiche und Thalamus), Hippocampus, Amygdala und kortikaler Bereiche im Spätstadium der Erkrankung.
Zusammenfassend ist die Huntington-Krankheit durch eine spezifische Degeneration von striatalen Neuronen gekennzeichnet, die zum indirekten Weg gehören. Wenn die Krankheit fortschreitet, breitet sich die Atrophie des Striatum entlang eines kaudal-rostralen und dorsal-ventralen Gradienten aus, was zu einer sequentiellen Störung kortiko-striataler Kreisläufe führt. Der resultierende Verlust der inhibitorischen Kontrolle in diesen Kreisläufen steht in direktem Zusammenhang mit dem Fortschreiten der motorischen, kognitiven und Verhaltenssymptome bei der Huntington-Krankheit, wie nachstehend erläutert.
Symptome von HD
HD zeichnet sich durch eine Vielzahl progressiver motorischer, kognitiver und verhaltensbedingter Symptome aus. Die ersten Symptome treten in der Regel im mittleren Alter auf, mit einem durchschnittlichen Beginn von 40, obwohl ein kleiner Prozentsatz der Patienten an einer beginnenden Huntington-Krankheit leidet, die vor dem Alter von 20 beginnt. Da sich die Symptome und das Fortschreiten der Huntington-Krankheit in gewissem Maße von der Erkrankung beim Erwachsenen unterscheiden, werden wir uns in dieser Übersicht auf die letztere Patientengruppe konzentrieren. Eines der ersten Symptome, die bei der Huntington-Krankheit sichtbar werden, ist Chorea (unwillkürliche Bewegungsstörung), und eine klinische Diagnose wird normalerweise nach Beginn der Bewegungsanomalien gestellt (Shannon, 2011). Einige Studien berichten jedoch über subtile kognitive und emotionale Veränderungen vor Beginn der motorischen Symptome, und die genaue Reihenfolge des Auftretens und Fortschreitens der Symptome der Huntington-Krankheit bleibt umstritten. Es liegen jedoch mehrere umfassende Reviews der klinischen Manifestationen von Huntington vor (Roos, 2010; Anderson, 2011; Shannon, 2011).
Motorische Symptome
Motorische Symptome zeigen sich bereits in den frühen Stadien der Huntington-Krankheit und sind in der Regel die ersten Symptome, die im Labor und bei Verwandten ersten Grades von Huntington-Patienten (de Boo et al., 1997; Kirkwood et al., 1999, 2001). Motorstörungen scheinen als Fehlfunktion in der Fehlerregelung (Smith et al., 2000), im Einklang mit der Rolle des kortiko-striatalen Motorkreislaufs beim sensomotorischen Lernen und Steuern (Graybielet al., 1994). Die ersten Anzeichen für motorische Anomalien sind oft subtile unwillkürliche Bewegungen (Chorea) von z. B. Gesichtsmuskeln, Fingern und Zehen ("Zucken"), Hyperreflexie und übertriebene willkürliche Bewegungen (Young ua, 1986; Shannon, 2011), die bei frühen Huntington-Patienten zu einem allgemeinen Anschein von Unruhe und Ungeschicklichkeit führen. Diese anormalen Bewegungen sind subtil und werden anfangs oft nicht bemerkt. Sie werden jedoch allmählich schlechter und breiten sich im Laufe der Zeit auf alle anderen Muskeln aus. Andere frühe motorische Symptome sind langsame oder verzögerte sakkadische Augenbewegungen (Peltsch et al., 2008) und Dysarthrie (Ramig, 1986; Young ua, 1986). Dysarthrie, eine motorische Sprachstörung, führt zu Schwierigkeiten bei der Artikulation und dem Verschleudern von Wörtern, was die Verständlichkeit der Sprache zunehmend erschwert. Dysphagie (Schluckbeschwerden) wird bei den meisten Patienten mit Beginn der Erkrankung im mittleren Stadium beobachtet und verschlechtert sich allmählich, bis die Patienten nicht mehr ohne fremde Hilfe essen können und im späten Stadium der Huntington-Krankheit häufig eine Sonde benötigen (Heemskerk und Roos, 2011). Andere nicht-choreische motorische Symptome, die sich normalerweise im mittleren Stadium der Erkrankung bemerkbar machen, sind komplexe Gangstörungen, posturale Instabilität und Dystonie (unwillkürliche Muskelkontraktionen, die langsame repetitive Bewegungen und abnorme Körperhaltungen verursachen), die häufig von häufigen Stürzen begleitet werdenKoller und Trimble, 1985; Tian et al., 1992; Louis et al., 1999; Grimbergen et al., 2008). Starrheit und Bradykinesie (langsame Bewegung und Reflexe) werden manchmal beobachtet, sind jedoch meist auf Fälle von Huntington-Syndrom beschränkt (Bittenbender und Quadfasel, 1962; Hansotia et al., 1968). Diese motorischen Symptome stehen im Einklang mit Fehlfunktionen der kortiko-striatalen Schaltkreise der sensomotorischen (und assoziativen / kognitiven Steuerung), die häufig bei der Huntington-Krankheit betroffen sind.
Verhaltens- und psychiatrische Symptome
Verhaltensstörungen bei der Huntington-Krankheit können komplex und schwer zu klassifizieren sein, und ihr Auftreten und Beginn ist von Person zu Person sehr unterschiedlich. Außerdem kann es manchmal schwierig sein, Verhaltensstörungen von der normalen Bewältigung einer belastenden Krankheit zu unterscheiden (Caine und Shoulson, 1983). Die Anzahl der Studien, die Verhaltensauffälligkeiten bei der Huntington-Krankheit charakterisiert haben, ist begrenzt, und daher gibt es relativ wenig Einsicht in ihre Prävalenz bei der Krankheit (van Duijn et al., 2007). Die am häufigsten und konsistent berichteten Verhaltens- und emotionalen Symptome bei der Huntington-Krankheit sind Reizbarkeit, Apathie und Depression, die bei einer Prävalenz von etwa 50% auftreten (Caine und Shoulson, 1983; Folstein und Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van Duijn et al., 2007, 2014; Tabrizi et al., 2009). Reizbarkeit und Apathie werden manchmal bei vor manifestierten HD-Patienten beobachtet (Tabrizi et al., 2009; van Duijn et al., 2014), und auch Depressionen wurden in frühen klinischen Stadien berichtet (Shiwach, 1994; Julien et al., 2007; Epping et al., 2013). Diese affektiven Symptome gehören zu den ersten nichtmotorischen Symptomen, die Angehörige ersten Grades wahrnehmen (Kirkwood et al., 2001). Zu den typischen Symptomen der Apathie, die sich im Verlauf der Krankheit allmählich verschlimmern, zählen Energie-, Motivations- und Initiativmangel, verminderte Ausdauer und Qualität der Arbeit, Beeinträchtigung des Urteils, schlechte Selbstpflege und emotionale Abstumpfung (Craufurd et al., 2001; Kirkwood et al., 2001). Depressive Symptome wurden mit einer erhöhten Aktivität im ventromedialen präfrontalen Kortex in Verbindung gebracht (Unschuld et al., 2012). Irritabilität ist mit einer Fehlfunktion des Orbitofrontalkreislaufs verbunden, die zu einer verminderten Kontrolle über emotionale Reaktionen in der Amygdala führt (Klöppel et al., 2010).
Andere, weniger häufig beobachtete psychiatrische Symptome und Störungen bei der Huntington-Krankheit sind Angstzustände, Zwangsstörungen, Manie, schizophrenieähnliche psychotische Symptome wie Paranoia, Halluzinationen und Wahnvorstellungen (Caine und Shoulson, 1983; Folstein und Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van Duijn et al., 2007). Diese Symptome treten in der Regel erst im mittleren oder späten Stadium der Erkrankung auf, obwohl sie gelegentlich bei präklinischen Huntington-Patienten aufgetreten sind (Duff et al., 2007). Zwangsstörung wurde mit einer Schädigung des orbitofrontalen Kortex und des vorderen cingulären Kortex in Verbindung gebracht, während die Schizophrenie, eine Störung, die Defizite bei der Organisation, Planung und Aufmerksamkeit mit sich bringt, mit der dorsolateralen präfrontalen Kortexdysfunktion zusammenhängt (Tekin und Cummings, 2002).
Es wird vermutet, dass die meisten psychiatrischen Symptome bei der Huntington-Krankheit tatsächlich Teil eines breiten, schlecht definierten "Frontallappensyndroms" oder "Exekutivdysfunktionssyndroms" sind, das Symptome wie Apathie, Reizbarkeit, Enthemmung, Impulsivität, Obsessivität und Ausdauer (Lyketsos et al., 2004; Rosenblatt, 2007), die häufig bei Huntington-Patienten beobachtet werden (Hamiltonet al., 2003; Duff et al., 2010b). Zusammenfassend zeigt die Literatur, dass der Beginn und das Fortschreiten der Verhaltenssymptome bei der Huntington Krankheit heterogen sind, wobei affektive Störungen am häufigsten und frühzeitig auftreten, während Angstzustände, Zwangsstörungen und psychotische Symptome seltener auftreten und in der Regel später auftreten . Diese psychiatrischen Symptome stehen im Zusammenhang mit Fehlfunktionen von kortiko-striatalen Kreisläufen der limbischen und assoziativen / kognitiven Kontrolle, die häufig bei Huntington betroffen sind.
Kognitive Symptome
Der kognitive Rückgang ist ein weiterer wichtiger Aspekt der HD-Pathologie. Viele Studien haben sich speziell auf das Auftreten kognitiver Symptome in präklinischen und frühen klinischen Stadien der Huntington-Krankheit konzentriert, in der Hoffnung, frühe klinische Biomarker der Krankheit zu entdecken Papp et al., 2011; Dumas et al., 2013). Insgesamt deuten die Ergebnisse darauf hin, dass subtile kognitive Veränderungen bis zu 5-10 Jahre vor Beginn der motorischen Symptome mit ausreichend empfindlichen Methoden beobachtet werden können. In einer Studie wurde sogar festgestellt, dass in präklinischen und frühen klinischen Stadien der Huntington-Krankheit bereits etwa 40% der Patienten die Kriterien für leichte kognitive Beeinträchtigungen (eine mit einem begrenzten Gedächtnisverlust verbundene Störung, die die Kriterien für die Diagnose von Demenz nicht erfüllt) erfüllen. Duff et al., 2010a). Allerdings unterstützen nicht alle Studien diese Ergebnisse (Blackmore et al., 1995; Giordani et al., 1995; de Boo et al., 1997; Kirkwood et al., 2001). Im Allgemeinen stimmt die Literatur zu, dass die Informationsverarbeitung und die psychomotorische Geschwindigkeit in diesem frühen Stadium besonders betroffen sind (Rothlind et al., 1993; Kirkwood et al., 1999; Verny et al., 2007; Paulsen et al., 2008). Andere häufig beobachtete frühe kognitive Beeinträchtigungen sind Probleme mit der Aufmerksamkeit, (Arbeits-) Gedächtnis und visuelle Fähigkeiten (Jason et al., 1988; Rothlind et al., 1993; Foroud et al., 1995; Lawrence et al., 1996; Hahn-Barma et al., 1998; Verny et al., 2007; Paulsen et al., 2008; Tabrizi et al., 2009; Papp et al., 2011; Stout et al., 2011). Kognitive Inflexibilität wurde bei Patienten mit frühen Erkrankungen beobachtet (Jason et al., 1988), in welchem Stadium extradimensionale Verschiebungen spezifisch beeinträchtigt werden, während das Umkehrlernen noch intakt ist (Lawrence et al., 1996). So können Patienten den Reizwert immer noch neu bewerten und neue Kontraste für die Stimulus-Belohnung innerhalb derselben Dimension (z. B. Form oder Farbe) erlernen, haben jedoch Probleme, ihre Aufmerksamkeit auf eine andere Dimension (z. B. von Farbe zu Form) zu verlagern die neue Aufgabenregel, um Belohnung zu erhalten. In späteren Stadien der Erkrankung verursachen kognitive Inflexibilität und Perseveration auch gestörte Umkehrlern bei Huntington-Patienten (Josiassen et al., 1983; Lange et al., 1995). Dieses Fortschreiten der Symptome steht im Einklang mit einer spezifischen Dysfunktion des dorsolateralen präfrontalen Kreislaufs zu einem frühen Zeitpunkt der Erkrankung, da extradimensionale Mengenverschiebungen durch den dorsolateralen präfrontalen Kortex vermittelt werden, während das Umkehrlernen durch den orbitofrontalen Kortex (Dias et al., 1996; McAlonan und Brown, 2003). Andere frühe Beeinträchtigungen umfassen unorganisiertes Verhalten, beeinträchtigte Planung, schlechtes Urteilsvermögen und verminderte Verhaltens- und Gefühlskontrolle (Watkins et al., 2000; Paradiso et al., 2008; Duff et al., 2010b). Bei frühen Huntington-Patienten wurde eine Enthemmung beobachtet, deren Leistung bei Aufgaben beeinträchtigt wird, die eine Hemmung vorpotenter, aber unangebrachter Reaktionen erfordern (Holl et al., 2013). Mehrere Studien haben schließlich gezeigt, dass präklinische Huntington-Patienten bei der Erkennung negativer Emotionen wie Ärger, Ekel, Angst und Traurigkeit beeinträchtigt sind. Die emotionale Erkennung nimmt allmählich ab und kann sich in frühen klinischen Stadien der Erkrankung auf Probleme mit neutralen Emotionen ausweiten (Johnson et al., 2007; Tabrizi et al., 2009; Labuschagne et al., 2013). Dieser Phänotyp steht im Zusammenhang mit der Dysfunktion des Orbitofrontalkortex, die an der Verarbeitung emotionaler und belohnender Informationen beteiligt ist (Henley et al., 2008; Ille et al., 2011).
Studien mit Tiermodellen der Huntington-Krankheit zeigen ähnliche kognitive Beeinträchtigungen wie bei Patienten. Obwohl nicht alle Studien robuste kognitive Defizite aufweisen (Fielding et al., 2012), die Ergebnisse in Ratten- und Mausmodellen der Huntington-Krankheit umfassen Angstzustände, erhöhte Reaktionsfähigkeit auf negative emotionale Reize und Beeinträchtigungen beim Umkehrlernen und StrategiewechselFaureet al., 2011; Abada et al., 2013). Eine Studie fand spezifische frühe Defizite beim Umkehrlernen vor dem Einsetzen motorischer Symptome in einem Rattenmodell der Huntington-Krankheit (Fink et al., 2012). Interessanterweise scheinen Huntington-Tiere eine erhöhte Reaktionsfähigkeit auf negative emotionale Reize zu haben, während menschliche Patienten eine verringerte Erkennung von negativen Emotionen zeigen. Derzeit ist unklar, ob dies Unterschiede in der Aufgabenstellung widerspiegelt (Erkennen von Emotionen) gegen Verhaltensreaktionen auf bedrohliche Reize), artenbedingte Unterschiede im Ergebnis der Pathologie oder ein grundlegender Unterschied zwischen dem Rattenmodell und dem menschlichen Zustand. Im Allgemeinen zeigen Studien sowohl an humanen Patienten als auch an Tiermodellen der Huntington-Krankheit, dass bereits in der frühen Huntington-Krankheit ein breites Spektrum an kognitiven Funktionen beeinträchtigt werden kann. Frühe Anomalien umfassen hauptsächlich Defizite in Bezug auf Aufmerksamkeit, Gedächtnis, kognitive Flexibilität und emotionales Erkennen. In dieser frühen Phase haben die Patienten oft ein schlechtes Bewusstsein für ihre eigenen (Abnahme) kognitiver Fähigkeiten (Hoth et al., 2007). Im Laufe der Zeit verschlechtern sich die kognitiven Symptome zunehmend und führen schließlich zu schweren subkortikalen Demenzerkrankungen im Spätstadium der Erkrankung. Obwohl das Auftreten von Symptomen im Allgemeinen mit einer sukzessiven Beeinträchtigung der assoziativen / kognitiven Kontrolle bzw. der limbischen kortiko-striatalen Kreisläufe übereinstimmt, können bestimmte Funktionen, die mit dem limbischen Kreislauf zusammenhängen, auch bereits im frühen Stadium der Huntington-Krankheit betroffen sein.
Zusammenfassung
Motorische, Verhaltens- und kognitive Symptome bei der Huntington-Krankheit wurden in der Vergangenheit ausführlich untersucht und sind aufgrund der großen Vielfalt und Variabilität des Auftretens und Beginns dieser Symptome über die Patienten hinweg immer noch ein Thema von Interesse. Im Allgemeinen beziehen sich Verhaltens- und kognitive Symptome auf drei frontale Verhaltenskategorien: Apathie, Funktionsstörung und Enthemmung. Die Kombination dieser Symptome wird manchmal als "Syndrom der ausführenden Funktionsstörung" bezeichnet. Alle diese Symptome stehen im Zusammenhang mit Defiziten in den kortiko-striatalen Kreisläufen, die den orbitofrontalen Kortex, den dorsolateralen präfrontalen Kortex und den anterioren cingulären Kortex betreffen. Wie oben diskutiert, haben neuropathologische Studien bei HD-Patienten eine allmähliche Degeneration des Striatum von dorsal nach ventral beobachtet. Obwohl die Verhaltens- und kognitiven Beobachtungen teilweise mit einer fortschreitenden Beeinträchtigung kortiko-striataler Kreisläufe übereinstimmen, scheinen die symptomatischen Befunde aufgrund pathologischer Beobachtungen diffuser zu sein als erwartet. Beginn und Verlauf von Verhaltens- und kognitiven Symptomen bei der Huntington-Krankheit sind sehr heterogen. Dies deutet darauf hin, dass die Schädigung striataler Regionen in früheren Stadien der Huntington-Krankheit variabler und weiter verbreitet sein kann als bisher angenommen. Diese Ansicht wird durch Beweise aus mehreren Studien der strukturellen Bildgebung gestützt (Thieben et al., 2002; Rosas et al., 2005; van den Bogaard et al., 2011).
Risikobereitschaft und pathologisches Spielverhalten in HD
Pathologisches Glücksspiel
Während viele Menschen in der Lage sind, entspannend zu spielen, kann dies für manche zu einem offensichtlichen Problem werden, da sie pathologische Formen dieses Verhaltens entwickeln. Pathologisches Glücksspiel zeichnet sich durch einen übermäßigen Glücksdrang aus, obwohl die finanziellen, persönlichen und beruflichen Konsequenzen eindeutig negativ sind. Es wurde kürzlich in DSM-V als Sucht eingestuft, da es sowohl in diagnostischen Kriterien als auch in der Neuropathologie sehr ähnlich zu Drogenmissbrauchsstörungen ist (van Holst ua, 2010; Clark und Goudriaan, 2012). Pathologisches Glücksspiel wird die erste und einzige „Verhaltensabhängigkeit“ sein, die in der Kategorie „erkannt“ wird.Sucht und verwandte Störungen “. Es sei jedoch darauf hingewiesen, dass Unterschiede zwischen der Sucht nach psychoaktiven Substanzen und der Spielsucht bestehen. Erstens besteht die Befriedigung des Verlangens nach psychoaktiven Substanzen in dem Konsumieren der Substanz, deren Wirkung bekannt ist, während die Befriedigung des Verlangens nach Glücksspielen ein unsicheres Ergebnis haben kann, da Geld gewonnen werden kann oder nicht, es sei denn, es handelt sich zum Beispiel um das Spielen selbst als aufregende Tätigkeit. Das pathologische Glücksspiel kann daher in dieser Hinsicht heterogener sein und auch ein unsichereres Ergebnis als der Missbrauch von Drogen. Es sei darauf hingewiesen, dass die Variabilität der Ergebnisse, einschließlich Gewinnen und Verlusten, für die Entwicklung der Spielsucht von entscheidender Bedeutung sein kann, da sie ein variables intermittierendes Verstärkungsmuster darstellt, das die mächtigste Form der instrumentellen / klassischen Konditionierung darstellt (Sharpe, 2002; Fiorillo et al., 2003). Zweitens können psychoaktive Substanzen aufgrund ihrer direkten pharmakologischen Aktivität an mehreren Neurotransmittersystemen die Aktivität im Gehirn und im peripheren Nervensystem stärker verändern als das Glücksspiel, wodurch sie die Suchtprozesse beschleunigen und den Missbrauch von Drogen zu einer stärkeren Form der Abhängigkeit machen.
Die zugrunde liegenden neurobiologischen Mechanismen des Glücksspiels sind komplex und beziehen viele verschiedene Gehirnregionen und Neurotransmittersysteme mit ein (Überblick in Raylu und Oei, 2002; Goudriaan et al., 2004; Potenza, 2013). Die Prädisposition für die Sucht wurde mit einem verringerten Spiegel an Dopamin-D2-Rezeptoren im Striatum in Verbindung gebracht, die in einer Rückkopplungsschleife die weitere Freisetzung von Dopamin hemmen. Die daraus resultierende Hyperaktivität dopaminerger Stoffwechselwege erhöht die Sensibilität für Belohnung, Motivation und positive Verstärkung des Suchtverhaltens (Volkow et al., 2002; Di Chiara und Bassareo, 2007). Spezifische Motivationsänderungen, die auftreten, wenn sich pathologisches Glücksspiel entwickelt, umfassen eine erhöhte Spielmotivation (van Holst ua, 2012) und verstärkte Aufmerksamkeit für Glücksspielreize (Brevers et al., 2011a,b). Darüber hinaus haben pathologische Spieler die kognitive Kontrolle des Verhaltens im Allgemeinen reduziert, wie zum Beispiel die verringerte Leistung bei Aufgaben zur Reaktionshemmung, erhöhte Impulsivität und die Bevorzugung sofortiger verzögerter Belohnungen bei neurokognitiven Aufgaben (Goudriaan et al., 2004; Brevers et al., 2012a; van den Bos ua, 2013a).
Pathologische Spieler schneiden schlecht ab im Vergleich zu Kontrollen bei belohnungsbedingten risikobehafteten Entscheidungsaufgaben (z. B. Cavedini et al., 2002; Marke et al., 2005; Brevers et al., 2012b; Rezension: Brevers et al., 2013). Diese schlechte Leistung ist unabhängig davon, ob Aufgaben explizite und stabile Regeln für Siege und Niederlagen enthalten, wie beispielsweise die Game of Dice-Aufgabe (Marke et al., 2005) oder ob Probanden durch Versuch und Irrtum lernen müssen, welche Entscheidungen auf lange Sicht von Vorteil sind, wie das IGT (Cavedini et al., 2002; Brevers et al., 2012b; siehe Sektion Riskante Entscheidungsfindung durch HD-Patienten bei Laboraufgaben für Details dieser Aufgabe). Der Schweregrad der Glücksspiele war jedoch eher mit der Leistung bei Entscheidungsaufgaben, bei denen die Wahrscheinlichkeit des Ergebnisses unbekannt ist (IGT), als mit Aufgaben mit expliziten Regeln (Brevers et al., 2012b). Diese Beobachtung ist interessant angesichts der Tatsache, dass bei normalen Probanden die zweite Hälfte der IGT, wenn Probanden Task-Eventualitäten gelernt haben, Aufgaben mit expliziten Regeln ähnelt. Zusammengefasst legen diese Daten daher nahe, dass bei pathologischen Glücksspielen Beeinträchtigungen bei der Entscheidungsfindung sowohl aus einer verringerten Kontrolle durch die Exekutive resultieren können, die mit expliziteren Regeln zusammenhängt, als auch einer gestörten (emotionalen) Verarbeitung von Belohnungsstrafen, die eher mit Gerichtsverfahren zu tun hat. Fehlerlernen zur Bewertung des langfristigen Wertes von Optionen (van den Bos ua, 2013a, 2014). Darüber hinaus deutet dies darauf hin, dass Störungen in letzterer ein prädisponierender Faktor für die Eskalation des Spielverhaltens sein können.
Aus diesen Studien geht hervor, dass die neurobiologische Prädisposition für die Entwicklung eines pathologischen Spielverhaltens sowohl im assoziativen / kognitiven Kontrollkreis als auch im limbischen Kreis (van den Bos ua, 2013a). Infolgedessen weisen pathologische Spieler eine verringerte kognitive Kontrolle, erhöhte Impulsivität und erhöhte Belohnungsempfindlichkeit auf, die alle Aspekte der Verhaltensinhibition sind (Iacono et al., 2008). Die Chance, dass ein Individuum in seinem Leben eine Sucht entwickelt, hängt jedoch auch von vielen anderen Aspekten ab, wie beispielsweise frühen Lebenserfahrungen und Umweltrisiken.
Pathologisches Spielen in HD: Epidemiologische Evidenz
Mit der zunehmenden Anzahl von Möglichkeiten, die das Internet bietet, sind in den letzten Jahren sowohl die legalen als auch die illegalen Online-Glücksspielmöglichkeiten gestiegen. Diese leicht zugänglichen und oft unkontrollierten Glücksspielaktivitäten können ein Risiko für jeden darstellen, der eine erhöhte Anfälligkeit für Spielsucht hat, ansonsten jedoch möglicherweise nicht an solchen Aktivitäten beteiligt sein (Griffiths, 2003). Huntington-Patienten sind eine der Gruppen, für die das Glücksspiel im Internet ein solches Risiko darstellen kann, da die Enthemmung des Verhaltens - ein häufiges Merkmal der Krankheit - ein wichtiger Faktor bei der Entwicklung von Abhängigkeiten ist (Iacono et al., 2008). Wie bereits erwähnt, zeigen Huntington-Patienten in einem frühen Stadium der Erkrankung mehrere Anzeichen von Enthemmung, wie beispielsweise Reizbarkeit, Beeinträchtigung der Antworthemmung und verminderte emotionale Erkennung. Andere Symptome, die bei der Huntington-Krankheit beobachtet wurden und die Fähigkeit des Patienten beeinflussen können, rationale Entscheidungen zu treffen, sind kognitive Inflexibilität, Beharrlichkeit, schlechtes Urteilsvermögen und verminderte Selbsterfahrung. Neben diesen symptomatischen Ähnlichkeiten zwischen Huntington-Patienten und pathologischen Spielern weisen beide Gruppen strukturelle und funktionelle Anomalien in ähnlichen kortikostriatalen Kreisläufen auf.
In Anbetracht dieser Ähnlichkeiten zwischen pathologischen Spielern und Huntington-Patienten können wir erwarten, dass die Häufigkeit von Glücksspielproblemen bei Huntington-Patienten im Vergleich zur Normalbevölkerung zunimmt. Dennoch hat bisher nur eine Studie Fälle von pathologischem Glücksspiel in einer italienischen Familie mit HD gemeldet (De Marchi et al., 1998). In dieser Familie wurde bei zwei Personen im Alter von 18 ein pathologisches Glücksspiel diagnostiziert, lange bevor klinische Anzeichen von Huntington auftraten. Andere epidemiologische Studien haben zu diesem Thema nicht berichtet, obwohl nachweislich eine Beeinträchtigung der Entscheidungsfindung, Risikobereitschaft und unzureichendes Urteilsvermögen ein Risiko für Huntington-Patienten darstellt, die mit wichtigen Lebensentscheidungen und finanziellen Angelegenheiten (Klitzman et al., 2007; Shannon, 2011). In ähnlicher Weise fehlen Berichte zu verwandten Themen wie Drogenmissbrauch und Sucht nach Internetnutzung in der aktuellen Literatur über die HD-Pathologie. Derzeit ist unklar, ob das Fehlen von Berichten über Glücksspielprobleme in der Huntington-Literatur auf mangelnde Aufmerksamkeit für dieses Phänomen zurückzuführen ist oder ob es tatsächlich keine erhöhte Verbreitung pathologischer Glücksspiele bei Huntington-Patienten gibt. Mehrere Gründe können erklären, warum solche Probleme nicht häufiger gemeldet wurden. Erstens, selbst wenn die Inzidenz von pathologischem Glücksspiel in der Huntington-Krankheit erhöht ist, betrifft dies wahrscheinlich nur einen kleinen Prozentsatz der Patienten. In Kombination mit der Tatsache, dass die Zahl der von der Huntington-Krankheit betroffenen Bevölkerung selbst begrenzt ist, kann dies dazu führen, dass Glücksspielprobleme als spezifisches Problem in dieser Patientengruppe unbemerkt bleiben. Zweitens kann das Fehlen von Glücksspielproblemen bei der Huntington-Krankheit mit der Unfähigkeit oder Unwilligkeit der Patienten zusammenhängen, das Haus aufgrund von motorischen Störungen und häufig beobachteten Anzeichen von Apathie und Depression zu verlassen. Vor dem Aufkommen des Internet-Glücksspiels hat dies möglicherweise HD-Patienten davon abgehalten, öffentliche Glücksspielorte wie das Casino zu besuchen. Schließlich scheint die Pubertät eine sensible Phase für die Entwicklung von Glücksspielproblemen zu sein (van den Bos ua, 2013a), während die meisten Huntington-Patienten erst im späteren Leben anfangen, Symptome der Desinhibition zu zeigen. Mit dem Aufkommen von Aktivitäten im Zusammenhang mit Jugendlichen, die mit dem Internet zu tun haben, können sie jedoch Formen des Freizeitverhaltens wie Online-Glücksspiele erlangen, die sich zu einem Problem entwickeln, wenn sich Symptome der Huntington-Krankheit später im Leben manifestieren. Während also die Umgebung, in der sich Huntington-Patienten mit Glücksspielen anfällig fühlen, dieses Verhalten in der Vergangenheit nicht gefördert hat, ist es klar, dass eine erhöhte Zugänglichkeit und Verfügbarkeit von Glücksspielmöglichkeiten von zu Hause aus die Prävalenz der damit verbundenen Probleme in der Huntington-Bevölkerung verändern kann .
Riskante Entscheidungsfindung durch HD-Patienten bei Laboraufgaben
Laboraufgaben werden häufig zur Beurteilung von kognitiven und Verhaltensauffälligkeiten bei neurologischen Erkrankungen verwendet. Um einen Einblick in die Prozesse und Beeinträchtigungen zu erhalten, die mit der Entscheidungsfindung und dem Risikobereitschaftsverhalten verbunden sind, wurden verschiedene Aufgaben entwickelt, darunter das IGT (Bechara et al., 1994) und die CGT (Rogers et al., 1999). Am IGT erhalten die Teilnehmer vier Kartenspiele. Sie werden angewiesen, Karten aus diesen Decks auszuwählen, mit denen sie Geld gewinnen oder verlieren können; Das Ziel der Aufgabe ist es, so viel Geld wie möglich zu gewinnen. Die Decks unterscheiden sich in der Häufigkeit und Höhe der Gewinne und Verluste. Zwei davon sind „schlechte“ Decks, was auf lange Sicht zu einem Gesamtverlust führt, und zwei sind „gute“ Decks, was zu einem Gesamtgewinn führt. Die Teilnehmer erhalten diese Informationen jedoch nicht und müssen bei den Versuchen herausfinden, welche Decks am vorteilhaftesten sind. Normal und gesund erlernen die Teilnehmer die Regeln der Aufgabe nach einer bestimmten Anzahl von Proben und beginnen schließlich, die beiden "guten" Decks zu bevorzugen. Trotzdem gibt es auch bei gesunden Teilnehmern erhebliche individuelle Leistungsunterschiede, z. B. deutliche geschlechtsspezifische Unterschiede (van den Bos ua, 2013b). In der CGT wird den Teilnehmern eine Reihe von 10-Boxen in zwei verschiedenen Farben angezeigt. Sie müssen eine probabilistische Entscheidung treffen, in welcher Farbbox ein Token versteckt ist. Sie müssen dann Kreditpunkte auf ihr Vertrauen in diese Entscheidung setzen. Bei dieser Aufgabe werden dem Teilnehmer während des Experiments alle relevanten Informationen angezeigt. Die Versuche sind unabhängig, wodurch Arbeitsspeicher und Lernbedarf minimiert werden. Beide Glücksspielaufgaben sind gut etabliert und das IGT wird als gültige Simulation der Entscheidungsfindung in der Praxis akzeptiert (Buelow und Suhr, 2009), während die CGT besonders nützlich ist, um Entscheidungen außerhalb eines Lernkontexts zu untersuchen.
HD-Patienten wurden sowohl bei der Iowa- als auch der Cambridge-Glücksspielaufgabe getestet. In einer Studie mit Patienten im mittleren Stadium Stout et al. (2001) festgestellt, dass die Leistung bei der IGT im Vergleich zu normalen Probanden verringert war. Der Unterschied in der Leistung wurde im zweiten Teil der Aufgabe deutlich; Wenn die Probanden normalerweise anfangen, die guten Decks zu bevorzugen, nahmen HD-Patienten weiterhin häufige Auswahlen aus den schlechten Decks vor. Dies deutet darauf hin, dass Huntington-Patienten entweder nicht herausfanden, welche Decks von Vorteil waren, oder trotz dieses Wissens weiterhin Karten aus den schlechten Decks auswählten. Die Autoren wiesen darauf hin, dass mehrere HD-Teilnehmer wussten, dass einige Decks nachteilig waren, wählten jedoch weiterhin Karten aus diesen Decks aus, was darauf schließen lässt, dass Huntington-Patienten die Regeln der Aufgabe lernen können, jedoch kein vorteilhaftes Auswahlmuster erzwingen und Widerstand leisten können auf individuelle Strafen und Belohnungen reagieren. Es wurde jedoch festgestellt, dass die eingeschränkte Leistung mit einer Beeinträchtigung des Gedächtnisses und der Konzeptualisierung einhergeht. Die Autoren spekulieren, dass HD-Patienten Schwierigkeiten haben könnten, sich an die langfristigen Folgen der Auswahl von Karten aus einem bestimmten Stapel zu erinnern. Huntington-Patienten wiesen bei Enthemmungen ebenfalls eine höhere Bewertung auf als gesunde Kontrollen, aber diese Maßnahme korrelierte nicht mit der Aufgabenleistung. In einem Follow-up der gleichen Daten verglichen Stout und seine Kollegen drei kognitive Entscheidungsmodelle, um das Leistungsdefizit von Huntington-Patienten zu erklären, und fanden heraus, dass dies am besten durch Defizite im Arbeitsgedächtnis und durch zunehmende Rücksichtslosigkeit und Impulsivität erklärt werden kann (Busemeyer und Stout, 2002). Die Beeinträchtigung der Leistung von Huntington-Patienten bei der IGT kann auch mit einer geringeren Auswirkung von Verlusten bei diesen Patienten zusammenhängen, die durch Messung der Hautleitfähigkeitsreaktionen während der IGT festgestellt wurde (Campbell et al., 2004). Dieser Befund steht im Einklang mit der gestörten Erkennung negativer Emotionen bei Huntington-Patienten (Johnson et al., 2007; Ille et al., 2011) und weist darauf hin, dass sie möglicherweise weniger empfindlich auf große Strafen reagieren und sich daher weniger wahrscheinlich von den schlechten Kartendecks abwenden. Insbesondere der zweite Teil des IGT erfordert die Fähigkeit, nachteilige Verhaltensweisen als Reaktion auf Strafen zu unterdrücken und gleichzeitig die rentablen Maßnahmen zu verstärken (de Visser et al., 2011; van den Bos ua, 2013b, 2014).
In einer begrenzten Anzahl anderer Studien wurden risikobehaftete Entscheidungen in frühen Stadien der Huntington-Krankheit getestet, bei diesen Patienten jedoch weder bei der IGT noch bei der CGT (Watkins et al., 2000; Holl et al., 2013). So scheint es, dass Beeinträchtigungen bei der Entscheidungsfindung und das Risiko von Glücksspielproblemen erst im Zwischenstadium der Erkrankung auftreten. Diese Studien fanden jedoch Beeinträchtigungen bei Aufgaben, die eine Planung und Hemmung präpotenter Reaktionen bei frühen Huntington-Patienten erforderten. Es scheint also, dass Huntington-Patienten zuerst subtile Probleme mit Hemmung, Planung, emotionaler Erkennung und Arbeitsgedächtnis entwickeln. Bei einigen Patienten kann dies bereits in frühen Stadien der Erkrankung zu Problemen bei der Beurteilung und Entscheidungsfindung führen, aber die meisten Huntington-Patienten haben keine Probleme mit riskanten Entscheidungsaufgaben, bis sie ein Zwischenstadium der Erkrankung erreichen.
Neurobiologische Mechanismen der Entscheidungsfindung in HD
Neurobiologische Wege, die normalen Entscheidungsprozessen im IGT zugrunde liegen
Die neurobiologischen Mechanismen, die den Entscheidungsprozessen im IGT zugrunde liegen, wurden eingehend untersucht und beschrieben (siehe z. Bechara et al., 2000; Doya, 2008; de Visser et al., 2011; van den Bos ua, 2013b, 2014). Die normale Ausführung dieser Aufgabe erfordert eine Interaktion zwischen den kortiko-striatalen limbischen und assoziativen / kognitiven Kontrollkreisen. Es wird angenommen, dass die Aktivität im limbischen Kreislauf in der ersten Phase des IGT dominant ist, während derer er in exploratives Verhalten involviert ist, auf Belohnungen und Strafen reagiert und die affektiven Werte kurz- und langfristiger Ergebnisse von Entscheidungen im Internet lernen kann Aufgabe (Manes et al., 2002; Clark und Manes, 2004; Fellows und Farah, 2005; Gleichgerret et al., 2010; de Visser et al., 2011; van den Bos ua, 2014). Andererseits ist der assoziative / kognitive Steuerkreis während des zweiten Teils des IGT wichtiger, wenn impulsive Reaktionen auf Belohnungen und Strafen für einen langfristigen Nutzen unterdrückt werden müssen, um vorteilhafte Verhaltensmuster zu verstärken und nachteilige Muster zu unterdrücken (Manes et al., 2002; Clark und Manes, 2004; Fellows und Farah, 2005; Gleichgerret et al., 2010; de Visser et al., 2011; van den Bos ua, 2014).
Neurobiologische Anomalien in IGT-Entscheidungsprozessen in der Huntington-Krankheit
Da Entscheidungsprozesse im IGT eine Wechselwirkung von kortiko-striatalen Kreisläufen limbischer und assoziativer / kognitiver Kontrolle beinhalten, ist es nicht überraschend, dass Huntington-Patienten bei der Erfüllung dieser Aufgabe beeinträchtigt sind. Eine der Beobachtungen von Stout und Kollegen ist, dass der Einfluss von Verlusten auf die Entscheidungsfindung bei Huntington-Patienten reduziert ist (Campbell et al., 2004). Dies steht im Einklang mit den Befunden, dass diese Patienten bei der Erkennung negativer Emotionen beeinträchtigt sind und möglicherweise durch Störungen im Orbitofrontalkortex (Ille et al., 2011). Der orbitofrontale Kortex ist wichtig für die emotionale Verarbeitung und wird bei normalen Personen als Reaktion auf Bestrafungen und Belohnungen bei einer Entscheidungsaufgabe aktiviert (O'Doherty et al., 2001). Ein weiterer Fund von Stout et al. (2001) ist, dass die Leistung von Huntington-Patienten im IGT mit einer Verringerung der Konzeptualisierung und des Langzeitgedächtnisses der Mattis-Dementia-Bewertungsskala korreliert. Ein Fehler beim Lernen oder Erinnern, welche Decks auf lange Sicht vorteilhaft sind, kann mit einer verringerten Aktivität der assoziativen / kognitiven Steuerschaltung zusammenhängen, die für die langfristige Planung und Impulssteuerung erforderlich ist (Manes et al., 2002; Clark und Manes, 2004; Fellows und Farah, 2005; Gleichgerret et al., 2010). Dies steht auch im Einklang mit spezifischen Defiziten des indirekten Pfads in der Huntington-Krankheit, da eine kürzlich durchgeführte Studie zeigt, dass der indirekte Pfad für die Bestrafungsempfindlichkeit bei einer Verstärkung-Lernaufgabe wichtig ist (Kravitz et al., 2012; Paton und Louie, 2012). Die Unempfindlichkeit gegenüber den zukünftigen Folgen einer Entscheidung kann auch durch eine ventromediale präfrontale Kortexdysfunktion verursacht werden, da eine ähnliche Unempfindlichkeit bei Patienten mit Schädigungen dieses präfrontalen Bereichs beobachtet wird (Bechara et al., 1994). So kann eine verminderte Leistungsfähigkeit von Huntington-Patienten im IGT durch eine Kombination von Dysfunktionen in kortiko-striatalen Kreisläufen, die den orbitofrontalen Kortex, den ventromedialen präfrontalen Kortex und den dorsolateralen präfrontalen Kortex betreffen, verursacht werden. Dies führt zu einer verringerten Reaktionsfähigkeit auf Bestrafung in der ersten Phase der Aufgabe, und das Nichtlernen, welche Decks langfristig vorteilhaft sind, plant entsprechend und unterdrückt impulsive Antworten in der zweiten Phase des IGT.
Diskussion
HD und pathologisches Spielen: Was sind die Risiken?
Die typische Gruppe von motorischen, emotionalen und kognitiven Symptomen der Huntington-Krankheit wird durch progressive striatale Atrophie verursacht, die die verschiedenen kortiko-striatalen Schaltkreise beeinflusst. Obwohl der Beginn und das Fortschreiten von Verhaltens- und kognitiven Symptomen sehr heterogen zu sein scheinen, werden motorische und kognitive Kreisläufe typischerweise früh in der Krankheit betroffen, während der limbische Kreislauf zu einem späteren Zeitpunkt betroffen ist. Interessanterweise beinhaltet die neurobiologische Prädisposition für pathologisches Glücksspiel und andere Abhängigkeiten Störungen in denselben kortiko-striatalen Kreisläufen, die in der Huntington-Krankheit betroffen sind. Trotz dieser auffallenden Ähnlichkeiten wurde HD in der medizinischen Literatur jedoch nicht mit pathologischem Glücksspiel oder anderen süchtig machenden Verhaltensweisen in Verbindung gebracht. Bisher wurde nur in einer Studie eine Familie beschrieben, in der bei mehreren von Huntington betroffenen Familienmitgliedern Probleme beim Spielen auftraten (De Marchi et al., 1998). Wir spekulieren, dass die motorischen Symptome der Patienten sowie ihr Alter und ihr soziales Umfeld bisher dazu beigetragen haben, dass sie trotz ihrer erhöhten Anfälligkeit für solche Probleme keine pathologischen Glücksspiele entwickeln können. Auf der anderen Seite kann erwartet werden, dass die häufig diagnostizierte Depression aufgrund von Korrelationsstudien die Impulsivität und das Risiko von Glücksspielproblemen erhöht (Clarke, 2006). Eine andere Erklärung für das Fehlen von Beobachtungen von Glücksspielproblemen bei der Huntington-Krankheit kann mit Unterschieden in der zugrunde liegenden Neuropathologie zusammenhängen. Während die kognitiven Störungen zwischen pathologischen Spielern und Huntington-Patienten sehr ähnlich zu sein scheinen, sind die emotionalen Veränderungen anderer Natur. Pathologische Spieler zeigen hauptsächlich eine erhöhte Empfindlichkeit gegenüber Belohnungen und fordern sie auf, das Glücksspiel zu beginnen und fortzusetzen. HD hingegen ist mit einer verminderten Empfindlichkeit gegenüber Strafen und negativen Emotionen verbunden. Dieser Unterschied kann ein wichtiger Grund dafür sein, dass Huntington-Patienten keine erhöhte Tendenz haben, mit dem Glücksspiel zu beginnen oder sich anderen belohnenden, süchtig machenden Verhaltensweisen zu widmen.
Trotzdem können Störungen im limbischen kortiko-striatalen Kreislauf von Huntington-Patienten in Situationen mit ungewissem Ausgang immer noch riskante Entscheidungen begünstigen, wie dies in der IGT gezeigt wurde (Doya, 2008). Darüber hinaus führt die Kombination aus einer verringerten Anfälligkeit für Bestrafung, dem Versagen, impulsive Reaktionen auf unmittelbare Belohnungen zu unterdrücken, und die Unfähigkeit, langfristig verzögerte Belohnungen zu berücksichtigen und vorteilhafte Verhaltensmuster entsprechend durchzusetzen, für Huntington-Patienten wahrscheinlich zu Spielproblemen, wenn sie auf ein Problem treffen Situation, die ein solches Verhalten fördert. Charakteristische Probleme von Huntington-Patienten mit Strategieänderung und Symptomen kognitiver Inflexibilität und Perseveration können in diesen Situationen zum Fortschreiten des pathologischen Verhaltens beitragen. Wir schlagen daher vor, dass Huntington-Patienten keine erhöhte Tendenz haben, mit dem Glücksspiel oder anderen süchtig machenden Verhaltensweisen zu beginnen, die ihrer Neuropathologie inhärent sind, sondern dass sie ein erhöhtes Risiko haben, eine Sucht zu entwickeln, sobald sie mit dem Spielen beschäftigt sind. In Übereinstimmung mit dieser Idee wurde beobachtet, dass Patienten mit einer Frontalläsion impulsiv werden und oft schlechte Entscheidungen treffen, dass sie jedoch kein erhöhtes Risikoverhalten zeigen (Miller, 1992; Bechara et al., 2000). Dies deutet darauf hin, dass die Beeinträchtigung von Entscheidungen und Risikobereitschaft oder -sucht nicht zwangsläufig zusammen vorkommt und dass unterschiedliche Kombinationen von limbischen und assoziativen / kognitiven Steuerkreisstörungen unterschiedliche Auswirkungen auf die Entscheidungsfindung und das Spielverhalten haben können. Unsere Hypothese würde auch erklären, warum bei der CGT keine schlechtere Leistung von Huntington-Patienten beobachtet wurde. Da bei dieser Aufgabe alle Informationen zu Chancen und Werten von Gewinnen und Verlusten im Voraus zur Verfügung stehen, entwickeln HD-Patienten möglicherweise keine nachteiligen Strategien, da sie nicht aktiv nach Risiken suchen. Dies müsste jedoch bei Patienten mit fortgeschrittener Krankheit getestet werden.
Wenn Huntington-Patienten in der Tat ein erhöhtes Risiko haben, ein pathologisches Spielverhalten zu entwickeln, wenn die entsprechende Situation gegeben wird, kann die Zunahme von leicht zugänglichen Internet-Glücksspielen ein spezifisches Risiko für diese Patientengruppe darstellen. Auch wenn sie diese Situationen nicht aktiv ausfindig machen, sind Huntington-Patienten heute viel wahrscheinlicher Glücksspielmöglichkeiten als in der Vergangenheit. Dies gilt insbesondere für Patienten, die aufgrund ihrer Symptome die meiste Zeit zu Hause verbringen, wobei das Internet ein wichtiges Mittel sein kann, um sie zu beschäftigen. Eine höhere Wahrscheinlichkeit, sich an einem Spielverhalten zu beteiligen, kann daher dazu führen, dass verwandte Probleme in der HD-Bevölkerung überproportional zunehmen. Wir schlagen vor, dass die Hausmeister sich dieser möglichen Risiken bewusst sein sollten und möglichst versuchen sollten, HD-Patienten von (Online-) Glücksspielen abzuhalten. Darüber hinaus argumentieren wir, dass Kliniker regelmäßig das Risiko und die Prävalenz von Glücksspielproblemen in der Huntington-Bevölkerung bewerten sollten, um Patienten und Betreuern eine angemessene Behandlung und Anleitung bieten zu können.
Zukünftige Richtungen
Neben epidemiologischen Studien zur Beurteilung der Prävalenz von pathologischem Glücksspiel und anderen Suchtkrankheiten bei der Huntington-Krankheit können verschiedene Forschungslinien vorgeschlagen werden, um das Verständnis der in diesem Beitrag behandelten Probleme zu verbessern. Zunächst wäre es interessant, die Leistungsdefizite des IGT direkt mit Störungen der kortiko-striatalen Aktivität bei Huntington-Patienten zu verknüpfen. Zu diesem Zweck können die Gehirnaktivierungsmuster von HD-Patienten während der Durchführung der IGT mit funktioneller Magnetresonanztomographie untersucht und mit der Aktivität bei normalen Probanden verglichen werden. Es wird erwartet, dass die Aktivität im Striatum, dorsolateralen präfrontalen Kortex und orbitofrontalen Kortex bei Huntington-Patienten während der Entscheidungsfindung im IGT abnimmt.
Um die Verhaltens- und neurobiologischen Aspekte des Glücksspielverhaltens bei der Huntington-Krankheit genauer zu untersuchen, können derzeit verfügbare Nagetier-Krankheitsmodelle verwendet werden. Auf Verhaltensniveau kann erwartet werden, dass diese Tiere, ähnlich wie bei menschlichen Patienten, eine verminderte Leistung bei der IGT zeigen. Nagetierversionen des IGT sind verfügbar (Rückblick: de Visser et al., 2011) und die Beteiligung verschiedener neuronaler Strukturen an diesen Modellen ist gut charakterisiert (de Visser et al., 2011; van den Bos ua, 2013a, 2014). Daher sind solche Experimente durchführbar und können mit einer eingehenden Analyse der zugrunde liegenden neuronalen Veränderungen in Nagetiermodellen der Huntington-Krankheit unter Verwendung verschiedener Techniken kombiniert werden. Mit dem Aufkommen ökologisch validerer Forschungsmethoden und -instrumente zur Bewertung der Entwicklung von pathologischem Verhalten kann außerdem das Risiko für die Entwicklung von pathologischem Glücksspiel unter (halb) natürlichen Bedingungen bei Mensch und Tier untersucht werden (van den Bos ua, 2013a). Zusammengenommen ermöglichen diese Studien zu den mit Glücksspielen zusammenhängenden Symptomen und der zugrunde liegenden Neuropathologie sowohl bei menschlichen Patienten als auch bei Tiermodellen der Huntington-Krankheit ein besseres Verständnis der mit Glücksspielen verbundenen Risiken - und möglicherweise anderer Suchtverhalten - bei der Huntington-Krankheit und verbessern unsere Fähigkeit, diese bereitzustellen angemessene Behandlung und Anleitung.
Interessenkonflikt
Die Autoren erklären, dass die Untersuchung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als möglicher Interessenkonflikt ausgelegt werden könnten.
Bibliographie
Abada, YK, Schreiber, R. und Ellenbroek, B. (2013). Motorische, emotionale und kognitive Defizite bei erwachsenen BACHD-Mäusen: ein Modell für die Huntington-Krankheit. Verhalten Gehirn Res. 238, 243-251. doi: 10.1016 / j.bbr.2012.10.039
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Albin, RL, Young, AB und Penney, JB (1989). Die funktionelle Anatomie von Basalganglienstörungen. Trends Neurosci. 12, 366–375. doi: 10.1016/0166-2236(89)90074-x
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Alexander, GE und Crutcher, MD (1990). Funktionelle Architektur der Basalganglien: neuronale Substrate der Parallelverarbeitung. Trends Neurosci. 13, 266–271. doi: 10.1016/0166-2236(90)90107-l
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Alexander, GE, Crutcher, MD und DeLong, MR (1990). Basalganglien-thalamokortikale Schaltkreise: parallele Substrate für motorische, okulomotorische, "präfrontale" und "limbische" Funktionen. Prog. Gehirn Res. 85, 119–146. doi: 10.1016/s0079-6123(08)62678-3
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Alexander, GE, DeLong, MR und Strick, PL (1986). Parallele Organisation von funktionell getrennten Kreisläufen zwischen Basalganglien und Cortex. Annu. Rev. Neurosci. 9, 357 – 381. doi: 10.1146 / annurev.neuro.9.1.357
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Anderson, KE (2011). "Kapitel 2 - Huntington-Krankheit", in Handbuch der klinischen Neurologie, Herausgeber WJ Weiner und E. Tolosa, Hyperkinetische Bewegungsstörungen (London: Elsevier), 15-24.
Bechara, A., Damasio, AR, Damasio, H. und Anderson, SW (1994). Unempfindlichkeit gegenüber zukünftigen Folgen nach Schädigung des präfrontalen Kortex des Menschen. Erkenntnis 50, 7–15. doi: 10.1016/0010-0277(94)90018-3
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Bechara, A., Damasio, H. und Damasio, AR (2000). Emotion, Entscheidungsfindung und der Orbitofrontalcortex. Cereb. Kortex 10, 295 – 307. doi: 10.1093 / cercor / 10.3.295
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Bittenbender, JB und Quadfasel, FA (1962). Starre und verwandte Formen von Chorea Huntington. Bogen. Neurol. 7, 275 – 288. doi: 10.1001 / archneur.1962.04210040027003
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Blackmore, L., Simpson, SA und Crawford, JR (1995). Kognitive Leistung in einer britischen Stichprobe von präsymptomatischen Personen, die das Gen für die Huntington-Krankheit tragen. J. Med. Genet. 32, 358 – 362. doi: 10.1136 / jmg.32.5.358
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Bonelli, RM und Cummings, JL (2007). Frontal-subkortikale Schaltung und Verhalten. Dialoge Klinik. Neurosci. 9, 141-151.
Brand, M., Kalbe, E., Labudda, K., Fujiwara, E., Kessler, J., und Markowitsch, HJ (2005). Entscheidungsstörungen bei Patienten mit pathologischem Glücksspiel. Psychiatrie Res. 133, 91 – 99. doi: 10.1016 / j.psychres.2004.10.003
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Brevers, D., Bechara, A., Cleeremans, A. und Noël, X. (2013). Iowa Gambling Task (IGT): XNUMX Jahre nach - Glücksspielstörung und IGT. Vorderseite. Psychol. 4: 665. doi: 10.3389 / fpsyg.2013.00665
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Brevers, D., Cleeremans, A., Bechara, A., Laloyaux, C., Kornreich, C., Verbanck, P., et al. (2011a). Zeitlicher Verlauf der Aufmerksamkeitslücke für Glücksspielinformationen bei problematischem Glücksspiel. Psychol. Süchtiger. Verhalten 25, 675-682. doi: 10.1037 / a0024201
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Brevers, D., Cleeremans, A., Goudriaan, AE, Bechara, A., Kornreich, C., Verbanck, P., et al. (2012b). Die Entscheidungsfindung unter Mehrdeutigkeit, aber nicht unter Risiko, hängt mit der Schwere des Problems von Glücksspielen zusammen. Psychiatrie Res. 200, 568 – 574. doi: 10.1016 / j.psychres.2012.03.053
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Brevers, D., Cleeremans, A., Verbruggen, F., Bechara, A., Kornreich, C., Verbanck, P., et al. (2012a). Impulsive Maßnahmen, aber impulsive Entscheidungen bestimmen den Schweregrad des Spiels. PLoS One 7: e50647. doi: 10.1371 / journal.pone.0050647
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Brevers, D., Cleeremans, A., Tibboel, H., Bechara, A., Kornreich, C., Verbanck, P., et al. (2011b). Reduzierter Aufmerksamkeitsimpuls für Glücksspielreize bei Problemspielern. J. Behav. Ther. Exp. Psychiatrie 42, 265 – 269. doi: 10.1016 / j.jbtep.2011.01.005
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Buelow, MT und Suhr, JA (2009). Erzeuge die Gültigkeit der iowa Glücksspielaufgabe. Neuropsychol. Rev. 19, 102–114. doi: 10.1007/s11065-009-9083-4
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Busemeyer, JR und Stout, JC (2002). Ein Beitrag kognitiver Entscheidungsmodelle zur klinischen Bewertung: Leistungseinbußen bei der Bechara-Glücksspielaufgabe. Psychol. Beurteilen. 14, 253-262. doi: 10.1037 / 1040-3590.14.3.253
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Caine, ED und Shoulson, I. (1983). Psychiatrische Syndrome bei der Huntington-Krankheit. Bin ich J. Psychiatrie 140, 728-733.
Campbell, MC, Stout, JC und Finn, PR (2004). Reduzierte autonome Reaktionsfähigkeit auf den Verlust von Glücksspielaufgaben bei der Huntington-Krankheit. J. Int. Neuropsychol. Soc. 10, 239-245. doi: 10.1017 / s1355617704102105
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
P. Cavedini, G. Riboldi, R. Keller, D'Annucci A. und L. Bellodi (2002). Frontallappenfunktionsstörung bei Patienten mit pathologischem Glücksspiel. Biol. Psychiatrie 51, 334–341. doi: 10.1016/s0006-3223(01)01227-6
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Clark, L. und Goudriaan, AE (2012). "Neuroimaging bei problematischem Spielen" in Enzyklopädie des Suchtverhaltensund Premierminister Miller (London: Elsevier).
Clark, L. und Manes, F. (2004). Soziale und emotionale Entscheidungsfindung nach einer Frontallappenverletzung Neurocase 10, 398-403. doi: 10.1080 / 13554790490882799
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Clarke, D. (2006). Impulsivität als Vermittler in der Beziehung zwischen Depression und Problemspiel. Pers. Individ. Sich unterscheiden. 40, 5-15. doi: 10.1016 / j.paid.2005.05.008
Craufurd, D., Thompson, JC und Snowden, JS (2001). Verhaltensänderungen bei der Huntington-Krankheit. Neuropsychiatrie Neuropsychol. Behav. Neurol. 14, 219-226.
de Boo, GM, Tibben, A., Lanser, JB, Jennekens-Schinkel, A., Hermans, J., Maat-Kievit, A., et al. (1997). Frühe kognitive und motorische Symptome bei identifizierten Trägern des Gens für die Huntington-Krankheit. Bogen. Neurol. 54, 1353 – 1357. doi: 10.1001 / archneur.1997.00550230030012
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
De Marchi, N., Morris, M., Mennella, R., La Pia, S. und Nestadt, G. (1998). Assoziation von Zwangsstörungen und pathologischem Glücksspiel mit der Huntington-Krankheit in einem italienischen Stammbaum: mögliche Assoziation mit der Huntington-Mutation. Acta Psychiatr. Scand. 97, 62–65. doi: 10.1111/j.1600-0447.1998.tb09964.x
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
de Visser, L., Homberg, JR, Mitsogiannis, M., Zeeb, FD, Rivalan, M., Fitoussi, A., et al. (2011). Nagetierversionen der Glücksspielaufgabe in Iowa: Chancen und Herausforderungen für das Verständnis von Entscheidungen. Vorderseite. Neurosc 5: 109. doi: 10.3389 / fnins.2011.00109
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Di Chiara, G. und Bassareo, V. (2007). Belohnungssystem und Sucht: was Dopamin tut und was nicht. Curr. Meinung. Pharmacol. 7, 69-76. doi: 10.1016 / j.coph.2007.02.001
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Dias, R., Robbins, TW und Roberts, AC (1996). Dissoziation im präfrontalen Kortex von affektiven und aufmerksamen Verschiebungen. Natur 380, 69-72. doi: 10.1038 / 380069a0
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
M. Dodd, K. Klos, J. Bower, Geda, Y., Josephs, K. und Ahlskog, J. (2005). Pathologisches Glücksspiel durch Medikamente zur Behandlung der Parkinson-Krankheit. Bogen. Neurol. 62, 1377 – 1381. doi: 10.1001 / archneur.62.9.noc50009
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Doya, K. (2008). Modulatoren der Entscheidungsfindung. Nat. Neurosc 11, 410-416. doi: 10.1038 / nn2077
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR und Stout, JC (2007). Psychiatrische Symptome bei der Huntington-Krankheit vor der Diagnose: Die Predictive-HD-Studie. Biol. Psychiatrie 62, 1341-1346. doi: 10.1016 / j.biopsych.2006.11.034
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR, Wang, C., Stout, JC, et al. (2010b). „Frontales“ Verhalten vor der Diagnose der Huntington-Krankheit und ihrer Beziehung zu den Markern des Fortschreitens der Erkrankung: Nachweis eines frühen Bewusstseinsverlusts. J. Neuropsychiatrie Clin. Neurosc 22, 196 – 207. doi: 10.1176 / appi.neuropsych.22.2.196
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Duff, K., Paulsen, J., Mills, J., Beglinger, LJ, Moser, DJ, Smith, MM, et al. (2010a). Leichte kognitive Beeinträchtigung bei der vorhergesagten Huntington-Krankheit. Neurologie 75, 500–507. doi: 10.1212/wnl.0b013e3181eccfa2
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Dumas, EM, van den Bogaard, SJ, Middelkoop, HA und Roos, RA (2013). Ein Überblick über die Wahrnehmung der Huntington-Krankheit. Vorderseite. Biosci. (Schol. Hrsg.) 5, 1-18. doi: 10.2741 / s355
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Epping, EA, Mills, JA, Beglinger, LJ, Fiedorowicz, JG, Craufurd, D., Smith, MM, et al. (2013). Charakterisierung von Depressionen bei der prodromalen Huntington-Krankheit in den neurobiologischen Prädiktoren der HD-Studie (PREDICT-HD). J. Psychiatr. Res. 47, 1423-1431. doi: 10.1016 / j.jpsychires.2013.05.026
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Faure, A., Höhn, S., Von Hörsten, S., Delatour, B., Raber, K., Le Blanc, P., et al. (2011). Veränderte emotionale und motivationale Verarbeitung im transgenen Rattenmodell für die Huntington-Krankheit. Neurobiol. Lernen. Mem. 95, 92 – 101. doi: 10.1016 / j.nlm.2010.11.010
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Fellows, LK und Farah, MJ (2005). Unterschiedliche zugrundeliegende Beeinträchtigungen bei der Entscheidungsfindung nach ventromedialen und dorsolateralen Frontallappenschäden beim Menschen. Cereb. Kortex 15, 58-63. doi: 10.1093 / cercor / bhh108
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Fielding, SA, Brooks, SP, Klein, A., Bayram-Weston, Z., Jones, L. und Dunnett, SB (2012). Profile der motorischen und kognitiven Beeinträchtigung im transgenen Rattenmodell der Huntington-Krankheit. Gehirn Res. Stier. 88, 223 – 236. doi: 10.1016 / j.brainresbull.2011.09.011
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Fink, KD, Rossignol, J., Crane, AT, Davis, KK, Bavar, AM, Dekorver, NW, et al. (2012). Frühe kognitive Dysfunktion im HD 51 CAG transgenen Rattenmodell der Huntington-Krankheit. Verhalten Neurosc 126, 479-487. doi: 10.1037 / a0028028
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Fiorillo, CD, Tobler, PN, und Schultz, W. (2003). Diskrete Codierung der Belohnungswahrscheinlichkeit und -unsicherheit durch Dopaminneuronen. Wissenschaft 299, 1898-1902. doi: 10.1126 / science.1077349
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Folstein, SE und Folstein, MF (1983). Psychiatrische Merkmale der Huntington-Krankheit: neue Ansätze und Erkenntnisse. Psychiatr. Dev. 1, 193-205.
Foroud, T., Siemers, E., Kleindorfer, D., Bill, DJ, Hodes, ME, Norton, JA, et al. (1995). Kognitive Scores bei Trägern des Huntington-Gens im Vergleich zu Nicht-Trägern. Ann. Neurol. 37, 657 – 664. doi: 10.1002 / ana.410370516
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
B. Giordani, Berent, S., Boivin, MJ, Penney, JB, Lehtinen, S., Markel, DS, et al. (1995). Neuropsychologische und genetische Längsschnittanalyse von Personen mit Risiko für die Huntington-Krankheit. Bogen. Neurol. 52, 59 – 64. doi: 10.1001 / archneur.1995.00540250063014
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Gleichgerrcht, E., Ibanez, A., Roca, M., Torralva, T. und Manes, F. (2010). Entscheidungsfindung bei neurodegenerativen Erkrankungen. Nat. Rev. Neurol. 6, 611 – 623. doi: 10.1038 / nrneurol.2010.148
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Goudriaan, AE, Oosterlaan, J., de Beurs, E. und Van den Brink, W. (2004). Pathologisches Glücksspiel: Ein umfassender Überblick über die Ergebnisse von biologischen Verhaltensweisen. Neurosc Biobehav. Rev. 28, 123-141. doi: 10.1016 / j.neubiorev.2004.03.001
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Graybiel, AM, Aosaki, T., Flaherty, AW, und Kimura, M. (1994). Die Basalganglien und die adaptive Motorsteuerung. Wissenschaft 265, 1826-1831. doi: 10.1126 / science.8091209
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Griffiths, M. (2003). Glücksspiel im Internet: Probleme, Bedenken und Empfehlungen. Cyberpsychol. Verhalten 6, 557-568. doi: 10.1089 / 109493103322725333
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Grimbergen, YAM, Knol, MJ, Bloem, BR, Kremer, BPH, Roos, RAC, und Munneke, M. (2008). Stürze und Gangstörungen bei der Huntington-Krankheit. MOV. Unordnung. 23, 970 – 976. doi: 10.1002 / mds.22003
Haber, SN, und Knutson, B. (2010). Die Belohnungsschaltung: Verknüpfung von Primatenanatomie und menschlicher Bildgebung. Neuropsychopharmakologie 35, 4-26. doi: 10.1038 / npp.2009.129
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Hadzi, TC, Hendricks, AE, Latourelle, JC, Lunetta, KL, Cupples, LA, Gillis, T., et al. (2012). Beurteilung der kortikalen und striatalen Beteiligung an Gehirnen der 523-Huntington-Krankheit. Neurologie 79, 1708–1715. doi: 10.1212/wnl.0b013e31826e9a5d
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
V. Hahn-Barma, B. Deweer, A. Dürr, C. Dodé, J. Feingold, J. Pillon, et al. (1998). Sind kognitive Veränderungen die ersten Symptome der Huntington-Krankheit? Eine Studie von Genträgern. J. Neurol. Neurosurg. Psychiatrie 64, 172 – 177. doi: 10.1136 / jnnp.64.2.172
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Hamilton, JM, Salmon, DP, Corey-Bloom, J., Gamst, A., Paulsen, JS, Jerkins, S., et al. (2003). Verhaltensauffälligkeiten tragen zu einem funktionellen Rückgang der Huntington-Krankheit bei. J. Neurol. Neurosurg. Psychiatrie 74, 120 – 122. doi: 10.1136 / jnnp.74.1.120
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Hansotia, P., Cleeland, CS und Chun, RW (1968). Jugend Huntington Chorea. Neurologie 18, 217-224.
Heemskerk, A.-W. und Roos, RAC (2011). Dysphagie bei Huntington-Krankheit: eine Überprüfung. Dysphagie 26, 62–66. doi: 10.1007/s00455-010-9302-4
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Henley, SMD, Wild, EJ, Hobbs, Neuseeland, Warren, JD, Frost, C., Scahill, RI, et al. (2008). Die Erkennung defekter Emotionen in der frühen Huntington-Krankheit ist neuropsychologisch und anatomisch generisch. Neuropsychologia 46, 2152-2160. doi: 10.1016 / j.neuropsychologia.2008.02.025
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Holl, AK, Wilkinson, L., Tabrizi, SJ, Painold, A. und Jahanshahi, M. (2013). Selektive exekutive Funktionsstörung, aber intakte riskante Entscheidungsfindung bei der frühen Huntington-Krankheit. MOV. Unordnung. 28, 1104 – 1109. doi: 10.1002 / mds.25388
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Hoth, KF, Paulsen, JS, Moser, DJ, Tranel, D., Clark, LA, und Bechara, A. (2007). Patienten mit Huntington-Krankheit haben das Bewusstsein für kognitive, emotionale und funktionelle Fähigkeiten beeinträchtigt. J. Clin. Exp. Neuropsychol. 29, 365-376. doi: 10.1080 / 13803390600718958
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Iacono, WG, Malone, SM und McGue, M. (2008). Verhaltensenthemmung und die Entwicklung einer frühzeitigen Sucht: gemeinsame und spezifische Einflüsse. Annu. Rev. Clin. Psychol. 4, 325 – 348. doi: 10.1146 / annurev.clinpsy.4.022007.141157
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Ille, R., Schäfer, A., Scharmüller, W., Enzinger, C., Schöggl, H., Kapfhammer, HP, et al. (2011). Emotionserkennung und Erfahrung bei der Huntington-Krankheit: Eine auf Voxel basierende Morphometrie-Studie. J. Psychiatrie Neurosci. 36, 383 – 390. doi: 10.1503 / jpn.100143
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Jason, GW, Pajurkova, EM, Suchowersky, O., Hewitt, J., Hilbert, C., Reed, J., et al. (1988). Presymptomatische neuropsychologische Beeinträchtigung der Huntington-Krankheit. Bogen. Neurol. 45, 769 – 773. doi: 10.1001 / archneur.1988.00520310079021
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Johnson, SA, Stout, JC, Solomon, AC, Langbehn, DR, Aylward, EH, Cruce, CB, et al. Und Predict-HD Investigators der Huntington Study Group (2007). Jenseits von Ekel: Gestörtes Erkennen negativer Emotionen vor der Diagnose der Huntington-Krankheit. Gehirn 130, 1732-1744. doi: 10.1093 / Gehirn / awm107
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Jones, L. und Hughes, A. (2011). "Pathogene Mechanismen bei der Huntington-Krankheit" in Internationale Überprüfung der Neurobiologie, Hrsg. J. Brotchie, E. Bezard und P. Jenner, Pathophysiologie, Pharmakologie und Biochemie der Dyskinesien (London: Academic Press), 373 – 418.
Josiassen, RC, Curry, LM und Mancall, EL (1983). Entwicklung neuropsychologischer Defizite bei der Huntington-Krankheit. Bogen. Neurol. 40, 791 – 796. doi: 10.1001 / archneur.1983.04050120041005
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Julien, CL, Thompson, JC, Wild, S., Yardumian, P., Snowden, JS, Turner, G., et al. (2007). Psychiatrische Erkrankungen bei der präklinischen Huntington-Krankheit. J. Neurol. Neurosurg. Psychiatrie 78, 939 – 943. doi: 10.1136 / jnnp.2006.103309
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Kassubek, J., Juengling, FD, Kioschies, T., Henkel, K., Karitzky, J., Kramer, B., et al. (2004). Topographie der Hirnatrophie bei der frühen Huntington-Krankheit: Eine auf Voxel basierende morphometrische MRI-Studie. J. Neurol. Neurosurg. Psychiatrie 75, 213 – 220. doi: 10.1136 / jnnp.2002.009019
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Kirkwood, SC, Siemers, E., Stout, JC, Hodes, ME, Conneally, PM, Christian, JC, et al. (1999). Längliche kognitive und motorische Veränderungen bei den vorsymptomatischen Huntington-Gen-Trägern. Bogen. Neurol. 56, 563 – 568. doi: 10.1001 / archneur.56.5.563
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Kirkwood, SC, Su, JL, Conneally, P. und Foroud, T. (2001). Fortschreiten der Symptome im frühen und mittleren Stadium der Huntington-Krankheit. Bogen. Neurol. 58, 273 – 278. doi: 10.1001 / archneur.58.2.273
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
R. Klitzman, D. Thorne, J. Williamson, W. Chung und K. Marder (2007). Entscheidungsfindung über reproduktive Entscheidungen zwischen Personen, die ein Risiko für die Huntington-Krankheit darstellen. J. Genet. Couns. 16, 347–362. doi: 10.1007/s10897-006-9080-1
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Klöppel, S., Stonnington, CM, Petrovic, P., Mobbs, D., Tüscher, O., Craufurd, D., et al. (2010). Reizbarkeit bei präklinischer Huntington-Krankheit. Neuropsychologia 48, 549-557. doi: 10.1016 / j.neuropsychologia.2009.10.016
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Koller, WC und Trimble, J. (1985). Die Gangabnormalität der Huntington-Krankheit. Neurologie 35, 1450 – 1454. doi: 10.1212 / wnl.35.10.1450
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Kravitz, AV, Tye, LD und Kreitzer, AC (2012). Unterschiedliche Rollen für direkte und indirekte neuronale Striatumwege bei der Verstärkung. Nat. Neurosc 15, 816 – 818. doi: 10.1038 / nn.3100
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
I. Labuschagne, R. Jones, J. Callaghan, D. Whitehead, EM Dumas, Say, MJ, et al. (2013). Emotionale Gesichtserkennungsdefizite und Medikationseffekte im Stadium vor der Manifestation durch Huntington-II-Stadium. Psychiatrie Res. 207, 118 – 126. doi: 10.1016 / j.psychres.2012.09.022
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Lange, KW, Sahakian, BJ, Quinn, NP, Marsden, CD und Robbins, TW (1995). Vergleich der exekutiven und visuospatialen Gedächtnisfunktion bei Huntington-Krankheit und Demenz vom Alzheimer-Typ, abgestimmt auf den Demenzgrad. J. Neurol. Neurosurg. Psychiatrie 58, 598 – 606. doi: 10.1136 / jnnp.58.5.598
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Lawrence, AD, Sahakian, BJ, Hodges, JR, Rosser, AE, Lange, KW und Robbins, TW (1996). Exekutive und mnemonische Funktionen bei der frühen Huntington-Krankheit. Gehirn 119, 1633-1645. doi: 10.1093 / Gehirn / 119.5.1633
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Li, SH und Li, XJ (2004). Huntingtin-Protein-Wechselwirkungen und die Pathogenese der Huntington-Krankheit. Trends Genet. 20, 146 – 154. doi: 10.1016 / j.tig.2004.01.008
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Louis, ED, Lee, P., Quinn, L. und Marder, K. (1999). Dystonie bei Huntington: Prävalenz und klinische Merkmale. MOV. Unordnung. 14, 95–101. doi: 10.1002/1531-8257(199901)14:1<95::aid-mds1016>3.0.co;2-8
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Lyketsos, CG, Rosenblatt, A. und Rabins, P. (2004). Vergessenes Frontallappensyndrom oder "Executive Dysfunction Syndrome". Psychosomatik 45, 247 – 255. doi: 10.1176 / appi.psy.45.3.247
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
MacDonald, ME, et al. Und Huntington's Collaboration Research Research Group (1993). Ein neuartiges Gen, das eine Trinukleotid-Wiederholung enthält, die auf Huntington-Chromosomen erweitert und instabil ist. Zelle 72, 971–983. doi: 10.1016/0092-8674(93)90585-e
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
F. Manes, Sahakian, B., Clark, L., Rogers, R., Antoun, N., Aitken, M., et al. (2002). Entscheidungsprozesse nach Schädigung des präfrontalen Kortex. Gehirn 125, 624-639. doi: 10.1093 / Gehirn / awf049
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
McAlonan, K. und Brown, VJ (2003). Der orbitale präfrontale Kortex vermittelt Umkehrlern und nicht die Verschiebung der Aufmerksamkeit bei der Ratte. Verhalten Gehirn Res. 146, 97-103. doi: 10.1016 / j.bbr.2003.09.019
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Miller, LA (1992). Impulsivität, Risikobereitschaft und die Fähigkeit, fragmentierte Informationen nach der frontalen Lobektomie zu synthetisieren. Neuropsychologia 30, 69–79. doi: 10.1016/0028-3932(92)90015-e
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Newman, JP (1987). Reaktion auf die Bestrafung bei Extravertierten und Psychopathen: Auswirkungen auf das impulsive Verhalten von Enthemmten. J. Res. Pers. 21, 464–480. doi: 10.1016/0092-6566(87)90033-x
O'Doherty, J., Kringelbach, ML, Rolls, ET, Hornak, J. und Andrews, C. (2001). Abstrakte Belohnungs- und Bestrafungsdarstellungen im menschlichen Orbitofrontalkortex. Nat. Neurosc 4, 95-102. doi: 10.1038 / 82959
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Papp, KV, Kaplan, RF und Snyder, PJ (2011). Biologische Marker der Erkenntnis bei der prodromalen Huntington-Krankheit: eine Übersicht. Gehirn Cogn. 77, 280-291. doi: 10.1016 / j.bandc.2011.07.009
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
S. Paradiso, Turner, BM, Paulsen, JS, Jorge, R., Ponto, LLB und Robinson, RG (2008). Neuronale Grundlagen der Dysphorie bei der frühen Huntington-Krankheit. Psychiatrie Res. 162, 73-87. doi: 10.1016 / j.pscychresns.2007.04.001
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Paton, JJ und Louie, K. (2012). Belohnung und Strafe beleuchtet. Nat. Neurosc 15, 807 – 809. doi: 10.1038 / nn.3122
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Paulsen, JS, Langbehn, DR, Stout, JC, Aylward, E., Ross, CA, Nance, M., et al. (2008). Erkennung der Huntington-Krankheit vor Jahrzehnten: Die Predictive-HD-Studie. J. Neurol. Neurosurg. Psychiatrie 79, 874 – 880. doi: 10.1136 / jnnp.2007.128728
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Peltsch, A., Hoffman, A., Armstrong, I., Pari, G. und Munoz, DP (2008). Sakkadische Beeinträchtigungen bei der Huntington-Krankheit. Exp. Gehirn Res. 186, 457–469. doi: 10.1007/s00221-007-1248-x
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Potenza, MN (2013). Neurobiologie des Spielverhaltens. Curr. Meinung. Neurobiol. 23, 660 – 667. doi: 10.1016 / j.conb.2013.03.004
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Ramig, LA (1986). Akustische Analyse der Phonation bei Patienten mit Huntington-Krankheit. Vorbericht. Ann. Otol. Rhinol. Laryngol. 95, 288-293.
Raylu, N. und Oei, TPS (2002). Pathologisches Glücksspiel. Eine umfassende Überprüfung. Clin. Psychol. Rev. 22, 1009–1061. doi: 10.1016/S0272-7358(02)00101-0
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
A. Reiner, I. Dragatsis und P. Dietrich (2011). "Genetik und Neuropathologie der Huntington - Krankheit" in Internationale Überprüfung der Neurobiologie, Hrsg. J. Brotchie, E. Bezard und P. Jenner, Pathophysiologie, Pharmakologie und Biochemie der Dyskinesien (London: Academic Press), 325 – 372.
Rogers, RD, Everitt, BJ, Baldacchino, A., Blackshaw, AJ, Swainson, R., Wynne, K., et al. (1999). Dissoziierbare Defizite bei der Entscheidungsfindung bei chronischen Amphetamin-Missbrauchern, Opiat-Missbrauchern, Patienten mit fokalen Schädigungen des präfrontalen Kortex und Tryptophan-erschöpften normalen Freiwilligen: Nachweis monoaminerger Mechanismen. Neuropsychopharmakologie 20, 322–339. doi: 10.1016/s0893-133x(98)00091-8
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Roos, RA (2010). Huntington-Krankheit: eine klinische Überprüfung. Orphanet J. Rare Dis. 5:40. doi: 10.1186/1750-1172-5-40
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Rosas, HD, Hevelone, ND, Zaleta, AK, Greve, DN, Salat, DH und Fischl, B. (2005). Regionale kortikale Ausdünnung bei der präklinischen Huntington-Krankheit und ihre Beziehung zur Wahrnehmung. Neurologie 65, 745 – 747. doi: 10.1212 / 01.wnl.0000174432.87383.87
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Rosenblatt, A. (2007). Neuropsychiatrie der Huntington-Krankheit. Dialoge Klinik. Neurosci. 9, 191-197.
Rothlind, JC, Bylsma, FW, Peyser, C., Folstein, SE und Brandt, J. (1993). Kognitive und motorische Korrelate des Alltags bei der frühen Huntington-Krankheit. J. Nerv. Ment. Dis. 181, 194–199. doi: 10.1097/00005053-199303000-00008
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Rushworth, MFS, Behrens, TEJ, Rudebeck, PH, und Walton, ME (2007). Unterschiedliche Rollen für den cingulierten und orbitofrontalen Kortex bei Entscheidungen und sozialem Verhalten. Tendenzen Cogn. Sci. 11, 168-176. doi: 10.1016 / j.tics.2007.01.004
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
C. Sánchez-Castañeda, Cherubini, A., Elifani, F., Péran, P., Orobello, S., Capelli, G., et al. (2013). Suche nach Biomarkern nach Huntington-Krankheit durch multimodale Querschnittsdarstellung der Basalganglien. Summen. Gehirn Mapp. 34, 1625-1635. doi: 10.1002 / hbm.22019
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Sesack, SR und Grace, AA (2010). Cortico-Basalganglien-Belohnungsnetzwerk: Mikroschaltung. Neuropsychopharmakologie 35, 27-47. doi: 10.1038 / npp.2009.93
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Shannon, KM (2011). "Kapitel 1 - Huntington-Krankheit - klinische Anzeichen, Symptome, präsymptomatische Diagnose und Diagnose", in Handbuch der klinischen Neurologie, Herausgeber WJ Weiner und E. Tolosa, Hyperkinetische Bewegungsstörungen (London: Elsevier), 3-13.
Sharpe, L. (2002). Ein neu formuliertes kognitiv-verhaltensmodell für problematisches Glücksspiel. Eine biopsychosoziale Perspektive. Clin. Psychol. Rev. 22, 1–25. doi: 10.1016/s0272-7358(00)00087-8
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Shiwach, R. (1994). Psychopathologie bei Huntington-Patienten. Acta Psychiatr. Scand. 90, 241–246. doi: 10.1111/j.1600-0447.1994.tb01587.x
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Smith, MA, Brandt, J. und Shadmehr, R. (2000). Die motorische Störung der Huntington-Krankheit beginnt mit einer Fehlfunktion bei der Fehlerkontrolle. Natur 403, 544-549. doi: 10.1038 / 35000576
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Snell, RG, MacMillan, JC, Cheadle, JP, Fenton, I., Lazarou, LP, Davies, P., et al. (1993). Zusammenhang zwischen der Wiederholung von Trinukleotiden und phänotypischen Variationen bei der Huntington-Krankheit. Nat. Genet. 4, 393 – 397. doi: 10.1038 / ng0893-393
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Stine, OC, Pleasant, N., Franz, ML, Abbott, MH, Folstein, SE und Ross, CA (1993). Korrelation zwischen dem Beginn der Huntington-Krankheit und der Dauer der Trinukleotid-Wiederholung in IT-15. Summen. Mol. Genet. 2, 1547 – 1549. doi: 10.1093 / hmg / 2.10.1547
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Stout, JC, Paulsen, JS, Queller, S., Solomon, AC, Whitlock, KB, Campbell, JC, et al. (2011). Neurokognitive Anzeichen bei prodromaler Huntington-Krankheit. Neuropsychologie 25, 1-14. doi: 10.1037 / a0020937
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Stout, JC, Rodawalt, WC und Siemers, ER (2001). Riskante Entscheidungsfindung bei der Huntington-Krankheit. J. Int. Neuropsychol. Soc. 7, 92-101. doi: 10.1017 / S1355617701711095
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Tabrizi, SJ, Langbehn, DR, Leavitt, BR, Roos, RA, Durr, A., Craufurd, D., et al. (2009). Biologische und klinische Manifestationen der Huntington-Krankheit in der longitudinalen TRACK-HD-Studie: Querschnittsanalyse der Ausgangsdaten. Lancet Neurol. 8, 791–801. doi: 10.1016/S1474-4422(09)70170-X
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Tekin, S. und Cummings, JL (2002). Frontal-subkortikale neuronale Schaltkreise und klinische Neuropsychiatrie: ein Update. J. Psychosom. Res. 53, 647–654. doi: 10.1016/s0022-3999(02)00428-2
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Thieben, MJ, Duggins, AJ, Good, CD, Gomes, L., Mahant, N., Richards, F., et al. (2002). Die Verteilung der strukturellen Neuropathologie bei der präklinischen Huntington-Krankheit. Gehirn 125, 1815-1828. doi: 10.1093 / Gehirn / awf179
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Tian, J., Herdman, SJ, Zee, DS und Folstein, SE (1992). Haltungsstabilität bei Patienten mit Huntington-Krankheit. Neurologie 42, 1232 – 1238. doi: 10.1212 / wnl.42.6.1232
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Unschuld, PG, Joel, SE, Pekar, JJ, Reading, SA, Oishi, K., McEntee, J., et al. (2012). Depressive Symptome bei der prodromalen Huntington-Krankheit korrelieren mit der Stroop-Interferenz-bezogenen funktionalen Konnektivität im ventromedialen präfrontalen Kortex. Psychiatrie Res. 203, 166-174. doi: 10.1016 / j.pscychresns.2012.01.002
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
van den Bogaard, SJ, Dumas, EM, Acharya, TP, Johnson, H., Langbehn, DR, Scahill, RI, et al. (2011). Frühe Atrophie des Pallidums und des Nucleus accumbens bei der Huntington-Krankheit. J. Neurol. 258, 412–420. doi: 10.1007/s00415-010-5768-0
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
van den Bos, R., Davies, W., Dellu-Hagedorn, F., Goudriaan, AE, S. Granon, J. Homberg, et al. (2013a). Artenübergreifende Herangehensweisen an das pathologische Glücksspiel: eine Übersicht über geschlechtsspezifische Unterschiede, jugendliche Vulnerabilität und ökologische Validität von Forschungsinstrumenten. Neurosc Biobehav. Rev. 37, 2454-2471. doi: 10.1016 / j.neubiorev.2013.07.005
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
van den Bos, R., Homberg, J. und de Visser, L. (2013b). Eine kritische Überprüfung der Geschlechtsunterschiede bei Entscheidungsaufgaben: Konzentrieren Sie sich auf die Glücksspielaufgabe in Iowa. Verhalten Gehirn Res. 238, 95-108. doi: 10.1016 / j.bbr.2012.10.002
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
van den Bos, R., Koot, S. und de Visser, L. (2014). Eine Nagetierversion der iowa-Glücksspielaufgabe: 7 Jahre des Fortschritts. Vorderseite. Psychol. 5: 203.doi: 10.3389 / fpsyg.2014.00203
van Duijn, E., Kingma, EM und van der Mast, RC (2007). Psychopathologie in verifizierten Huntington-Gen-Trägern. J. Neuropsychiatrie Clin. Neurosc 19, 441 – 448. doi: 10.1176 / appi.neuropsych.19.4.441
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
van Duijn, E., Reedeker, N., Giltay, EJ, Eindhoven, D., Roos, RAC, und van der Mast, RC (2014). Verlauf der Reizbarkeit, Depression und Apathie bei Huntington-Krankheit im Zusammenhang mit motorischen Symptomen während einer zweijährigen Nachbeobachtungszeit. Neurodegener. Dis. 13, 9-16. doi: 10.1159 / 000343210
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
van Holst, RJ, van den Brink, W., Veltman, DJ und Goudriaan, AE (2010). Warum Spieler nicht gewinnen können: Ein Überblick über kognitive und neuroimographische Befunde beim pathologischen Glücksspiel. Neurosc Biobehav. Rev. 34, 87-107. doi: 10.1016 / j.neubiorev.2009.07.007
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
van Holst, RJ, Veltman, DJ, Büchel, C., Van den Brink, W., und Goudriaan, AE (2012). Verzerrte Erwartungskodierung bei problematischem Glücksspiel: Ist das süchtig machend in der Erwartung? Biol. Psychiatrie 71, 741-748. doi: 10.1016 / j.biopsych.2011.12.030
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Verny, C., Allain, P., Prudean, A., Malinge, MC, Gohier, B., Scherer, C., et al. (2007). Kognitive Veränderungen asymptomatischer Träger des Mutationsgens der Huntington-Krankheit. EUR. J. Neurol. 14, 1344-1350. doi: 10.1111 / j.1468-1331.2007.01975.x
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Volkow, ND, Fowler, JS und Wang, GJ (2002). Die Rolle von Dopamin bei der Medikamentenverstärkung und -sucht beim Menschen: Ergebnisse von bildgebenden Studien. Verhalten Pharmacol. 13, 355–366. doi: 10.1097/00008877-200209000-00008
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Vonsattel, JP, und DiFiglia, M. (1998). Huntington-Krankheit. J. Neuropathol. Exp. Neurol. 57, 369–384. doi: 10.1097/00005072-199805000-00001
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Vonsattel, JPG, Keller, C. und Cortes Ramirez, EP (2011). Kapitel 4 - Huntington-Krankheit - Neuropathologie “in Handbuch der klinischen Neurologie, Hrsg. W. Weiner und E. Tolosa, Hyperkinetische Bewegungsstörungen (London: Elsevier), 83 – 100.
Vonsattel, JPG (2008). Huntington-Modelle und humane Neuropathologie: Ähnlichkeiten und Unterschiede. Acta Neuropathol. 115, 55–69. doi: 10.1007/s00401-007-0306-6
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Watkins, LHA, Rogers, RD, Lawrence, AD, Sahakian, BJ, Rosser, AE und Robbins, TW (2000). Beeinträchtigte Planung, aber intakte Entscheidungsfindung bei der frühen Huntington-Krankheit: Implikationen für eine spezifische frontostriatale Pathologie. Neuropsychologia 38, 1112–1125. doi: 10.1016/s0028-3932(00)00028-2
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Weintraub, D., Papay, K., Siderowf, A. und Parkinson Progression Markers Initiative. (2013). Screening auf Impulskontrollsymptome bei Patienten mit De-novo-Parkinson-Krankheit: eine Fall-Kontroll-Studie. Neurologie 80, 176–180. doi: 10.1212/wnl.0b013e31827b915c
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
T. Witjas, A. Eusebio, F. Fluchère und JP Azulay (2012). Suchtverhalten und Parkinson-Krankheit. Rev. Neurol. (Paris) 168, 624 – 633. doi: 10.1016 / j.neurol.2012.06.014
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Wolf, RC, Vasic, N., Schönfeldt-Lecuona, C., Landwehrmeyer, GB und Ecker, D. (2007). Dorsolaterale präfrontale Kortexdysfunktion bei der vorsymptomatischen Huntington-Krankheit: Evidenz aus ereignisbedingter fMRI. Gehirn 130, 2845-2857. doi: 10.1093 / Gehirn / awm210
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Yin, HH und Knowlton, BJ (2006). Die Rolle der Basalganglien bei der Habitusbildung. Nat. Rev. Neurosci. 7, 464-476. doi: 10.1038 / nrn1919
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Yin, HH, Ostlund, SB und Balleine, BW (2008). Belohnungsgesteuertes Lernen über Dopamin hinaus im Nucleus Accumbens: Die integrativen Funktionen von Corticobasalganglien. EUR. J. Neurosci. 28, 1437-1448. doi: 10.1111 / j.1460-9568.2008.06422.x
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Young, AB, Shoulson, I., Penney, JB, Starosta-Rubinstein, S., Gomez, F., Travers, H., et al. (1986). Huntington-Krankheit in Venezuela Neurologische Merkmale und Funktionsabnahme. Neurologie 36, 244 – 249. doi: 10.1212 / WNL.36.2.244
Pubmed Zusammenfassung | Pubmed Volltext | CrossRef Volltext
Schlüsselwörter: Huntington-Krankheit, Risikobereitschaft, Glücksspiel, präfrontaler Kortex, Basalganglien, Desinhibtion
Zitieren: Kalkhoven C, Sennef C, Peeters A und van den Bos R (2014) Risikobereitschaft und pathologisches Glücksspielverhalten bei der Huntington-Krankheit. Vorderseite. Verhalten Neurosc 8: 103. doi: 10.3389 / fnbeh.2014.00103
Erhalten: 30 November 2013; Papier ausstehend veröffentlicht: 18 Januar 2014;
Akzeptiert: 12 März 2014; Online veröffentlicht: 02 April 2014.
Bearbeitet von:
Patrick Anselme, Universität Lüttich, Belgien
Rezensiert von:
Damien Brevers, Université Libre de Bruxelles, Belgien
Bryan F. Sänger, Universität von Michigan, USA
