Erektile Dysfunktion (ED) kommt mit zunehmendem Alter häufig vor. Früher wurde die ED-Behandlung hauptsächlich von Urologen angeboten, aber die Zulassung und weit verbreitete Verwendung von Phosphodiesterase-Inhibitoren hat es Hausärzten ermöglicht, eine gezielte ED-Behandlung anzubieten. Obwohl große, multizentrische klinische Studien die Wirksamkeit und Sicherheit dieser Medikamente gezeigt haben, sind sie bei 30–35 % der Männer unwirksam, können Nebenwirkungen verursachen und verbessern die zugrunde liegende Pathologie nicht. Ein gründliches Verständnis der erektilen Physiologie und der Ursachen von ED sowie ein umfassender Behandlungsplan, der alle beitragenden Faktoren berücksichtigt, können wirksamer sein als eine medikamentöse Behandlung und können Aspekte der psychischen und physischen Gesundheit über Erektionsprobleme hinaus verbessern.
Erektile Dysfunktion (ED) – die Unfähigkeit, eine Erektion zu entwickeln und aufrechtzuerhalten, die fest genug für die Penetration ist – tritt häufig mit zunehmendem Alter auf. Ungefähr 40 % der Männer im Alter von 40 Jahren und 70 % der Männer im Alter von 70 Jahren leiden an irgendeiner Form von ED.1 ED ist mit mehreren körperlichen Erkrankungen verbunden, kann ein Vorbote einer Stoffwechsel- oder Gefäßerkrankung sein und beeinträchtigt die psychosoziale Gesundheit. Phosphodiesterase-Typ-5-Inhibitoren (PDE5i) sind die häufigste Erstbehandlung bei ED. Große, multizentrische klinische Studien haben die Wirksamkeit und Sicherheit dieser Medikamente gezeigt; Sie sind jedoch bei 30–35 % der Patienten unwirksam.2 kann Nebenwirkungen verursachen und die zugrunde liegende Pathologie nicht verbessern. Eine umfassende Behandlung der ED, die sich auf alle beitragenden Faktoren konzentriert, kann wirksamer sein als eine medikamentöse Behandlung und kann Aspekte der psychischen und physischen Gesundheit über Erektionsprobleme hinaus verbessern.
ED entsteht durch multifaktorielle, komplexe Mechanismen, an denen das Nerven-, Gefäß- und endokrine System beteiligt ist. Eine grundlegende Überprüfung der Anatomie und Physiologie von Erektionen wird einen Rahmen zum Verständnis der Pathophysiologie und der Begründung für Behandlungsoptionen bieten (Figure 1). Die Struktur des Penis besteht aus zwei Gefäßgewebezylindern (Corpora Cavernosa), die sich über die gesamte Länge des Penisschafts erstrecken, zusammen mit dem Corpus spongiosum, der die Harnröhre umgibt. Penisgewebe wird durch autonome (sympathische und parasympathische) und somatische (sensorische und motorische) Aspekte des peripheren Nervensystems innerviert. Sympathische Nerven entspringen von T11–L2 und wirken antierektil, indem sie die Ejakulation und Detumeszenz kontrollieren. Parasympathische Nerven entspringen von S2–S4 und sind proerektil. Sympathische und parasympathische Nerven verschmelzen zu kavernösen Nerven, die in die Corpora Cavernosa, den Corpus Spongiosum und die Eichel eindringen und den Blutfluss während der Erektion regulieren. Der Nervus pudendus sorgt für die Sensibilität des gesamten Beckens und die motorische Funktion aller Schließmuskeln, des Beckenbodens und der Steifheitsmuskulatur.
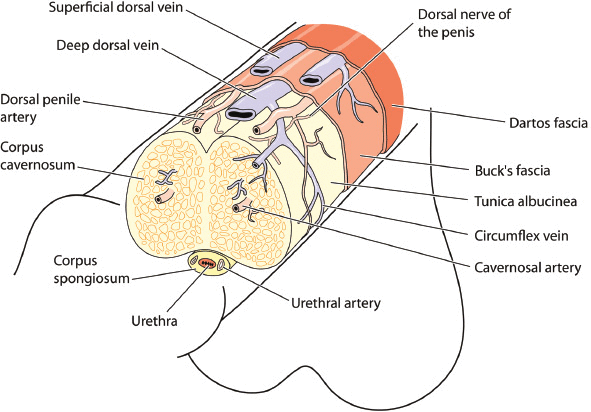
Abbildung 1:
Anatomie des Penis mit Darstellung der wichtigsten Strukturen, Blutgefäße und Nerven.
Die inneren Schambeinarterien versorgen den Penis mit Blut und verzweigen sich in die Bulbourethral-, Dorsal- und Cavernosalarterien. Die Bulbourethralarterie verläuft durch die tiefe Penisfaszie (Buck) und versorgt den Penisbulbus und die Penisharnröhre. Die Arteria dorsalis verläuft zwischen dem Nervus dorsalis und der tiefen Vena dorsalis und gibt Zirkumflexäste ab, die die Zirkumflexvenen mit Endästen in der Eichel begleiten. Die tiefe Penis- oder Schwellkörperarterie tritt am Crus in den Corpus Cavernosum ein und verläuft über die gesamte Länge des Penisschafts, um die spezialisierten Helicinarterien zu versorgen.
Sexuelle Stimulation regt die Ausschüttung von Acetylcholin durch parasympathische Nerven an. In den Endothelzellen, die die Penisarterien auskleiden, katalysiert Stickoxidsynthase (NOS) die Oxidation von L-Arginin zu Stickoxid (NO) und L-Citrullin. NO aktiviert die Guanylatcyclase in den Schwellkörpern und im Spongiosum, was wiederum das zyklische Guanosinmonophosphat (cGMP) erhöht, was zu einer Entspannung der glatten Gefäßmuskulatur, einer Gefäßerweiterung und einer erhöhten Durchblutung führt. Durch die schnelle Füllung und Ausdehnung des Sinussystems kommt es zum Einschluss von Blut durch Verschluss der Venengeflechte und der Tunica albuginea, was zu einem nahezu vollständigen Verschluss des venösen Abflusses führt. Der intrakavernöse Druck erreicht bei voller Erektion 100 mmHg. Die ischiokavernösen Muskeln komprimieren die mit Blut gefüllten Schwellkörper, während sich die Dammmuskeln zusammenziehen, wodurch der Enddruck mehrere hundert mmHg erreicht. Nach der Ejakulation hört die Freisetzung von Neurotransmittern aufgrund der Erregung des sympathischen Nervs auf und Phosphodiesterase-Enzyme bauen cGMP ab, was zu Abschwellung und Schlaffheit führt (Figure 2).
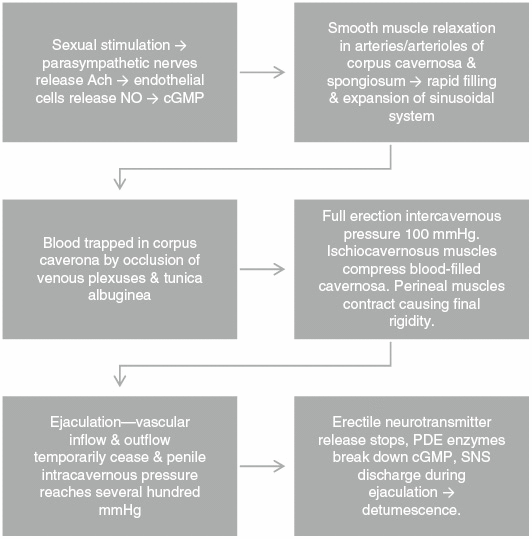
Abbildung 2:
Physiologie der Erektionen.
Ach, Acetylcholin; cGMP, zyklisches Guanosinmonophosphat; NO, Stickoxid; PDE, Phosphodiesterase; SNS, sympathisches Nervensystem.
Eine gründliche Beurteilung der ED erfordert eine umfassende Anamnese, die Verwendung validierter Fragebögen, eine körperliche Untersuchung und Laborarbeiten. Bildgebende Verfahren wie Duplex-Doppler-Ultraschall, Penisarteriographie und MRT sollten von einem Urologen durchgeführt und einem möglichen chirurgischen Eingriff vorbehalten bleiben.
GESCHICHTE
Eine gründliche Anamnese bietet die Möglichkeit, alle Ursachen/Beteiligungsfaktoren im Zusammenhang mit ED zu identifizieren. Im Hinblick auf psychosoziale Faktoren ist die Frage nach aktuellen Stressfaktoren und Beziehungsproblemen unerlässlich.
Das genitale Selbstbild und die Erwartungen an die sexuelle Häufigkeit werden bei der Erhebung der Sexualanamnese oft vernachlässigt, wirken sich jedoch erheblich auf die sexuelle Leistungsfähigkeit aus. Ergebnisse der Entwicklung und Validierung der Male Genital Self-Image Scale (MGSIS), die Männer im Alter von 18 bis 60 Jahren bewertete, ergaben, dass Männer mit einem besseren genitalen Selbstbild weniger ED berichteten und 20 % der Männer mit ihrer Penisgröße unzufrieden waren.3 Männer mit einem negativen Selbstbild im Genitalbereich fragen sich möglicherweise, wie ihre Penisgröße im Vergleich zu anderen Männern abschneidet. Alfred Kinseys Daten zu 2500 Männern ergaben, dass die durchschnittliche Länge eines schlaffen Penis 1–4 Zoll und die eines erigierten Penis durchschnittlich 5–6.5 Zoll beträgt. Interessanterweise neigten Männer dazu, ihre Penisgröße im Vergleich zur tatsächlichen Größe zu unterschätzen.4
Die Erörterung der Erwartungen hinsichtlich der Häufigkeit sexueller Aktivitäten ist für Männer mit geringer Libido, dem Gefühl sexueller Unzulänglichkeit oder Neugier hinsichtlich ihrer sexuellen Häufigkeit im Vergleich zu anderen Männern relevant. Statistiken über die Häufigkeit sexueller Begegnungen sind begrenzt. Eine AARP-Umfrage unter 1670 Männern und Frauen über 45 ergab, dass 41 % der Männer in den Fünfzigern, 50 % der Männer in den Sechzigern und 24 % der Männer in den Siebzigern mindestens einmal pro Woche Sex haben (um diese Statistik neu zu formulieren). – 60 % der Männer in den Fünfzigern, 15 % in den Sechzigern und 70 % der Männer in den Siebzigern haben seltener als einmal pro Woche Sex.5 Die International Society for Sexual Medicine (ISSM) berichtete über die Ergebnisse der National Survey of Sexual Health and Behavior des Kinsey Institute aus dem Jahr 2010 und stellte fest, dass knapp die Hälfte der verheirateten Männer im Alter von 25 bis 49 Jahren mehrmals im Monat bis wöchentlich Sex hatte höchste Rate in jeder Alterskategorie.6 Eine weitere vom ISSM veröffentlichte Studie, in der Männer und Frauen über 50 Jahre befragt wurden, ergab, dass nur 20–30 % der Männer und Frauen bis ins 80. Lebensjahr sexuell aktiv bleiben.7
Der Gebrauch von Pornografie ist ein Thema, das für Ärzte möglicherweise unangenehm ist, wenn es mit ihren männlichen Patienten besprochen wird. Obwohl die Diagnose einer Pornografiesucht umstritten ist, gibt es zunehmend Hinweise darauf, dass häufiger Pornografiekonsum Auswirkungen auf die sexuelle Zufriedenheit der Partner, das Ehe- und Beziehungsglück sowie sexuelle Funktionsstörungen, einschließlich geringer Libido und ED, hat.8-11 Internet-Pornografie bietet grenzenlose Neuheiten und ein On-Demand-Videoformat, das die sexuelle Erregung beeinträchtigen kann und es Männern erschwert, zu echten Partnern zu wechseln.12 Es wurde kein validiertes Screening-Tool zur Identifizierung pornografiebedingter Schwierigkeiten, einschließlich ED, entwickelt. Nach der Frage nach der Häufigkeit des Pornografiekonsums sollten Gesundheitsdienstleister nach der Fähigkeit fragen, beim Partnersex und bei der Masturbation eine Erektion zu erreichen und aufrechtzuerhalten, ohne dass Pornografie verwendet oder daran erinnert wird. Wenn die Verwendung oder Erinnerung pornografischer Bilder erforderlich ist, um eine angemessene Erektion hervorzurufen, kann eine durch Pornografie verursachte ED ein Problem darstellen.
VALIDIERTE FRAGEBÖGEN
Validierte Fragebögen sind beim Screening auf ED hilfreich. Der im klinischen Umfeld und in der veröffentlichten Forschung am häufigsten verwendete Fragebogen ist der 15 Punkte umfassende International Index of Erectile Function (IIEF-15), der in 32 Sprachen validiert ist.13 Eine kürzere Version, der IIEF-5 oder der Sexual Health Inventory for Men (SHIM)-Fragebogen, kann ebenfalls für die Diagnose und die Überwachung der Behandlungswirksamkeit nützlich sein.14,15
KÖRPERLICHE UNTERSUCHUNG
Die körperliche Untersuchung sollte eine Penis- und Hodenuntersuchung, möglicherweise die Stärke der Beckenbodenmuskulatur (über digitale Tests), den Blutdruck, Anzeichen einer Herz-Kreislauf-Erkrankung, Größe, Gewicht und Taillenumfang umfassen.
AUFARBEITUNG
Basierend auf der Anamnese und der körperlichen Untersuchung können Labortests umfassende Stoffwechsel- und Lipidtests, Nüchterninsulin, Hämoglobin A1C, Entzündungsmarker wie hsCRP, Gesamttestosteron und freies Testosteron, Schilddrüsentests und bei jüngeren Männern mit Verdacht auf Hypogonadismus Luteinisierendes Hormon und Prolaktin umfassen .
Ursachen und beitragende Faktoren für ED können sich überschneiden. Dazu gehören psychosoziale Probleme, neurologische Probleme, übermäßiger Gebrauch von Pornografie, endokrine Störungen, Nebenwirkungen von Medikamenten und Gefäßveränderungen.
PSYCHOGEN
Erheblicher Stress, Beziehungsschwierigkeiten, Depressionen, Angstzustände und posttraumatische Belastungsstörungen können allesamt zur ED beitragen. Leistungsangst, erstmals 1970 von Masters und Johnson beschrieben,16 ist die Unfähigkeit, aufgrund früherer Erfahrungen mit ED eine Erektion zu erreichen. Sexuelle Funktionsstörungen, insbesondere ED und vermindertes sexuelles Verlangen, sind bei männlichen Veteranen mit posttraumatischer Belastungsstörung deutlich erhöht.17 Psychogene ED tritt normalerweise beim Partnersex mit normaler Erektionsfunktion während der Masturbation auf. Der Beginn kann abrupt erfolgen und mit Stress wie dem Verlust des Arbeitsplatzes, dem Tod eines Verwandten oder finanziellen Problemen einhergehen. Nächtliche oder morgendliche Erektionen sind oft normal.
NEUROLOGISCH
Das limbische System, einschließlich der Amygdala; Hippocampus; und Gyri dentatus und cinguli, ist einer der ältesten Bereiche des Gehirns, der allen Säugetieren gemeinsam ist. Diese Gehirnregion reguliert Emotionen und versucht, Schmerzen zu vermeiden und Vergnügen zu suchen. Untersuchungen legen nahe, dass sexuell angenehme visuelle Reize die Amygdala und den Hypothalamus bei Männern stärker aktivieren als bei Frauen.18 Der Input von der Amygdala gelangt zum ventralen Striatum, einem großen Teil der Basalganglien, der als Teil des Belohnungssystems fungiert. Der Nucleus accumbens im ventralen Striatum enthält eine große Konzentration dopaminerger Neuronen und gilt als Lustzentrum des Gehirns. Die Dopamin-Signalübertragung spielt eine zentrale Rolle bei der sexuellen Erregung und Motivation. Die Aktivierung von Dopaminrezeptoren in den lumbosakralen parasympathischen Nerven des Rückenmarks erleichtert Erektionen.19
Erkrankungen, die die normale Dopaminsignalisierung oder Neurotransmission stören oder das Zentralnervensystem schädigen können, beispielsweise Parkinson-Krankheit, Multiple Sklerose, Diabetes oder Schlaganfall, können ebenfalls ED verursachen. Eine Verletzung des Nervus cavernosus während einer radikalen Prostatektomie führt bei mehr als 50 % der Männer zu ED.20 Langstreckenradfahren kann den Pudendusnerv und die Blutgefäße zwischen Sattel und Schambeinfuge komprimieren, wodurch die Durchblutung und der Sauerstoffgehalt des Penis eingeschränkt werden.21,22 Bei Radfahrern kann es zu vorübergehender ED und Taubheitsgefühl im Genitalbereich kommen; Allerdings besteht bei ihnen möglicherweise kein höheres Risiko für ED. Die Ergebnisse einer kürzlich durchgeführten Umfrage unter 5000 Sportlern zeigten, dass Radfahrer genauso häufig an ED leiden wie Schwimmer und Läufer.23
VERWENDUNG VON PORNOGRAFIE
Obwohl der Gebrauch von Pornografie als gesellschaftlich akzeptabel und normal angesehen werden kann, sind die gesundheitlichen Risiken eines häufigen Gebrauchs nicht bekannt. Internetpornografie bietet grenzenlose visuelle Neuheiten und veranschaulicht den Coolidge-Effekt, ein biologisches Phänomen, das bei männlichen Tieren beobachtet wird, wenn sie neues Interesse zeigen, wenn sie verschiedenen empfänglichen Sexualpartnern vorgestellt werden.24 Dies stellt möglicherweise einen evolutionären Vorteil dar, der es einem Männchen ermöglicht, mehrere Weibchen zu befruchten. Neuartige sexuelle visuelle Reize bewirken eine stärkere Erregung, festere Erektionen und eine schnellere Ejakulation mit beweglicheren Spermien und einer besseren Samenproduktion.25-27
Übermäßiger Gebrauch von Internetpornografie kann die Neuroplastizität beeinflussen.28 Alle Drogenmissbrauchs- und Verhaltenssüchte, wie z. B. Internetspiele und übermäßiger Nahrungskonsum, beeinflussen den mesolimbischen Dopaminweg und den Nucleus accumbens.29 Die Neuheit fördert den Anstieg von Dopamin im Nucleus accumbens und löst die Freisetzung des cAMP-Response-Element-Bindungsproteins (CREB) aus. CREB reguliert die Genexpression von Dynorphin, einem Protein, das die Dopaminfreisetzung verlangsamt und so das Belohnungssystem dämpft.30 Es wird angenommen, dass dies die molekulare Grundlage der Toleranz ist, da größere Mengen des Medikaments oder Verhaltens erforderlich sind, um erhöhte Mengen an CREB zu überwinden. Bei Abstinenz fördert die Dopaminreduktion Anhedonie und kann möglicherweise zu einer Abhängigkeit von der Droge oder dem Verhalten führen.
Zusätzlich zu CREB wird DeltaFosB bei wiederholter Dopaminflutung des Nucleus accumbens freigesetzt. DeltaFosB fördert eine positive Verstärkung des Suchtverhaltens, indem es die Dynorphinausschüttung unterdrückt und die Empfindlichkeit gegenüber der Droge oder dem Verhalten erhöht. DeltaFosB bleibt relativ lange bestehen, weshalb einige Suchtspezialisten es als „molekularen Schalter für Sucht“ bezeichnen.31 Dieser Mechanismus erklärt, wie der wiederholte Konsum von Pornografie wie bei anderen Suchtmitteln zu einer Desensibilisierung und einer Herunterregulierung des Dopaminrezeptors führt, was den Benutzer in einen Kreislauf aus Essattacken, Verlangen und Erosion der Willenskraft versetzt.32
ENDOKRINE
Testosteron ist nicht nur für die Entwicklung und das Wachstum des Penis und die Steigerung des Sexualtriebs notwendig, sondern reguliert auch die erektile Physiologie durch verschiedene Mechanismen. Testosteron fördert eine gesunde Nervenstruktur, Integrität und Funktion, insbesondere des Nervus cavernosus.33 Tier- und Humanstudien legen nahe, dass Testosteron die Genexpression der Stickoxidsynthase und die NO-Produktion in den Penisarterien steigert, was für die Gefäßerweiterung notwendig ist.34,35 Testosteron moduliert wahrscheinlich die PDE5-Aktivität, wie Tierstudien belegen, die eine Hochregulierung der PDE5-Expression durch Testosteron-Supplementierung zeigen.36,37
Niedrige Mengen an freiem und bioverfügbarem (aber nicht vollständigem) Testosteron werden mit erektiler Dysfunktion in Verbindung gebracht.38 Obwohl unbekannt ist, wie hoch der Testosteronspiegel ist, der zum Erreichen und Aufrechterhalten einer Erektion erforderlich ist, scheint für die Erektionsfähigkeit eine Mindestmenge erforderlich zu sein.39,40 Eine Testosteronergänzung verbessert möglicherweise nicht die ED bei allen Männern. Einige Studien haben jedoch gezeigt, dass eine Testosterontherapie hilfreich sein und eine bessere Wirkung von PDE-5-Hemmern ermöglichen kann.41,42
Einige Autoren haben hohe Östradiolspiegel bei Männern oder ein hohes Östradiol-zu-Testosteron-Verhältnis im Zusammenhang mit ED dokumentiert.43-45 Aromatasehemmer verhindern die Umwandlung von Testosteron in Östradiol und können bei älteren Männern mit leichtem Hypogonadismus das gesamte und bioverfügbare Testosteron erhöhen und gleichzeitig den Östradiolspiegel leicht senken.46 Derzeit gibt es keine Hinweise darauf, dass die Aromatasehemmung die Sexualfunktion verbessert, und es gibt keine Literatur, die den Einsatz von Aromatasehemmern bei Hypogonadismus unterstützt.47 Darüber hinaus haben einige Studien herausgefunden, dass das Verhältnis zwischen Östradiol und Testosteron keinen Zusammenhang mit der erektilen Funktion oder dem sexuellen Verlangen hat.48,49
Eine hohe Prolaktinsekretion ist eine seltene Ursache für niedrigen Testosteronspiegel und ED. Dies kann auf einen Hypophysentumor (Prolaktinom), Marihuana oder Medikamente wie Amphetamine, H2-Blocker, Risperidon, SSRIs, MAO-Hemmer und einige trizyklische Antidepressiva zurückzuführen sein. Prolaktin sollte nur bei geringem sexuellen Verlangen, Gynäkomastie und/oder einem Gesamttestosteronspiegel von weniger als 4 ng/ml (400 ng/dl) gemessen werden.50
Sowohl Hypothyreose als auch Hyperthyreose können zu ED führen und ED kommt bei Männern mit Dysthyreose häufiger vor als bei Kontrollpersonen.51 Die Behandlung von Hypothyreose und Hyperthyreose kann die ED verbessern.52 Daher wird bei Männern mit ED ein Screening auf Schilddrüsenfunktionsstörungen empfohlen.
VASCULAR
Eine optimale Gefäßgesundheit ist für das Erreichen und Aufrechterhalten einer Erektion von größter Bedeutung. Gefäßdysfunktionen verursachen 70–80 % der nicht-psychogenen ED bei älteren Männern. Da eine Atherosklerose der Koronar-, Karotis-, Hirn- oder peripheren Arterien möglicherweise erst im fortgeschrittenen Stadium Symptome verursacht, kann ED das früheste Anzeichen einer generalisierten Gefäßerkrankung sein.53,54 In der Prostatakrebs- und Präventionsstudie wurden fast 10,000 Männer, die dem Placebo-Arm zugeteilt wurden, alle drei Monate untersucht und von 1994 bis 2003 auf ED und Herz-Kreislauf-Erkrankungen untersucht. ED war ein ebenso großer Risikofaktor für zukünftige kardiovaskuläre Ereignisse wie Rauchen und Familienanamnese Herzinfarkt.55 Das Vorliegen einer erektilen Dysfunktion kann auch ein Prädiktor für die Gesamtmortalität sein.56 ED weist die gleichen Risikofaktoren wie Herz-Kreislauf-Erkrankungen auf: Bluthochdruck, Bewegungsmangel, schlechte Ernährung, Rauchen, Diabetes und Hyperlipidämie. Der zugrunde liegende Mechanismus der vaskulären ED ist eine endotheliale Dysfunktion.57,58 Die Regulierung der Gefäßerweiterung ist eine Funktion von Stickstoffmonoxid (NO), das von Endothelzellen freigesetzt wird. NO initiiert die Produktion von cGMP, was zu einer Entspannung der glatten Muskulatur und einer Gefäßerweiterung der Arterien im Schwellkörper führt. Eine endotheliale Dysfunktion erhöht das ED-Risiko, unabhängig vom klinischen Nachweis einer Herz-Kreislauf-Erkrankung.59,60
NEBENWIRKUNGEN VON MEDIKAMENTEN
Viele Arzneimittel können zur ED beitragen, indem sie Neurotransmitter, Hormone, Nervenfunktionen oder den Blutfluss beeinflussen. Obwohl die Liste nicht erschöpfend ist, gehören zu den häufigsten Übeltätern Antidepressiva (insbesondere SSRIs wie Fluoxetin, Sertralin, Citalopram), Anxiolytika, ZNS-Depressiva und Muskelrelaxantien (Lorazepam, Cyclobenzaprin). Diuretika (HCTZ, Spironolacton, Triamteren, Furosemid) sowie blutdrucksenkende Mittel und Betablocker (Clonidin, Enalapril, Metoprolol) tragen ebenfalls häufig zur ED bei.
Es ist wichtig, einen umfassenden Behandlungsplan für ED zu entwickeln, da dieser wahrscheinlich wirksamer ist als die Verwendung eines einzelnen Mittels, um nur die Symptome zu behandeln.
PSYCHOSEXUELLE BERATUNG
Für einige Männer mit ED kann eine Überweisung zu kognitiver Verhaltenstherapie, Stressbewältigung oder Paartherapie angebracht sein. Der kausale Zusammenhang zwischen Depression und ED ist unklar und wahrscheinlich bidirektional.61 Tatsächlich zeigte eine randomisierte kontrollierte Studie (RCT) mit 152 Männern mit gleichzeitiger leichter bis mittelschwerer Depression und ED eine verbesserte Stimmung bei Männern, denen Sildenafil verabreicht wurde, als sich ihre ED besserte.62 ED, die durch Leistungsangst oder Depression verursacht wird, lässt sich am besten mit individueller kognitiver Verhaltenstherapie, Beziehungsberatung oder der Zusammenarbeit mit einem zertifizierten Sexualtherapeuten behandeln. Es gibt auch Hinweise darauf, dass eine Gruppentherapie die Erektionsfähigkeit verbessern kann. Eine Cochrane-Überprüfung von 11 klinischen Studien (von denen neun randomisiert waren) kam zu dem Schluss, dass eine gezielte Geschlechtsgruppentherapie bei ED wirksamer war als keine Behandlung. Eine Metaanalyse von Studien, in denen Gruppentherapie plus Sildenafilcitrat mit Sildenafil allein verglichen wurde, ergab, dass Männer, die Gruppentherapie plus Sildenafil erhielten, eine signifikante Verbesserung des erfolgreichen Geschlechtsverkehrs zeigten und weniger wahrscheinlich als diejenigen, die nur Sildenafil erhielten, den Geschlechtsverkehr abbrachen. Die Gruppentherapie verbesserte auch die ED im Vergleich zu Sildenafilcitrat allein deutlich.63
Überarbeitung durch übermäßigen Gebrauch von Pornografie
Die Umkehrung der ED, die auf häufigen Gebrauch von Pornografie zurückzuführen ist, erfordert, dass der Patient jegliche Pornografie, Pornografieersatzstoffe, Pornografierückrufe und im Wesentlichen alle künstliche sexuelle Stimulation eliminiert. Dies ermöglicht die Wiederherstellung der sexuellen Erregung und Erektionsfähigkeit mit echten Partnern. Obwohl unbekannt ist, wie lange es dauert, das Gehirn durch die Vermeidung von Pornografie „neu zu starten“, schlägt der Experte für Pornografiesucht, Gary Wilson, klinische Erfahrungen vor und Online-Foren zeigen eine schnellere Genesung bei Männern über 50 Jahren, was darauf hindeutet, dass 2 Monate typisch sind.64 Jüngere Männer benötigen möglicherweise mehr Zeit, möglicherweise bis zu 5 Monate, da die Theorie besteht, dass die Nutzung von Internetpornografie bereits in jüngeren Jahren begann. Sexuelle Erregung ist vor allem im Kindes- und Jugendalter konditioniert und kann bei Männern stärker sein als bei Frauen.65-67
PHYSIOTHERAPIE
Die Beckenbodenmuskulatur, die eine Rolle bei der Aufrechterhaltung der Erektion spielt, wird mit zunehmendem Alter schwächer. Physiotherapie zur Stärkung der Bulbocavernosus- und Ischiocavernosus-Muskeln sowie des Bindegewebes kann bei manchen Patienten eine wirksame Behandlung der erektilen Dysfunktion ermöglichen. In einer randomisierten, kontrollierten Studie wurde 40 Männern mit ED beigebracht, zweimal täglich im Stehen, Sitzen und Liegen den Penis maximal zurückzuziehen und den Hodensack anzuheben sowie nach dem Urinieren die Beckenbodenmuskulatur anzuspannen. Die Ergebnisse waren überraschend – nach 6 Monaten erlangten 40 % der Teilnehmer ihre normale erektile Funktion zurück und 35 % zeigten eine gewisse Verbesserung; 66 % der Männer berichteten außerdem über ein vermindertes Tröpfeln nach dem Wasserlassen. Eine einfachere Technik könnte darin bestehen, männlichen Patienten Kegel-Übungen beizubringen, indem man sie den Urin in der Mitte des Strahls anhalten lässt, um die Muskeln zu identifizieren, die für die Durchführung der Übung benötigt werden. Diese Muskeln sollten dreimal täglich 5 Sekunden lang, 10–20 Mal hintereinander, angespannt werden. Männer können aufgrund der möglichen Verbesserung der Orgasmusqualität, einer häufigen Nebenwirkung, die Arnold Kegel vor mehreren Jahrzehnten bei Frauen dokumentierte, die häufig Kegelübungen durchführten, Anreize für die Durchführung von Kegel- oder Beckenbodenstärkungsübungen erhalten.68
VAKUUMVERSCHLUSSVORRICHTUNG
Das Vakuumverengungsgerät (VCD), umgangssprachlich auch „Penispumpe“ genannt, wurde 1974 von Geddings Osbon entwickelt.69 Osbon bezeichnete es als „jugendäquivalentes Gerät“ und behauptete, es persönlich 20 Jahre lang ohne Fehler genutzt zu haben. Das erste Vakuum-Konstriktionsgerät wurde 1982 von der FDA für ED zugelassen.
Der VCD erhöht den Blutfluss zum Penis, indem er einen Unterdruck von 110–225 mmHg erzeugt (manuell oder mit einer batteriebetriebenen Pumpe) und den venösen Ausfluss mit einem Verengungsring verhindert. Studien deuten darauf hin, dass etwa 55–70 % der Männer mit VCDs ausreichende Erektionen erreichen können.70, 71 Einige Männer berichten, dass die durch eine VCD erzielte Erektion dazu neigt, violett, kalt oder taub zu sein, und zu den Nebenwirkungen gehören Blutergüsse am Penisschaft und das Einklemmen des Ejakulats während des Orgasmus durch das Verengungsband. Aufgrund der Gefahr einer Ischämie sollte der Konstriktionsring nicht länger als 30 Minuten an Ort und Stelle belassen werden.
DIÄT, TRAINING UND GEWICHTSVERLUST
Die Suche nach Aphrodisiaka zur Stimulierung der Libido und zur Verbesserung der sexuellen Leistungsfähigkeit reicht bis in die Antike zurück. Tatsächlich stammt das Wort Aphrodisiakum von der griechischen Liebesgöttin Aphrodite, die aus dem Meer geboren und in einer Jakobsmuschel oder Austernschale an Land gebracht wurde. Obwohl Austern reichlich Zink enthalten, das für die Testosteronproduktion benötigt wird, hat der Verzehr dieser Austern nachweislich keine Verbesserung der Libido oder der Erektionsfähigkeit zur Folge.
Bestimmte Lebensmittel verbessern jedoch die Gefäßgesundheit und können daher die Erektionsfähigkeit verbessern. Beispielsweise erhöhen nitratreiche Lebensmittel wie Rüben und Blattgemüse den Stickoxidspiegel, fördern die normale Endothelfunktion und senken den Blutdruck.72-74 Granatapfelkerne und -saft verbessern außerdem die Endothelfunktion und senken den Blutdruck, während sie oxidiertes und glykiertes LDL verringern, wodurch die Bildung von atherosklerotischem Plaque minimiert und die Dicke und Steifheit der Arterienwände gemildert wird.75-78 Maissirup und Erfrischungsgetränke mit hohem Fruchtzuckergehalt erhöhen das Risiko, an einem metabolischen Syndrom, Arteriosklerose, Diabetes und ED zu erkranken.79 Darüber hinaus tragen Lebensmittel mit hochgradig fortgeschrittenen Glykierungsendprodukten wie Speck, Fast-Food-Hamburger, Hot Dogs, Käse, Pizza und frittierte Lebensmittel zu Diabetes, Herz-Kreislauf-Erkrankungen und ED bei.80-82 Anstatt sich auf die Vermeidung bestimmter Lebensmittel zu konzentrieren, kann es für ED-Patienten am vorteilhaftesten sein, eine mediterrane Ernährung mit reichlich Gemüse, Obst, nativem Olivenöl extra, Vollkornprodukten, Nüssen und Fisch sowie mäßigem Weinkonsum einzuführen. Erkenntnisse aus vier klinischen Studien deuten darauf hin, dass die mediterrane Ernährung und der Lebensstil die sexuelle Funktion positiv beeinflussen.83,84 Außerdem lindert es Entzündungen und verzögert die sexuelle Dysfunktion bei diabetischen Männern.
Es gibt wenig Debatte darüber, dass körperliche Betätigung mehrere Risikofaktoren verbessert, die zu ED beitragen, darunter die Verringerung von Entzündungen, die Verbesserung der Endothelfunktion, die Förderung der Insulinsensitivität, die Verbesserung von Lipoproteinen und die Verbesserung des viszeralen Fettabbaus.85-89 Eine kürzlich durchgeführte systematische Überprüfung und Metaanalyse bestätigt, dass mäßiger bis intensiver Sport über einen Zeitraum von mindestens 8 Wochen die ED verbessern kann.90
Sowohl übermäßiger als auch unzureichender Körperfettanteil wird mit ED in Verbindung gebracht. Beispielsweise hat die Hallym Aging Study den Körperfettanteil und seinen Zusammenhang mit ED bei koreanischen Männern gemessen.91 Männer mit dem niedrigsten und höchsten Körperfettanteil hatten häufiger ED. Zentrale Fettleibigkeit ist mit metabolischem Syndrom, Gefäßdysfunktion und niedrigem Testosteronspiegel verbunden, die alle zur Entwicklung von ED beitragen.92,93 Fettgewebe sondert mehr als 35 Hormone und Zytokine ab, die fast alle Entzündungen, Insulinresistenz und schließlich Gefäßerkrankungen fördern.94,95 Entzündungen scheinen eine Schlüsselrolle bei der Ursache von ED zu spielen. Übergewichtige Männer mit ED haben höhere Werte an Entzündungsmarkern (IL-6, IL-9, IL-18 und CRP) und eine beeinträchtigte Endothelfunktion als übergewichtige Männer ohne ED.96
Eine Gewichtsabnahme kann die Erektionsfähigkeit deutlich verbessern. In einer RCT verbesserten fettleibige Männer, die innerhalb von zwei Jahren durchschnittlich 33 Pfund verloren, ihre sexuelle Leistungsfähigkeit.97 Die ED verbesserte sich bei mehr als 30 % der Abnehmgruppe im Vergleich zu 5 % der Kontrollgruppe. Die Interventionsgruppe erhielt Ernährungsberatung, Ratschläge zur Steigerung der körperlichen Aktivität auf etwa 3 Stunden pro Woche sowie monatliche oder zweimonatliche Treffen. Neben einem durchschnittlichen Gewichtsverlust von 15 % zeigten Männer in der Interventionsgruppe auch eine Verringerung der Entzündungsmarker IL-6 und hsCRP, was ihr kardiometabolisches Risikoprofil verbesserte.
PFLANZLICHE STOFFE UND AMINOSÄUREN
Der Einsatz von Pflanzenstoffen, Nährstoffen und anderen natürlichen Therapien zur Steigerung der sexuellen Leistungsfähigkeit hat aufgrund des Internetmarketings erheblich zugenommen. Nur wenige natürliche Therapien wurden klinischen Studien am Menschen unterzogen, um Sicherheit und Wirksamkeit zu belegen. Die folgenden Pflanzenstoffe und Aminosäuren können jedoch bei der Behandlung von ED hilfreich sein, insbesondere für Männer, die keine PDE5i-Medikamente einnehmen möchten.
Pausinystalia Yohimbe
Yohimbe ist eine immergrüne Pflanze aus Zentralafrika, die drei Alkaloide enthält: Rauwolscin, Corynanthin und Yohimbin. Der aktivste Bestandteil von Yohimbe, Yohimbin, ist ein Arzneimittel mit einem gut beschriebenen Wirkmechanismus als Antagonist des präsynaptischen α1 und α2-adrenerge und 5-HT(1B)-Rezeptoren und partieller Agonist von 5-HT(1A)-Rezeptoren.98 Metaanalysen legen nahe, dass Yohimbin bei ED wirksam ist99,100 Yohimbin kann auch bei verzögerter oder nicht möglicher Ejakulation helfen.101 Die Dosierung beträgt 15–30 mg, bis zu 100 mg pro Tag. Yohimbe wird möglicherweise am besten nach Bedarf verabreicht, da die Wirkung schnell einsetzt, innerhalb von 10–15 Minuten, mit einer Halbwertszeit von 35 Minuten. Yohimbin dringt in das Zentralnervensystem ein und kann zu Nebenwirkungen wie Tachykardie, Bluthochdruck, Reizbarkeit und Angstzuständen führen. Häufig treten auch Schwitzen, Übelkeit, Schwindel, Kopfschmerzen und Hautrötungen auf. Wie bei allen Pflanzenstoffen sind viele rezeptfreie Nahrungsergänzungsmittelmarken möglicherweise nicht zuverlässig. Eine Studie, in der 49 Yohimbe-Marken getestet wurden, ergab erhebliche Schwankungen in der Menge an Yohimbin – 0 bis 12.1 mg – pro Portion, wobei 19 Marken kein Rauwolscin und Corynanthin enthielten, was darauf hindeutet, dass sie aus stark verarbeiteten Pflanzenextrakten oder synthetischen Ursprungs waren.102
Tribulus Terrestris
T. terrestris wächst in Europa, Asien, Afrika und im Nahen Osten. Die Wurzel und Frucht werden sowohl in der chinesischen als auch in der ayurvedischen Medizin seit langem verwendet. Es wird häufig behauptet, dass Tribulus die Testosteronproduktion verbessert; Klinische Studien haben diese Annahme jedoch nicht gestützt, außer bei der intravenösen Anwendung bei Primaten.103-106 Tierstudien haben gezeigt, dass Tribulus die erektile Funktion und die NO-Produktion verbessern kann.107,108 Eine RCT mit 180 Männern mit leichter bis mittelschwerer ED unter Verwendung von 500 mg standardisierter T. terrestris Dreimal täglich eingenommen, berichteten von einer Verbesserung der Libido, der ED, der Zufriedenheit beim Geschlechtsverkehr und der Orgasmusqualität. Es wurden keine nachteiligen Auswirkungen gemeldet.109
Eurycoma longifolia
Eurycoma longifolia, bekannt als Malaysischer Ginseng oder Tongkat Ali, ist eine Blütenpflanze, die in Indonesien, Malaysia, Thailand, Vietnam, Laos und Indien beheimatet ist. Eine Metaanalyse von RCTs legt nahe E. longifolia lindert ED deutlich.110 Darüber hinaus legt eine chinesische Übersicht veröffentlichter Studien nahe E. longifolia verbessert das Samenvolumen, die Libido und den Testosteronspiegel.111 Die Pflanze verfügt möglicherweise über eine adaptogene Fähigkeit und reduziert nachweislich Müdigkeit, verbessert das Wohlbefinden, senkt den Cortisolspiegel und erhöht den Testosteronspiegel bei gestressten Personen.112 Als Wasserwurzelextrakt eingenommen, scheint Eurycoma ohne nennenswerte Nebenwirkungen sicher zu sein. Die empfohlene Dosierung beträgt 200–300 mg ein- oder zweimal täglich, mit einer patentierten Form, die auf 22 % Eurypeptide und 40 % Glycosaponine standardisiert ist.
Epimedium spp.
Epimedium spp. wachsen in China und Korea und gehören zur Familie der Berberidaceae (die auch die bekannten Pflanzenstoffe enthält, Mahonia aquifolium, Hydrastis canadensis und Berberis vulgaris). Es wurden mindestens 50 Arten identifiziert, die allgemein als „Ziegenkraut“ bekannt sind. Der mutmaßliche Wirkstoff Icariin ist ein Flavonoid, das im Tierversuch durch PDE5-Hemmung und Stickoxid-Induktion die Erektionsfunktion verbessert.113-115 – Klinische Studien am Menschen Epimedium fehlen; Daher liegen keine Dosierungsempfehlungen vor.
L-Arginin
L-Arginin ist eine Aminosäure, die bei Erkrankungen mit erhöhtem Arginase-Enzym wie Diabetes und Nierenversagen essentiell ist.116,117 Arginin wird von Darm-Enterozyten und Hepatozyten genutzt und in L-Citrullin oder L-Ornithin umgewandelt. Die Absorption von oralem L-Arginin schwankt erheblich – eine 6-g-Dosis wird zu etwa 68 % absorbiert, während eine 10-g-Dosis nur zu 20 % absorbiert wird.118,119
Stickoxid ist das Nebenprodukt der Umwandlung von L-Arginin in Citrullin. Darüber hinaus erhöht die Citrullin-Supplementierung den Plasma-Argininspiegel. Arginin kann in hohen Dosierungen die ED verbessern; Beispielsweise verbessern 5000 mg die ED, insbesondere wenn die NO-Metaboliten im Urin niedrig sind.120 Theoretisch könnte L-Arginin am besten wirken, wenn der ADMA-Spiegel erhöht ist. Da ADMA eNOS, das für die NO-Produktion benötigte Endothelenzym, hemmt, kann eine L-Arginin-Supplementierung das Arginin-zu-ADMA-Verhältnis wiederherstellen.121 Eine L-Arginin-Supplementierung kann bei ED in Kombination mit Yohimbin oder Pycnogenol (Kiefernrinde) wirksamer sein Pinus Pinaster).122-124 Eine Nahrungsergänzung mit L-Arginin kann Herpes auslösen und Ausbrüche verstärken. Darüber hinaus berichtete eine im Jahr 2013 veröffentlichte RCT, dass die Einnahme von 3000 mg L-Arginin dreimal täglich ein erhöhtes Mortalitätsrisiko bei Patienten mit kürzlich aufgetretenem Herzinfarkt ergab.125
PHARMAKOLOGISCHE THERAPIEN
Die wichtigsten pharmakologischen Ansätze für ED sind PDE5-Hemmer, Apomorphin und intrakavernöse Injektionstherapien.
PDE5-Inhibitoren
Phosphodiesterase-Typ-5-Hemmer (PDE5i) sind die häufigste medikamentöse Behandlung von ED. Ihr Wirkungsmechanismus ist gut bekannt. Er hemmt das Enzym Phosphodiesterase Typ 5, das cGMP abbaut, und verlängert so effektiv die NO-Aktivität in den Penisarterien. Medikamente dieser Klasse unterscheiden sich in ihrer Selektivität für die 11 verschiedenen PDE-Isoenzyme. Diese Kreuzreaktivität mit PDE-Isoenzymen findet sich insbesondere in der glatten Gefäß-, Viszeral- und Lungenmuskulatur und trägt zu Nebenwirkungen bei.126 Vardenafil und Sildenafil binden beispielsweise drei- bzw. siebenmal häufiger an PDE6, ein Enzym in der Netzhaut, das Licht in Nervenimpulse umwandelt. Die Hemmung dieses Enzyms führt zu Farbwahrnehmungsstörungen, die als „Chromatopsie“ bekannt sind.
Vier PDE5i-Medikamente wurden von der FDA zugelassen – Sildenafil im Jahr 1998, Vardenafil und Tadalafil im Jahr 2003 und Avanafil im Jahr 2012. Es wurden keine direkten Studien zum Vergleich der Wirksamkeit dieser Medikamente durchgeführt. Diese Medikamente unterscheiden sich in Wirkungsbeginn, Wirkdauer und Nebenwirkungen.127 Der Wirkungseintritt von Sildenafil und Vardenafil dauert 30–60 Minuten und die Dauer beträgt 10–12 Stunden. Der Wirkungseintritt von Tadalafil dauert je nach Dosierung 15–30 Minuten, wobei die längste Wirkungsdauer 36 Stunden beträgt. Avanafil hat mit 15 Minuten den kürzesten Wirkungseintritt und eine Wirkungsdauer von ca. 6 Stunden.
Die Verwendung von PDE5i kann das Prostatakrebsrisiko senken, möglicherweise weil Männer, die sie verwenden, möglicherweise häufiger ejakulieren, was vor Prostatakrebs schützt.128,129 Langfristig Sildenafil Die Einnahme von Citrat (Viagra) ist mit einem leicht erhöhten Melanomrisiko verbunden.130 Zu den häufigsten Nebenwirkungen von PDE5i gehören Kopfschmerzen bei bis zu 20 % der Männer, Hitzegefühl bei bis zu 15 % sowie Dyspepsie und verstopfte Nase bei bis zu 10 %. Obwohl selten, können Schwindel und Priapismus auftreten. Alle PDE5i sind bei Männern, die Nitrate einnehmen, kontraindiziert.
Apomorphin
Apomorphin wird seit 1869 zur Behandlung der Parkinson-Krankheit eingesetzt und wurde auf seine Wirkung auf die erektile Funktion untersucht. Obwohl Apomorphin aus Morphin gewonnen wird, enthält es kein Morphin und bindet nicht an Opioidrezeptoren. Es hat eine hohe Affinität zu Dopaminrezeptoren und der Mechanismus zur Verbesserung des Sexualtriebs und der Erektionen beruht wahrscheinlich auf einer mäßigen Affinität zu D2-Rezeptoren im Hypothalamus und im limbischen System.131 In klinischen Phase-II- und III-Studien am Menschen mit 5000 Männern führten 3–4 mg sublinguales Apomorphin innerhalb von 10–25 Minuten zu Erektionen, die fest genug für die Penetration waren, mit einer Verbesserung von etwa 20–25 % gegenüber Placebo.132,133 Das einzige patentierte pharmazeutische Apomorphin in den USA ist das injizierbare Apokyn, das von der FDA zur Behandlung der Parkinson-Krankheit zugelassen ist; Apomorphin kann jedoch als sublinguale Lutschtablette zubereitet und mit einem PDE5i kombiniert werden. Dosierungen von 2–3 mg können genauso wirksam sein wie 4–6 mg, ohne dass Nebenwirkungen wie Übelkeit, Kopfschmerzen oder Schwindel auftreten. Aufgrund einer möglichen Hypotonie sollte Apomorphin nicht gleichzeitig mit Ondansetronhydrochlorid, einem häufig verschriebenen Antiemetikum, angewendet werden.
Intrakavernöse Injektionen
Die 1983 eingeführten intrakavernösen Injektionen modulieren die Endothelfunktion und sind selbst bei Männern mit schwerer ED sehr wirksam; Alprostadil führt bei bis zu 93 % der Männer zu Erektionen, wobei die Wirksamkeit der Bi-, Tri- und Quad-Mischung bis zu 97.6 % beträgt.134-136 Alprostadil, 20 oder 40 μg Prostaglandin E1, ist die einzige von der FDA zugelassene patentierte intrakavernöse Injektion, während zwei weitere Medikamente, Phentolamin und Papaverin, in einer zusammengesetzten Formel zu PGE1 hinzugefügt werden können. Die häufigste Nebenwirkung von PGE1 allein sind Schmerzen bei 48.5 % der Männer. Bi-Mix, der oft 0.5–3.0 mg Phentolamin und 30 mg Papaverin enthält, verursacht keine Schmerzen, ist aber möglicherweise nicht so wirksam. Tri-Mix, der normalerweise 5–10 μg (und bis zu 40 μg) PGE1, 0.5–1.0 mg Phentolamin und 15–30 mg Papaverin enthält, reduziert die Schmerzwahrscheinlichkeit auf 2.9 %. Der Zusatz von 0.15 mg Atropin in der Quad-Mischung, der Männern vorbehalten ist, bei denen die Tri-Mischung unwirksam ist, lindert die Schmerzen erheblich. Die benötigte Menge an PGE1, Bi-, Tri- oder Quad-Mix variiert zwischen 0.1 und 0.3 ml. Empirisch (nur Verwendung von PGE1, unabhängig von der Ätiologie oder dem Schweregrad der ED, wobei Dosierungs- oder Formelanpassungen auf der Grundlage der Ergebnisse des Patienten vorgenommen werden) und risikobasiert (Verwendung von Bi-Mix, Tri-Mix oder hochdosiertem Tri-Mix basierend auf einem Algorithmus zur Berücksichtigung der ED Ätiologie und Anzahl der ED-Risikofaktoren) scheinen die Dosierungsansätze hinsichtlich Wirksamkeit, Komplikation und Zufriedenheitsraten ähnlich zu sein.137 Zu den Nebenwirkungen zählen Schmerzen an der Injektionsstelle, Priapismus und die Entwicklung von Narbengewebe oder der Peyronie-Krankheit. Einen hervorragenden Artikel über Wirksamkeit, Dosierung und Nebenwirkungen von intracavernosalen Injektionen finden Sie in Medscapes Zusammenfassung „Intracavernosal Injection Algorithm“ von Jeffrey Albaugh.138
Extrakorporale Stoßwellentherapie mit niedriger Intensität
Die extrakorporale Stoßwelle geringer Intensität (LI-ESW) entstand in den 1990er Jahren, als gezeigt wurde, dass Ultraschall die Angiogenese in Rattenwunden induziert.139 LI-ESW verwendet Stoßwellen, eine Art akustische Welle, die Energie transportiert und biologische Reaktionen auslöst, wenn sie auf das Zielgewebe angewendet wird.140 Das Verfahren variiert hinsichtlich der Energieflussdichte, der Frequenz (Anzahl der Impulse pro Sekunde in Hz) und der Gesamtzahl der abgegebenen Impulse. Der Wirkungsmechanismus für die ED-Verbesserung scheint in der Regeneration von neuronalen Stickoxid (nNOS)-positiven Nerven im Penis, einer verbesserten Stickoxidfreisetzung und der Reparatur von endothelialen und vaskulären glatten Muskelzellen durch Rekrutierung mesenchymaler Stammzellen zu liegen.141 Die Behandlung kann auch lokale Penis-Vorläuferzellen aktivieren.142 Derzeit ist LI-ESW nicht von der FDA für ED zugelassen; Es wurden jedoch viele klinische Studien mit einem guten Sicherheitsprofil und unterschiedlichem Erfolg durchgeführt.
In der ersten ED-Pilotstudie, die 2010 veröffentlicht wurde, wurden sechs LI-ESW-Sitzungen bei 20 Männern durchgeführt, die nicht auf PDE5-Hemmer (PDE5i) reagierten. Die Ergebnisse zeigten eine Verbesserung der erektilen Funktion, der Erektionsdauer und der Penissteifheit innerhalb eines Monats. Verbesserungen wurden über einen Zeitraum von bis zu 1 Monaten berichtet.143 Mehrere RCTs haben über positive Ergebnisse mit LI-ESW berichtet. In einer Studie mit 67 Männern mit ED, die auf PDE5i ansprachen, erhielt der Behandlungsarm 12 Sitzungen mit einer verbesserten Erektionsfunktion und Hämodynamik des Penis, die bei etwa 50 % der Männer ohne Verwendung ihres PDE5i beobachtet wurde.144 In einer ähnlichen RCT in Indien mit 135 PDE5i-Respondern, die in 12 Sitzungen behandelt wurden, konnten 78 % der behandelten Männer nach einem Monat ohne Medikamente Erektionen erreichen, die fest genug für die Penetration waren.145 Obwohl diese Ergebnisse auch nach einem Jahr Nachbeobachtung anhielten, gab es eine sehr hohe Abbrecherquote, einschließlich 1 % der Schein- und 58 % der Behandlungsarme.
Männer, die nicht auf PDE5i ansprechen, können nach einer LI-ESW-Behandlung zu Respondern werden. In einer offenen, einarmigen prospektiven Studie mit 29 Männern, die nicht auf PDE5i reagierten, führten 12 Behandlungen dazu, dass 72 % der Männer Erektionen erreichen konnten, die fest genug für die Penetration mit einem PDE5i waren.146 In einer neueren RCT mit 58 PDE5i-Non-Respondern sprachen 54 % nach einem Monat LI-ESW-Therapie auf PDE5i an, verglichen mit 1 % in der Scheingruppe.147
Die in längeren Nachbeobachtungsstudien beobachteten anhaltenden Verbesserungen deuten darauf hin, dass einige Männer nach der Behandlung die zugrunde liegende Pathologie, die ihre ED verursacht, umkehren können oder dass LI-ESW zu einem gewissen Grad an Penisrehabilitation führen kann. In einer RCT mit 6-monatiger Nachbeobachtung von 112 Männern, die alle fünf Behandlungssitzungen erhielten, da der Placebo-Arm nach 10 Wochen eine aktive Behandlung erhielt, waren es nach 6 Monaten etwa 20 % des Erstbehandlungsarms und 23 % der behandelten Anfangsgruppe Die Placebo-Gruppe konnte weiterhin ohne Medikamente Geschlechtsverkehr haben.148 Eine weitere einjährige Nachuntersuchung von 1 älteren Männern (Durchschnittsalter 50 Jahre) mit vaskulären Risikofaktoren wie Diabetes, Bluthochdruck, Dyslipidämie und koronarer Herzkrankheit ergab eine nachhaltige Verbesserung des ED-Schweregrades und der selbstberichteten Erektionsqualität um 65 %.149
Die Anzahl der LI-ESW-Behandlungen für ein optimales Ergebnis und wie lange die Behandlung wirksam bleibt, ist nicht bekannt. Eine kürzlich an 126 Männern in einem dänischen Krankenhaus durchgeführte RCT verglich Männer, die nach 6 und 12 Monaten fünf mit zehn Sitzungen erhielten; Die Behandlung war in beiden Gruppen zu etwa 38 % wirksam, was darauf hindeutet, dass zusätzliche Sitzungen das Ergebnis möglicherweise nicht verbessern.150,151 In einer 2-jährigen Nachuntersuchung einer offenen Studie mit 156 Männern verbesserte sich die Wirkung bei 63 % nach 4 Wochen, wobei die Wirksamkeit bei 53 % nach 2 Jahren anhielt.152 Es überrascht nicht, dass Männer mit schwerer ED früher einen Ausfall erlitten. Alle Patienten mit Diabetes und schwerer ED verloren die Wirkung, während 76 % der Männer mit leichter ED und ohne Diabetes die Wirksamkeit beibehielten.
Die Zahl der Studien, in denen LI-ESWT bei ED eingesetzt wird, hat in den letzten Jahren dramatisch zugenommen. Eine narrative Überprüfung der veröffentlichten Literatur aus dem Jahr 2013 ergab, dass 60–75 % der PDE5i-Responder Erektionen erreichen konnten, die fest genug für die Penetration ohne Medikamente waren, und 72 % der PDE5i-Non-Responder wurden zu Respondern.153 Aktuelle Metaanalysen, die 14 Studien einschließlich 7 RCTs überprüften, ergaben, dass die LI-ESW-Therapie sicher und wirksam ist und die Ergebnisse mindestens drei Monate anhalten.154 Männer mit leichter oder mittelschwerer ED scheinen besser auf die Behandlung anzusprechen als Männer mit schwerer ED, wobei die Energieflussdichte, die Anzahl der abgegebenen Stoßwellen und die Behandlungsdauer eng mit dem Ergebnis korrelieren.
PRP- und Stammzellinjektion
Die Injektion von plättchenreichem Plasma (PRP) oder mesenchymalen Stammzellen in den Schwellkörper verspricht eine Verbesserung der ED und die Wiederherstellung der Penisarterien- und Nervenfunktion. Zur Herstellung von PRP werden Blutplättchen aus antikoaguliertem Blut in einer Zentrifuge zentrifugiert und konzentriert. PRP enthält mehr als 300 bioaktive Proteine, Wachstumsfaktoren und Adhäsionsmoleküle, die die Gewebeheilung verbessern und die Regeneration von Nerven- und Gefäßgewebe fördern können.155-157 Da das Penisgefäßsystem die endothelreichste Region des Körpers eines Mannes ist und der Blutfluss im schlaffen Penis im Vergleich zur systemischen Zirkulation langsamer ist (was eine bessere Retention ermöglicht), kann PRP theoretisch Vorteile im Penisgewebe bewirken, die den Verbesserungen ähneln, die bei orthopädischen Verletzungen beobachtet werden .
Es wurden nur wenige Pilotstudien zur Sicherheit und Machbarkeit mit PRP bei ED veröffentlicht. In einer in Italien durchgeführten Humanstudie wurden neun Männer mit ED untersucht, die zusätzlich zur Vakuumtherapie PRP erhielten. Es war eine leichte Verbesserung zu beobachten, die einzige geringfügige Nebenwirkung waren leichte Schmerzen und Blutergüsse an der Injektionsstelle.158
Reduzierte Mengen zirkulierender endothelialer Vorläuferzellen (EPCs), einer Art von Stammzellen, die für die Regeneration der vaskulären Endothelauskleidung notwendig sind, sind ein unabhängiger Risikofaktor für ED.159 Bei chronischen Entzündungen, die bei Diabetes, Hypercholesterinämie, Fettleibigkeit, Herz-Kreislauf-Erkrankungen und Zigarettenrauchen auftreten, sind die EPCs verringert.160 Tierstudien legen nahe, dass Testosteron die EPC-Mobilisierung aus dem Knochenmark stimuliert und die Angiogenese verbessert.161,162 Zwei Übersichtsarbeiten zu veröffentlichten Tierstudien mit intrakavernösen Injektionen von Stammzellen aus Knochenmark, Fettgewebe und Skelettmuskeln berichteten über positive Ergebnisse bei der Endothel-, glatten Muskel- und Nervenfunktion im Penisgewebe.163,164
PRP und Stammzelltherapie können Männern mit Gefäß- und Nervenverletzungen aufgrund von Diabetes oder radikaler Prostatektomie helfen. Einige Pilotstudien am Menschen deuten darauf hin, dass das Verfahren sicher und wirksam sein könnte. An einer Studie nahmen 11 Männer teil, die sich aufgrund von Prostatakrebs einer radikalen Prostatektomie unterzogen hatten und deren ED nicht auf PDE5i ansprach.165 Autologe Stammzellen aus Fettgewebe, die in den Corpus Cavernosum injiziert wurden, stellten bei acht der elf Männer die Erektionsfähigkeit wieder her, ohne dass es zu Nebenwirkungen kam. In einer anderen Pilotstudie mit nicht autologen menschlichen Nabelschnurstammzellen konnten sechs von sieben älteren Männern mit Diabetes und ED, die nicht auf PDE5i reagierten, im dritten Monat wieder morgendliche Erektionen bekommen, und zwei von sieben konnten immer noch eine Erektion erreichen mit PDE5i nach 6 Monaten. Interessanterweise sank der Blutzuckerspiegel zwei Wochen nach der Injektion, wobei sich der Hämoglobin-A2C-Spiegel bis zu vier Monate lang verbesserte und keine nachteiligen Auswirkungen beobachtet wurden. Positive Ergebnisse wurden auch in einer Pilotstudie am Menschen beobachtet, an der 1 Männer mit schwerer ED nach radikaler Prostatektomie teilnahmen, die nicht auf Alprostadil, PDE4i oder ein Vakuumgerät ansprachen.166 In dieser Phase-I-Studie wurden steigende Dosen autologer Stammzellen aus dem Knochenmark verwendet. Höhere Dosen waren wirksamer, da neun von zwölf Männern mit PDE5i Erektionen erreichen konnten, die fest genug für die Penetration waren; Die Vorteile hielten ein Jahr lang ohne nachteilige Auswirkungen an.
Während PRP- und Stammzellinjektionen als experimentell gelten und keine FDA-Zulassung und keinen Versicherungsschutz haben, suchen Männer möglicherweise Ärzte auf, die diese Verfahren durchführen. Mögliche Nebenwirkungen sind Infektionen und die Entwicklung von Narbengewebe oder die Peyronie-Krankheit. Theoretisch können Stammzellen auch die Tumorentstehung fördern, das Ausmaß dieses Risikos ist jedoch unbekannt.167
Erektile Dysfunktion ist ein häufiges medizinisches Problem mit mehreren möglichen, sich oft überschneidenden Faktoren und Ursachen. Eine sorgfältige und gründliche Anamneseerhebung, die Verwendung validierter Fragebögen, eine körperliche Untersuchung und Laboruntersuchungen sind erforderlich, um einen Plan zur Linderung der Symptome zu entwickeln und gleichzeitig die zugrunde liegenden Ursachen anzugehen. Zu den Behandlungsoptionen gehören Änderungen der Ernährung und des Lebensstils, physiotherapeutische Übungen, die Verwendung von Vakuumkonstriktionsgeräten, pflanzliche und Aminosäure-Nahrungsergänzungsmittel, Medikamente, extrakorporale Stoßwellentherapie geringer Intensität und möglicherweise intrakavernöse Injektionen mit plättchenreichem Plasma oder Stammzellen.
- Führen Sie eine gründliche Anamnese, Fragebogendokumentation, Untersuchung und relevante Laborarbeiten durch
- Besprechen Sie Ursachen/Beteiligungsfaktoren:
- Psychogen
- Neurologisch
- Übermäßiger Gebrauch von Pornografie
- Endokrin
- Nebenwirkungen von Medikamenten
- Gefäßveränderungen
- Überprüfen Sie relevante Behandlungsoptionen:
- Psychosexuelle Beratung
- Pornografie-Abstinenz
- Physiotherapie (Kegel-Therapie) oder Verwendung eines Vakuum-Konstriktionsgeräts
- Ernährungsumstellungen
- Übungsempfehlung
- Möglichkeiten zur Gewichtsabnahme
- Pflanzliche Heilmittel und Aminosäuren
- Medikamente:
- PDE5i: unterschiedlicher Beginn, Wirkdauer und Nebenwirkungen
- Kann durch eine Versicherung gedeckt sein oder auch nicht, kann teuer sein
- Apomorphin, das nicht von der FDA für ED zugelassen ist, muss zusammengesetzt werden
- PDE5i: unterschiedlicher Beginn, Wirkdauer und Nebenwirkungen
- Extrakorporale Stoßwelle geringer Intensität
- Keine FDA-Zulassung für ED und kein Versicherungsschutz
- Die Sicherheitsdaten sind gut und die meisten Studien zeigen positive Ergebnisse
- Möglicherweise sind wiederholte Behandlungen erforderlich
- PRP- und Stammzellinjektionen
- Aufgrund fehlender randomisierter Studien und möglicher Sicherheitsbedenken nicht empfohlen
Für die Vorbereitung und das Schreiben dieses Artikels wurden keine Mittel bereitgestellt.
- Feldman HA, Goldstein I, Hatzichristou DG, et al. Impotenz und ihre medizinischen und psychosozialen Zusammenhänge: Ergebnisse der Massachusetts Male Aging Study.
- McMahon CN, Smith CJ, Shabsigh R. Behandlung der erektilen Dysfunktion, wenn PDE5-Hemmer versagen.
- Herbenick D, Schick V, Reece M, et al. Die Entwicklung und Validierung der männlichen Genital-Selbstbildskala: Ergebnisse einer landesweit repräsentativen Wahrscheinlichkeitsstichprobe von Männern in den Vereinigten Staaten.
- Gebhard P, Johnson A.
- Fisher L, Anderson G, Chapagain M, et al.
- Schick V, Herbenick D, Reece M, et al. Sexuelles Verhalten, Kondomgebrauch und sexuelle Gesundheit von Amerikanern über 50: Auswirkungen auf die Förderung der sexuellen Gesundheit älterer Erwachsener.
- Berger J., Doan A., Kehoe J., et al. PD69-12-Umfrage zu sexueller Funktion und Pornografie.
- Zillmann D, Bryant J. Der Einfluss von Pornografie auf die sexuelle Befriedigung 1.
- Sun C, Bridges A, Johnson JA, et al. Pornografie und das männliche Sexualskript: eine Analyse von Konsum und sexuellen Beziehungen.
- Poulsen FO, Busby DM, Galovan AM. Verwendung von Pornografie: Wer nutzt sie und wie hängt sie mit Paarergebnissen zusammen?
- Perry SL. Reduziert der Konsum von Pornografie mit der Zeit die Qualität der Ehe? Belege aus Längsschnittdaten.
- Park B, Wilson G, Berger J, et al. Verursacht Internetpornografie sexuelle Funktionsstörungen? Eine Rezension mit klinischen Berichten.
- Rosen RC, Riley A, Wagner G, et al. Der internationale Index der erektilen Funktion (IIEF): eine mehrdimensionale Skala zur Beurteilung der erektilen Dysfunktion.
- Rosen RC, Cappelleri JC, Smith MD, et al. Entwicklung und Bewertung einer gekürzten 5-Punkte-Version des International Index of Erectile Dysfunction (IIEF-5) als Diagnoseinstrument für erektile Dysfunktion.
- Cappelleri JC, Rosen RC. Das Sexual Health Inventory for Men (SHIM): eine 5-Jahres-Überprüfung von Forschung und klinischer Erfahrung.
- Bruce T, Barlow D. Die Natur und Rolle von Leistungsangst bei sexueller Dysfunktion. In: Leitenberg H, hrsg.
- Bentsen I., Giraldi A., Kristensen E., et al. Systematische Überprüfung der sexuellen Dysfunktion bei Veteranen mit posttraumatischer Belastungsstörung.
- Hamann S, Herman RA, Nolan CL, et al. Männer und Frauen reagieren unterschiedlich auf visuelle sexuelle Reize.
- Simonsen U, Comerma-Steffensen S, Andersson KE. Modulation dopaminerger Signalwege zur Behandlung der erektilen Dysfunktion.
- Campbell J, Burnett A. Neuroprotektive und nervenregenerative Ansätze zur Behandlung der erektilen Dysfunktion nach einer Verletzung des Nervus cavernosus.
- Ricchiuti VS, Haas CA, Seftel AD, et al. Schädigung des Pudendusnervs im Zusammenhang mit leidenschaftlichem Radfahren.
- Oberpenning F, Roth S, Leusmann DB, et al. Das Alcock-Syndrom: vorübergehende Unempfindlichkeit des Penis aufgrund einer Kompression des Nervus pudendus im Alcock-Kanal.
- Awad MA, Gaither TW, Murphy GP, et al. Radfahren sowie männliche Sexual- und Harnfunktion: Ergebnisse einer großen, multinationalen Querschnittsstudie.
- Ventura-Aquino E, Fernandez-Guasti A, Paredes R. Hormone und der Coolidge-Effekt.
- Koukounas E, Over R. Zuweisung von Aufmerksamkeitsressourcen während der Gewöhnung und Dishabituation männlicher sexueller Erregung.
- Kim SC, Bang JH, Hyun JS, et al. Veränderungen der erektilen Reaktion auf wiederholte audiovisuelle sexuelle Stimulation.
- Joseph P., Sharma R., Agarwal A., et al. Männer ejakulieren größere Samenmengen, beweglichere Spermien und schneller, wenn sie Bildern von neuen Frauen ausgesetzt sind.
- Volkow ND, Baler D. Suchtwissenschaft: Entdeckung neurobiologischer Komplexität.
- Liebe T, Laier C, Marke M, et al. Neurowissenschaften der Internetpornografiesucht: eine Überprüfung und ein Update.
- Nestler EJ, Barrot M, Selbst DW. DeltaFosB: ein anhaltender molekularer Schalter für die Sucht.
- Pitcher KK, Frohmader KS, Vialou V, et al. Natürliche und medikamentöse Belohnungen wirken auf gemeinsame Mechanismen der neuronalen Plastizität, wobei ΔFosB ein Schlüsselmediator ist.
- Traish A, Goldstein I, Kim N. Testosteron und erektile Funktion: von der Grundlagenforschung zu einem neuen klinischen Paradigma für die Behandlung von Männern mit Androgeninsuffizienz und erektiler Dysfunktion.
- Park KH, Kim SW, Kim KD, et al. Auswirkungen von Androgenen auf die Expression von Stickoxidsynthase-mRNAs im Corpus cavernosum der Ratte.
- Mikhail N. Spielt Testosteron eine Rolle bei der erektilen Funktion?
- Morelli A, Filippi S, Mancina R, et al. Androgene regulieren die Expression und funktionelle Aktivität der Phosphodiesterase Typ 5 in den Schwellkörpern.
- Zhang XH, Morelli A, Luconi M, et al. Testosteron reguliert die PDE5-Expression und die In-vivo-Reaktion auf Tadalafil im Corpus Cavernosum der Ratte.
- Liao M, Huang X, Gao Y, et al. Testosteron wird mit erektiler Dysfunktion in Verbindung gebracht: eine Querschnittsstudie an chinesischen Männern.
- Buena F, Swerdloff RS, Steiner BS, et al. Die sexuelle Funktion ändert sich nicht, wenn der Testosteronspiegel im Serum pharmakologisch im normalen männlichen Bereich liegt.
- Armagan A, Kim NN, Goldstein I, et al. Dosis-Wirkungs-Beziehung zwischen Testosteron und erektiler Funktion: Hinweise auf die Existenz einer kritischen Schwelle.
- Jain P, Rademaker AW, McVary KT. Testosteron-Supplementierung bei erektiler Dysfunktion: Ergebnisse einer Metaanalyse.
- Aversa A, Isidori AM, Spera G, et al. Androgene verbessern die kavernöse Vasodilatation und die Reaktion auf Sildenafil bei Patienten mit erektiler Dysfunktion.
- Mancini A, Milardi D, Bianchi A, et al. Erhöhte Östradiolspiegel bei venöser Verschlussstörung: ein möglicher Funktionsmechanismus der venösen Leckage.
- Wu F, Chen T, Mao S, et al. Bei chinesischen Männern mit sexueller Dysfunktion sind die Östradiol- und Testosteronspiegel verändert.
- Srilatha B, Adaikan PG, Chong YS. Relevanz des Östradiol-Testosteron-Gleichgewichts für die Prognose von Patienten mit erektiler Dysfunktion.
- Leder BZ, Rohrer JL, Rubin SD, et al. Auswirkungen der Aromatasehemmung bei älteren Männern mit niedrigem oder grenzwertig niedrigem Testosteronspiegel im Serum.
- Tan RBW, Guay AT, Hellstrom WJG. Klinischer Einsatz von Aromatasehemmern bei erwachsenen Männern.
- Dastello-Porcar AM, Martinez-Jabaloyas JM. Testosteron/Östradiol-Verhältnis: Ist es nützlich bei der Diagnose von erektiler Dysfunktion und geringem sexuellen Verlangen?
- Gades NM, Jacobson DJ, McGree ME, et al. Die Zusammenhänge zwischen Serum-Sexualhormonen, erektiler Funktion und Sexualtrieb: die Olmsted Country Study of Harnsymptome und Gesundheitszustand bei Männern.
- Buvat J, Lemaire A. Endokrines Screening bei 1,022-Männern mit erektiler Dysfunktion: klinische Bedeutung und kosteneffektive Strategie.
- Gabrielson AT, Sartor RA, Hellstrom WJG. Der Einfluss von Schilddrüsenerkrankungen auf sexuelle Funktionsstörungen bei Männern und Frauen.
- Krassas GE, Tziomalos K, Papadopoulou F, et al. Erektile Dysfunktion bei Patienten mit Hyper- und Hypothyreose: Wie häufig und sollten wir sie behandeln?
- Cheitlin M. Erektile Dysfunktion: das früheste Anzeichen einer generalisierten Gefäßerkrankung?
- Billups KL. Erektile Dysfunktion als frühes Anzeichen einer Herz-Kreislauf-Erkrankung.
- Thompson IM, Tangen CM, Goodman PJ, et al. Erektile Dysfunktion und daraus resultierende Herz-Kreislauf-Erkrankungen.
- Böhm M, Baumhäkel M, Teo K, et al. Erektile Dysfunktion sagt kardiovaskuläre Ereignisse bei Hochrisikopatienten voraus, die Telmisartan, Ramipril oder beides erhalten: die laufende Studie „Telmisartan allein und in Kombination mit Ramipril Global Endpoint Trial/Telmisartan Randomized AssessmeNt Study in ACE-intoleranten Patienten mit Herz-Kreislauf-Erkrankungen“ (ON TARGET/TRANSCEND).
- Guay AT. ED2: erektile Dysfunktion = Endotheldysfunktion.
- Aversa A, Bruzziches R, Francomano D, et al. Endotheldysfunktion und erektile Dysfunktion beim alternden Mann.
- Kaya C, Uslu Z, Karaman I. Ist die Endothelfunktion bei Patienten mit erektiler Dysfunktion beeinträchtigt?
- Kaiser DR, Billups K, Mason C, et al. Beeinträchtigte endothelabhängige und -unabhängige Vasodilatation der Arteria brachialis bei Männern mit erektiler Dysfunktion und keiner anderen klinischen Herz-Kreislauf-Erkrankung.
- Seidman SN, Roose SP. Der Zusammenhang zwischen Depression und erektiler Dysfunktion.
- Seidman SN, Roose SP, Menza MA, et al. Behandlung der erektilen Dysfunktion bei Männern mit depressiven Symptomen: Ergebnisse einer placebokontrollierten Studie mit Sildenafilcitrat.
- Melnick T, Soares BG, Nasselo AG. Psychosoziale Interventionen bei erektiler Dysfunktion.
- Wilson G.
- Brom M, Both S, Laan E, et al. Die Rolle von Konditionierung, Lernen und Dopamin im Sexualverhalten: eine Erzählung über Tier- und Humanstudien.
- Klucken T, Schweckendiek J, Merz CJ, et al. Neurale Aktivierungen des Erlernens konditionierter sexueller Erregung: Effekte von Kontingenzbewusstsein und Sex.
- Griffee K, O'Keefe S, Beard K, et al. Die sexuelle Entwicklung des Menschen unterliegt einer kritischen Phase des Lernens: Auswirkungen auf Sexualsucht, Sexualtherapie und Kindererziehung.
- Kegel AH. Progressives Widerstandstraining zur funktionellen Wiederherstellung der Dammmuskulatur.
- Hoyland K, Vasdev N, Adshead J. Die Verwendung von Vakuum-Erektionsgeräten bei erektiler Dysfunktion nach radikaler Prostatektomie.
- Vrijhof HJ, Delaere KP. Vakuumverengungsvorrichtungen bei erektiler Dysfunktion: Akzeptanz und Wirksamkeit bei Patienten mit Impotenz organischer oder gemischter Genese.
- Kolettis PN, Lakin MM, Montague DK, et al. Wirksamkeit des Vakuumkonstriktionsgeräts bei Patienten mit körperlich-venöser Verschlussstörung.
- Siervo M, Lara J, Ogbonmwan I, et al. Die Ergänzung mit anorganischem Nitrat und Rote-Bete-Saft senkt den Blutdruck bei Erwachsenen: eine systematische Überprüfung und Metaanalyse.
- Hord N, Tang Y, Bryan NS. Nahrungsquellen für Nitrate und Nitrite: der physiologische Kontext für potenzielle gesundheitliche Vorteile.
- Hobbs DA, George TW, Lovegrove JA. Die Auswirkungen des Nitrat-Blutdrucks in der Nahrung und der Endothelfunktion: eine Überprüfung menschlicher Interventionsstudien.
- Fuhrman B, Volkova N, Aviram M. Granatapfelsaft hemmt die Aufnahme von oxidiertem LDL und die Cholesterinbiosynthese in Makrophagen.
- Aviram M, Rosenblat M, Gaitini D, et al. Der dreijährige Verzehr von Granatapfelsaft bei Patienten mit Karotisstenose reduziert die Intima-Media-Dicke der Karotis, den Blutdruck und die LDL-Oxidation.
- Ignarro LJ, Byrns RE, Sumi D, et al. Granatapfelsaft schützt Stickoxid vor oxidativer Zerstörung und verstärkt die biologische Wirkung von Stickoxid.
- Stowe CB. Die Auswirkungen des Granatapfelsaftkonsums auf den Blutdruck und die Herz-Kreislauf-Gesundheit.
- Adamowicz J, Drewa T. Gibt es einen Zusammenhang zwischen Erfrischungsgetränken und erektiler Dysfunktion?
- Neves D. Fortgeschrittene Glykationsendprodukte: ein häufiger Weg bei Diabetes und altersbedingter erektiler Dysfunktion.
- Uribarri J, del Castillo MD, de la Maza MP, et al. Endprodukte der fortgeschrittenen Glykierung in der Nahrung und ihre Rolle für Gesundheit und Krankheit.
- Uribarri J, Woodruff S, Goodman S, et al. Fortgeschrittene Glykationsendprodukte in Lebensmitteln und ein praktischer Leitfaden zu deren Reduzierung in der Ernährung.
- Maiorino MI, Bellastella G, Chiodini P, et al. Primäre Prävention sexueller Dysfunktion mit mediterraner Ernährung bei Typ-2-Diabetes: die randomisierte MÈDITA-Studie.
- Di Francesco S, Tenaglia R. Mittelmeerdiät und erektile Dysfunktion: eine aktuelle Perspektive.
- Slentz CA, Houmard JA, Johnson JL, et al. Inaktivität, körperliches Training und Entzug sowie Plasma-Lipoproteine. STRRIDE: eine randomisierte, kontrollierte Studie zur Trainingsintensität und -menge.
- Di Francescomarino S, Sciartilli A, Di Valerio, et al. Die Auswirkung von körperlicher Betätigung auf die Endothelfunktion.
- Walther C, Gielen S, Hambrecht R. Die Wirkung von körperlichem Training auf die Endothelfunktion bei Herz-Kreislauf-Erkrankungen beim Menschen.
- Fuchsjager-Mayrl G, Pleiner J, Wiesinger GF, et al. Bewegungstraining verbessert die Gefäßendothelfunktion bei Patienten mit Typ-1-Diabetes.
- Vina J, Sanchis-Gomar F, Martinez-Bellow V, et al. Bewegung wirkt wie eine Droge; die pharmakologischen Vorteile von Bewegung.
- Silva A, Sousa N, Azevedo LF, et al. Körperliche Aktivität und Bewegung bei erektiler Dysfunktion: systematische Überprüfung und Metaanalyse.
- Cho YG, Song HJ, Lee SK, et al. Der Zusammenhang zwischen Körperfettmasse und erektiler Dysfunktion bei koreanischen Männern: Hallym Aging Study.
- Diaz-Arjonilla M, Schwarcz M, Swerdloff RS, et al. Fettleibigkeit, niedriger Testosteronspiegel und erektile Dysfunktion.
- Kapoor D, Clarke S, Channer KS, et al. Erektile Dysfunktion ist bei Männern mit Typ-2-Diabetes mit niedrigen bioaktiven Testosteronspiegeln und viszeraler Adipositas verbunden.
- Fantuzzi G. Fettgewebe, Adipokine und Entzündungen.
- Mattu HS, Randeva HS. Rolle von Adipokinen bei Herz-Kreislauf-Erkrankungen.
- Giugliano F. Erektile Dysfunktion geht mit endothelialer Dysfunktion und erhöhten proinflammatorischen Zytokinspiegeln bei adipösen Männern einher.
- Evans M. Abnehmen, um erektile Dysfunktion zu verlieren.
- Millan MJ, Newman-Tancredi A, Audinot V, et al. Agonistische und antagonistische Wirkungen von Yohimbin im Vergleich zu Fluparoxan an alpha(2)-adrenergen Rezeptoren (AR), Serotonin (5-HT)(1A), 5-HT(1B), 5-HT(1D) und Dopamin D( 2) und D(3)-Rezeptoren. Bedeutung für die Modulation der frontokortikalen monoaminergen Übertragung und depressiver Zustände.
- Ernst E, Pittler MH. Yohimbin gegen erektile Dysfunktion: eine systematische Überprüfung und Metaanalyse randomisierter klinischer Studien.
- Carey MP, Johnson BT. Wirksamkeit von Yohimbin bei der Behandlung von Erektionsstörungen: vier metaanalytische Integrationen.
- Adeniyi AA, Brindley GS, Pryor JP, et al. Yohimbin zur Behandlung von Orgasmusstörungen.
- Cohen PA, Wang YH, Maller G, et al. Pharmazeutische Mengen an Yohimbin in Nahrungsergänzungsmitteln in den USA.
- Neychev V, Mitev V. Prosexuelle und androgenverstärkende Wirkung von Tribulus Terrestris L.: Fakt oder Fiktion?
- Gauthaman K, Ganesan AP. Die hormonellen Wirkungen von Tribulus Terrestris und seine Rolle bei der Behandlung männlicher erektiler Dysfunktion – eine Bewertung an Primaten, Kaninchen und Ratten.
- Qureshi A, Naughton DP, Petroczi A. Eine systematische Übersicht über den Kräuterextrakt Tribulus Terrestris und die Wurzeln seiner mutmaßlichen aphrodisierenden und leistungssteigernden Wirkung.
- Neychev VK, Mitev Vi. Das aphrodisierende Kraut Tribulus Terrestris hat keinen Einfluss auf die Androgenproduktion bei jungen Männern.
- Gauthaman K, Ganesan AP, Prasad RN. Sexuelle Wirkungen von Punturevine (Tribulus Terrestris) Extrakt (Protodioscin): eine Bewertung unter Verwendung eines Rattenmodells.
- Adaikan PG, Gauthaman K, Prasad RN, et al. Proerektile pharmakologische Wirkungen von Tribulus Terrestris Extrakt am Kaninchen Corpus Cavernosum.
- Kamenov Z, Fileva S, Kalinov K, et al. Bewertung der Wirksamkeit und Sicherheit von Tribulus Terrestris bei männlicher sexueller Dysfunktion – eine prospektive, randomisierte, doppelblinde, placebokontrollierte klinische Studie.
- Kotirum S, Ismail SB, Chaiyakunapruk N. Wirksamkeit von Tongkat Ali (Eurycoma longifolia) zur Verbesserung der erektilen Funktion: systematische Überprüfung und Metaanalyse randomisierter kontrollierter Studien.
- Do HE, Mohamed IN, Hussain Z, et al. Eurycoma longifolia als potenzielles Adoptogen der männlichen sexuellen Gesundheit: eine systematische Überprüfung klinischer Studien.
- Talbott SM, Talbott J, George A, et al. Wirkung von Tongkat Ali auf Stresshormone und den psychischen Stimmungszustand bei mäßig gestressten Probanden.
- Dell'Agli M, Galli GV, Dal Cero, et al. Starke Hemmung der menschlichen Phosphodiesterase-5 durch Icariin-Derivate.
- Ning H, Xin ZC, Lin G, et al. Auswirkungen von Icariin auf die Phosphodiesterase-5-Aktivität in vitro und den zyklischen Guanosinmonophosphatspiegel in Zellen der glatten Schwellkörpermuskulatur.
- Jiang Z, Hu B, Wang J, et al. Wirkung von Icariin auf die zyklischen GMP-Spiegel und auf die mRNA-Expression der cGMP-bindenden cGMP-spezifischen Phosphodiesterase (PDE5) in der Penishöhle.
- Romero M, Platt DH, Tawfik HE, et al. Eine durch Diabetes verursachte koronare Gefäßfunktionsstörung geht mit einer erhöhten Arginaseaktivität einher.
- Schramm L, La M, Heidbreder E, et al. L-Arginin-Mangel und -Supplementierung bei experimentellem akutem Nierenversagen und bei menschlicher Nierentransplantation.
- Curis E, Nicolis I, Moinard C, et al. Fast alles über Citrullin bei Säugetieren.
- Bode-Böger SM, Böger RH, Galland A, et al. L-Arginin-induzierte Vasodilatation bei gesunden Menschen: pharmakokinetisch-pharmakodynamische Beziehung.
- Chen J, Wollman Y, Chernichovsky T, et al. Wirkung der oralen Verabreichung des hochdosierten Stickoxidspenders L-Arginin bei Männern mit organischer erektiler Dysfunktion: Ergebnisse einer doppelblinden, randomisierten, placebokontrollierten Studie.
- Bode-Böger SM, Scalera F, Ignarro LJ. Das L-Arginin-Paradoxon: Bedeutung des L-Arginin/asymmetrischen Dimethylarginin-Verhältnisses.
- Lebret T, Hervé JM, Gorny P, et al. Wirksamkeit und Sicherheit einer neuartigen Kombination aus L-Argininglutamat und Yohimbinhydrochlorid: eine neue orale Therapie für erektile Dysfunktion.
- Akhondzadeh S, Amiri A, Bagheri A. Wirksamkeit und Sicherheit der oralen Kombination von Yohimbin und L-Arginin (SX) zur Behandlung der erektilen Dysfunktion: eine multizentrische, randomisierte, doppelblinde, placebokontrollierte klinische Studie.
- Stanislavov R, Nikolova V. Behandlung der erektilen Dysfunktion mit Pycnogenol und L-Arginin.
- Schulman SP, Becker LC, Kass DA, L-Arginin-Therapie bei akutem Myokardinfarkt: die vaskuläre Wechselwirkung mit dem Alter bei Myokardinfarkt (VINTAGE MI), randomisierte klinische Studie.
- Saenz de Tejada I, Angulo J, Cuevas P, et al. Vergleichende Selektivitätsprofile von Tadalafil, Sildenafil und Vardenafil unter Verwendung eines In-vitro-Phosphodiesterase-Aktivitätstests.
- Evans J, Hill S. Ein Vergleich der verfügbaren Phosphodiesterase-5-Hemmer bei der Behandlung der erektilen Dysfunktion: ein Schwerpunkt auf Avanafil.
- Chavez A, Coffield KS, Rajab MH, Jo C. Inzidenzrate von Prostatakrebs bei Männern, die wegen erektiler Dysfunktion mit Phosphodiesterase-Typ-5-Hemmern behandelt wurden: retrospektive Analyse.
- Fahrer JR, Wilson KM, Sinnott JA, et al. Ejakulationshäufigkeit und Prostatakrebsrisiko: aktualisierte Ergebnisse mit einem zusätzlichen Jahrzehnt Nachbeobachtung.
- Tang H, Wu W, Fu S, et al. Phosphodiesterase-Typ-5-Inhibitoren und Melanomrisiko: Eine Metaanalyse.
- Chen KK, Chan JY, Chang LS. Dopaminerge Neurotransmission am paraventrikulären Kern des Hypothalamus bei der zentralen Regulierung der Peniserektion bei der Ratte.
- Altwein JE, Keuler FU. Orale Behandlung der erektilen Dysfunktion mit Apomorphin SL.
- Heaton JP. Kernthemen aus den klinischen Studien zu Apomorphin SL.
- Linet OI, Ogring FG. Wirksamkeit und Sicherheit von intrakavernösem Alprostadil bei Männern mit erektiler Dysfunktion.
- Porst H, Buvat J, Meuleman E, et al. Intrakavernöses Alprostadil Alfadex – eine wirksame und gut verträgliche Behandlung der erektilen Dysfunktion. Ergebnisse einer europäischen Langzeitstudie.
- Baniel J, Israilov S, Engelstein D, et al. Dreijahresergebnis eines progressiven Behandlungsprogramms für erektile Dysfunktion mit intrakavernösen Injektionen vasoaktiver Medikamente.
- Bernie HL, Segal R, Le B, et al. Ein empirischer vs. risikobasierter Ansatzalgorithmus zur intrakavernösen Injektionstherapie: eine prospektive Studie.
- Albaugh J. Intracavernosaler Injektionsalgorithmus.
- Young SR, Dyson M. Die Wirkung von therapeutischem Ultraschall auf die Angiogenese.
- Lu Z, Lin G, Reed-Maldonado A, et al. Die Behandlung mit extrakorporalen Stoßwellen niedriger Intensität verbessert die erektile Funktion: eine systematische Überprüfung und Metaanalyse.
- Qiu X, Lin G, Xin Z, et al. Auswirkungen einer Niedrigenergie-Stoßwellentherapie auf die erektile Funktion und das Gewebe eines diabetischen Rattenmodells.
- Lin G, Reed-Maldonado AB, Wang B, et al. In-situ-Aktivierung von Penis-Vorläuferzellen mit extrakorporaler Stoßwellentherapie geringer Intensität.
- Vardi Y, Appel B, Jacob G, et al. Kann eine niedrigintensive extrakorporale Stoßwellentherapie die Erektionsfähigkeit verbessern? Eine 6-monatige Follow-up-Pilotstudie bei Patienten mit organischer erektiler Dysfunktion.
- Vardi Y, Appel B, Kilchevsky A, et al. Hat die extrakorporale Stoßwellentherapie geringer Intensität einen physiologischen Effekt auf die erektile Funktion? Kurzfristige Ergebnisse einer randomisierten, doppelblinden, scheinkontrollierten Studie.
- Srini VS, Reddy RK, Shultz T, et al. Extrakorporale Stoßwellentherapie niedriger Intensität bei erektiler Dysfunktion: eine Studie an einer indischen Bevölkerung.
- Grünwald I, Appel B, Vardi Y. Extrakorporale Stoßwellentherapie niedriger Intensität – eine neuartige wirksame Behandlung der erektilen Dysfunktion bei Patienten mit schwerer ED, die schlecht auf eine PDE5-Hemmer-Therapie ansprechen.
- Kitrey ND, Grünwald I, Appel B, et al. Eine Behandlung mit Stoßwellen geringer Intensität im Penis kann PDE5i-Non-Responder zu Respondern machen: eine doppelblinde, scheinkontrollierte Studie.
- Olsen AB, Persiani M, Boie S, et al. Kann eine niedrigintensive extrakorporale Stoßwellentherapie die erektile Dysfunktion verbessern? Eine prospektive, randomisierte, doppelblinde, placebokontrollierte Studie.
- Bechara A, Casabé A, De Bonis W, et al. Zwölfmonatige Wirksamkeit und Sicherheit der Stoßwellentherapie niedriger Intensität bei erektiler Dysfunktion bei Patienten, die nicht auf Phosphodiesterase-Typ-5-Hemmer ansprechen.
- Fojecki GL, Tiessen S, Osther PJ. Wirkung der niedrigenergetischen linearen Stoßwellentherapie auf erektile Dysfunktion – eine doppelblinde, scheinkontrollierte, randomisierte klinische Studie.
- Fojecki GL, Tiessen S, Osther PJ. Wirkung der linearen extrakorporalen Stoßwellentherapie niedriger Intensität bei erektiler Dysfunktion – 12-Monats-Follow-up einer randomisierten, doppelblinden, scheinkontrollierten Studie.
- Kitrey ND, Vardi Y, Appel B, et al. Stoßwellenbehandlung geringer Intensität bei erektiler Dysfunktion – wie lange hält die Wirkung an?
- Grünwald I, Kitrey ND, Appel B, et al. Extrakorporale Stoßwellentherapie niedriger Intensität bei Gefäßerkrankungen und erektiler Dysfunktion: Theorie und Ergebnisse.
- Clavijo R, Kohn TP, Kohn JR, et al. Auswirkungen der extrakorporalen Stoßwellentherapie niedriger Intensität auf die erektile Dysfunktion: eine systematische Überprüfung und Metaanalyse.
- Pavlovic V, Ciric M, Jovanovic V, et al. Plättchenreiches Plasma: ein kurzer Überblick über bestimmte bioaktive Komponenten.
- Coppinger JA, Cagney G, Toomey S, et al. Die Charakterisierung der von aktivierten Blutplättchen freigesetzten Proteine führt zur Lokalisierung neuer Blutplättchenproteine in menschlichen atherosklerotischen Läsionen.
- Yu W, Wang J, Yin J. Plättchenreiches Plasma: ein vielversprechendes Produkt zur Behandlung der peripheren Nervenregeneration nach einer Nervenverletzung.
- Banno JJ, Kinnick TR, Roy L, et al. Die Wirksamkeit von plättchenreichem Plasma (PRP) als ergänzende Therapie zur Behandlung der erektilen Dysfunktion (ED): erste Ergebnisse.
- Baumhäkel M, Werner N, Bohm M, et al. Zirkulierende endotheliale Vorläuferzellen korrelieren mit der erektilen Funktion bei Patienten mit koronarer Herzkrankheit.
- Ichim TE, Warbington T, Cristea O, et al. Intrakavernöse Verabreichung mononukleärer Knochenmarkszellen: eine neue Methode zur Behandlung der erektilen Dysfunktion?
- Franck-Lissbrant I, Häggström S, Damber JE, et al. Testosteron stimuliert die Angiogenese und das Gefäßneuwachstum in der ventralen Prostata kastrierter erwachsener Ratten.
- Sieveking DP, Chow RW, Ng MK. Androgene, Angiogenese und kardiovaskuläre Regeneration.
- Mingchao Li, Ruan Y, Wang T, et al. Stammzelltherapie bei diabetischer erektiler Dysfunktion bei Ratten: eine Metaanalyse.
- Lin CS, Xin ZC, Wang Z, et al. Stammzelltherapie bei erektiler Dysfunktion: eine kritische Rezension.
- Haahr MK, Jensen CH, Toyserkani NM, et al. Sicherheit und potenzielle Wirkung einer einzelnen intrakavernösen Injektion von autologen, aus Fettgewebe gewonnenen regenerativen Zellen bei Patienten mit erektiler Dysfunktion nach radikaler Prostatektomie: eine offene klinische Phase-I-Studie.
- Yiou R, Hamidou L, Birebent B, et al. Sicherheit intrakavernöser mononukleärer Knochenmarkszellen bei erektiler Dysfunktion nach radikaler Prostatektomie: eine offene Pilotstudie zur Dosissteigerung.
- Mousavinejad M, Andrews P, Shoraki E. Aktuelle Überlegungen zur biologischen Sicherheit in der Stammzelltherapie.
