Neurosci Biobehav Rev. 2011 Jan; 35 (3): 939-55. doi: 10.1016 / j.neubiorev.2010.10.014. Epub 2010 2.
- 1Bernard B. Brodie Abteilung für Neurowissenschaften, Universität Cagliari, Cittadella Universitaria, 09042 Monserrato, Kalifornien, Italien. [E-Mail geschützt]
ABSTRAKT
Oxytocin ist ein starker Induktor der Erektion des Penis, wenn es in das zentrale Nervensystem injiziert wird. Bei männlichen Ratten ist der empfindlichste Hirnbereich für den pro-erektilen Effekt von Oxytocin der paraventrikuläre Kern des Hypothalamus. Dieser Kern und die umgebenden Regionen enthalten die Zellkörper aller oxytocinergen Neuronen, die in extra-hypothalamische Hirnareale und das Rückenmark projizieren. Diese Übersicht zeigt, dass Oxytocin die Erektion des Penis auch dann induziert, wenn es in einige dieser Bereiche injiziert wird (z. B. ventraler Tegmentum, ventrales Subiculum des Hippocampus, posteromedialer kortikaler Nucleus des Amygdala und thorakolumbales Rückenmark). Mikroinjektionsstudien in Kombination mit intrazerebralen Mikrodialyse- und Doppelimmunfluoreszenzstudien legen nahe, dass Oxytocin in diesen Bereichen direkt oder indirekt (hauptsächlich durch Glutaminsäure) mesolimbische dopaminerge Neuronen aktiviert. Dopamin, das im Nucleus Accumbens freigesetzt wird, aktiviert wiederum Nervenbahnen, die zur Aktivierung von dopaminergen Neuronen im Nucleus paraventricularis führen. Dies aktiviert nicht nur oxytocinerge Neuronen, die in das Rückenmark projizieren und die Peniserektion vermitteln, sondern auch diejenigen, die in die obigen extra-hypothalamischen Bereiche projizieren und die Aktivität von mesolimbischen dopaminergen Neuronen, die die Motivation und Belohnung kontrollieren, direkt oder indirekt (durch Glutaminsäure) modulieren. Zusammen können diese neuralen Bahnen einen komplexen hypothetischen Kreislauf bilden, der nicht nur in der vollendeten Phase der sexuellen Aktivität (erektile Funktion und Kopulation) eine Rolle spielt, sondern auch in den motivierenden und lohnenden Aspekten der antizipatorischen Phase des sexuellen Verhaltens.
1.Einführung
Penis Erektion ist eine männliche sexuelle Reaktion, die eine Schlüsselrolle bei der Reproduktion von Säugetieren einschließlich des Menschen spielt, und das kann auch in Kontexten beobachtet werden, die sich von denen unterscheiden, die streng mit Reproduktion verbunden sind. Abhängig von dem Kontext, in dem die Erektion des Penis auftritt, nehmen verschiedene zentrale und periphere neurale und / oder humorale Mechanismen an ihrer Regulierung teil (siehe Meisel und Sachs, 1994; Argiolas und Melis, 1995, 2004, 2005; Sachs, 2000, 2007; McKenna, 2000; Giuliano und Rampin, 2000, 2004; Andersson, 2001; Melis und Argiolas, 1995a, 2003; Hull et al., 2002). Unter den zentralen Neurotransmittern und Neuropeptiden, die Penis Erektion kontrollieren, sind die bekanntesten Dopamin, Serotonin, exzitatorische Aminosäuren, Stickstoffmonoxid, Adrenocorticotropin, Oxytocin und Opioidpeptide. Sie können die Erektion des Penis erleichtern oder hemmen, indem sie in mehreren Gehirnbereichen wirken, dh der mediale präoptische Bereich, der paraventrikuläre Kern des Hypothalamus, der ventrale Tegmentum, der Hippocampus, die Amygdala, der Bettnucleus der Stria terminalis, der Nucleus accumbens, die Medulla oblongata und das Rückenmark (Tabelle 1) (siehe Meisel und Sachs, 1994; Witt und Insel, 1994; Stancampiano et al., 1994; Argiolas und Melis, 1995, 2005; Argiolas, 1999; Bancila et al., 2002; Giuliano und Rampin, 2000, McKenna, 2000, Andersson, 2001, Hull et al., 2002, Coolen et al., 2004).
Oxytocin, das Neurohypophysenpeptid, das für seine hormonelle Rolle in Laktation und Geburt bekannt ist, ist bei Frauen und Männern nicht nur in Neuronen mit Zellkörpern in den paraventrikulären und supraoptischen Kernen des Hypothalamus vorhanden, die zur Neurohypophyse, sondern auch in Neuronen projizieren vom Nucleus paraventricularis und umgebenden Strukturen bis zu extrahypothalamischen Hirnarealen (dh Septum, ventrales Tegmentum, Hippocampus, Amygdala, Medulla oblongata und Rückenmark). Von diesen Neuronen wird angenommen, dass sie an zahlreichen zentralen Funktionen beteiligt sind, wie Gedächtnis, Lernverhalten, Affiliationsverhalten und sozio-sexuellem Verhalten, einschließlich Peniserektion und Kopulationsverhalten (siehe Buijs, 1978; Sofroniew, 1983; Argiolas und Gessa, 1991; Pedersen et al ., 1992; Carter, 1992; Wagner und Clemens, 1993; Ivell und Russel, 1995; Carter et al., 1997; Tang ua, 1998; Veronneau-Longueville et al., 1999). Tatsächlich erleichtert Oxytocin die erektile Funktion und das männliche Sexualverhalten bei Mäusen, Ratten, Kaninchen und Affen (siehe Argiolas und Gessa, 1991; Carter, 1992; Pedersen et al., 1992; Argiolas und Melis, 1995, 2004; Argiolas, 1999). Dies kann auch beim Menschen vorkommen, da Plasma-Oxytocin durch sexuelle Reize verstärkt wird, insbesondere bei Ejakulation (Carmichael et al., 1987; Murphy et al., 1987) und durch die Manipulation der Brust und der Genitalien, die üblicherweise während der sexuellen Ausstrahlung auftreten Geschlechtsverkehr (Tindall, 1974).
Eine erleichterte Wirkung von Oxytocin auf das männliche Sexualverhalten wurde zuerst durch die Fähigkeit von intravenös verabreichtem Oxytocin gezeigt, die Latenz bis zur ersten Ejakulation zu verringern und die sexuelle Erschöpfung männlicher Kaninchen gepaart mit empfänglichen Weibchen (Melin und Kihlstrom, 1963) zu verzögern. Die sexuellen Wirkungen von Oxytocin wurden jedoch erst in den achtziger Jahren endgültig erkannt. Es wurde dann gefunden, dass Oxytocin, das zentral in Nanogramm - Mengen verabreicht wurde, die Peniserektion (Argiolas et al., 1985, 1986) induziert und das Kopulationsverhalten (Arletti et al., 1985) bei männlichen Ratten verbessert und die Lordose bei weiblichen Ratten erhöht (Arletti und Bertolini, 1985; Caldwell et al., 1986), anscheinend indem sie auf Oxytocinergic-Rezeptoren vom Uterustyp einwirken (siehe Argiolas und Melis, 1995, 2004; Argiolas, 1999; Melis und Argiolas, 2003; und Literaturstellen darin). Oxytocin verbessert das Sexualverhalten nicht nur bei sexuell potenten männlichen Ratten (Arletti et al., 1985), sondern auch bei älteren männlichen Ratten (Arletti et al., 1990) und bei dominanten, aber nicht untergeordneten männlichen Totenkopfäffchen (Winslow und Insel , 1991).
Die pro-erektile Wirkung von Oxytocin ist testosteronabhängig, da es durch Hypophysektomie und Kastration aufgehoben und durch Supplementierung mit Testosteron oder seinen Metaboliten Estradiol und 5_-Dihydrotestosteron zusammen gegeben wird (Melis et al., 1994a). Der empfindlichste Hirnbereich für die Induktion der Erektion des Penis durch Oxytocin ist der paraventrikuläre Kern des Hypothalamus (Melis et al., 1986), von dem alle extra-hypothalamischen oxytocinergen Projektionen ausgehen (siehe oben). Hier wurde festgestellt, dass Oxytocin eine Erektion des Penis (und Gähnen) induzieren kann, wenn es in so niedrigen Dosen wie 3 pmol injiziert wird (siehe Abschnitt 2.1 unten). Oxytocin induzierte die Peniserektion auch bei bilateraler Injektion in das CA1 - Feld des Hippocampus, nicht aber in das dorsale Subiculum (siehe Abschnitt 2.3 unten), das laterale Septum, den Nucleus caudatus, den medialen präoptischen Bereich, den ventromedialen Nucleus des Hypothalamus und den supraoptischer Kern (Melis et al., 1986). Was den Mechanismus anbelangt, durch den Oxytocin im paraventrikulären Kern diese sexuelle Reaktion auslöst, legen zahlreiche Studien nahe, dass Oxytocin seine eigenen Neuronen aktiviert. Im Einklang mit dieser Hypothese erhöht die sexuelle Interaktion FOS, das Genprodukt des unmittelbar frühen Gens c-fos in paraventrikulären oxytocinergen Neuronen, die in das Rückenmark projiziert werden und an der Kontrolle der Erektion des Penis beteiligt sind (siehe Witt und Insel, 1994 und Referenzen) darin, und sexuelle Impotenz (z. B. die Unfähigkeit einer erwachsenen männlichen Ratte, mit einer ovariektomierten östrogenprogesteronprimierten rezeptiven Frau zu kopulieren) wurde bei der männlichen Ratte mit geringen Mengen an Oxytocin-mRNA im paraventrikulären Kern des Hypothalamus assoziiert (Arletti et al., 1997).
Ob Oxytocin die antizipatorische Phase oder die konsumatorische Phase des Sexualverhaltens beeinflusst, ist derzeit unklar. Da Oxytocin die Erektion des Penis induziert und der Haupteffekt von Oxytocin auf das kopulatorische Verhalten eine Abnahme des post-ejakulatorischen Intervalls bei männlichen Ratten ist (Arletti et al., 1985), ist anzunehmen, dass das Peptid die sexuelle Leistungsfähigkeit verbessert. Da Oxytocin jedoch auch die sozio-sexuelle Interaktion erhöht (siehe Pedersen et al., 1992; Carter et al., 1997; Ivell und Russel, 1995), verhindern Oxytocin-Rezeptor-Antagonisten kontaktfreie Erektionen (Melis et al., 1999a), die gelten als Index der sexuellen Erregung (siehe Sachs, 1997, 2000, 2007; Melis et al., 1998, 1999b und Referenzen darin), eine mögliche Rolle von Oxytocin in sexueller Erregung und sexueller Motivation kann nicht ausgeschlossen werden.
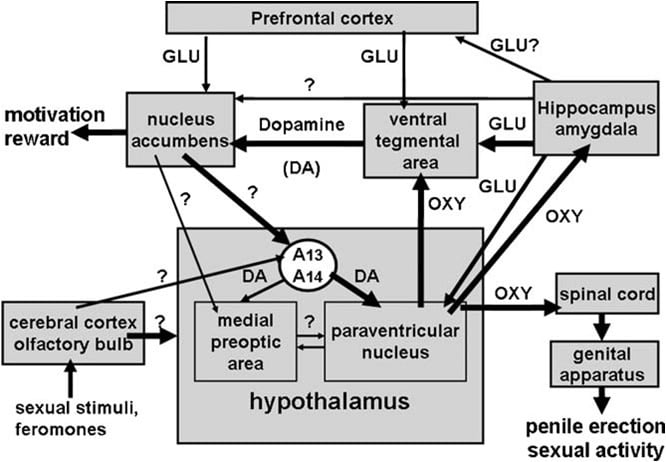
Diese Übersicht fasst veröffentlichte und unveröffentlichte Ergebnisse aktueller Studien zusammen, die zeigen, dass Oxytocin induziert die Peniserektion nicht nur, wenn es in den paraventrikulären Kern des Hypothalamus injiziert wird, sondern auch in anderen extra-hypothalamischen Gehirnbereichen, wie dem ventralen Tegmentum (Melis et al., 2007, 2009a; Succu et al., 2008), tDas ventrale Subiculum des Hippocampus und der hintere Nucleus der Amygdala (Melis et al., 2009b, 2010), die wichtige Bestandteile des limbischen Systems sind und von denen angenommen wird, dass sie eine Schlüsselrolle bei Motivations- und Belohnungsprozessen spielen. Diese Studien zeigen, dass Oxytocin an neuralen Schaltkreisen beteiligt ist, zu denen auch andere Neurotransmitter wie Dopamin und Glutaminsäure und andere Gehirnareale als der paraventrikuläre Kern gehören, z. B. der ventrale Tegmentum, der Nucleus accumbens, der Hippocampus und Bereiche identifiziert. Diese Schaltkreise vermitteln wahrscheinlich eine Wechselwirkung zwischen dem mesolimbischen und dem incerto-hypothalamischen dopaminergen System und spielen nicht nur in der konsumatorischen Phase des männlichen Sexualverhaltens (z. B. Erektion und Kopulation des Penis) eine Rolle, sondern auch in sexueller Motivation und Sexualität Erregung, wodurch ein neurales Substrat zur Erklärung der motivierenden und lohnenden Eigenschaften der sexuellen Aktivität bereitgestellt wird.
2. Oxytocin beeinflusst die Erektion des Penis, indem es in verschiedenen Gehirnbereichen wirkt
2.1. Der paraventrikuläre Kern des Hypothalamus
Wie oben erwähnt, wurde der paraventrikuläre Kern des Hypothalamus bald als der für den pro-erektilen Effekt von Oxytocin am empfindlichsten empfundene Hirnbereich identifiziert. Bei einer einseitigen Injektion in diesen Zellkern wurde Oxytocin in Dosen gefunden, die so niedrig wie 3 ng (3 pmol) waren (Melis et al., 1986). Struktur-Aktivitäts-Beziehung Studien zeigten, dass Oxytocin-induzierte Erektion des Penis wurde durch uterine Oxytocin-Rezeptoren, gekoppelt an einen Ca2 + -Einstrom in die Zellkörper von Oxytocinergen Neuronen vermittelt projiziert in extra-hypothalamische Hirnareale und die Aktivierung von Stickstoffmonoxid-Synthase. Stickoxid wiederum als intrazellulärer Botenstoff mit einem bisher unbekannten Mechanismus (ohne Guanylatcyclase) führt zur Aktivierung von Oxytocinergen-Neuronen, die in das Rückenmark und in extra-hypothalamische Hirnareale projizieren und eine Erektion des Penis induzieren (Abb. 1) (vgl unten und Argiolas und Melis, 1995, 2004, 2005 und Referenzen darin). Die Fähigkeit von Oxytocin, seine eigenen Neuronen zu aktivieren
Abb. 1. (MISSING) Schematische Darstellung von oxytocinergen Neuronen, die aus dem paraventrikulären Kern des Hypothalamus stammen und in extra-hypothalamische Hirnareale wie das Rückenmark, die VTA, den Hippocampus, die Amygdala, etc. projizieren. Die Aktivierung dieser Neuronen durch Dopamin, exzitatorische Aminosäuren, Oxytocin selbst, Hexarelin-Analogpeptide und VGF-abgeleitete Peptide führen zu einer Erektion des Penis, die durch Stimulation von GABAergen, Opioid- und Cannabinoid-CB1-Rezeptoren reduziert und / oder aufgehoben werden kann. Die Aktivierung von oxytocinergen Neuronen ist sekundär zu der Aktivierung von Stickstoffmonoxid-Synthase, die in diesen Neuronen vorhanden ist. In der Tat aktiviert endogenes Stickstoffmonoxid, das durch die Stimulierung von Dopamin, exzitatorischer Aminosäure oder Oxytocinrezeptoren oder exogenem Stickoxid gebildet wird, das von Stickstoffmonoxiddonoren direkt in den paraventrikulären Kern abgegeben wird, oxytocinerge Neuronen durch einen noch nicht identifizierten Mechanismus, der offensichtlich nicht mit dem Ovar assoziiert ist Stimulation der Guanylatcyclase. Dies wiederum verursacht die Freisetzung von Oxytocin im Rückenmark und in extra-hypothalamischen Hirnarealen. Einige Details zu den Mechanismen, durch die Oxytocin die Erektion des Penis induziert, wenn es in diesen Bereichen freigesetzt wird, z. B. die VTA, das ventrale Subiculum und die Amygdala, sind in den jeweiligen Hirnbereichsabschnitten beschrieben. Hier wirkt Oxytocin auf seine eigenen Rezeptoren und erhöht die NO-Produktion, was zu einer Peniserektion führt, wie sie im PVN gefunden wird. Im Gegensatz zum PVN aktiviert das kaudale VTA NO jedoch die Guanylatcyclase. Dies führt zu einer Erhöhung der cGMP-Konzentration, was zur Aktivierung von mesolimbischen dopaminergen Neuronen und zur Erektion des Penis führt. Im VS aktiviert NO glutamaterge Neuronen, die in extrahippocampale Bereiche, einschließlich der VTA, projizieren. Glutaminsäure in der VTA aktiviert wiederum mesolimbische dopaminerge Neuronen, wie sie bei Oxytocin gefunden werden. Mechanismen, die den oben beschriebenen ähnlich sind, funktionieren wahrscheinlich auch, wenn die Erektion des Penis in physiologischen Kontexten auftritt, nämlich wenn männliche Ratten in Anwesenheit einer unzugänglichen empfänglichen Frau (zB kontaktlose Erektionen) oder während der Kopulation platziert werden.
im paraventrikulären Kern wurde durch Studien unterstützt, die zeigen, dass: (1) Oxytocin-Rezeptoren sind in diesem hypothalamischen Kern vorhanden (Freund-Mercier et al., 1987; Freund-Mercier und Stoeckel, 1995); (2) Oxytocin erleichtert seine eigene Freisetzung in vitro und in vivo (Freund-Mercier und Richard, 1981, 1984; Moos et al., 1984); und (3) Oxytocin regt seine eigenen Neuronen an, indem es im paraventrikulären Kern agiert (Yamashita et al., 1987). Oxytocinerge Synapsen, die auf die Zellkörper von magnozellulären oxytocinergen Neuronen auftreffen, wurden auch im paraventrikulären und supraoptischen Kern des Hypothalamus identifiziert (Theodosis, 1985). Schließlich zerstört die Zerstörung von zentralen oxytocinergen Neuronen durch elektrolytische oder chemische exzitotoxische Läsionen des paraventrikulären Kerns, die den Oxytocingehalt über das zentrale Nervensystem und das Rückenmark vollständig abbauen, nicht nur die pro-erektile Wirkung von Oxytocin, sondern auch die durch Medikamente induzierte Peniserektion und kontaktlose Erektionen (siehe unten und Argiolas et al., 1987a, b; Liu et al., 1997 und Referenzen darin). Ähnliche Ergebnisse wie bei Läsionen des paraventrikulären Nucleus finden sich bei potenten und selektiven Oxytocin-Rezeptor-Antagonisten. Tatsächlich verhinderten diese Verbindungen, die in Nanogramm-Mengen in den paraventrikulären Kern injiziert wurden, vollständig die Oxytocin-induzierte Erektion des Penis, während sie in die Seitenventrikel nicht nur die durch Oxytocin selbst induzierten Peniserektionen, sondern auch die medikamenteninduzierte Erektion des Penis verhinderten (siehe Abschnitt 3 unten) und Argiolas und Melis, 1995, 2004, 2005 und darin enthaltene Referenzen) und kontaktfreie Erektionen (Melis et al., 1999a) und waren darüber hinaus äußerst wirksam bei der Beeinträchtigung des kopulatorischen Verhaltens von sexuell potenten männlichen Ratten (Argiolas et al., 1988). Außerdem erhöht die sexuelle Interaktion FOS, das Genprodukt des unmittelbar frühen Gens c-fos in paraventrikulären oxytocinergen Neuronen, die in das Rückenmark projiziert werden und an der Kontrolle der Erektion des Penis beteiligt sind (siehe Witt und Insel, 1994 und Referenzen darin). Endlich, sexuelle Impotenz (z. B. die Unfähigkeit einer erwachsenen männlichen Ratte, mit einer Östrogen-Progesteron-stimulierten empfänglichen Frau zu kopulieren) hwie auch bei der männlichen Ratte mit geringen Mengen an Oxytocin-mRNA und an Stickstoffoxid-Synthase im paraventrikulären Kern des Hypothalamus assoziiert (Benelli et al., 1995; Arletti et al., 1997) (für eine ausführliche Übersicht dieser Studien siehe Argiolas, 1999; Argiolas und Melis, 2004, 2005).
2.2. Der ventrale Tegmentum
Das ventrale Tegmentum wurde erst kürzlich als Hirnareal entdeckt, in dem Oxytocin die Erektion des Penis induziert. Dieser Bereich enthält oxytocinerge Nervenenden, die aus dem paraventrikulären Kern und Oxytocin-Rezeptoren stammen (Freund-Mercier et al., 1987; Vaccari et al., 1998). Genauer gesagt wurde Oxytocin als fähig befunden, iHerabsetzung der Erektion des Penis, wenn sie einseitig in den kaudalen, nicht aber in den ventralen Bereich des ventralen Trostraums injiziert wird in einer dosisabhängigen Weise (Melis et al., 2007). Die aktiven Dosen waren höher als diejenigen, die bei Injektion in den paraventrikulären Kern erforderlich waren, und ähnelten denen, die eine Erektion des Penis induzierten, wenn sie in das ventrale Subiculum des Hippocampus oder in den posteromedialen kortikalen Kern der Amygdala injiziert wurden (siehe unten). Offensichtlich wird der pro-erektile Effekt durch die Aktivierung von mesolimbischen dopaminergen Neuronen, die in die Hülle des Nucleus accumbens projiziert werden, aktiviert, was wiederum noch unbekannte Nervenbahnen aktiviert, die zu den incerto-hypothalamischen dopaminergen Neuronen projizieren, die auf paraventrikuläre oxytocinerge Neuronen einwirken und die Peniserektion vermitteln (Melis et al., 2007, 2009a).
In Bezug auf den Mechanismus, durch den Oxytocin die dopaminerge Neurotransmission im ventralen Tegmentalbereich aktiviert, deuten die verfügbaren Daten darauf hin Oxytocin stimuliert Oxytocinerg-Rezeptoren, die sich in den Zellkörpern von mesolimbischen dopaminergen Neuronen befinden. Dies erhöht den Ca2 + -Einstrom innerhalb der Zellkörper von dopaminergen Neuronen, wodurch Stickstoffmonoxid-Synthase aktiviert wird (Succu et al., 2008). Im Gegensatz zum paraventrikulären Kern (siehe Abschnitt 3 unten) aktiviert Stickstoffmonoxid wiederum die Guanylatcyclase, wodurch die Konzentration von zyklischem GMP erhöht wird. In Übereinstimmung mit diesem Mechanismus wird entweder d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin, ein potenter Oxytocinantagonist, oder S-Methyl-thio-1-citrullin, ein potenter Inhibitor der neuronalen Stickstoffmonoxid-Synthase, in die Zelle injiziert kaudaler ventraler Tegmentbereich vor Oxytocin, Aufhebung der Erektion des Penis und Erhöhung der extrazellulären Dopaminkonzentration in der Schale des Nucleus accumbens, induziert durch Oxytocin. Darüber hinaus induziert 8-Brom-cyclisches GMP, ein aktives Phosphodiesterase-resistentes cyclisches GMP-Analogon, die Erektion des Penis, wenn es in das kaudale ventrale Tegmentum injiziert wird und erhöht die extrazelluläre Dopaminkonzentration in der Hülle des Nucleus accumbens, wie es bei Oxytocin gefunden wird das kaudale ventrale Tegmentum (Succu et al., 2008; Melis et al., 2009a) (siehe auch Abb. 2).
Immer in Übereinstimmung mit diesem Mechanismus reduziert Haloperidol, ein potenter Dopamin D2-Rezeptorantagonist, der in die Schale des Nucleus accumbens injiziert wird, die Erektion des Penis, induziert durch Oxytocin, injiziert in den ventralen Tegmentum (Melis et al., 2007). Der obige Mechanismus wird auch durch Doppelimmunfluoreszenzstudien unterstützt, die zeigen, dass Oxytocinfasern auf die Zellkörper von dopaminergen Neuronen im kaudalen ventralen Tegmentum auftreffen, die zuvor mit dem in die Schale des Nucleus accumbens injizierten retrograden Tracer Fluorogold markiert wurden ( Melis et al., 2007; Succu et al., 2008). Die Aktivierung dieser dopaminergen Neuronen und von Dopaminrezeptoren im Nucleus accumbens führt wiederum zur Aktivierung noch zu identifizierender Nervenbahnen, die die dopaminergen Neuronen des Drüsenhypothalamus stimulieren, um Dopamin im paraventrikulären Kern freizusetzen, wodurch die in die Lunge projizierten Oxytocinergen aktiviert werden Rückenmark und vermittelnde Penis Erektion (siehe oben und Melis et al., 2007; Succu et al., 2007, 2008). In der Tat injizierte Oxytocin in das kaudale ventrale Tegmentum in einer Dosis, die eine Erektion des Penis bewirkte, eine erhöhte extrazelluläre Dopaminkonzentration im Dialysat nicht nur aus dem Nucleus accumbens, sondern auch aus dem paraventrikulären Nucleus (Succu et al., 2007).
2.3. Der Hippocampus
Das CA1-Feld des Hippocampus war das andere Gehirngebiet reich an Oxytocinergic-Fasern und Rezeptoren, die durch die früheren Studien identifiziert wurden, bei denen die Injektion von Oxytocin eine Erektion des Penis induzierte (siehe Bujis, 1978; Sofroniew, 1983). Im Gegensatz zum Nucleus paraventricularis konnte Oxytocin jedoch nur bei bilateraler Injektion und höherer Dosis als im Nucleus paraventricularis (Melis et al., 1986; Chen et al., 1992) als injiziert injiziert werden. Injektionen von Oxytocin in das Subiculum wurden in diesen früheren Studien als inaktiv festgestellt. Neuere und sorgfältigere Mikroinjektionsstudien führen jedoch zur Identifizierung von a Region des ventralen Subiculum bei der die Injektion von Oxytocin dosisabhängig die Erektion des Penis induzieren konnte (Melis et al., 2009b). Der pro-erektile Effekt von Oxytocin, das in diesen Gehirnbereich injiziert wurde, wurde in Dosen beobachtet, die denen ähnlich waren, die im ventralen Tegmentalbereich nach einseitiger Injektion (Melis et al., 2007) im paraventrikulären Kern gefunden wurden. Offensichtlich induziert Oxytocin, das in das ventrale Subiculum injiziert wird, eine Erektion des Penis durch Aktivierung von Oxytocinergenrezeptoren in Neuronen, die Stickstoffmonoxid-Synthase enthalten, was eine Zunahme der Stickstoffoxidproduktion verursacht. Stickstoffmonoxid aktiviert wiederum als interzellulärer Botenstoff die Glutaminsäure-Neurotransmission, die zur Erektion des Penis führt, möglicherweise durch neurale (glutamaterge) efferente Projektionen aus dem ventralen Subiculum zu extrahippocampalen Hirnarealen, die die Aktivität von mesolimbischen dopaminergen Neuronen modulieren (z. B. das ventrale Tegmentum, der präfrontale Cortex, der paraventrikuläre Nucleus) (siehe unten und Melis, 2007, 2009b; Succu et al., 2008).
Dieser Wirkungsmechanismus wird durch intrazerebrale Mikrodialyseexperimente unterstützt, die zeigen, dass Oxytocin, das in Dosen injiziert wird, die die Peniserektion induzieren, die Stickstoffoxidproduktion und extrazelluläre Glutaminsäurekonzentration im Dialysat aus dem ventralen Subiculum erhöht (Melis et al. , 2010) und extrazellulärem Dopamin im Nucleus accumbens (Melis et al., 2007). Diese Antworten wurden nicht nur durch den Oxytocin-Rezeptor-Antagonisten d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin antagonisiert, sondern auch durch den neuronalen Stickoxid-Synthase-Inhibitor S-Methyl-Thio-Lucitrin und durch den Stickoxid-Scavenger Hämoglobin gegeben in das ventrale Subiculum wenige Minuten vor Oxytocin (Melis et al., 2010).
Darüber hinaus induziert die Aktivierung der glutamatergen Neurotransmission durch NMDA, die in das ventrale Subiculum injiziert wird, in Übereinstimmung mit diesem Wirkungsmechanismus die Peniserektion (Melis et al., 2010). Der Phänotyp von efferenten Projektionen aus dem ventralen Subiculum, die die Aktivierung von mesolimbischen dopaminergen Neuronen und die Zunahme von extrazellulärem Dopamin im Nucleus accumbens verursachen, ist derzeit unbekannt. Da die durch das in das ventrale Subiculum injizierte Oxytocin induzierte Erektion des Penis gleichzeitig mit einem Anstieg der extrazellulären Glutaminsäure im Dialysat aus dem ventralen Tegmentum, nicht jedoch aus dem Nucleus accumbens auftritt und durch (+) MK-801 antagonisiert wird, ein potenter, nicht kompetitiver Antagonist von exzitatorischen Aminosäurerezeptoren des NMDA-Subtyps (Woodruff et al., 1987), der in den ventralen Tegmentalbereich injiziert wurde, jedoch nicht in den Nucleus accumbens (siehe Abb. 2 und Melis et al., 2009b) , Es ist wahrscheinlich, dass diese Projektionen zur Aktivierung der glutamatergen Neurotransmission im ventralen Tegmentum führen, was wiederum mesolimbische dopaminerge Neuronen aktiviert, die in den Nucleus accumbens projizieren. Ob die erhöhte Konzentration an Glutaminsäure im ventralen Tegmentum nach Oxytocininjektion in das ventrale Subiculum von Neuronen aus dem Subiculum oder aus anderen Hirnarealen (zB dem präfrontalen Kortex) freigesetzt wird, ist derzeit nicht bekannt. Dennoch, dies bewirkt die Aktivierung von mesolimbischen dopaminergen Neuronen und eine erhöhte Freisetzung von Dopamin im Nucleus accumbens. Hier führt die Aktivierung von Dopaminrezeptoren zur Aktivierung von dopaminergen Neuronen im Inerto-Hypothalamus, wodurch Dopamin im Nucleus paraventricularis freigesetzt wird, wodurch oxytocinerge Neuronen aktiviert werden, die zum Rückenmark vorstehen und die Peniserektion vermitteln (siehe oben und Melis et al., 2007, 2009a; Succu et al., 2008).
2.4. Die Amygdala
Die Amygdala ist eine weitere Gehirnregion, die reich an Oxytocin-Fasern und -Rezeptoren ist (siehe Freund-Mercier et al., 1987; Vaccari et al., 1998; Uhl-Bronner et al., 2005). Es wird angenommen, dass Oxytocin an verschiedenen Funktionen beteiligt ist, von Anxiolyse, sozialem Gedächtnis und Kognition, sozial verstärktem Lernen, emotionaler Empathie, emotionaler Gesichtsverarbeitung und Angst beim Menschen bis hin zu erektiler Funktion und sexuellem Verhalten (siehe Kondo et al., 1998; Dominguez et Al., 2001; Ebner et al., 2005; Huber et al., 2005; Domes et al., 2007; Petrovic et al., 2008; Lee et al., 2009; Donaldson und Young, 2009; Hurlemann et al. , 2010). Die Fähigkeit von Oxytocin, bei männlichen Ratten eine Peniserektion zu induzieren, wenn sie im posteromedialen kortikalen Kern der Amygdala induziert wird, wurde jedoch erst kürzlich entdeckt (Melis et al., 2009b). Diese Reaktion erfolgte gleichzeitig mit einer Zunahme der extrazellulären Dopaminkonzentration in dem Dialysat, das aus der Schale des Nucleus accumbens erhalten wurde, wie es nach Oxytocininjektion in das ventrale Subiculum gefunden wurde (Melis et al., 2009b). Der Mechanismus, durch den Oxytocin in den posteromedialen kortikalen Kern der Amygdala injiziert wird, ist im Moment unbekannt. Die verfügbaren Daten zeigen, dass sowohl die Peniserektion als auch der Anstieg der extrazellulären Dopaminkonzentration im Dialysat aus dem Nucleus accumbens durch die Aktivierung von Oxytocinergenrezeptoren vermittelt werden, da beide Reaktionen durch den Oxytocinrezeptorantagonisten d (CH2) 5Tyr ( Me) 2-Orn8-Vasotocin, das wenige Minuten vor Oxytocin in den Amygdala-Kern injiziert wurde (Melis et al., 2009b).
Welcher Mechanismus auch immer Oxytocin im posteromedialen kortikalen Kern der Amygdala aktiviert, die durch das Peptid induzierte sexuelle Reaktion wird durch die Blockade aller dopaminergen Rezeptoren mit cis-Flupenthixol, das in die Hülle des Nucleus accumbens injiziert wird, und durch die Blockade von NMDA-Rezeptoren mit ( +) MK-801 wurde in das ventrale Tegmentum injiziert, jedoch nicht in den Nucleus accumbens, wie es für die Erektion des Penis gefunden wurde, induziert durch Oxytocin, injiziert in das ventrale Subiculum (Melis et al., 2009b). Dies legt nahe, dass Oxytocin, das in den posteromedialen Kern der Amygdala injiziert wird, die Glutaminsäure-Neurotransmission im ventralen Tegmentalbereich aktiviert. Dies wiederum verursacht die Aktivierung von mesolimbischen dopaminergen Neuronen, was zu einer Erektion des Penis führt. In Anbetracht von Studien, die Nervenbahnen zeigen, die diesen Kern der Amygdala mit dem ventralen Subiculum verbinden (Canteras et al., 1995; French und Totterdell, 2003), werfen diese Befunde die Möglichkeit auf, dass eine Wechselwirkung zwischen diesen beiden Hirnregionen bestehen kann Wege von der Amygdala entweder zum Nucleus accumbens oder zum ventralen Tegmentum wurden beschrieben (Kelley und Domesick, 1982; Witter, 2006).
2.5. Das Rückenmark
Das Rückenmark ist ein weiterer Bereich des zentralen Nervensystems, der oxytocinerge Fasern und Rezeptoren enthält (Freund-Mercier et al., 1987; Uhl-Bronner et al., 2005), in denen Oxytocin die Erektion des Penis induziert (Tang et al., 1998 Veronneau-Longueville et al., 1999, Giuliano und Rampin, 2000, Giuliano et al., 2001). Wie oben erwähnt, stammen diese oxytocinergen Fasern aus dem paraventrikulären Kern des Hypothalamus und tragen zu absteigenden Wegen bei, die autonome spinale Nervenzellen steuern, die die Erektion des Penis bewirken. Tatsächlich stellen diese Fasern synaptische Kontakte in den dorsalen präganglionären sympathischen und parasympathischen Zellsäulen im thorako-lumbalen und lumbo-sakralen Trakt mit Spinalneuronen dar, die die Schwellkörper des Schwellkörpers innervieren (Marson und McKenna, 1996; Giuliano und Rampin, 2000; Giuliano et al. , 2001). Diese synaptischen Kontakte wurden durch Markierung von Rückenmarksneuronen, die aus dem Penis stammten und das Erreichen des Rückenmarks mit spezifischen retrograden Tracern, die in Schwellkörper injiziert wurden, in Kombination mit Doppelimmunfluoreszenz- und konfokalen lasermikroskopischen Studien demonstriert (Tang et al., 1998; Veronneau-Longueville et al., 1999). In Übereinstimmung mit diesen Studien stieg bei anästhesierten männlichen Ratten die intrathekale Injektion von kumulativen Dosen von Oxytocin im lumbo-sacralen, aber nicht im thorako-lumbalen Bereich, der intrakavernöse Druckanstieg in dosisabhängiger Weise an. Diese Effekte wurden durch die Blockade des oxytocinergen Rezeptors mit d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin und durch einen Teil der Beckennerven (Giuliano und Rampin, 2000; Giuliano et al., 2001) aufgehoben. Diese Ergebnisse zeigen, dass Oxytocin, das am lumbosakralen Rückenmark wirkt, den intrakavernösen Druck erhöht, und legt nahe, dass Oxytocin, das während der physiologischen Aktivierung des paraventrikulären Kerns freigesetzt wird, ein potenter Aktivator von spinalen pro-erektilen Neuronen ist, die in die Schwellkorpora projizieren. Interessanterweise erhalten diese pro-erektilen spinalen Neuronen, auf die Oxytocin seine pro-erektile Wirkung ausübt, synaptische Kontakte von serotoninergen Neuronen, die aus dem Nucleus paragigantocellularis der retikulären Form der Medulla oblongata stammen (Marson und McKenna, 1992; Tang et al ., 1998). Die Zerstörung dieser serotoninergen Neuronen erleichtert die Ejakulation und Penisreflexe bei männlichen Ratten (Marson und McKenna, 1992; Yells et al., 1992). Da Arzneimittel, die 5HT2C-Rezeptoren stimulieren, die Erektion des Penis erleichtern, wenn sie intracerebroventrikulär, aber nicht in den paraventrikulären Kern verabreicht werden, und Medikamente, die 5HT2C-Rezeptoren blockieren, reduzieren auch Dopaminagonisten und Oxytocin-induzierte Erektion des Penis, während Dopaminantagonisten die durch 5HT2C-Agonisten induzierte Erektion des Penis nicht reduzieren. (siehe Stancampiano et al., 1994 und Referenzen darin), wurde auch vorgeschlagen, dass Oxytocin die Wirkung von erektilen 5HT2C-Rezeptoren auf Höhe des lumbosakralen Rückenmarks erleichtert (Stancampiano et al., 1994). Alternativ könnte Oxytocin die Aktivität von spinalen absteigenden serotoninergen Neuronen beeinflussen, indem es direkt im Nucleus paragigantocellularis wirkt, wo diese Neuronen entstehen (siehe Stancampiano et al., 1994).
3. Wechselwirkungen zwischen Oxytocin, Dopamin und Glutaminsäure im Zentralnervensystem und Erektion des Penis
Wie in Abschnitt 1 erwähnt, stammen alle im Zentralnervensystem vorhandenen Oxytocinergen im Nucleus paraventricularis und den umgebenden Strukturen. Die Aktivität dieser Neuronen wird von verschiedenen Neurotransmittern und / oder Neuropeptiden gesteuert. Zu den am intensivsten untersuchten paraventrikulären Spiegeln gehören Dopamin, Glutaminsäure, Gamma-Aminobuttersäure (GABA), Stickstoffmonoxid, Endocannabinoide, Opioidpeptide, Wachstumshormon freisetzende Peptide, VGF-verwandte Peptide und Oxytocin selbst. Dopamin, Glutaminsäure, Wachstumshormon freisetzende Peptide, VGF-abgeleitete Peptide und Oxytocin sind stimulierend, z. B. erleichtern diese Verbindungen und ihre Agonisten die Peniserektion, wenn sie in den paraventrikulären Kern injiziert werden, während GABA, Opioidpeptide und Endocannabinoide hemmend sind, zB diese Verbindungen oder ihre Agonisten hemmen die Erektion des Penis (siehe Meisel und Sachs, 1994; Witt und Insel, 1994; Argiolas und Melis, 1995, 2004, 2005; Giuliano und Rampin, 2000, 2004; McKenna, 2000; Andersson, 2001; Hull et al., 2002).
Mehrere Linien von experimenteller Evidenz legen nahe, dass diese oxytocinergen Neuronen und die obigen Neurotransmitter und Neuropeptide an der Kontrolle der erektilen Funktion und des Sexualverhaltens in verschiedenen physiologischen Kontexten beteiligt sind. Darüber hinaus kann Oxytocin, das in extra-hypothalamischen Gehirnbereichen, wie dem ventralen Tegmentum, dem Hippocampus und seinen Regionen, der Amygdala und dem Rückenmark freigesetzt wird, die Aktivität jener Neuronen beeinflussen, auf die oxytocinerge Synapsen auftreffen. Zur Zeit sind die einzigen mit der Sicherheit bestimmten Nervenzellen, die für die Erektion des Penis wichtig sind, die Zellkörper der mesolimbischen dopaminergen Neurone des kaudalen ventralen Tegmentum, die in die Schale des Nucleus accumbens projizieren (Melis et al., 2007) (Succu et al., 2008), und die pro-erektilen spinalen Neuronen, die vom lumbosakralen Trakt zu den Schwellkorpora projiziert werden (siehe Giuliano und Rampin, 2000; Giuliano et al., 2001) (siehe auch Abschnitte 2.2 und 2.5). . Obwohl in dem ventralen Subiculum, der Amygdala und dem Rückenmark, Bereiche, die alle für die Erektion des Penis wichtig sind (siehe oben), in der Tat auch oxytocinerge Synapsen und Rezeptoren identifiziert wurden, ist in diesen Bereichen die Art des Neurotransmitters / der Neuronen vorhanden welche oxytocinergen Nervenenden auftreffen, sind noch unbekannt.
Dieser Abschnitt des Überblicks fasst die neuere Literatur zu den Mechanismen zusammen, die dem pro-erektilen Effekt von Oxytocin zugrunde liegen, das in das kaudale ventrale Tegmentum, das ventrale Subiculum des Hippocampus und in das Rückenmark injiziert wird. Besonderes Augenmerk wird auf die Wechselwirkung des Peptids mit Dopamin und Glutaminsäure in diesen Bereichen und auf die Rolle, die diese Wechselwirkung bei der zentralen Kontrolle der erektilen Funktion spielen kann, gelegt. Eine kurze Zusammenfassung der Wirkungen von Dopamin und Glutaminsäure auf oxytocinerge Neurone im Nucleus paraventricularis, die ebenfalls eine Schlüsselrolle bei der Erektionsfunktion spielen, wird zuerst gegeben, um den Leser auf den frühen Stand der Forschung auf diesem Gebiet aufmerksam zu machen Diese Studien wurden bereits ausführlich untersucht (siehe Argiolas und Melis, 1995, 2004, 2005; Melis und Argiolas, 2003). Auch in diesem Fall wird besonderes Augenmerk auf die neuesten Ergebnisse gelegt, die eine wichtige Rolle sowohl für eine Dopamin-Oxytocin-Bindung als auch eine Glutaminsäure-Oxytocin-Bindung nicht nur bei der sexuellen Leistung (Peniserektion und -kopulation), sondern auch bei sexuellem zeigen Erregung und sexuelle Motivation.
3.1. Dopamin-Oxytocin-Interaktion im Nucleus paraventricularis
Das Fähigkeit von Dopamin-Agonisten, die Erektion des Penis durch Aktivierung von zentralen, oxytocinergen Neuronen zu induzieren wurde unmittelbar nach der Entdeckung vorgeschlagen, dass Apomorphin eine Peniserektion induziert, wenn es in den paraventrikulären Kern (Melis et al., 1987) injiziert wird, wenn der Oxytocin-Rezeptor-Antagonist d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin intracerebroventrikulär (icv) injiziert wurde in der Lage, die Erektion des Penis fast vollständig zu reduzieren, die nicht nur durch Oxytocin gegeben wird, sondern auch durch subkutan verabreichtes Apomorphin (Argiolas et al., 1987b). Diese Ergebnisse wurden von denen anderer Studien gefolgt, die ähnliche Ergebnisse zeigten, wenn d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin icv verabreicht wurde und Apomorphin direkt in den paraventrikulären Kern verabreicht wurde (Melis et al., 1989b), lSie deuten darauf hin, dass Dopaminagonisten eine Erektion des Penis induzieren, indem sie paraventrikuläre, oxytocinerge Neuronen aktivieren, die in extra-hypothalamische Hirnareale und insbesondere in das Rückenmark projizieren (Siehe Argiolas und Melis, 1995, 2004, 2005). Im Einklang mit dieser Hypothese wurde kürzlich bei anästhesierten Ratten eine Blockade von lumbo-sakralen oxytocinergen Rezeptoren durch einen nicht-peptidischen Oxytocin-Rezeptor-Antagonisten gefunden, die apomorphininduzierte Erhöhungen des intrakavernösen Drucks, induziert durch den Dopaminagonisten Apomorphin, abschaffen kann, was einen Beweis für a paraventrikulo-spinaler oxytocinergischer Weg, der an der Erektion des Penis beteiligt ist (Baskerville et al., 2009).
Studien für die Die Identifizierung des Dopaminrezeptors, der für die Induktion der Peniserektion verantwortlich ist, offenbarte, dass auch im paraventrikulären Nucleus Dopaminrezeptoragonisten eine Erektion des Penis induzieren, indem sie auf Dopaminrezeptoren der D2-Familie einwirkenwie mit Dopamin-Rezeptor-Agonisten gefunden, die systemisch verabreicht werden (siehe Melis et al., 1987; Eaton et al., 1991; Melis und Argiolas, 1995a). Dementsprechend wurde gefunden, dass Apomorphin, ein stark gemischter D1 / D2-Rezeptor-Agonist, und Quinpirol, ein potenter selektiver D2-Rezeptor-Agonist, aber nicht SKF 38393, ein selektiver D1-Rezeptor-Agonist, in diesen hypothalamischen Kern injiziert werden können und die durch diese D2-Rezeptor-Agonisten induzierte sexuelle Reaktion wurde durch D2-Rezeptor-Antagonisten, wie Haloperidol und 1-Sulpirid, abgeschafft, jedoch nicht durch SCH 23390, einen selektiven D1-Rezeptor-Antagonisten (Melis et al., 1987). Die Fähigkeit von Apomorphin, eine Peniserektion zu induzieren, wenn es in den paraventrikulären Kern injiziert wurde, wurde durch telemetrische Studien bestätigt, die zeigen, dass der in den paraventrikulären Kern eingebrachte Dopaminagonist den intrakavernösen Druck bei wachen männlichen Ratten erhöhen kann, ohne den systemischen Blutdruck zu verändern (Chen et al. , 1999; Giuliano und Allard, 2001), wie nach systemischer Injektion gefunden (Bernabè et al., 1999). Diese Studien auch bestätigten eine Hauptrolle von D2-Rezeptoren, da D1-Rezeptor-Agonisten gewöhnlich nicht in der Lage waren, den intrakavernösen Druck zu erhöhen, wenn sie in den paraventrikulären Kern injiziert wurden (Chen et al., 1999).
Mehrere Linien von experimentellem Beweismaterial waren dann verfügbar, was nahelegt, dass paraventrikuläre D2-Rezeptoren, deren Stimulation die Peniserektion induziert, sich auf den Zellkörpern von oxytocinergen Neuronen befinden. Erstens enthält der paraventrikuläre Nucleus dopaminerge Nervenenden, die zu den so genannten incertohypothalamischen dopaminergen Neuronen gehören. Die Zellkörper dieser Neuronen befinden sich in der A13- und A14-Gruppe von Dahlstrom und Fuxe (1964), verzweigen sich stark und innervieren mehrere hypothalamische Strukturen, einschließlich paraventrikulärer oxytocinergen Neuronen, die in die Neurohypophyse und / oder in extra-hypothalamische Hirnareale projizieren (Buijs et al., 1984; Lindvall et al., 1984).
Die Beteiligung dieser dopaminergen Neurone auf paraventrikulärer Ebene bei der Kontrolle von Erektion und Kopulation des Penis wird durch Mikrodialyse-Studien unterstützt, die zeigen, dass die Konzentrationen von extrazellulärem Dopamin und 3,4-Dihydroxyphenylessigsäure (DOPAC), seinem Hauptmetaboliten, im Dialysat von der paraventrikuläre Kern von sexuell wirksamen männlichen Ratten, die kontaktfreie Erektionen zeigen, wenn sie in Gegenwart eines unzugänglichen ovarektomierten Östrogen + Progesteron-vorbehandelten rezeptiven Weibchens (Melis et al., 2003) gesetzt werden.
Der Anstieg der Dopamin - und DOPAC - Konzentrationen war sogar noch höher, wenn die Paarung mit dem empfänglichen Weibchen erlaubt war (Melis et al., 2003), wie im medialen präoptischen Bereich (Hull et al., 1995) und im Nucleus accumbens (Pfaus und Everitt, 1995). Zweitens zeigen mehrere Studien, dass die durch die Stimulation von paraventrikulären D2-Rezeptoren induzierte Erektion des Penis durch Oxytocin, das in diesen Bereichen freigesetzt wird, vermittelt wird. Dementsprechend wurde gefunden, dass Apomorphin, das in Dosen verabreicht wurde, die eine Peniserektion induzieren, die Oxytocinkonzentration nicht nur im Plasma von Ratten und Affen (Melis et al., 1989a; Cameron et al., 1992), sondern auch im extra-hypothalamischen Gehirn erhöhen konnte Bereiche wie der Hippocampus (Melis et al., 1990). In Übereinstimmung mit diesen Ergebnissen wurde kürzlich gezeigt, dass Apomorphin, das in den paraventrikulären Kern in einer Dosis injiziert wurde, die die Erektion des Penis induziert, in der Lage ist, auch die extrazelluläre Dopaminkonzentration im Nucleus accumbens zu erhöhen, eine Wirkung, die durch den Oxytocin-Rezeptor-Antagonisten d reduziert wird (CH2). 5Tyr (Me) 2-Orn8-Vasotocin in den ventralen Tegmentum injiziert (Succu et al., 2007; Melis et al., 2009a) (siehe auch Abschnitt 4). Drittens, bilaterale elektrolytische Läsionen des paraventrikulären Kerns, die Oxytocin aus extra-hypothalamischen Hirnarealen fast eliminieren (Hawthorn et al., 1985), Apomorphin-induzierte Erektion des Penis (Argiolas et al., 1987a) und selektive Oxytocin-Rezeptor-Antagonisten in die Seitenventrikel, aber nicht in den Nucleus paraventricularis gegeben, verringern dosisabhängig apomorphininduzierte Erektion des Penis mit einer Potenz parallel zu der dieser Verbindungen in blockierenden Oxytocinrezeptoren (Melis et al., 1989b). Oxytocin-Rezeptor-Antagonisten sind auch extrem wirksam bei der Verringerung der Erleichterung des männlichen Sexualverhaltens, das nicht nur durch Oxytocin, sondern auch durch Apomorphin (Argiolas et al., 1988, 1989) induziert wird.
Bezüglich des Mechanismus, durch den D2-Rezeptoren durch Dopamin- oder Dopaminrezeptor-Agonisten aktiviert werden, erhöhen sich die Aktivität von Oxytocinergen Neuronen, wodurch Oxytocin in extrahypothalamischen Hirnarealen und im Rückenmark freigesetzt wird, zahlreiche experimentelle Datenunterstützen die Hypothese, dass die Stimulation von D2-Rezeptoren die Konzentration von intrazellulären Ca2 + -Ionen in den Zellkörpern von Oxytocinergen Neuronen erhöht, was zur Aktivierung der Stickstoffmonoxid-Synthase führt, ein Ca2 + -Calmodulin-abhängiges Enzym, das in diesen Zellkörpern vorhanden ist (Vincent und Kimura, 1992; Torres et al., 1993; Sanchez et al., 1994; Sato-Suzuki et al., 1998). Die erhöhte Stickoxidproduktion verursacht wiederum die Aktivierung von Oxytocinergen Neuronen. Dementsprechend wurde die (1) apomorphininduzierte Erektion des Penis durch organische Calciumkanalblocker und durch GVIA, einem potenten und selektiven Blocker von spannungsabhängigen Ca2 + -Kanälen des N-Typs (McCleskey et al., 1987), verhindert Nucleus (siehe Argiolas et al., 1990, und Referenzen darin); (2) Apomorphin-induzierte Peniserektion wurde durch Stickstoffmonoxid-Synthase-Hemmer in den paraventrikulären Kern (Melis et al., 1994c) verhindert verhindert; und (3) Apomorphin und andere D2-Rezeptor-Agonisten, die in Dosen verabreicht wurden, die die Erektion des Penis induzierten, erhöhten die Stickstoffoxidproduktion im paraventrikulären Dialysat, das durch intrazerebrale Mikrodialyse erhalten wurde, eine Zunahme, die durch Inhibitoren der paraventrikulären Stickstoffmonoxid-Synthase in Dosen vermindert wurde D2-Rezeptor-Agonist induzierte Penis Erektion (Melis et al., 1996). Der Mechanismus, durch den Stickstoffmonoxid paraventrikuläre oxytocinerge Neuronen aktiviert, ist immer noch unbekannt, obwohl die verfügbaren Daten darauf hindeuten, dass Stickstoffmonoxid als intrazellulärer Messenger wirkt und dass die Guanylatcyclase nicht beteiligt ist. In der Tat erwies sich das aktive Phosphodiesterase-resistente Analogon von zyklischem GMP, 8-Brom-Cyclo-GMP, als nicht in der Lage, eine Erektion des Penis zu induzieren, wenn es in den paraventrikulären Kern gegeben wird (Fig. 2) (siehe Melis und Argiolas, 1995b und Referenzen darin).
Die obige Interpretation wurde oft als nicht überzeugend angesehen, hauptsächlich deshalb, weil die Stimulation von D2-Rezeptoren von Dopamin normalerweise durch eine Inhibierung und nicht durch Anregung der Zellkörper der Neuronen, die diese Rezeptoren enthalten, über verschiedene G-Protein-gekoppelte Mechanismen gekoppelt ist (siehe Sokoloff und Schwartz, 1995). Eine mögliche Erklärung für diese Diskrepanz, die einer direkten Stimulation von paraventrikulären oxytocinergen Neuronen durch Dopamin entspricht, wurde kürzlich durch die Entdeckung von a G-Protein-gekoppeltes Dopamin D4 Rezeptor, ein Mitglied der D2-Rezeptorfamilie (D2, D3 und D4), dessen Stimulation den Ca2 + -Einstrom in Zellpräparationen erhöht, die eine klonierte Version dieses Rezeptorsubtyps enthalten (Moreland et al., 2004). Noch wichtiger ist, dass ein selektiver D4-Rezeptor-Agonist (z. B. ABT 724) (N-Methyl-4- (2-Cyanophenyl) piperazynil-3methylbenzamidmaleat) bei männlichen Ratten zur Erektion des Penis bei männlichen Ratten induziert wurde (Brioni et al., 2004). Dieser Effekt wurde mit dem selektiven D2-Rezeptorsubtyp-Agonisten PNU-95666E (R-5,6-Dihydro-N, N-Dimethyl-4Himidazo [4,5,1-i] Chinolin-5-Amin) (Hsieh et al., 2004) nicht gefunden war auch nicht in der Lage, den Ca2 + -Einstrom in den Zellpräparationen zu erhöhen, die die clonierte Version des D4-Rezeptor-Subtyps enthielten (Brioni et al., 2004; Moreland et al., 2004). In Übereinstimmung mit der obigen Hypothese und den Ergebnissen wurde PD 168,077 (N-Methyl-4- (2-Cyanophenyl) piperazynil-3methylbenzamidmaleat), PIP-3EA (2- [4- (2-Methoxyphenyl) piperazin-1-ylmethyl] imidazo [1,2-a] Pyridin) und andere selektive D4-Rezeptor-Agonisten (Heier et al., 1997; Melis et al., 2006b; Löber et al., 2009) konnten eine Erektion des Penis induzieren, wenn sie systemisch, icv und injiziert wurden der paraventrikuläre Kern, obwohl weniger effektiv als Apomorphin. Der pro-erektile Effekt dieser D4-Rezeptor-Agonisten wurde durch L-745,870 (3- (4- [Chlorphenyl] piperazin-1-yl) -Methyl-1H-Pyrrolo [2,3-B] Pyridin-Trihydrochlorid) verhindert, einem selektiven D4-Rezeptor Antagonist (Patel et al., 1997; Melis et al., 2005, 2006b; Löber et al., 2009).
Schließlich wurde der pro-erektile Effekt der obigen D4-Rezeptor-Agonisten auch durch Stickstoffoxid-Synthase-Inhibitoren, die in den paraventrikulären Kern gegeben wurden, und durch d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin, einen selektiven Oxytocin-Rezeptor-Antagonisten, reduziert gegeben ICV aber nicht im paraventrikulären Kern. Diese Ergebnisse stimmen mit der Hypothese überein, dass D4-Rezeptor-Agonisten auch oxytocinerge Neuronen durch Aktivierung von Stickstoffoxid-Synthase stimulieren und Oxytocin in extrahypothalamischen Hirnregionen freisetzen, was wiederum die Peniserektion erleichtert, wie für Apomorphin und klassische D2-Agonisten gezeigt (Melis et al ., 2005, 2006b; Löber et al., 2009).
Die obigen Befunde unterstützen auch die Hypothese, dass Dopamin eine Erektion des Penis induziert, indem es auf D4-Rezeptoren wirkt, die auf den Zellkörpern von paraventrikulären oxytocinergen Neuronen lokalisiert sind und einen erhöhten Ca2 + -Einstrom in die Zellkörper von oxytocinergen Neuronen verursachen, was zu einer erhöhten Stickstoffoxidproduktion führt. Stickoxid wiederum aktiviert oxytocinerge Neuronen, um Oxytocin in extra-hypothalamischen Hirnarealen und im Rückenmark freizusetzen, wie bereits diskutiert. In dieser Hinsicht Es ist bemerkenswert, dass Dopaminrezeptoren in den Zellkörpern von oxytocinergen Neuronen im paraventrikulären Kern identifiziert wurden erst kürzlich durch Doppelimmunfluoreszenzstudien mit hochselektiven D2-, D3- und D4-Rezeptor-Antikörpern und mit Oxytocin-Antikörpern. Diese Studien haben die Expression aller drei D2-Rezeptor-Subtypen (D2, D3 und D4) gezeigt, die getrennt in den Zellkörpern von oxytocinergen Neuronen im paraventrikulären Kern (und auch im supraoptischen Kern und im medialen präoptischen Bereich) (Baskerville) ko-lokalisierten und Douglas, 2008; Baskerville et al., 2009).
Dies liefert eine starke neuroanatomische Unterstützung für die Möglichkeit, dass Dopamin- und Dopaminrezeptor-Agonisten vom D2-Typ eine Erektion des Penis induzieren, indem sie direkt oxytocinerge Neuronen aktivieren, die in die oben erwähnten Gehirnbereiche des Extrahypothalamus projizierenB. das Rückenmark, der ventrale Tegmentum, der Hippocampus und die Amygdala. Diese Ergebnisse liefern jedoch keine Hilfe zur Identifizierung des D2-Rezeptor-Subtyps / s, dessen Stimulation die erektile Antwort verursacht. Unglücklicherweise kann keine Hilfe sogar von Studien erhalten werden, die auf die Identifizierung von Oxytocinergen-Neuronen gerichtet sind, die durch Dopamin-Rezeptor-Agonisten im Nucleus paraventricularis aktiviert werden. Trotz der unterschiedlichen Aktivität an den verschiedenen Dopamin-Rezeptor-Subtypen verursachen entweder gemischte Dopamin-Rezeptor-Agonisten (zB Apomorphin) oder selektive D2-Rezeptor-Agonisten (zB Chinpirol, die auf alle D2-Rezeptor-Subtypen wirkt) oder selektive D4-Rezeptor-Agonisten die Aktivierung von oxytocinergen Neuronen, gemessen durch die Zunahme von FOS-Protein in parvozellulären oxytocinergen Neuronen des paraventrikulären Kerns (Bitner et al., 2006). Dieser Befund wurde jedoch kürzlich in Frage gestellt, da der FOS-Proteinanstieg in paraventrikulären oxytocinergen Neuronen nur gefunden wurde, wenn die Erektion des Penis durch Quinerolan induziert wurde, das hauptsächlich auf D2- und D3-Rezeptor-Subtypen wirkt, nicht jedoch auf PD 168077, einen D4-Rezeptoragonisten. trotz der Fähigkeit beider Verbindungen, die sexuelle Reaktion zu induzieren (Baskerville et al., 2009).
Weitere Experimente mit selektiven Agonisten der anderen D2-Rezeptor-Subtypen (hauptsächlich D2 und D3) sind dann notwendig, um die genaue Rolle jedes Dopamin-Rezeptor-Subtyps bei der Kontrolle der erektilen Funktion auf paraventrikulärer Ebene zu identifizieren. In dieser Hinsicht ist Apomorphin, das wirksam auf alle Dopamin-Rezeptor-Subtypen einwirkt (siehe Brioni et al., 2004 und die darin enthaltenen Referenzen), viel wirksamer als D4-Rezeptor-Agonisten beim Induzieren der Erektion des Penis, wenn es in den Paraventrikus injiziert wird Kern. Dies könnte durch eine höhere Affinität von Apomorphin zu D4-Rezeptoren im Vergleich zu der der getesteten D4-Rezeptor-Agonisten erklärt werden, oder alternativ können D4-Rezeptor-Agonisten als D4-Rezeptor-Partialagonisten oder die gleichzeitige Aktivierung von verschiedenen Dopamin-Rezeptor-Subtypen durch Apomorphin wirken produzieren eine höhere Aktivierung von Oxytocinergen Neuronen, die die Erektion des Penis vermitteln, als die Aktivierung durch D2-Rezeptor-Agonisten des D4-Rezeptor-Subtyps.
Wechselwirkungen zwischen Dopamin D1 und D2-Rezeptoren wurden bereits bei der Kontrolle des Sexualverhaltens auf der Ebene des medialen präoptischen Bereichs beschrieben (siehe Hull et al., 1989). Für den Fall, dass die Unfähigkeit selektiver D2-Rezeptor-Agonisten, eine Peniserektion zu induzieren (Hsieh et al., 2004), wird bestätigt (siehe jedoch Depoortère et al., 2009), zum Beispiel sogar auch nach Injektion dieser Verbindungen in den paraventrikulären Kern , eine wichtige Rolle für D3-Rezeptoren allein oder zusammen mit der von D4-Rezeptoren bei der Aktivierung von Oxytocinergen Neuronen Vermittlung Penis Erektion sollte im Detail analysiert werden (siehe Baskerville et al., 2009). Leider sind selektive D2- und D3-Rezeptor-Agonisten (z. B. die sich hinsichtlich ihrer Affinität für diese zwei Rezeptorsubtypen für mindestens vier / fünf Größenordnungen in vitro unterscheiden) derzeit nicht verfügbar. Aus diesem Grund wurde kürzlich vorgeschlagen, dass D3 - Rezeptoren die durch klassische D2 - Rezeptor - Agonisten induzierte Erektion des Penis vermitteln, die hauptsächlich auf der Fähigkeit von mutmaßlichen D3 - Rezeptor - Antagonisten beruht, die durch klassische D2 - Agonisten, wie z Apomorphin, Quinpirol und Pramipexol, die alle Dopamin-D2-Rezeptor-Subtypen wirksam aktivieren (Collins et al., 2009), müssen sicherlich mit anderen Experimenten validiert werden. Diese Validierung ist auch deshalb notwendig, weil in dieser Studie keine Wirkung von D4-Rezeptor-Agonisten auf die Erektion des Penis gefunden wurde, was im krassen Gegensatz zu den Ergebnissen der oben zitierten Studien steht, die einen pro-erektilen Effekt von D4-Rezeptor-Agonisten zeigen. In der Tat, sogar die Fähigkeit von Apomorphin, Erektion des Penis (und Gähnen) in D4-Rezeptor-Knockout-Mäusen mit einer Potenz zu induzieren, die mit derjenigen von D4-Rezeptor-Knockout-Mäusen identisch ist, und die Fähigkeit von D3-Rezeptor-Antagonisten, die Apomorphin-Antwort bei diesen Tieren aufzuheben ( Collins et al., 2009) kann nicht als ein endgültiger Beweis für eine selektive Rolle des D3-Rezeptor-Subtyps bei D2-Rezeptor-Agonist-induzierter Peniserektion angesehen werden. Unterschiedliche Speziesunterschiede, Studien mit Neurotransmitter / Neuropeptid und / oder Neurotransmitter / Neuropeptid-Rezeptor-Gen-Ablation (Neurotransmitter / Neuropeptid und / oder Neurotransmitter / Neuropeptid-Rezeptor-Knockout-Tiere) haben in der Regel weitere Verwirrung und Komplikationen bei der Bestätigung der vermeintlichen sexuellen Rolle von Neurotransmittern und / oder Neuropeptide und ihre Rezeptoren. Die Oxytocin-Gen-Ablation erzeugt nämlich Oxytocin-Knockout-Mäuse, die sich normalerweise paaren und vermehren, als ob Oxytocin für die Paarung und die Kopulation unnötig wäre. Auch die homozygoten weiblichen Oxytocin-Knockout-Mäuse zeigen eine normale Paarung und Geburt, allerdings mit einer deutlichen Beeinträchtigung des Milchabbaus (Nishimori et al., 1996; Young et al., 1996). Die Ablation des Gens, das für die neuronale Stickoxidsynthase kodiert, erzeugt auch Stickoxidsynthase-Knockout-Mäuse, die sich normalerweise paaren und kopulieren (Huang et al., 1993). Diese Befunde weisen jedoch wahrscheinlich auf ein wichtiges Merkmal der Reproduktionsphysiologie hin, dh auf die Redundanz der Systeme, die an ihrer Kontrolle auf zentraler und peripherer Ebene beteiligt sind.
Eine solche Redundanz hat sicherlich evolutionären Ursprung, da sie die Weitergabe von Genen an die nächste Generation für das Überleben der Spezies garantiert. Daher legt die Tatsache, dass die Ablation des D4-Rezeptorgens den pro-erektilen Effekt von Apomorphin nicht verändert, nahe, dass D4-Rezeptoren, wie Oxytocin und Stickoxid, nur einige der Mediatoren sind, die in den Systemen zur Steuerung der erektilen Funktion arbeiten Dies legt nahe, dass diese Rezeptoren bei der Kontrolle der Peniserektion und des sexuellen Verhaltens keine Rolle spielen. Das Versagen von D4-Agonisten, eine Erektion des Penis zu induzieren, wenn es männlichen Ratten verschiedener Stämme systemisch verabreicht wird, wurde kürzlich durch eine andere Studie berichtet (Depoortère et al., 2009). Im Gegensatz zu den Arbeiten von Collins et al. (2009), und um das Bild über die Rolle der verschiedenen D2-Rezeptor-Subtypen bei der Kontrolle der Peniserektion noch rätselhafter zu machen, zeigt diese Studie auch, dass mutmaßlich D3-Rezeptor-Antagonisten, die systemisch verabreicht wurden, die Apomorphin-induzierte Peniserektion nicht reduzieren konnten männliche Ratten des Stammes, die für die pro-erektile Wirkung von Apomorphin empfindlicher sind, während die sexuelle Reaktion (und das Gähnen) durch den selektiven D2-Antagonisten L-741,626 (3 - [[4- (4-Chlorphenyl) -4-Hydroxypiperidin] antagonisiert wurde -1-yl] methyl-1H-Indol), was die Autoren zu der Annahme veranlasst, dass D2-Rezeptoren anstelle von D3- und D4-Rezeptoren diejenigen sind, die eine Hauptrolle bei der D2-Agonisten-induzierten Peniserektion spielen (Depoortère et al., 2009). Schließlich ist die Möglichkeit, dass die erregende Wirkung von Dopaminrezeptoragonisten auf oxytocinerge Neuronen zumindest teilweise eine Peniserektion vermittelt, eher indirekt als direkt, z. B. durch Veränderungen in der Aktivität anderer Neurotransmitter vermittelt oder beeinflusst, Neuropeptiden, die in der Lage sind, die Aktivität von Oxytocinerge Neuronen im Nucleus paraventricularis, kann nicht völlig ausgeschlossen werden.
3.2. Glutaminsäure-Oxytocin-Wechselwirkung im Nucleus paraventricularis
Der paraventrikuläre Kern des Hypothalamus ist sehr reich an Synapsen, die eine exzitatorische Aminosäure als Neurotransmitter enthalten (z. B. Glutaminsäure und Asparaginsäure)) (Van Den Pol, 1991). Exzitatorische Aminosäuren in diesem Kern sind an zahlreichen Funktionen beteiligt, einschließlich der Peniserektion und des sexuellen Verhaltens (Roeling et al., 1991; Melis et al., 1994b, 2000, 2004b). Demnach ist N-Methyl-d-asparaginsäure (NMDA), ein selektiver Agonist des NMDA-Rezeptorsubtyps, aber nicht (±) -_-Amino-3-Hydroxy-5-Methyl-Isoxazol-4-Propionsäure (AMPA) ein selektiver Agonist des AMPA-Rezeptorsubtyps oder (±) -trans (1) -Amino-1,3-Cyclopentandicarbonsäure (ACPD), ein selektiver Agonist des metabotropen Rezeptorsubtyps, wurde gefunden, dass er in der Lage ist, eine Erektion des Penis zu induzieren paraventrikulärer Kern von frei beweglichen Ratten (Melis et al., 1994b). Der pro-erektile Effekt von 948 MR Melis, A. Argiolas / Neuroscience und Biobehavioral Reviews 35 (2011) 939-955 NMDA wurde durch (+) MK-801, einem nicht-kompetitiven NMDA-Rezeptor-Antagonisten (Woodruff et al., 1987 ), injiziert in den paraventrikulären Kern (Melis et al., 1994b). In Übereinstimmung mit diesen Ergebnissen wurde in NMD-Studien zur Überwachung des intrakavernösen Drucks eine wesentlich höhere Aktivität von Agonisten der anderen exzitatorischen Aminosäurerezeptor-Subtypen festgestellt, wenn der intrakanavernosale Druck bei wachen oder anästhesierten männlichen Ratten in den paraventrikulären Nucleus injiziert wurde (Zahran et al., 2000; Chen und Chang, 2003).
Wie oben für Oxytocin und Dopamin vorgeschlagen, ist es wahrscheinlich, dass NMDA-Rezeptoren, die eine Erektion des Penis vermitteln, in den Zellkörpern von Oxytocinergen-Neuronen lokalisiert sind, da Nervenendigungen von exzitatorischen Aminosäuren auf oxytocinerge Zellkörper im Nucleus paraventricularis auftreffen (Van Den Pol, 1991). In Analogie zu dem, was bei Dopaminrezeptor-Agonisten gefunden wurde, wird der pro-erektile Effekt von NMDA offenbar durch die Aktivierung der oxytocinergen Neurotransmission vermittelt, indem er durch den Oxytocin-Antagonisten d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin gegeben icv aber aufgehoben wird nicht in den paraventrikulären Kern (siehe Argiolas und Melis, 1995, 2004, 2005 und die darin enthaltenen Referenzen). Ebenso ist die NMDA-induzierte Aktivierung der oxytocinergen Neurotransmission auch sekundär zur Aktivierung der Stickstoffmonoxid-Synthase, da NMDA-induzierte Peniserektion durch Stickstoffmonoxid-Synthase-Inhibitoren (N-Nitro-N-methyl-argininmethylester und N- Methyl-thio-1-citrullin) in den Nucleus paraventricularis gegeben, und NMDA injiziert in den paraventrikulären Kern in Dosen, die Erektion des Penis induzieren, erhöht Stickoxid-Produktion im Kern des Hypothalamus (siehe Argiolas und Melis, 1995, 2004, 2005 und Referenzen darin ). Wie für Dopamin-Rezeptor-Agonisten kann die NMDA-induzierte Aktivierung von Stickstoffoxiden auch sekundär zu einem erhöhten Ca2 + -Einstrom in oxytocinergen Zellkörpern durch die Ca2 + -Kanal-gekoppelten NMDA-Rezeptoren sein, wie in mehreren neuralen Präparaten gezeigt (für eine Übersicht siehe Snyder, 1992; Southam und Garthwaite, 1993; Schuman und Madison, 1994 und Referenzen darin). Stickoxid wiederum aktiviert die oxytocinerge Neurotransmission (so). Der Ursprung von glutamatergen Projektionen, die paraurentrikuläre, oxytocinerge Neurone aktivieren, die die Peniserektion vermitteln, ist unbekannt, obwohl einige neuroanatomische und elektrophysiologische Beweise darauf hindeuten, dass sie zumindest teilweise im Hippocampus entstehen (Saphier und Feldman, 1987; Chen et al., 1992) . Obwohl weitere Arbeiten notwendig sind, um den Ursprung der glutamatergen Projektionen zum paraventrikulären Kern besser zu charakterisieren, wird die Beteiligung von Glutaminsäure im paraventrikulären Kern bei der Kontrolle der Erektion des Penis und des Sexualverhaltens durch Mikrodialyse-Studien eindeutig unterstützt. Demgemß waren die extrazellulären Konzentrationen von Glutaminsäure und Asparaginsäure in dem aus dem paraventrikulären Kern von männlichen Ratten stammenden Dialysat, das kontaktfreie Erektionen zeigte, erhöht, wenn sie in Gegenwart von unzugänglichen Östrogen + Progesteron-vorbehandelten rezeptiven weiblichen Ratten gegeben wurden (Melis et al., 2004b), Penis-Erektionen, die auch durch die Aktivierung der zentralen Oxytocinergen Transmission vermittelt werden (Melis et al., 1999a, b). Solche Erhöhungen wurden sogar noch höher gefunden, wenn eine Kopulation mit der empfangenden Frau erlaubt war (Melis et al., 2004a). In Übereinstimmung mit der Hypothese, dass eine erhöhte Aktivität exzitatorischer Aminosäuren im paraventrikulären Kern während der Erektion und Kopulation des Penis auftritt, werden sowohl kontaktfreie Erektionen als auch das kopulierende Verhalten (während der Penisepopulation) durch Blockade von NMDA-Rezeptoren im paraventrikulären Nucleus reduziert und dieser Reduktion folgt eine Abnahme des Anstiegs der Stickstoffoxidproduktion, die in diesem hypothalamischen Kern in diesen physiologischen Kontexten auftritt (Melis et al., 2000). Eine Erhöhung der extrazellulären Glutaminsäurekonzentration als Folge einer verminderten GABA-Freisetzung aus GABAergen Nervenendigungen, die auf exzitatorische aminoacidergische Synapsen neben oxytocinergen Zellkörpern auftreffen, wurde ebenfalls im paraventrikulären Kern nach Blockade der Cannabinoid-CB1-Rezeptoren durch den CB1-Antagonisten SR 141761A gefunden. bei Dosen, die eine Peniserektion induzieren, in die Seitenventrikel oder direkt in den paraventrikulären Kern gegeben (siehe Succu et al., 2006; Castelli et al., 2007). Ein solcher Anstieg führte zur Aktivierung der Stickstoffoxid-Synthase in den Zellkörpern von oxytocinergen Neuronen, was die Stickstoffoxidproduktion erhöhte. Stickoxid aktiviert seinerseits die oxytocinergen Neuronen, die die Erektion des Penis wie oben beschrieben vermitteln. Im Einklang mit diesem Mechanismus wurde die durch SR 141761A induzierte Erektion des Penis durch die Blockade von NMDA - Rezeptoren und durch Stickoxid - Synthase - Inhibitoren reduziert, nicht jedoch durch die Blockade von Dopamin - oder Oxytocin - Rezeptoren im paraventrikulären Kern, während sie durch die Blockade von zentrale Oxytocin-Rezeptoren durch Oxytocin-Rezeptor-Antagonisten gegeben ICV
3.3. Oxytocin-Dopamin-Interaktion im ventralen Tegmentum
Oxytocin induziert eine Peniserektion, wenn es dosisabhängig in den kaudalen Teil des ventralen Tegmentum injiziert wird (Melis et al., 2007). Die niedrigste aktive Dosis, die einseitig injiziert wurde, war 20 ng, während die höchste getestete Dosis 100 ng war. Der Oxytocin-Effekt wird durch die Aktivierung von oxytocinergen Rezeptoren vermittelt, da die sexuelle Reaktion durch die vorherige Injektion des Oxytocin-Antagonisten d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin im kaudalen ventralen Tegmentum aufgehoben wird. Diese Rezeptoren sind in den Zellkörpern dopaminerger Neuronen lokalisiert, die hauptsächlich zur Hülle des Nucleus accumbens vorstehen. Demnach zeigen (1) Doppelimmunfluoreszenzuntersuchungen, dass im kaudalen ventralen Tegmentumbereich die oxytocinergen Fasern in engem Kontakt mit den Zellkörpern dopaminerger Neuronen stehen, von denen die Mehrzahl positiv für Tyrosinhydroxylase markiert war und zuvor den retrograden Tracer Fluorogold enthielt injiziert in die Schale des Nucleus accumbens (Melis et al., 2007), und (2) ventralen Tegmentum Oxytocin-induzierte Penis Erektion tritt gleichzeitig mit einer Erhöhung der Konzentration von extrazellulären Dopamin in dem Dialysat aus der Schale von der Nucleus accumbens (Melis et al., 2007). Eine Oxytocin-induzierte Erektion des Penis tritt auch gleichzeitig mit einem Anstieg der Stickstoffoxidproduktion im ventralen Tegmentum auf, wobei beide Reaktionen nicht nur durch d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin und durch den Stickoxidsynthaseinhibitor S- antagonisiert werden. Methyl-thio-1-citrullin, aber auch durch _-Conotoxin, einen spannungsabhängigen Ca2 + -Kanalblocker und durch ODQ (1H- [1,2,4] oxadiazol [4,3-a] Chinoxalin-1-one), ein potenter Guanylat-Inhibitor Cyclase, alle im kaudalen ventralen Tegmentum vor Oxytocin gegeben (Succu et al., 2008). Da viele der mit Fluorogold markierten dopaminergen Zellkörper, die von oxytocinergen Fasern kontaktiert wurden, die im kaudalen ventralen Tegmentum positiv für Tyrosinhydroxylase waren, wurden sie auch positiv für Stickstoffoxid-Synthase und Guanylatcyclase (Succu et al., 2008), Oxytocin, markiert induzierte Penis Erektion kann durch den folgenden Mechanismus vermittelt werden. Die Aktivierung von oxytocinergen Rezeptoren in dopaminergen Zellkörpern durch das Peptid erhöht den Ca2 + -Einstrom innerhalb der Zellkörper dopaminerger Neuronen. Dies aktiviert die Stickstoffoxid-Synthase, ein Ca2 + -Calmodulin-abhängiges Enzym, wodurch die Stickstoffoxidproduktion erhöht wird. Stickoxid wiederum aktiviert Guanylatcyclase, was zu einer erhöhten Konzentration von zyklischem GMP führt. Cyclisches GMP aktiviert dopaminerge Neuronen, die in den Nucleus accumbens projizieren. Die Rolle von zyklischem GMP bei der Erektion des Penis, induziert durch Oxytocin, das in das kaudale ventrale Tegmentum injiziert wird, wird auch durch die Fähigkeit von 8-Brom-Cyclen GMP, ein aktives Phosphodiesterase-resistentes Analogon von zyklischem GMP, induziert Penis Erektion bei der Injektion in die kaudalen ventralen Tegmentum und zur Erhöhung des extrazellulären Dopamins im Dialysat aus dem Nucleus accumbens (Succu et al., 2008; Melis et al., 2009a). Dies steht im Widerspruch zu dem Mechanismus, durch den Stickoxid oxytocinerge Neuronen im paraventrikulären Kern aktiviert, wobei 8-bromcyclisches GMP nicht in der Lage ist, eine Peniserektion zu induzieren, wenn es in diesen Kern injiziert wird (Melis und Argiolas, 1995b) (Fig. 2). Was die Nervenbahnen betrifft, die durch Dopamin im Nucleus accumbens aktiviert werden und zur Peniserektion führen, sind diese noch unbekannt. Die verfügbaren Daten legen jedoch nahe, dass diese Wege die Dopamin-Neurotransmission im paraventrikulären Kern des Hypothalamus aktivieren. Dementsprechend tritt eine Oxytocin-induzierte Peniserektion gleichzeitig mit einem Anstieg des extrazellulären Dopamins auf, nicht nur in der Nucleus accumbens, aber auch im Nucleus paraventricularis, und wird durch den Dopamin-Rezeptor-Antagonisten Haloperidol, der in den paraventrikulären Nucleus injiziert wird, antagonisiert (Melis et al., 2007). EINZusammengenommen unterstützen diese Ergebnisse die Idee, dass Oxytocinergen-Neuronen, die aus dem paraventrikulären Kern stammen und in das kaudale ventrale Tegmentum projizieren, bei Aktivierung Oxytocin in diesem Bereich freisetzen, wodurch ein NO-zyklisches GMP-Signalisierungssystem aktiviert wird, was wiederum mesolimbische dopaminerge Neuronen aktiviert (Melis et al., 2007, 2009a; Succu et al., 2008). Dopamin, das im Nucleus accumbens freigesetzt wird, aktiviert wiederum Nervenbahnen, die zur Aktivierung von dopaminergen Neuronen im Intestinum-Hypothalamus führen, die paraventrikuläre, oxytocinerge Neurone stimulieren, die in die Rückenmark vermittelnde Erektion des Penis projizieren. Gleichzeitig kann Dopamin, das im Nucleus paraventricularis freigesetzt wird, auch oxytocinerge Neuronen aktivieren, die in extra-hypothalamische Hirnareale wie den ventralen Tegmentalbereich, den Hippocampus, die Amygdala und vielleicht andere Hirnareale projizieren.
Wie bereits erwähnt, erhöht sich im Einklang mit dieser Hypothese Apomorphin, das in den paraventrikulären Kern in einer Dosis injiziert wird, die die Peniserektion induziert, auch die extrazelluläre Dopaminkonzentration im Nucleus accumbens, eine Wirkung, die durch den Oxytocinrezeptorantagonisten d (CH2) 5Tyr (Me ) 2-Orn8-Vasotocin in den ventralen Tegmentum injiziert (Succu et al., 2007; Melis et al., 2009a). Zusammen können die oben genannten neuralen Bahnen eine hypothetische neurale Verschaltung bilden, die Dopamin, Oxytocin und andere Neurotransmitter (z. B. Glutaminsäure, siehe unten) beinhaltet, die nicht nur die sexuelle Leistung, sondern auch die sexuelle Motivation und die sexuelle Belohnung beeinflussen (siehe Abschnitt 4).
3.4. Oxytocin-Glutaminsäure-Interaktion im ventralen Subiculum des Hippocampus
Oxytocin induziert eine Peniserektion, wenn es dosisabhängig in das ventrale, nicht aber in das dorsale Subiculum injiziert wird (Melis et al., 2009b). Die sexuelle Reaktion wird durch die Stimulation von Oxytocinrezeptoren vermittelt, die durch die vorherige Injektion von d (CH2) 5Tyr (Me) 2-Orn8-Vasotozin aufgehoben wird, das in die gleiche Stelle von Oxytocin gegeben wird, wie es in anderen Hirnarealen zu finden ist (siehe oben). . Was die Lokalisierung dieser Rezeptoren betrifft, legen die verfügbaren Daten nahe, dass sie in den Zellkörpern von Neuronen lokalisiert sind, die reich an Stickstoffmonoxid-Synthase sind.
Demnach zeigen Mikrodialyse-Studien, dass die Oxytocin-induzierte Erektion des Penis gleichzeitig mit einem Anstieg der Stickstoffoxidproduktion im ventralen Subiculum auftritt, und dieser Anstieg wird nicht nur durch die vorherige Injektion des Stickoxid-Synthase-Inhibitors S-Methyl-thio-1-citrullin aufgehoben und durch den Stickoxidfänger Hämoglobin, aber auch durch d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin, alle in die gleiche Stelle von Oxytocin in Dosen verabreicht, die die Erektion des Penis antagonisieren (Melis et al., 2010). Wichtiger ist, dass Oxytocin-induzierte Peniserektion auch gleichzeitig mit einer Erhöhung der Konzentration extrazellulärer Glutaminsäure im ventralen Subiculum auftritt, die nur teilweise durch den nicht-kompetitiven NMDA-Rezeptor-Antagonisten (+) MK-801 antagonisiert wird ventrales Subiculum (Melis et al., 2010). Zusammengenommen legen diese Ergebnisse nahe, dass neu gebildetes Stickstoffmonoxid, indem es als ein interzellulärer Bote wirkt, Glutaminsäure-Neurotransmission aktiviert, was zu einer Erektion des Penis führt, möglicherweise durch neurale efferente Projektionen von ventral Subiculum zu extra-hippokampalen Hirnarealen. Im Einklang mit dieser Hypothese NMDA, das in das ventrale Subiculum injiziert wird, induziert in einer dosisabhängigen Weise die Erektion des Penis, und dieser Effekt wird vollständig durch die vorherige Injektion in die gleiche Stelle von (+) MK-801, aber nicht durch S-Methyl-thio-1-citrullin antagonisiert Hämoglobin oder d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin (Melis et al., 2010). Was die neuralen efferenten Wege betrifft, die zu extrahippocampalen Hirnbereichen projizieren, die durch exzitatorische Aminosäuren (dh Glutaminsäure) im ventralen Subiculum aktiviert werden, ist es wahrscheinlich, dass diese glutamaterge sind, wie es die Mehrheit der hippocampalen efferenten Projektionen sind. Im Moment könnte nur vermutet werden, dass diese Projektionen die Aktivität von mesolimbischen dopaminergen Neuronen modulieren, welche wiederum die Aktivität von dopaminergen Neuronen im Darm-Hypothalamus im paraventrikulären Kern modulieren, was zur Aktivierung von oxytocinergen Neuronen führt vermittelnde Penis Erektion wie bereits besprochen (siehe oben).
Dementsprechend tritt die durch das ventrale Subiculum Oxytocin induzierte Erektion des Penis gleichzeitig mit einer Zunahme der Konzentration des extrazellulären Dopamins in der Hülle des Nucleus accumbens auf, und dieser Anstieg, wie die Erektion des Penis, wird aufgehoben durch d (CH2) 5Tyr (Me) 2- Orn8-Vasotocin wird vor Oxytocin in das ventrale Subiculum gegeben (Melis et al., 2009b). Da ventrale Subiculum-Oxytocin-induzierte Erektion des Penis auch durch (+) MK-801 in das ventrale Tegmentum, aber nicht in den Nucleus accumbens (Melis et al., 2009b) injiziert wird, kommt es außerdem zu einer Zunahme extrazellulär Glutaminsäure im ventralen Tegmentum, nicht jedoch im Nucleus accumbens, wobei beide Reaktionen durch d (CH2) 5Tyr (Me) -Orn8-Vasotocin aufgehoben werden, das vor Oxytocin in das ventrale Subiculum injiziert wird (siehe Abb. 3), Es ist wahrscheinlich, dass die Aktivierung von mesolimbischen dopaminergen Neuronen sekundär zu einer erhöhten glutamatergen Neurotransmission im ventralen Tegmentum ist. Dies legt nahe, dass eine Glutaminsäure-Dopamin-Wechselwirkung, die die Erektion des Penis kontrolliert, im ventralen Tegmentum existiert. Weitere Untersuchungen sind notwendig, um festzustellen, ob die pro-erektilen efferenten glutametergerichteten Wege vom Subiculum zum ventralen Tegmentum direkt oder indirekt, dh durch den präfrontalen Cortex oder andere Hirnareale verlaufen (siehe Melis et al., 2009b und Literaturangaben darin). Da der paraventrikuläre Kern auch glutamaterge Projektionen aus dem Hippocampus erhält (siehe oben und Saphier und Feldman, 1987), und Glutaminsäure aktiviert paraventrikuläre oxytocinerge Neuronen, einschließlich derjenigen, die in den ventralen Tegmentalbereich vorstehen (Siehe Argiolas und Melis, 2005 und Referenzen darin), und Oxytocin im ventralen Tegmentum induziert die Erektion des Penis und erhöht die Aktivität des mesolimbischen dopaminergen Neuronss (siehe oben), ist es verlockend zu spekulieren, dass paraventrikuläre oxytocinerge Neuronen können auch zumindest teilweise an der Aktivierung von mesolimbischen dopaminergen Neuronen durch Oxytocin, das in das ventrale Subiculum injiziert wird, beteiligt sein (siehe Abschnitt 4).
4. Abschließende Bemerkungen
Die oben besprochenen Studien bestätigen und erweitern frühe Ergebnisse, die zeigen, dass Oxytocin bei männlichen Ratten eine Schlüsselrolle bei der zentralen Kontrolle der Erektion des Penis auf der Ebene des paraventrikulären Kerns des Hypothalamus und des Rückenmarks spielt. Insbesondere die meisten recent-Studien zeigen, dass Oxytocin die Erektion des Penis beeinflusst, indem es auch in anderen Bereichen des Gehirns wirkt, dh im ventralen Tegmentum, im ventralen Subiculum und im posteromedialen kortikalen Nucleus der Amygdala.
Auf paraventrikulärer Ebene ist der wichtigste neue Befund vielleicht die Entdeckung der Expression aller Dopaminrezeptoren der D2 - Familie (D2, D3 und D4) in den Zellkörpern oxytocinerger Neurone im Nucleus paraventricularis (und im supraoptischen Kern und im Nucleus nucleus) der mediale präoptische Bereich) (Baskerville und Douglas, 2008; Baskerville et al., 2009). Dies liefert starke neuroanatomische unterstützen die Hypothese, dass Dopamin- und Dopamin-Rezeptor-Agonisten direkt oxytocinerge Neuronen aktivieren können, die an der erektilen Funktion beteiligt sind und nicht nur auf das Rückenmark, sondern auch auf extra-hypothalamische Hirnareale projizieren. In dieser Hinsicht ist es auch wichtig, dass die Dopaminrezeptor-Agonist-induzierte Zunahme des intrakavernösen Drucks durch die Blockade von Oxytocinergenrezeptoren im Rückenmark lumbosakral reduziert wird (Baskerville et al., 2009). In der Tat, obwohl ein solcher Nachweis bei anästhesierten männlichen Ratten erhalten wurde, bestätigt der Befund die Aktivierung eines paraventrikulo-spinalen oxytocinergen absteigenden Pfades, der an der Dopamin-Rezeptor-Agonist-induzierten Peniserektion beteiligt ist. HEs muss jedoch noch geklärt werden, ob die durch die Stimulation von Dopaminrezeptoren in oxytocinergen Zellkörpern induzierte Peniserektion sekundär zur Aktivierung eines spezifischen Dopaminrezeptorsubtyps der D2-Familie (D2, D3 oder D4) ist. oder wenn diese Rezeptorsubtypen bei der Modulation der erektilen Reaktion kooperieren, möglicherweise in unterschiedlicher Weise, abhängig vom Kontext, in dem die Erektion des Penis auftritt (siehe Moreland et al., 2004; Enguhard-Gueiffier et al., 2006; Melis et al., 2006a, b; Löber et al., 2009; Collins et al., 2009; Depoortèreet al., 2009; Baskerville et al., 2009).
Ein weiterer wichtiger neuer Befund ist, dass Oxytocin die Peniserektion induziert, wenn es nicht nur in den paraventrikulären Kern oder das CA1-Feld des Hippocampus, sondern auch in den ventralen Tegmentum, das ventrale Subiculum und den posteromedialen kortikalen Kern der Amygdala injiziert wird. Diese Gehirnareale wurden in den früheren Studien nicht getestet, die zeigten, dass Oxytocin bei männlichen Ratten spontane Peniserektionsepisoden erhöhte, obwohl sie wie die lumbosakralen Rückenmarks-Oxytocinergen-Projektionen aus dem paraventrikulären Nucleus erhalten wurden. Oxytocin wurde tatsächlich befähigt, spontane Peniserektionsepisoden zu verstärken, die bei erwachsenen männlichen Ratten in Abwesenheit von sexuellen Reizen auftreten, wie solche, die von der Anwesenheit einer zugänglichen oder unzugänglichen empfänglichen (oestrogenprogesteron-geprimten) ovariektomierten weiblichen Ratte stammen Manipulation der Genitalien bei Injektion in den paraventrikulären Kern und das CA1 - Feld des Hippocampus, nicht jedoch in das dorsale Subiculum, das laterale Septum, den Nucleus caudatus, den medialen präoptischen Bereich, den ventromedialen Nucleus und den supraoptischen Kern (Melis et al. , 1986). In all diesen Studien wurde die Erektion des Penis normalerweise gezählt, wenn der Penis aus der Penishülle durch einen Beobachter hervorging, der die gegebenen Behandlungen nicht direkt während des Experiments oder später durch Beobachtung des auf einem Videoband mit einer Videokamera aufgezeichneten Experiments kannte. Jede Erektion des Penis dauert 0.5-1 min und wird normalerweise von Penispflege und / oder Hüftbeugung begleitet. Bei diesen Ratten wird normalerweise kein Experiment durchgeführt, um den Effekt der sexuellen Erfahrung, des Alters oder wenn diese Ratten in niedrige oder hohe Responder eingeteilt werden können, auf den pro-erektilen Effekt von Oxytocin, injiziert in die verschiedenen Gehirnbereiche, zu untersuchen. Dies gilt auch für die Mehrzahl der Studien über die pro-erektile Wirkung anderer Neuropeptide und Arzneimittel, die spontane Erektionsepisoden des Penis erhöhen, einschließlich Dopaminagonisten, exzitatorische Aminosäuren, ACTH-MSH, Hexarelin und VGF-Peptide. Die pro-erektile Wirkung dieser Verbindungen wurde jedoch immer wieder durch Telemetrieverfahren bestätigt, die das Auftreten einer Erektion des Penis durch den spontan oder nach Verabreichung dieser Verbindungen auf unterschiedlichen Wegen, dh systemisch, intracerebroventrikulär oder intrazerebroventrikulär oder intrazerebroventrikulär auftretenden Druckanstieg im Inneren bestimmen direkt in spezifische Hirnkerne, nach der Implantation eines Druckmikro-Transducers direkt in die Schwellkörper (siehe Bernabè et al., 1999). Im ventralen Tegmentum, dem ventralen Subiculum und dem posteromedialen Nucleus der Amygdala induziert auch Oxytocin die Erektion des Penis, indem es auf die Oxytocinergen Rezeptoren einwirkt. Dies führt zur Aktivierung von mesolimbischen dopaminergen Neuronen, die ihren Ursprung im ventralen Tegmentum haben und in die Schale des Nucleus accumbens projizieren. wie durch die Erhöhungen der extrazellulären Dopaminkonzentration in dem aus der Schale des Nucleus accumbens erhaltenen Dialysat und durch die Verringerung der erektilen Reaktion, die durch das in diese extra-hypothalamischen Bereiche injizierte Peptid induziert wurde, nach der Blockade dopaminerger Rezeptoren in der Nucleus Accumbens (siehe unten). Bezüglich der Mechanismen, die durch die Stimulation von Oxytocinergenrezeptoren in diesen Gehirnbereichen aktiviert werden, die zur Aktivierung von mesolimbischen dopaminergen Neuronen und zur Erektion des Penis führen, sind diejenigen, die im kaudalen ventralen Tegmentum auftreten, am besten zu klären. In der Tat zeigen hier pharmakologische und Immunofluoreszenz-Ergebnisse, dass Oxytocin-Nervenendigungen auf die Zellkörper von dopaminergen Neuronen auftreffen, die in die Schale des Nucleus accumbens projizieren (Melis et al., 2007, 2009a; Succu et al., 2008). Viele dieser Neuronen sind reich an Stickstoffmonoxid-Synthase und in Guanylatcyclase. Die Stimulation von Oxytocinergen Rezeptoren in den Zellkörpern dieser dopaminergen Neuronen bewirkt die Aktivierung von Stickstoffmonoxid-Synthase, was zu einer erhöhten Stickstoffoxidproduktion führt. Stickoxid wiederum aktiviert Guanylatcyclase, wodurch die Konzentration von zyklischem GMP erhöht wird, was zur Aktivierung von mesolimbischen dopaminergen Neuronen und zur Freisetzung von Dopamin im Nucleus accumbens führt, gemessen durch die Zunahme von extrazellulärem Dopamin im Dialysat aus dem Nucleus accumbens, erhalten durch intrazerebrale Mikrodialyse (Succu et al., 2008 ). Dopamin, das im Nucleus accumbens freigesetzt wird, aktiviert wiederum Nervenbahnen, die zur Erektion des Penis führen. Dies wird durch die Fähigkeit der Dopaminrezeptorantagonisten Haloperidol und / oder cis-Flupentixol, die in den Nucleus accumbens injiziert werden, unterstützt, die ventrale Tegmentalbereichs-Oxytocin-induzierte Peniserektion zu reduzieren (Succu et al., 2008). Einer der pro-erektilen Wege scheint incerto-hypothalamische dopaminerge Neuronen zu aktivieren, insbesondere solche, die auf die Zellkörper von paraventrikulären oxytocinergen Neuronen projizieren. In der Tat injiziert Oxytocin in den kaudalen ventralen Tegmentum erhöht extrazellulären Dopamin nicht nur im Nucleus accumbens, sondern auch im Nucleus paraventricularis, und die Blockade der Dopaminrezeptoren im Nucleus paraventricularis reduziert signifikant ventral Tegmentum Oxytocin-induzierten Penis Erektion (Succu et al. , 2007, 2008; Melis et al., 2007, 2009a). Die Existenz dieser Nucleus accumbens Dopamin-paraventrikuläre Dopamin-Paraventrikuläre Oxytocin-ventralen Tegmentum Oxytocin-Dopamin-Links wird auch durch die Fähigkeit einer pro-erektilen Dosis von Apomorphin und des D4-Rezeptor-Agonisten PD 168077 in den paraventrikulären Kern injiziert, um extrazelluläre Dopamin in der Schale des Nucleus accumbens (Succu et al., 2007), Antwort zu erhöhen dies wird aufgehoben durch d (CH2) 5Tyr (Me) -Orn8-Vasotocin, das in das ventrale Tegmentum gegeben wird (Melis et al., 2009a, siehe auch unten). Weitere Arbeiten sind jedoch notwendig, um die neuralen Signalwege zu identifizieren, die den Nucleus accumbens mit dem dopaminergen System incerto-hypothalamisch verbinden.
Der Mechanismus, durch den Oxytocin die Erektion des Penis induziert und mesolimbische dopaminerge Neuronen aktiviert, wenn er in das ventrale Subiculum oder in den posteromedialen Nucleus der Amygdala injiziert wird, ist im Moment nur teilweise verstanden. Auch in diesen Bereichen aktiviert Oxytocin seine eigenen Rezeptoren, die zur Aktivierung der Stickoxid-Synthase führen und so die Stickoxidproduktion erhöhen. Stickoxid wiederum aktiviert unbekannte efferente Projektionen, die die glutamaterge Neurotransmission im ventralen Tegmentalbereich scheinbar erhöhen. Glutaminsäure stimuliert dann mesolimbische dopaminerge Neuronen, die zu einer Erektion des Penis führen. Diese Hypothese stützt sich hauptsächlich auf die Fähigkeit von Oxytocin, das in das ventrale Subiculum injiziert wird, die extrazelluläre Glutaminsäure im ventralen Tegmentum zu erhöhen (Abb. 3) und des nicht-kompetitiven NMDA-Rezeptor-Antagonisten (+) MK-801, injiziert in den ventralen Tegmentumbereich, jedoch nicht in den Nucleus accumbens, um die durch Oxytocin induzierte Peniserektion zu reduzieren, die entweder in das ventrale Subiculum oder in den posteromedialen Nucleus injiziert wird der Amygdala (Melis et al., 2009b). Im Moment sind weitere Details für die ventrale Subiculum-Oxytocin-induzierte Peniserektion verfügbar. Hier scheint Oxytocin-induzierte Peniserektion sekundär zu sein für die Aktivierung von Oxytocinerg-Rezeptoren, die in den Zellkörpern von Stickstoffmonoxid-Synthase-enthaltenden Neuronen lokalisiert sind. Dies führt zu einem Anstieg der Produktion von Stickstoffmonoxid, das die glutamaterge Neurotransmission aktiviert, indem es als interzellulärer Botenstoff mit einem ähnlichen Mechanismus wie bei Langzeitpotenzierung wirkt (siehe Snyder, 1992; Southam und Garthwaite, 1993; Schuman und Madison, 2004). . In Übereinstimmung mit dieser Hypothese tritt eine Oxytocin-induzierte Erektion des Penis gleichzeitig mit einer Erhöhung der extrazellulären Glutaminsäure im Dialysat aus dem ventralen Subiculum auf, und die Stimulation der exzitatorischen Aminosäurerezeptoren im ventralen Subiculum durch NMDA induziert die Erektion des Penis. Glutaminsäure wiederum aktiviert neurale efferente Projektionen, die zur Aktivierung von mesolimbischen dopaminergen Neuronen im ventralen Tegmentum führen, wie oben berichtet. Ob diese Mechanismen auch im posteromedialen Kern der Amygdala wirksam sind, ist derzeit nicht bekannt. Darüber hinaus sind weitere Studien erforderlich, um zu beweisen, dass (1) oxytocinerge Nervenendigungen und Rezeptoren im ventralen Subiculum und im posteromedialen Kern der Amygdala in Zellkörpern von Neuronen lokalisiert sind, die Stickstoffmonoxid-Synthase (2) enthalten, wenn diese Neuronen schließlich vorhanden sind unter Kontrolle exzitatorischer Aminosäuren (glutamaterge Synapsen) und (3) zur Identifizierung des durch Stickoxid aktivierten Signalsystems. In diesem Zusammenhang ist bemerkenswert, dass die Fähigkeit von Oxytocin, die Stickstoffoxid-Synthase-Aktivität in den Zellkörpern von dopaminergen Neuronen im kaudalen ventralen Tegmentalbereich und von noch unbekannten Neuronen im ventralen Subiculum und im posteromedialen Nucleus der Amygdala zu erhöhen, erinnert die Fähigkeit von Oxytocin, Stickstoffoxid-Synthase in den Zellkörpern von oxytocinergen Neuronen im paraventrikulären Kern zu aktivieren (Melis et al., 1997). Während jedoch im ventralen Tegmentum die erhöhte Produktion von Stickstoffmonoxid in den Zellkörpern dopaminerger Neurone zur Aktivierung dieser Neuronen durch Aktivierung der Guanylatcyclase und Erhöhung des zyklischen GMP führt, kommt dies im paraventrikulären Kern nicht vor. Dementsprechend induziert 8-bromcyclisches GMP, das in den paraventrikulären Kern injiziert wird, keine Erektion des Penis, während es dies tut, wenn es in das ventrale Tegmentum injiziert wird. Ein weiterer Signalweg, der sich vom Stickstoffmonoxidzyklischen GMP - System unterscheidet, ist dann auf der paraventrikulären Ebene bei der Aktivierung von Oxytocinergen Neuronen beteiligt, die die Erektion des Penis durch endogenes und / oder exogenes Stickoxid (Melis und Argiolas, 1995b; Melis et al., 1997) vermitteln (Abb . 1). Andererseits scheint zyklisches GMP im ventralen tegmentalen Bereich auch eine Schlüsselrolle bei der Aktivierung von mesolimbischen dopaminergen Neuronen und bei der Zunahme von extrazellulärem Dopamin zu spielen, das in dem aus der Schale des Nucleus accumbens von männlichen Ratten erhaltenen Dialysat vorkommt ausgewählt für das Zeigen oder Nicht-Zeigen von kontaktlosen Penis-Erektionen, wenn sie in Gegenwart einer unzugänglichen ovariektomierten empfänglichen (Östrogen + Progesteron-behandelten) weiblichen Ratte gegeben werden. Unter diesen experimentellen Bedingungen wird bei männlichen Ratten, die kontaktfreie Peniserektionen zeigen, erwartungsgemäß eine Zunahme der extrazellulären Dopaminkonzentration gefunden, und diese Zunahme wird durch Phosphodiesteraseinhibitoren, die in das kaudale ventrale Tegmentum gegeben werden, weiter erhöht (Sanna et al., 2009).
Die Fähigkeit von Oxytocin, in den ventralen Tegmentum, in das ventrale Subiculum und in den posteromedialen kortikalen Nucleus der Amygdala injiziert zu werden, zusammen mit dem in den paraventrikulären Nucleus injizierten Dopaminagonisten, um die Erektion des Penis zu induzieren und mesolimbische dopaminerge Neurone zu aktivieren, verdient eine Bemerkung . Erstens können Mechanismen ähnlich denen, die oben erwähnt wurden, wirksam sein, wenn die Erektion des Penis in physiologischen Kontexten auftritt, wie während der Kopulation (wenn Kopula-Penis-Erektionen auftreten) oder während nicht-kontaktierender Penis-Erektionen. Diese Erektionen sind Pheromon-vermittelte Erektionen des Penis, die nicht von denen durch Medikamente oder Oxytocin induzierten Erektionen unterschieden werden können, die auftreten, wenn sexuell starke männliche Ratten in die Gegenwart einer unzugänglichen, empfängnisverursachenden (ovariektomierten Östrogen + Progesteron-geprimten) weiblichen Ratte gebracht werden und als Index der sexuellen Aktivität angesehen werden Erregung (Sachs, 1997, 2007). Obwohl diese Ergebnisse nicht zeigen, dass Oxytocin in diesen Bereichen eine Rolle bei der Erektion von Penis spielt, die in physiologischen Kontexten oder nach der Verabreichung von Medikamenten auftritt, verstärken sie frühere Befunde, was nahelegt, dass diese Gehirnregionen zu denen gehören, bei denen Oxytocin zentral verabreicht wird nicht nur spontane Erektionsepisoden, die nach pro-erektilen Drogen beobachtet werden, sondern auch, um männliches (und weibliches) Sexualverhalten zu verbessern (siehe Argiolas und Melis, 2004 und Referenzen darin). Dementsprechend steigt die Oxytocinkonzentration im Hippocampus männlicher Ratten, die mit einer pro-erektilen Dosis von Apomorphin behandelt wurden, einem klassischen Dopaminagonisten (Melis et al., 1990) und d (CH2) 5Tyr (Me) -Orn8-Vasotocin, das Oxytocin blockiert -Rezeptoren, ist nicht nur äußerst wirksam bei der Beeinträchtigung des Kopulationsverhaltens (Argiolas et al., 1987a), sondern auch der fazilitierenden Wirkung von Apomorphin auf männliches kopulatorisches Verhalten (Argiolas et al., 1987b) bei sexuell potenten männlichen Ratten, während der Erektion des Penis auftreten. d (CH2) 5Tyr (Me) -Orn8-Vasotocin ist auch äußerst wirksam bei der Reduktion von kontaktlosen Erektionen bei sexuell potenten männlichen Ratten, wenn es in Nanograden in die Seitenventrikel gegeben wird, aber nicht in das PVN (Melis et al., 1999a).
Zweitens spielen mesolimbische dopaminerge Neuronen eine Schlüsselrolle in den motivierenden und lohnenden Eigenschaften natürlicher Verstärkungsreize wie Nahrung, Wasser und sexueller Aktivität (Fibiger und Phillips, 1988; Wise und Rompre, 1989; Everitt, 1990). Insbesondere wird angenommen, dass Dopamin, das von diesen Neuronen freigesetzt wird, die Übertragung der motivationalen Aspekte natürlicher Reize in zielgerichtetes Verhalten vermittelt, zum Beispiel im Fall von sexueller Aktivität, der Suche nach einem Sexualpartner und des Geschlechtsverkehrs, um Belohnung und Befriedigung zu erreichen (Goto und Gnade, 2005). Dementsprechend steigt die extrazelluläre Dopaminkonzentration im Dialysat aus dem Nucleus accumbens von sexuell potenten männlichen Ratten während der Exposition gegenüber einer unzugänglichen ovarektomierten, mit Östrogen + Progesteron stimulierten weiblichen Ratte, und ein solcher Anstieg war noch höher, wenn die männliche Ratte mit der empfänglichen Frau kopulieren konnte (Pfaus und Everitt, 1995).
Drittens stützen die vorliegenden Ergebnisse die Hypothese, dass ein neuraler Kreislauf den paraventrikulären Kern direkt oder indirekt (durch das ventrale Subiculum und / oder den posteromedialen kortikalen Kern der Amygdala) und den Nucleus accumbens und von hier aus durch unbekannte mit dem ventralen Tegmentum verbindet zurück in den Nucleus paraventricularis, um die Aktivität von Oxytocinergen Neuronen zu steuern, die zur Erektion des Penis führen, und von oxytocinergen Neuronen, die in den ventralen Tegmentalbereich, das ventrale Subiculum und den posteromedialen kortikalen Kern der Amygdala projizieren und auf diese Weise modulieren Aktivität von mesolimbischen dopaminergen Neuronen (Abb. 4). Dieser komplexe neuronale Schaltkreis kann eine Rolle bei der Integration von neuralen Aktivitäten spielen, die bei der Kontrolle der konsumatorischen (erektilen-ejakulatorischen) und antizipatorischen (motivierenden und lohnenden) Aspekte des männlichen Sexualverhaltens in physiologischen Kontexten eine Rolle spielen. In der Tat nimmt extrazelluläres Dopamin im Nucleus accumbens (Pfaus und Everitt, 1995) und im paraventrikulären Nucleus sexuell wirksamer männlicher Ratten während der Exposition gegenüber einer unzugänglichen empfänglichen weiblichen Ratte zu, wenn kontaktfreie Erektionen auftreten, und noch mehr, wenn eine Kopulation erlaubt ist. zB wenn in Copula Penis Erektionen auftreten (Melis et al., 2003). Obwohl weitere Untersuchungen erforderlich sind, um die Rolle von endogenem Oxytocin im ventralen Tegmentum, dem ventralen Subiculum und der Amygdala bei nichtkontaktbedingten Erektionen und sexuellem Verhalten zu klären, kann es daher sinnvoll sein, anzunehmen, dass diese hypothetische neurale Schaltung zwar zur konsumatorische Aspekte des Sexualverhaltens, kann gleichzeitig auch das mesolimbische dopaminerge System aktivieren, das ein neurales Substrat zur Erklärung der belohnenden Eigenschaften sexueller Aktivität liefert (Everitt, 1990; Pfaus und Everitt, 1995). In dieser Hinsicht ist es bemerkenswert, dass das mesolimbische dopaminerge System, das durch in den ventralen Tegmentum injizierten Oxytocin aktiviert wird, durch Missbrauchsdrogen, wie Opiate, Cannabinoide, Amphetamin, Kokain und Alkohol (Tanda et al., 1997), aktiviert wird dass Oxytocin in der Lage war, die Toleranz und Abhängigkeit von Kokain, Morphin, Alkohol und Cannabinoiden zu reduzieren (Kovacs et al., 1998; Cui et al., 2001). Zusammenfassend scheint es, dass Oxytocin, das nicht nur im ventralen Tegmentalbereich, sondern auch im ventralen Subiculum und dem posteromedialen kortikalen Kern der Amygdala freigesetzt wird, mesolimbische dopaminerge Neurone aktivieren kann, die an den appetitiven und lohnenden Wirkungen sexueller Aktivität beteiligt sein können . Die Aktivierung von mesolimbischen dopaminergen Neuronen kann direkt sein, durch oxytocinerge Rezeptoren in den Zellkörpern von mesolimbischen dopaminergen Neuronen oder indirekt durch die Aktivierung von Glutaminsäure-Neurotransmission im ventralen Tegmentum.
Dopamin, das im Nucleus accumbens freigesetzt wird, moduliert wiederum die Aktivität der dopaminergen Neuronen im Nucleus paraventricularis incerto-hypothalamisch, was entweder eine Erektion des Penis (durch Aktivierung von zum Rückenmark vorragenden oxytocinergen Neuronen) oder eine sexuelle Motivation und Belohnung (durch Aktivierung von Oxytocinergen) zur Folge hat Neuronen, die in den ventralen Tegmentalbereich, das ventrale Subiculum oder den posteromedialen kortikalen Nucleus der Amygdala projizieren. Da Dopamin auch in der Nucleus accumbens Schale und im Nucleus paraventricularis freigesetzt wird, wenn die Erektion des Penis in physiologischen Kontexten auftritt (z. B. kontaktlose Erektionen und Kopulation) (Succu et al., 2007; Melis et al., 2003, 2007) wahrscheinlich, dass zentrale oxytocinerge Neuronen an neuralen Schaltkreisen beteiligt sind, die eine Wechselwirkung zwischen dem mesolimbischen und dem incerto-hypothalamischen dopaminergen System vermitteln. Diese neuronalen Schaltkreise können nicht nur in der vollendeten Phase des Sexualverhaltens (zB Erektion und Kopulation des Penis) eine Rolle spielen, sondern auch in der sexuellen Motivation, der sexuellen Erregung und der sexuellen Belohnung.
Schematische Darstellung einer hypothetischen neuronalen Verschaltung mit Oxytocin, die die sexuelle Motivation, Belohnung und sexuelle Leistung beeinflusst, wie es die Ergebnisse dieses Kapitels und früherer Berichte nahelegen. Oxytocinerge Neuronen, die aus dem paraventrikulären Kern stammen und zum Rückenmark springen, wenn sie beispielsweise durch Dopamin und Glutaminsäure (aber auch durch andere Neurotransmitter und / oder Neuropeptide) aktiviert werden, erleichtern die Erektion des Penis und die sexuelle Leistungsfähigkeit durch Aktivierung von zum Rückenmark vorragenden oxytocinergen Neuronen. Dopamin und Glutaminsäure (aber auch Neurotransmitter und Neuropeptide) im Nucleus paraventricularis aktivieren auch oxytocinerge Neuronen, die in den ventralen Tegmentalbereich projizieren, wodurch mesolimbische dopaminerge Neuronen aktiviert werden, die in den Nucleus accumbens projizieren und die sexuelle Motivation und Belohnung modulieren. Dopamin, das im Nucleus accumbens (NAs) freigesetzt wird, aktiviert wiederum noch unbekannte Nervenbahnen, die die Aktivität von dopaminergen Neuronen im Intestinum-Hypothalamus (die in den A13-A14-Gruppen von Dahlstrom und Fuxe entspringen) unter anderem auf Oxytocinergen erhöhen das Rückenmark, was zu einer Erektion des Penis führt. Diese Schaltung kann auch durch Oxytocin aktiviert werden, das nicht nur in den kaudalen ventralen Tegmentalbereich injiziert wird, sondern auch in das ventrale Subiculum und in die Amygdala, die ebenfalls eine oxytocinerge Innervation aus dem paraventrikulären Nucleus erhalten, möglicherweise durch direkte oder indirekte glutamaterge Efferenzen zum Ventral Tegmentum, was zur Modulation sowohl der sexuellen Motivation als auch der Erektion des Penis führt. Schließlich kann die obige Schaltung auch durch sexuelle Stimuli und Pheromone aktiviert werden, da extrazelluläres Dopamin und Glutaminsäure im paraventrikulären Kern (und im medialen präoptischen Bereich) während der Pheromon-vermittelten kontaktfreien Erektionen und der Kopulation ansteigen (für geeignete Literatur siehe Referenzliste).
Danksagung Diese Arbeit wurde teilweise durch eine Förderung des AA und MRM vom italienischen Ministerium der Universität und der Forschung unterstützt
Bibliographie
Andersson, KE, 2001. Pharmakologie der Erektion des Penis. Pharmacol. Rev. 53, 417-450. Argiolas, A., 1994. Stickoxid ist ein zentraler Mediator der Erektion des Penis. Neuropharmakologie 33, 1339-1344. Argiolas, A., 1999. Neuropeptide und Sexualverhalten. Neurosc Biobehav. Rev. 23, 1127-1142. Argiolas, A., Gessa, GL, 1991. Zentrale Funktionen von Oxytocin. Neurosc Biobehav. Rev. 15, 217-231. Argiolas, A., Melis, MR, 1995. Neuromodulation der Peniserektion: Ein Überblick über die Rolle von Neurotransmittern und Neuropeptiden. Prog. Neurobiol. 47, 235-255. Argiolas, A., Melis, MR, 2004. Die Rolle von Oxytocin und des paraventrikulären Kerns im Sexualverhalten männlicher Säugetiere. Physiol. Verhalten 83, 309-317. Argiolas, A., Melis, MR, 2005. Zentrale Kontrolle der Erektion des Penis: Rolle des paraventrikulären Kerns des Hypothalamus. Prog. Neurobiol. 76, 1-21. Argiolas, A., Collu, M., Gessa, GL, Melis, MR, Serra, G., 1988. Der Oxytocin-Antagonist d (CH2) 5Tyr (Me) -Orn8-Vasotocin antagonisiert männliches kopulatorisches Verhalten bei Ratten. E. J. Pharmacol. 149, 389-392. A. Argiolas, M. Collu, P. D'Aquila, GL Gessa, MR Melis, G. Serra, 1989. Die Apomorphin-Stimulation des männlichen Kopulationsverhaltens wird durch den Oxytocin-Antagonisten d (CH2) 5Tyr (Me) -Orn8-Vasotocin bei Ratten verhindert. Pharmacol. Biochem. Verhalten 33, 81-83. Argiolas, A., Melis, MR, Gessa, GL, 1985. Intraventrikuläres Oxytocin induziert Gähnen und Peniserektion bei Ratten. E. J. Pharmacol. 117, 395-396. Argiolas, A., Melis, MR, Gessa, GL, 1986. Oxytocin: ein extrem starker Induktor von Penis Erektion und Gähnen bei männlichen Ratten. E. J. Pharmacol. 130, 265-272. Argiolas, A., Melis, MR, Mauri, A., Gessa, GL, 1987a. Eine paraventrikuläre Kernläsion verhindert das Gähnen und die Erektion des Penis, die durch Apomorphin und Oxytocin induziert wird, jedoch nicht durch ACTH bei Ratten. Gehirn Res. 421, 349-352. Argiolas, A., Melis, MR, Vargiu, L., Mauri, A., Gessa, GL, 1987b. d (CH2) 5Tyr (Me) -Orn8-Vasotocin, ein potenter Oxytocin-Antagonist, wirkt der Erektion und dem Gähnen des Penis entgegen, die durch Oxytocin und Apomorphin, nicht aber durch ACTH 1-24 ausgelöst werden. E. J. Pharmacol. 134, 221-224. Argiolas, A., Melis, MR, Stancampiano, R., Gessa, GL, 1990. _-Conotoxin verhindert Apomorphin und Oxytocin-induzierte Erektion und Gähnen des Penis bei männlichen Ratten. Pharmacol. Biochem. Verhalten 37, 253-257. Arletti, R., Bertolini, A., 1985. Oxytocin stimuliert das Lordoseverhalten bei weiblichen Ratten. Neuropeptide 6, 247-255. R. Arletti, C. Bazzani, M. Castelli, A. Bertolini, 1985. Oxytocin verbessert die männliche Kopulationsleistung bei Ratten. Horm Verhalten 19, 14-20. Arletti, R., Benelli, A., Bertolini, A., 1990. Das sexuelle Verhalten alternder männlicher Ratten wird durch Oxytocin stimuliert. E. J. Pharmacol. 179, 377-382. Arletti, R., Calzà, L., Giardino, L., Benelli, A., Cavazzutti, E., Bertolini, A., 1997. Sexuelle Impotenz ist verbunden mit einer verminderten Produktion von Oxytocin und einer erhöhten Produktion von Opioidpeptiden im paraventrikulären Kern des Hypothalamus. Neurosc Lette. 233, 65-68. Bancila, M., Giuliano, F., Rampin, O., Mailly, P., Brisorgueil, M. J., Clas, A., Verge, D., 2002. Beweise für eine direkte Projektion vom paraventrikulären Kern des Hypothalamus auf mutmaßliche serotoninerge Neurone des Zellkerns paragigantozellularis, die an der Kontrolle der Erektion bei Ratten beteiligt sind. E. J. Neurosc 16, 1240-1249. Burnett, AL, Löwenstein, CJ, Bredt, DS, Tschang, TSK, Snyder, SH, 1992. Stickoxid: ein physiologischer Mediator der Erektion des Penis. Wissenschaft 257, 401-403. Baskerville, TA, Douglas, AJ, 2008. Interaktion zwischen Dopamin und Oxytocin bei der Kontrolle des sexuellen Verhaltens. Prog. Gehirn Res. 170, 277-289. Baskerville, TA, Allard, J., Wayman, C., Douglas, AJ, 2009. Dopamin-Oxytocin-Interaktion in Penis Erektion. E. J. Neurosc 30, 2151-2164. Benelli, A., Bertolini, A., Poggioli, R., Cavazzutti, E., Calzà, L., Giardino, L., Arletti, R., 1995. Stickoxid ist am männlichen Sexualverhalten von Ratten beteiligt. E. J. Pharmacol. 294, 505-510. Bernabè, J., Rampin, O., Sachs, BD, Giuliano, F., 1999. Intracavernöser Druck während der Erektion bei Ratten: ein integrativer Ansatz basierend auf telemetrischer Aufzeichnung. Am. J. Physiol. 276, R441-R449. Bitner, RS, Nikkel, AL, Otte, S., Martino, B., Barlow, EH, Bhatia, P., Stewart, AO, Brioni, JD, Decker, MW, Moreland, RB, 2006. Dopamin-D4-Rezeptor-Signalgebung im paraventrikulären hypothalamischen Nucleus der Ratte: Nachweis einer natürlichen Kopplung, die eine sofortige frühe Geninduktion und mitogen-aktivierte Proteinkinase-Phosphorylierung umfasst. Neuropharmakologie 50, 521-531. Brioni, JD, Moreland, RB, Cowart, M., Hsieh, GC, Stewart, AO, Hedlund, P., Donnelly-Roberts, DL, Nakane, M., Lynch 3rd., J., Kolasa, T., Polakowski , JS, Osinski, MA, Marsh, K., Andersson, KE, Sullivan, JP, 2004. Aktivierung von Dopamin D4-Rezeptoren durch ABT-724 induziert Penis Erektion bei Ratten. Proc Natl. Acad. Sci USA 101, 6758-6763. Buijs, RM, 1978. Intra- und extra-hypothalamische Vasopressin- und Oxytocin-Signalwege bei der Ratte. Zellgewebe Res. 192, 423-435. Buijs, RM, Geffard, M., Pool, CW, Hoorneman, EMD, 1984. Die dopaminerge Innervation des supraoptischen und paraventrikulären Kerns. Eine licht- und elektronenmikroskopische Studie. Gehirn Res. 323, 65-72. Caldwell, JD, Prange, AJ, Pedersen, CA, 1986. Oxytocin erleichtert die sexuelle Empfänglichkeit von Östrogen-behandelten weiblichen Ratten. Neuropeptide 7, 175-189. Cameron, JL, Pomerantz, SM, Layden, LM, Amico, JA, 1992. Dopaminerge Stimulation von Oxytocin-Konzentrationen im Plasma von männlichen und weiblichen Affen durch Apomorphin und einen D2-Rezeptor-Agonisten. J. Clin. Endocrinol. Metab. 75, 855-860. Canteras, NS, Simerly, RB, Swanson, LW, 1995. Organisation von Projektionen aus dem medialen Kern der Amygdala: eine PHAL-Studie an der Ratte. J. Komp. Neurol. 360, 213-245. Carmichael, MS, Humbert, R., Dixen, J., Palmisano, G., Greeleaf, W., Davidson, JM, 1987. Plasma Oxytocin erhöht die menschliche sexuelle Reaktion. J. Clin. Endocrinol. Metab. 64, 27-31. Carter, CS, 1992. Oxytocin und sexuelles Verhalten. Neurosc Biobehav. Rev. 16, 131-144. Carter, CS, Lederhendler, II, Kirkpatrick, B., 1997. Die Interaktive Neurobiologie der Zugehörigkeit, Annalen der New York Academy of Sciences, vol. 807 Die New Yorker Akademie der Wissenschaften, New York. Castelli, MP, Piras, AP, Melis, T., Succu, S., Sanna, F., Melis, MR, Collu, S., Ennas, MG, Diaz, G., Mackie, K., Argiolas, A. , 2007. Cannabinoid-CB1-Rezeptoren im Nucleus paraventricularis und zentrale Kontrolle der Erektion des Penis: Immunzytochemie, Autoradiographie und Verhaltensstudien. Neurowissenschaft 147, 197-206. Chen, KK, Chang, LS, 2003. Wirkung von erregenden Aminosäure-Rezeptor-Agonisten auf die Erektion des Penis nach Verabreichung in den paraventrikulären Kern des Hypothalamus bei Ratten. J. Urol. 62, 575-580. Chen, KK, Chan, JYH, Tschang, LS, Chen, MT, Chang, SHH, 1992. Erbrechen der Erektion des Penis nach Aktivierung der Hippocampus-Formation bei der Ratte. Neurosc Lette. 141, 218-222. Chen, KK, Chan, JYH, Chang, LS, 1999. Dopaminerge Neurotransmission am paraventrikulären Kern des Hypothalamus bei zentraler Regulation der Erektion des Penis bei der Ratte. J. Urol. 162, 237-242. Collins, GT, Truccone, A., Haji-Abdi, F., Newman, AH, Grundt, P., Reis, KC, Ehemänner, SM, Gierig, BM, Enguhard-Gueiffer, C., Gueiffer, A., Chen , J., Wang, S., Katz, JL, Grandy, DK, Sunahara, RK, Woods, JH, 2009. Pro-erektile Effekte von DopaminD2-ähnlichen Agonisten werden durch den D3-Rezeptor in Ratten und Mäusen vermittelt. J. Pharmacol. Exp. Ther. 329, 210-217. Coolen, LM, Allard, J., Truitt, WA, McKenna, KE, 2004. Zentrale Regulierung der Ejakulation. Physiol. Verhalten 83, 203-215. Cui, SS, Bowen, RC, Gu, GB, Hannesson, BK, Yu, PH, Zhang, X., 2001. Prävention des Cannabinoid-Entzugssyndroms durch Lithium: Beteiligung der oxytocinergen neuronalen Aktivierung. J. Neurosc 21, 9867-9876. Dahlström, A., Fuxe, K., 1964. Beweise für die Existenz von monoaminhaltigen Neuronen im Zentralnervensystem. I. Demonstration von Monoaminen in den Zellkörpern von Hirnstammneuronen. Acta Physiol. Scand. 62 (Suppl. 232), 1-54. Depoortère, R., Bardin, L., Rodrigues, M., Abrial, E., Aliaga, M., Newman-Tancredi, A., 2009. Penis Erektion und Gähnen durch Dopamin D2-like-Rezeptor-Agonisten in Ratten induziert: Einfluss der Belastung und Beitrag von Dopamin D2, aber nicht D3 und D4-Rezeptoren. Verhalten Pharmacol. 20, 303-311. Domes, G., Heinrichs, M., Buchel, C., Braus, DF, Herpertz, SC, 2007. Oxytocin dämpft Amygdala-Reaktionen auf emotionale Gesichter unabhängig von der Wertigkeit. Biol. Psychiatrie 62, 11871190. Dominguez, J., Riolo, JV, Xu, Z., Hull, ME, 2001. Regulation durch die mediale Amygdala der Kopulation und mediale präoptische Dopaminfreisetzung. J. Neurosc 21, 349-355. Donaldson, ZR, Junge, LJ, 2009. Oxytocin, Vasopressin und die Neurogenetik der Sozialität. Wissenschaft 322, 900-904. Eaton, RG, Markowski, VF, Lumley, LA, Thompson, JT, Moses, J., Hull, EM, 1991. D2-Rezeptoren im Nucleus paraventricularis regulieren Genitalreaktionen und Kopulation bei männlichen Ratten. Pharmacol. Biochem. Verhalten 39, 177-181. Ebner, K., Bosch, AB, Krömer, SA, Singewald, N., Neumann, ID, 2005. Die Freisetzung von Oxytocin in der zentralen Amygdala der Ratte moduliert das Stress-Coping-Verhalten und die Freisetzung von exzitatorischen Aminosäuren. Neuropsychopharmakologie 30, 223-230. Enguehard-Geiiffier, C., Hübner, H., El Hakmaoui, A., Allouchi, H., Gmeiner, P., Argiolas, A., Melis, MR, Gueiffier, A., 2006. 2 - [(4-Phenylpiperazin-1-yl) methyl] imidazo (di) azin als selektive D4-Liganden. Induktion der Peniserektion durch 2- [4- (2-Methoxyphenyl) piperazin-1-ylmethyl] -imidazo [1,2-a] pyridin (PIP3EA), ein potenter und selektiver D4-Agonist. J. Med. Chem. 49, 3938-3947. Everitt, BJ, 1990. Sexuelle Motivation: Eine neurale und verhaltensanalytische Analyse der Mechanismen, die appetitiven und kopulierenden Reaktionen männlicher Ratten zugrunde liegen. Neurosc Biobehav. Rev. 14, 217-232. Fibiger, HC, Phillips, AG, 1988. Mesocorticelimbisches Dopaminsystem und Belohnung. Ann. N. Y. Acad. Sci 5, 206-215. Französisch, SJ, Totterdell, S., 2003. Einzelne Nucleus accumbens-Projektionsneuronen erhalten sowohl basolaterale Amygdala als auch ventrale subiculare Afferenzen bei Ratten. Neurowissenschaft 119, 19-31. 954 MR Melis, A. Argiolas / Neuroscience und Biobehavioral Bewertungen 35 (2011) 939-955 Freund-Mercier, MJ, Richard, P., 1981. Exzitatorische Effekte intraventrikulärer Oxytocin-Injektionen auf den Milchspendereflex der Ratte. Neurosc Lette. 23, 193-198. Freund-Mercier, MJ, Richard, P., 1984. Elektrophysiologische Beweise für die Erleichterung der Kontrolle von Oxytocin-Neuronen durch Oxytocin während des Säugens bei der Ratte. J. Physiol. (Lond.) 352, 447-466. Freund-Mercier, MJ, Stoeckel, ME, 1995. Somatodendritische Autorezeptoren auf Oxytocin-Neuronen. In: Ivell, R., Russel, JA (Hrsg.), Oxytocin, zelluläre und molekulare Ansätze in der Medizin und Forschung. Erw. Exp. Med. Biol., 365. Plenum Press, New York und London, pp. 185-194. Freund-Mercier, MJ, Stoeckel, ME, Palacios, JM, Pazos, JM, Richard, PH, Porte, A., 1987. Pharmakologische Eigenschaften und anatomische Verteilung von 3H-Oxytocin-Bindungsstellen im Wistar-Rattenhirn, untersucht durch Autoradiographie. Neurowissenschaft 20, 599-614. Giuliano, F., Rampin, O., 2000. Zentrale Kontrolle der Erektion des Penis. Neurosc Biobehav. Rev. 24, 517-533. Giuliano, F., Allard, J., 2001. Dopamin und sexuelle Funktion. Int. J. Impotenz Res. 13 (Suppl. 3), 18-28. Giuliano, F., Rampin, O., 2004. Neurale Kontrolle der Erektion. Physiol. Verhalten 83, 189-201. Giuliano, F., Bernabè, J., McKenna, KE, Longueville, F., Rampin, O., 2001. Spinale properektile Wirkung von Oxytocin in anästhesierten Ratten. Am J. Physiol. Regul. Integ. Komp. Physiol. 280, R1870-R1877. Goto, Y., Gnade, AA, 2005. Dopaminerge Modulation des limbischen und kortikalen Antriebs des Nucleus accumbens im zielgerichteten Verhalten. Nat. Neurosc 8, 805-812. Hawthorn, J., Ang, VT, Jenkins, JS, 1985. Auswirkungen von Läsionen in den hypothalamischen paraventrikulären, supraoptischen und suprachiasmatischen Kernen auf Vasopressin und Oxytocin in Rattenhirn und Rückenmark. Gehirn Res. 346, 51-57. Heier, RF, Dolak, LA, Duncan, JN, Hyslop, DK, Lipton, MF, Martin, LJ, Mauragis, MA, Piercey, MF, Nichols, NF, Schreur, PJ, Smith, MW, Mond, MW, 1997. Synthese und biologische Aktivitäten von (R) -5,6-dihydro-N, N-dimethyl-4H-imidazo [4,5,1-ij] chinolin-5-amin und seinen Metaboliten. J. Med. Chem. 40, 639-646. Hsieh, GC, Hollingsworth, PR, Martino, B., Chang, R., Terranova, MA, O'Neill, AB, Lynch, JJ, Moreland, RB, Donnelly-Roberts, DL, Kolasa, T., Mikusa, JP , McVey, JM, Marsh, KC, Sullivan, JP, Brioni, JD, 2004. Zentrale Mechanismen, die die Erektion des Penis bei wachen Ratten regulieren: die dopaminergen Systeme, die mit der proorektilen Wirkung von Apomorphin in Zusammenhang stehen. J. Pharmacol. Exp. Ther. 308, 330-338. Huang, PL, Dawson, TM, Bredt, DS, Snyder, SH, Fishman, MC, 1993. Gezielte Störung des neuronalen Stickoxid-Synthase-Gens. Zelle 75, 1273-1286. Huber, D., Veinante, P., Stoop, R., 2005. Vasopressin und Oxytocin regen verschiedene neuronale Populationen in der zentralen Amygdala an. Wissenschaft 308, 245-248. Hull, EM, Warner, RK, Bazzett, TJ, Eaton, RC, Thompson, JT, 1989. Das D2 / D1-Verhältnis im medialen präoptischen Bereich beeinflusst die Kopulation männlicher Ratten. J. Pharmacol. Exp. Ther. 251, 422-427. Hull, EM, Du, J., Lorrain, DS, Matuszewich, L., 1995. Extrazelluläres Dopamin im medialen präoptischen Bereich: Implikationen für sexuelle Motivation und hormonelle Kontrolle der Kopulation. J. Neurosc 15, 7465-7471. Rumpf, EM, Meisel, RL, Sachs, BD, 2002. Männliches sexuelles Verhalten. In: Pfaff, DW, Arnold, AP, Etgen, AM, Fahrbach, SE, Rubin, RT (Hrsg.), Hormone, Gehirn und Verhalten. Academic Press, New York, pp. 3-137. Hurlemann, R., Patin, A., Onur, OA, Cohen, MX, Baumgartner, T., Metzler, S., Dziobek, I., Gallinat, J., Wagner, M., Maier, W., Kendrick, KM, 2010. Oxytocin fördert Amygdala-abhängiges, sozial verstärktes Lernen und emotionale Empathie bei Menschen. J. Neurosc 30, 4999-5007. Ivell, R., Russel, JA, 1995. Oxytocin: Zelluläre und molekulare Ansätze in Medizin und Forschung. Fortschritte in der experimentellen Medizin und Biologie, vol. 395 Plenum Presse, New York. Kelley, AE, Domesick, VB, 1982. Die Verteilung der Projektion von der Hippocampus-Formation auf den Nucleus accumbens bei der Ratte: eine anterograde und retrograde Meerrettich-Peroxidase-Studie. Neurowissenschaft 7, 2321-2335. Kimura, Y., Naitou, Y., Wanibuchi, F., Yamaguchi, T., 2008. Die 5-HT (2C) -Rezeptoraktivierung ist ein üblicher Mechanismus für die pro-aktiven Wirkungen von Apomorphin, Oxytocin und Melanotan-II bei Ratten. E. J. Pharmacol. 589, 157-162. Kondo, Y., Sachs, BD, Sakuma, Y., 1998. Bedeutung der medialen Amygdala bei der Erektion der Ratte, hervorgerufen durch Fernimpulse von Östrusweibchen. Verhalten Gehirn Res. 91, 215-222. Kovacs, GL, Sarnyai, Z., Szabo, G., 1998. Oxytocin und Sucht: eine Überprüfung. Psychoneuroendokrinologie 23, 945-962. Lee, HJ, Macbeth, AH, Pagani, JH, Scott Young 3rd, W., 2009. Oxytocin: der große Vermittler des Lebens. Prog. Neurobiol. 88, 127-151. Lindvall, O., Bjorklund, A., Skagerberg, G., 1984. Selektive isochemische Demonstration von Dopamin-terminalen Systemen im Ratten-Di- und Telencephalon: neue Evidenz für die dopaminerge Innervation hypothalamischer neurosekretorischer Kerne. Gehirn Res. 306, 19-30. Liu, YC, Salamone, JD, Sachs, BD, 1997. Beeinträchtigte sexuelle Reaktion nach Läsionen des paraventrikulären Kerns des Hypothalamus bei männlichen Ratten. Verhalten Neurosc 111, 1361-1367. Löber, S., Tschammer, N., Hübner, H., Melis, MR, Argiolas, A., Gmeiner, P., 2009. Das Azulen-Gerüst als neuartiges Bioisostere: Design von potenten Dopamin-D4-Rezeptor-Liganden, die die Erektion des Penis induzieren. Chem. Med. Chem. 4, 325-328. McCleskey, EW, Fox, AP, Feldman, DH, Cruz, LJ, Olivera, BM, Tsien, RW, Yoshikami, D., 1987. _-Conotoxin: direkte und persistente Blockade bestimmter Arten von Kalziumkanälen in Neuronen, aber nicht in Muskeln. Prot. Nat. Acad. Sci USA 84, 4327-4331. McKenna, KE, 2000. Einige Vorschläge bezüglich der Organisation der Kontrolle des zentralen Nervensystems der Erektion des Penis. Neurosc Biobehav. Rev. 24, 535-540. Marson, L., McKenna, KE, 1992. Eine Rolle für 5-Hydroxytryptamin bei der absteigenden Hemmung der spinalen sexuellen Reflexe. Exp. Gehirn Res. 88, 313-318. Marson, L., McKenna, KE, 1996. ZNS-Zellgruppen, die an der Kontrolle der Ischiocavernosus- und Bulbospongiosus-Muskeln beteiligt sind: eine Transneuronal-Tracing-Studie unter Verwendung von Pseudorabies-Virus. J. Komp. Neurol. 374, 161-179. Meisel, RL, Sachs, BD, 1994. Die Physiologie des männlichen Sexualverhaltens. In: Knobil, E., Neil, J. (Hrsg.), Die Physiologie der Fortpflanzung, vol. 2, zweite Ausgabe. Raven Press, New York, pp. 3-96. Melin, P., Kihlstrom, JE, 1963. Einfluss von Oxytocin auf das Sexualverhalten bei männlichen Kaninchen. Endokrinologie 73, 433-435. Melis, MR, Argiolas, A., 1995a. Dopamin und sexuelles Verhalten. Neurosc Biobehav. Rev. 19, 19-38. Melis, MR, Argiolas, A., 1995b. Stickoxid-Donatoren induzieren Penis Erektion und Gähnen, wenn sie in das zentrale Nervensystem von männlichen Ratten injiziert. E. J. Pharmacol. 294, 1-9. Melis, MR, Argiolas, A., 2003. Zentrale Oxytocinerge Neurotransmission: ein Medikament Ziel für die Therapie der psychischen erektilen Dysfunktion. Curr. Drogen Ziele 4, 55-66. Melis, MR, Argiolas, A., Gessa, GL, 1986. Oxytocin-induziertes Gähnen und Peniserektion: Wirkort im Gehirn. Gehirn Res. 398, 259-265. Melis, MR, Argiolas, A., Gessa, GL, 1987. Apomorphin-induziertes Gähnen und Peniserektion: Wirkort im Gehirn. Gehirn Res. 415, 98-104. Melis, MR, Argiolas, A., Gessa, GL, 1989a. Apomorphin erhöht Plasma-Oxytocin-Spiegel bei Ratten. Neurosc Lette. 98, 351-355. Melis, MR, Argiolas, A., Gessa, GL, 1989b. Nachweis, dass Apomorphin Erektion des Penis und Gähnen durch Freisetzung von Oxytocin im zentralen Nervensystem induziert. E. J. Phamacol. 164, 565-570. Melis, MR, Argiolas, A., Stancampiano, R., Gessa, GL, 1990. Wirkung von Apomorphin auf Oxytocin-Konzentrationen in verschiedenen Hirnarealen und Plasma von männlichen Ratten. E. J. Pharmacol. 182, 101-107. Melis, MR, Mauri, A., Argiolas, A., 1994a. Apomorphin- und Oxytocin-induzierte Erektion und Gähnen des Penis bei intakten und kastrierten männlichen Ratten: Wirkung von Sexualsteroiden. Neuroendokrinologie 59, 349-354. Melis, MR, Stancampiano, R., Argiolas, A., 1994b. Penis Erektion und Gähnen induziert durch paraventrikuläre NMDA-Injektionen werden durch Oxytocin vermittelt. Pharmacol. Biochem. Verhalten 48, 203-207. Melis, MR, Stancampiano, R., Argiolas, A., 1994c. Prävention durch NG-Nitro-L-Arginin Methylester von Apomorphin und Oxytocin-induzierter Erektion und Gähnen des Penis: Wirkort im Gehirn. Pharmacol. Biochem. Verhalten 48, 799-804. Melis, MR, Succu, S., Argiolas, A., 1996. Dopaminagonisten erhöhen die Stickstoffoxidproduktion im paraventrikulären Kern des Hypothalamus: Korrelation mit Erektion des Penis und Gähnen. E. J. Neurosc 8, 2056-2063. Melis, MR, Succu, S., Iannucci, U., Argiolas, A., 1997. Oxytocin erhöht die Stickstoffoxidproduktion im paraventrikulären Kern des Hypothalamus: Korrelation mit Erektion und Gähnen des Penis. Reg. Peptide 69, 105-112. Melis, MR, Succu, S., Mauri, A., Argiolas, A., 1998. Die Stickstoffoxidproduktion ist im paraventrikulären Kern des Hypothalamus männlicher Ratten während der kontaktfreien Erektionen und der Kopulation des Penis erhöht. E. J. Neurosc 10, 1968-1974. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 1999a. Der Oxytocin-Antagonist d (CH2) 5Tyr (Me) 2-Orn8-Vasotocin reduziert bei männlichen Ratten kontaktfreie Erektionen des Penis. Neurosc Lette. 265, 171-174. Melis, MR, Succu, S., Spano, MS, Argiolas, A., 1999b. Morphin injiziert in den paraventrikulären Kern des Hypothalamus verhindert kontaktfreie Erektionen und beeinträchtigt die Kopulation: Beteiligung von Stickoxid. E. J. Neurosc 11, 1857-1864. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 2000. Wirkung von exzitatorischen Aminosäure-, Dopamin- und Oxytocinrezeptorantagonisten auf die kontaktfreie Peniserektion und die paraventrikuläre Stickstoffmonoxidproduktion bei männlichen Ratten. Verhalten Neurosc 114, 849-857. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2003. Das extrazelluläre Dopamin erhöht sich im paraventrikulären Kern männlicher Ratten während der sexuellen Aktivität. E. J. Neurosc 17, 1266-1272. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2004a. Antagonismus von Cannabinoid CB1rezeptoren im paraventrikulären Kern von männlichen Ratten induziert Penis Erektion. Neurosc Lette. 359, 17-20. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2004b. Extrazelluläre exzitatorische Aminosäuren nehmen im paraventrikulären Kern männlicher Ratten während der sexuellen Aktivität zu: Hauptrolle der NMDA-Rezeptoren in der erektilen Funktion. E. J. Neurosc 19, 2569-2575. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2005. PD-168,077, ein selektiver Dopamin-D4-Rezeptor-Agonist, induziert eine Erektion des Penis, wenn er in den paraventrikulären Kern männlicher Ratten injiziert wird. Neurosc Lette. 379, 59-62. Melis, MR, Succu, S., Mascia, MS, Sanna, F., Melis, T., Succu, S., Castelli, MP, Argiolas, A., 2006a. SR 141716A-induzierte Peniserektion bei männlichen Ratten: Beteiligung von paraventrikulärer Glutaminsäure und Stickstoffmonoxid. Neuropharmakologie 50, 219-228. Melis, MR, Succu, S., Sanna, F., Mascia, MS, Melis, T., Enguehard-Geiiffier, C., Hubner, H., Gmenier, P., Gueiffier, A., Argiolas, A., 2006b. PIP3EA und PD168077, zwei selektive Dopamin-D4-Rezeptor-Agonisten, induzieren Peniserektion bei männlichen Ratten: Ort und Wirkmechanismus im Gehirn. E. J. Neurosc 24, 2021-2030. Melis, MR, Melis, T., Cocco, C., Succu, S., Sanna, F., Pillolla, G., Boi, A., Ferri, GL, Argiolas, A., 2007. Oxytocin, das in den ventralen Tegmentalbereich injiziert wird, induziert die Erektion des Penis und erhöht das extrazelluläre Dopamin im Nucleus accumbens MR Melis, A. Argiolas / Neuroscience und Biobehavioral Reviews 35 (2011) 939-955 955 und paraventrikulärer Kern des Hypothalamus männlicher Ratten. E. J. Neurosc 26, 1026-1035. Melis, MR, Sanna, F., Succu, S., Zarone, P., Boi, A., Argiolas, A., 2009a. Die Rolle von Oxytocin in den antizipatorischen und konsumatorischen Phasen des Sexualverhaltens männlicher Ratten. In: Jastrow, H., Feuerbach, D. (Hrsg.), Handbuch der Oxytocinforschung: Synthese, Speicherung und Freisetzung, Wirkungen und Arzneiformen. Nova Publishers Inc., New York, USA, pp. 109-125. Melis, MR, Succu, S., Sanna, F., Boi, A., Argiolas, A., 2009b. Oxytocin, das in das ventrale Subiculum oder den posteromedialen kortikalen Kern der Amygdala injiziert wird, induziert die Erektion des Penis und erhöht extrazelluläres Dopamin im Nucleus accumbens männlicher Ratten. E. J. Neurosc 30, 1349-1357. Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., Ferri, GL, Argiolas, A., 2010. Oxytocin induziert Penis Erektion, wenn in das ventrale Subiculum injiziert: Rolle von Stickstoffmonoxid und Glutaminsäure. Neuropharmakologie 58, 1153-1160. Moreland, RB, Nakane, M., Donnelly-Roberts, DL, Miller, LN, Chang, R., Uchic, ME, Terranova, MA, Gubbins, EJ, Helfrich, RJ, Namovic, MT, El-Kouhen, OF, Meister, JN, Brioni, JD, 2004. Vergleichende Pharmakologie von humanen Dopamin D (2) -ähnlichen Rezeptor-stabilen Zelllinien, gekoppelt an Calciumfluss durch Galpha (qo5). Biochem. Pharmacol. 68, 761-772. Moos, F., Freund-Mercier, MJ, Guerne, Y., Guerne, JM, Stoeckel, ME, Richard, P., 1984. Freisetzung von Oxytocin und Vasopressin durch magnozelluläre Kerne in vitro: spezifische fazilitierende Wirkung von Oxytocin auf seine eigene Freisetzung. J. Endocrinol. 102, 63-72. Murphy, MR, Seckl, JR, Burton, S., Checkley, SA, Lightman, SL, 1987. Veränderungen in Oxytocin und Vasopressin Sekretion während der sexuellen Aktivität bei Männern. J. Clin. Endocrinol. Metab. 65, 738-741. Nishimori, K., Young, LJ, Guo, Q., Wang, Z., Insel, TR, Matzuk, MM, 1996. Oxytocin ist für die Stillzeit erforderlich, aber nicht für das Geburts- oder Fortpflanzungsverhalten. Proc Natl. Acad. Sci USA 93, 11699-11704. Patel, S., Freedman, S., Chapman, KL, Emms, F., Fletcher, AE, M. Knowles, M. Marwood, R., Mccallister, G., Myers, J., Curtis, J., Kulagowski, JJ, Leeson, PD, Ridgill, M., Graham, M., Matheson, S., Rathbone, D., Watt, AP, Bristow, LJ, Rupniak, NM, Baskin, E., Lynch, JJ, Ragan, CI 1997. Biologisches Profil von L 745,870, einem selektiven Antagonisten mit hoher Affinität für den Dopamin-D4-Rezeptor. J. Pharmacol. Exp. Ther. 283, 636-647. Pedersen, CA, Caldwell, JD, Jirikowski, GF, Insel, TR, 1992. Oxytocin im mütterlichen, sexuellen und sozialen Verhalten, Annalen der New York Academy of Sciences, vol. 652 Die New Yorker Akademie der Wissenschaften, New York. Petrovic, P., Kalisch, R., Singer, T., Dolan, RJ, 2008. Oxytocin dämpft affektive Bewertungen von konditionierten Gesichtern und Amygdala-Aktivität. J. Neurosc 28, 6607-6615. Pfaus, JG, Everitt, BJ, 1995. Die Psychopharmakologie des Sexualverhaltens. In: Knobil, FE, Kupfer, DJ (Hrsg.), Psychopharmakologie: Die vierte Generation des Fortschritts. Raven Press, New York, pp. 742-758. Rajfer, J., Aronson, WJ, Bush, PA, Dorey, FJ, Ignarro, LJ, 1992. Stickstoffmonoxid als Vermittler der Entspannung des Corpus cavernosum als Reaktion auf nichtadrenerge, nichtcholinerge Neurotransmission. N. Engl. J. Med. 326, 90-94. Roeling, TAP, Van Erp, AMM, W. Meelis, W. Kruk, Veening, JG, 1991. Verhaltenseffekte von NMDA in den hypothalamischen paraventrikulären Kern der Ratte injiziert. Gehirn Res. 550, 220-224. Sachs, BD, 1997. Erektion, hervorgerufen bei männlichen Ratten durch Luftgeruch von weiblichen Frauen. Physiol. Verhalten 62, 921-924. Sachs, BD, 2000. Kontextuelle Ansätze für die Physiologie und Klassifizierung von Erektionsfunktionen, erektiler Dysfunktion und sexueller Erregung. Neurosc Biobehav. Rev. 24, 541-560. Sachs, BD, 2007. Eine kontextuelle Definition der männlichen sexuellen Erregung. Horm Verhalten 51, 569-578. F. Sanchez, JR Alonso, R. Arevalo, E. Blanco, J. Aijon, J. Vazquez, 1994. Koexistenz von NADPH-Diaphorase mit Vasopressin und Oxytocin in den hypothalamischen magnozellulären neurosekretorischen Kernen der Ratte. Zellgewebe Res. 276, 31-34. F. Sanna, S. Succu, A. Boi, MR Melis, A. Argiolas, 2009. Phosphodiesterase-5-Inhibitoren erleichtern die berührungslose Erektion bei männlichen Ratten: Wirkort im Gehirn und Wirkmechanismus. J. Sex. Med. 6, 2680-2689. Saphier, D., Feldman, S., 1987. Auswirkungen von septalen und hippokampalen Stimuli auf paraventrikuläre Nucleusneuronen. Neurowissenschaft 20, 749-755. Sato-Suzuki, I., Kita, I., Oguri, M., Arita, H., 1998. Stereotype gähnende Reaktionen durch elektrische und chemische Stimulation des paraventrikulären Kerns der Ratte. J. Neurophysiol. 80, 2765-2775. Schuman, EM, Madison, DV, 1994. Stickoxid und synaptische Funktion. Ann. Rev. Neurosc 17, 153-183. Snyder, SH, 1992. Stickstoffmonoxid: zuerst in einer neuen Klasse von Neurotransmittern? Wissenschaft 254, 494-496. Sofroniew, MV, 1983. Vasopressin und Oxytocin im Gehirn und Rückenmark von Säugetieren. Trends Neurosci. 6, 467-472. Sokoloff, P., Schwartz, JC, 1995. Ein halbes Jahrzehnt später neuartige Dopamin-Rezeptoren. Trends Pharmacol. Sci 16, 270-275. Southam, E., Garthwaite, J., 1993. Der stickstoffoxid-cyclische GMP-Signalweg im Rattenhirn. Neuropharmakologie 32, 1267-1277. R. Stancampiano, MR Melis, A. Argiolas, 1994. Erektion und Gähnen des Penis, induziert durch 5-HT1c-Agonisten bei männlichen Ratten: Beziehung zur dopaminergen und oxytocinergischen Übertragung. E. J. Pharmacol. 261, 149-155. S. Succu, MS Mascia, F. Sanna, T. Melis, A. Argiolas, MR Melis, 2006. Der Cannabinoid-CB1-Rezeptorantagonist SR 141716A induziert die Erektion des Penis durch Erhöhung der extrazellulären Glutaminsäure im paraventrikulären Kern männlicher Ratten. Verhalten Gehirn Res. 169, 274-281. S. Succu, F. Sanna, T. Melis, A. Boi, A. Argiolas, MR Melis, 2007. Die Stimulierung von Dopaminrezeptoren im paraventrikulären Kern des Hypothalamus männlicher Ratten induziert die Erektion des Penis und erhöht das extrazelluläre Dopamin im Nucleus accumbens: Beteiligung von zentralem Oxytocin. Neuropharmakologie 52, 1034-1043. S. Succu, F. Sanna, C. Cocco, T. Melis, A. Boi, GL Ferri, A. Argiolas, MR Melis, 2008. Oxytocin induziert die Erektion des Penis, wenn es in den ventralen Tegmentbereich männlicher Ratten injiziert wird: die Rolle von Stickstoffmonoxid und cyclischem GMP. E. J. Neurosc 28, 813-821. Tanda, G., Pontieri, FE, Di Chiara, G., 1997. Cannabinoide und Heroinaktivierung der mesolimbischen Dopaminübertragung durch einen gemeinsamen Mu1-Opioidrezeptormechanismus. Wissenschaft 276, 2048-2050. Y. Tang, O. Rampin, A. Calas, P. Facchinetti, F. Giuliano, 1998. Oxytocinergic und serotoninergic Innervation von identifizierten lumbosakralen Kernen, die die Erektion des Penis bei männlichen Ratten kontrollieren. Neurowissenschaft 82, 241-254. Theodose, DT, 1985. Oxytocin-immunreaktive terminale Synapse an Oxytocin-Neuronen in den supraoptischen Kernen. Nature (London) 313, 682-684. Tindall, JS, 1974. Stimuli, die die Freisetzung von Oxytocin verursachen. In: Geiger, SR, Knobil, E., Sawyer, WH, Greef, R., Astwood, EB (Hrsg.), Handbook of Physiology. Sekte. 7, Endocrinology, vol. IV. American Physiology Society, Washington DC, pp. 257-267. G. Torres, S. Lee, C. Rivier, 1993. Ontogenese der hypothalamischen Stickoxidsynthase der Ratte und Kolokalisation mit Neuropeptiden. Mol. Zelle Neurosc 4, 155-163. Uhl-Bronner, S., Waltisperger, E., Martinez-Lorenzana, G., Condes, LM, Freund-Mercier, MJ, 2005. Sexuell dimorphe Expression von Oxytocin-Bindungsstellen im Vorderhirn und im Rückenmark der Ratte. Neurowissenschaft 135, 147-154. Vaccari, C., Lolait, SJ, Ostrowski, NL, 1998. Vergleichende Verteilung von Vasopressin V1b und Oxytocinrezeptor-Botenstoff Ribonukleinsäuren im Gehirn. Endokrinologie 139, 5015-5033. Van Den Pol, A., 1991. Glutamat- und Aspartat-Immunreaktivität in hypothalamischen präsynaptischen Axonen. J. Neurosc 11, 2087-2101. Veronneau-Longueville, F., Rampin, O., Freund-Mercier, MJ, Tang, Y., Calas, A., Marson, L., McKenna, KE, Stöckel, ME, Benoit, G., Giuliano, F. 1999. Oxytocinergic Innervation autonomer Kerne, die die Erektion des Penis bei der Ratte kontrollieren. Neurowissenschaft 93, 1437-1447. Vincent, SR, Kimura, H., 1992. Histochemische Kartierung von Stickoxidsynthase im Rattenhirn. Neurowissenschaft 46, 755-784. Wagner, CK, Clemens, LG, 1993. Neurophysin-haltiger Stoffwechselweg vom paraventrikulären Kern des Hypothalamus zu einem geschlechtsdimorphen Motorkern im Lendenrückenmark. J. Komp. Neurol. 336, 106-116. Winslow, JT, Insel, TR, 1991. Der soziale Status in Paaren von männlichen Eichhörnchenaffen bestimmt die Verhaltensreaktion auf die zentrale Verabreichung von Oxytocin. J. Neurosc 11, 2032-2038. Wise, RA, Rompre, P.-P., 1989. Gehirn Dopamin und Belohnung. Ann. Rev. Psychol. 40, 191-225. Witt, DM, Insel, TR, 1994. Männliches Sexualverhalten aktiviert c-fos-ähnliches Protein in Oxytocin-Neuronen im paraventrikulären Kern des Hypothalamus. J. Neuroendocrinol. 6, 13-18. Witter, MP, 2006. Verbindungen des Subikulums der Ratte: Topographie in Bezug auf die säulen- und laminare Organisation. Behav Gehirn Res. 174, 251-264. Woodruff, GN, Foster, AC, Gill, R., Kemp, JA, Wong, EH, Iversen, LL, 1987. Die Wechselwirkung zwischen MK-801 und Rezeptoren für N-Methyl-d-Aspartat: funktionelle Konsequenzen. Neuropharmakologie 26, 903-909. H. Yamashita, O. Shigeru, K. Inenaga, M. Kasai, S. Uesugi, H. Kannan, H., T. Kaneko, 1987. Oxytocin regt in vitro vorwiegend mutmaßliche Oxytocin-Neuronen im supraoptischen Kern der Ratte an. Gehirn Res. 416, 364-368. Yells, DP, Hendricks, SE, Prendergast, MA, 1992. Läsionen des Nucleus paragigantocellularis: Auswirkungen auf das Paarungsverhalten bei männlichen Ratten. Gehirn Res. 596, 73-79. Young, WS, Shepard, E., Amico, J., Hennighausen, L., LaMarca, ME, McKinney, C., Ginns, EI, 1996. Ein Mangel an Maus-Oxytocin verhindert den Milchausstoß, nicht aber die Fruchtbarkeit oder Geburt. J. Neuroendocrinol. 8, 847-854. AR Zahran, P. Vachon, F. Courtois, S. Carrier, 2000. Erhöht den intrakavernären Penisdruck nach Injektionen von exzitatorischen Aminosäurerezeptor-Agonisten in den paraventrikulären Hypothalamuskern von anästhesierten Ratten. J. Urol.