- 1Département des sciences biomédicales, Section des neurosciences et de la pharmacologie clinique et Centre d'excellence pour la neurobiologie des toxicomanies, Université de Cagliari, Cagliari, Italie
- 2Département des sciences de la vie et de l'environnement, section des sciences pharmaceutiques, pharmacologiques et nutraceutiques, Université de Cagliari, Cagliari, Italie
- 3Institut des neurosciences, Conseil national de recherches, section de Cagliari, Cittadella Universitaria, Cagliari, Italie
Les rats non consanguins romains High RHA (RHA) et Low-Evitement (RLA), qui diffèrent pour une acquisition respectivement rapide ou médiocre de la réponse d'évitement actif dans la boîte navette, présentent des différences d'activité sexuelle lorsqu'ils sont mis en présence d'un agent sexuel. rat femelle réceptif. En effet, les rats RHA présentent des niveaux plus élevés de motivation sexuelle et de performance copulatoire que les rats RLA, qui persistent également après une activité sexuelle répétée. Ces différences ont été corrélées à une tonalité plus élevée du système dopaminergique mésolimbique des rats RHA par rapport aux rats RLA, révélée par la plus grande augmentation de dopamine trouvée dans le dialysat obtenu à partir du noyau accumbens de la RHA par rapport aux rats RLA au cours de l'activité sexuelle. Ce travail montre que la dopamine et la noradrénaline (NA) extracellulaires augmentent également dans le dialysat à partir du cortex préfrontal médian (mPFC) de rats RHA et RLA mâles mis en présence d'un rat femelle inaccessible et plus nettement lors d'une interaction sexuelle directe. De telles augmentations de la dopamine (et de son principal métabolite, 3,4-acide dihydroxyphénylacétique, DOPAC) et de la NA ont été observées chez des animaux naïfs et expérimentés, mais elles étaient plus élevées: (i) chez les rats RLA que chez les rats RLA; et (ii) chez des rats RHA et RLA expérimentés sexuellement que chez leurs homologues naïfs. Enfin, les différences de dopamine et de NA dans la mPFC sont concomitantes à celles ayant une activité sexuelle, les rats RHA présentant des niveaux supérieurs de motivation sexuelle et de performance copulatoire par rapport aux rats RLA dans les conditions sexuellement naïves et expérimentées. Ces résultats suggèrent qu'un tonus dopaminergique plus élevé se produit également dans la mPFC, ainsi qu'un tonus noradrénergique accru, qui pourrait être impliqué dans les différents modèles de copulation trouvés chez les rats RHA et RLA, comme suggéré pour le système dopaminergique mésolimbique.
Introduction
Les lignées de rats hybrides romaines High RHA (RHA) et Low-Evitement (RLA), sélectionnées à l'origine pour l'acquisition respectivement rapide ou médiocre de la réponse d'évitement actif dans la boîte navette (Bignami, 1965; Broadhurst et Bignami, 1965; Driscoll et Bättig, 1982; Fernández-Teruel et al., 2002; Giorgi et al., 2007) présentent des différences significatives d'activité sexuelle lorsqu'elles sont mises en présence d'une rat femelle sexuellement réceptive. En effet, les rats RHA présentent des niveaux plus élevés de motivation sexuelle que les rats RLA, comme en témoigne le nombre plus élevé d'érections péniennes sans contact que ces rats ont montré lorsqu'ils sont mis en présence d'une femelle réceptrice inaccessible, et de meilleures performances de copulation que les rats RLA, comme l'a révélé par les différences significatives de nombreux paramètres de copulation trouvés principalement dans le premier test de copulation entre les deux lignées de rat, mais aussi après cinq tests de copulation, bien que atténués (Sanna et al., 2014a). Parmi les différences les plus marquées entre les rats RHA et RLA, on note le pourcentage de rats qui initient le montage et l’intromission et qui éjaculent lors du premier test de copulation, respectivement 80% des rats RHA et 40% des rats RLA (Sanna et al., 2014a). Un grand nombre de preuves expérimentales suggèrent qu'un ton dopaminergique différent sur le plan fonctionnel est impliqué dans les différences de copulation entre les rats RHA et RLA. En fait, l’apomorphine, un agoniste mixte des récepteurs de la dopamine D1 / D2 administré à des doses facilitant le comportement sexuel, et de l’halopéridol, un antagoniste des récepteurs de la dopamine D2, administré à faibles doses qui inhibent le comportement sexuel (Sanna et al., 2014b). En conséquence, il a été démontré que les rats RLA sont plus sensibles à la facilitation et à l'inhibition du comportement sexuel induites respectivement par l'apomorphine et l'halopéridol, comme le montrent les modifications plus importantes induites par les deux médicaments, principalement lorsqu'elles sont administrées à des doses plus faibles avec des paramètres de copulation différents Rats RLA par rapport aux rats RHA (Sanna et al., 2014b). Peut-être plus important pour cette étude, les différents modèles de copulation des rats RHA et RLA sont également liés aux différences d'activité des neurones dopaminergiques mésolimbiques, dont l'activité est connue pour augmenter au cours du comportement sexuel (Pfaus et al., 1990; Pleim et al., 1990; Pfaus et Phillips, 1991; Damsma et al., 1992; Wenkstern et al., 1993; Balfour et al., 2004; Pitchers et al., 2010, 2013; Beloate et al., 2016). En effet, malgré le fait que les rats RHA et RLA sexuellement naïfs et sexuellement expérimentés ont des valeurs basales similaires de la dopamine extracellulaire dans le dialysat du noyau accumbens, les concentrations de dopamine extracellulaire et d’acide 3,4-dihydroxyphénylacétique (DOPAC, l’un de ses principaux métabolites) ), se sont révélés augmenter différentiellement dans les dialysats obtenus à partir de la coquille de noyau accumbens de rats RHA et RLA naïfs et sexuellement expérimentés dans les phases à la fois anticipative et consommatrice du comportement sexuel. Les différences ci-dessus étaient plus marquées entre les rats RHA et RLA naïfs sexuellement, mais persistaient entre les rats RHA et RLA expérimentés sexuellement, bien qu'elles aient tendance à diminuer chez ces rats, comme le montrent les différences de comportement sexuel (Sanna et al., 2015).
Le rôle fonctionnel des augmentations de l'activité dopaminergique dans le noyau accumbens observé au cours de l'activité sexuelle (soit dans les phases d'appétit et de consommation du comportement sexuel) fait encore l'objet de débats, de même que celui observé lors de l'alimentation qui, tout comme l'activité sexuelle, a valence de motivation. Ainsi, bien que la dopamine dans le noyau accumbens soit impliquée dans la motivation et que les neurones dopaminergiques mésolimbiques soient généralement appelés neurones gratifiants, au cours des dernières années 15, des études récentes confirment l'hypothèse selon laquelle la dopamine mésolimbique ne serait pas impliquée dans l'expression primaire de comportements motivés ou valorisants. mais plutôt avec l’apprentissage et la mémoire des associations stimulus-récompense (Agmo et al., 1995; Berridge et Robinson, 1998; Ikemoto et Panksepp, 1999; Pitchers et al., 2013, 2014; Beloate et al., 2016; Salamone et al., 2016). Conformément à cette hypothèse, le blocage des récepteurs de la dopamine dans le noyau accumbens ou l’inactivation des neurones dopaminergiques dans la région du tegmental ventral ont été récemment trouvés incapables de modifier l’expression des aspects appétitifs et consommatifs du comportement copulateur chez le rat mâle (Pitchers et al., 2013, 2014; Beloate et al., 2016).
Cependant, un rôle d'autres régions du cerveau contenant de la dopamine dans les différences de comportement sexuel susmentionnées entre les rats RHA et RLA ne peut être exclu. En conséquence, il est bien connu que la dopamine exerce des effets facilitants sur les phases antagoniste et comportementale du comportement sexuel chez les animaux de laboratoire ainsi que chez l'homme non seulement dans le noyau accumbens (Everitt, 1990; Pfaus et al., 1990; Hull et al., 1991; Pfaus et Everitt, 1995; Melis et Argiolas, 2011), mais aussi dans d’autres régions du cerveau, telles que la région préoptique médiale, l’hypothalamus et ses noyaux (c’est-à-dire le noyau paraventriculaire (PVN); Pfaus et Phillips, 1991; Argiolas et Melis, 1995, 2005, 2013; Hull et al., 1995, 1999; Melis et Argiolas, 1995; Melis et al., 2003; Succu et al., 2007; Pfaus, 2010). Un autre domaine contenant de la dopamine et pouvant jouer un rôle dans le comportement sexuel est le cortex préfrontal médial (mPFC; Fernández-Guasti et al., 1994; Agmo et Villalpando, 1995; Agmo et al., 1995; Hernández-Gonzáles et al., 1998, 2007; Kakeyama et al., 2003; Balfour et al., 2006; Afonso et al., 2007; Davis et al., 2010; Febo, 2011). En fait, dans cette zone cérébrale, se trouvent les terminaisons nerveuses des neurones dopaminergiques mésocorticaux, avec leurs corps cellulaires localisés dans la région tegmentale ventrale en tant que neurones dopaminergiques mésolimbiques. Quant au noyau accumbens, le rôle exact de cette région cérébrale dans le comportement sexuel est loin d’être clair. En effet, on constate généralement que les lésions de la mPFC ne peuvent modifier le comportement sexuel de rats mâles avec une femelle sexuellement réceptive (Fernández-Guasti et al., 1994; Agmo et Villalpando, 1995; Agmo et al., 1995; Hernández-Gonzáles et al., 1998, 2007; Kakeyama et al., 2003; Balfour et al., 2006; Afonso et al., 2007), ni l'expression de la préférence du lieu conditionné pour la récompense sexuelle (Davis et al., 2010). Cependant, les lésions mPFC, qui n'altéraient pas l'apparence de la préférence du lieu conditionnée pour la récompense sexuelle, supprimaient chez les mêmes animaux la possibilité de former une aversion conditionnée pour l'activité sexuelle lorsqu'ils étaient associés à des stimuli aversifs (Davis et al., 2010) et une mise à feu sélective de cellules lors d'approches de comportements d'un rat mâle envers une femelle sexuellement réceptive inaccessible ont été mesurées dans la mPFC de rats mâles (Febo, 2011). Ces résultats suggèrent que l’activation de la mPFC pendant le comportement sexuel joue un rôle dans l’intégration d’informations internes et externes pour l’exécution et le contrôle de comportements orientés vers un objectif plutôt que dans l’expression de réponses innées aux renforçateurs naturels (voir plus loin). Goto et Grace, 2005). En conséquence, avec le noyau accumbens, le mPFC fait partie d’un système neuronal complexe impliqué dans la modulation du comportement motivé (comportement orienté vers l’objectif), ce qui nécessite l’intégration des informations cognitives du mPFC, des informations émotionnelles de l’amygdale et du contexte. informations connexes de l'hippocampe, dans le noyau accumbens (Goto et Grace, 2005).
Des preuves expérimentales suggèrent que la libération de dopamine dans la mPFC est impliquée dans la régulation adaptative du comportement motivé, et qu'une dérégulation de ces mécanismes jouerait un rôle dans des états pathologiques ou mésadaptés, tels que les troubles psychiatriques tels que la schizophrénie, le déficit de l'attention et les troubles hyperactifs ( TDAH), dépression (Dunlop et Nemeroff, 2007; Masana et al., 2011), ou toxicomanie et comportement de jeu (Everitt et Robbins, 2005). Fait intéressant, l’activité de la dopamine libérée dans la mPFC peut être influencée par la noradrénaline (NA), présente dans la mPFC à des niveaux plus élevés que la dopamine, et en particulier par le transporteur de NA (NET), qui est non seulement plus abondante que la transporteur de dopamine (DAT) dans la mPFC (Carboni et al., 1990, 2006; Gresch et al., 1995; Westernik et al., 1998), mais montre également une affinité pour la dopamine même supérieure à celle pour NA (Corne, 1973). Étant donné que la dopamine et la NA coopèrent souvent dans de nombreuses fonctions de la mPFC, de la mémoire de travail à la formation d’attention, en passant de l’apprentissage à l’inversion, à l’inhibition de la réponse et à la réponse au stress (voir Robbins et Arnsten, 2009), cela laisse à penser que la dopamine, seule ou avec NA, dans la mPFC pourrait également jouer un rôle dans les différences de comportement entre les rats RHA et RLA, y compris ceux présents dans le comportement sexuel.
Afin de tester cette hypothèse, l'activité du système dopaminergique mésocortical et du système noradrénergique dans le mPFC a été étudiée dans les deux lignées de rats RHA et RLA par microdialyse intracérébrale. En résumé, la dopamine (et son principal métabolite, la DOPAC) et la NA ont été mesurés dans des dialysats obtenus à partir des compartiments prélimbique (PrL) et infralimbique (IL) de la mPFC de sexuellement naïfs (par exemple, jamais exposés à une femme réceptive) et sexuellement expérimentés. Les rats RLA (ayant par exemple subi cinq tests de copulation préliminaires et montrant des niveaux d'activité de copulation constants) lorsqu'ils sont mis en présence d'une femelle réceptrice inaccessible et lors d'une interaction sexuelle directe par chromatographie liquide à haute pression couplée à une détection électrochimique (HPLC-ECD).
Matériels et méthodes
Animaux
Rats mâles RHA et RLA non consanguins (N = 30 pour chaque ligne, pesant 300 g au début du travail expérimental) provenaient tous de la colonie fondée à 1998 à l’Université de Cagliari, en Italie (Giorgi et al., 2007). Les procédures utilisées pour l’élevage sélectif de la colonie sarde ont déjà été décrites en détail (Giorgi et al., 2005).
Des rats femelles SD stimulées ovariectomisées (250 – 300 g au début du travail expérimental) utilisées dans toutes les expériences ont été obtenues auprès d'Envigo (San Pietro al Natisone, Italie). Les animaux ont été acclimatés quatre fois par cage (38 cm × 60 cm × 20 cm) aux locaux du Département de sciences biomédicales de l'Université de Cagliari pendant un minimum de 10 jours avant le début des expériences, à 24 ° C, humidité relative 60%, cycle lumière / obscurité 12 h inversé (lumières éteintes de 08: 00 h à 20: 00 h), eau et aliments de laboratoire standard ad libitum. Les animaux ont été manipulés quotidiennement pendant 1 – 2 min tout au long de la période d'habituation, afin de limiter le stress lié à la manipulation pendant les expériences; de plus, le contact avec le personnel d'entretien de l'animalerie était limité à un seul surveillant et la literie dans les cages de la maison n'était jamais changée ni la veille ni le jour des expériences. Toutes les expériences ont été effectuées entre 10: 00 h et 18: 00 h. Cette étude a été réalisée conformément aux recommandations des directives des Communautés européennes, de la directive de septembre 22, 2010 (2010 / 63 / EU) et de la législation italienne (DL March 4, 2014, n. 26). Le protocole a été approuvé par le comité d'éthique pour l'expérimentation animale de l'université de Cagliari (autorisation n ° 361 / 2016-PR, avril 08, 2016 à FS).
Groupes expérimentaux
Des rats mâles RHA et RLA sexuellement naïfs et sexuellement expérimentés ont été utilisés. Les rats sexuellement naïfs étaient des rats jamais exposés à une femelle sensibilisée sexuellement réceptive-ovariectomisée et à l'estradiol + progestérone; les rats sexuellement expérimentés étaient des rats qui avaient déjà subi cinq tests de copulation consécutifs de 60 min à des intervalles de 3 jours avec une femelle réceptive (Sanna et al., 2014a,b). Les femelles ont été amenées dans l'oestrus par traitement avec du benzoate d'œstradiol sous-cutané (200 μg / rat dans de l'huile d'arachide) et de la progestérone (0.5 mg / rat dans de l'huile d'arachide), 48 h et 6 h avant les tests de copulation, respectivement. Oestrus a été vérifié par coloration de May-Grunwald-Giemsa et examen microscopique des frottis vaginaux 1 h avant les expériences. En accord avec les études précédentes (Sanna et al., 2014a,b, 2015) cinq tests de copulation préliminaires ont été jugés suffisants pour que des rats romains mâles des deux lignées présentent des niveaux d'activité de copulation constants: par exemple, des rats RHA et RLA sexuellement expérimentés remplissaient le critère d'au moins une éjaculation réalisée dans chacun des deux derniers tests (un rat RHA et deux rats RLA qui ne répondaient pas à ce critère ont été écartés au cours de cette phase). Deux jours après ces tests de copulation préliminaires, des rats romains expérimentés sexuellement ont subi une chirurgie stéréotaxique pour l'implantation d'une sonde de microdialyse dans le mPFC, comme décrit ci-dessous (Sanna et al., 2015).
Microdialyse dans le CPFm lors du comportement sexuel
La veille de la microdialyse, des rats sexuellement naïfs ou expérimentés ont été placés dans un appareil stéréotaxique (Stoelting Co., Wood Dale, IL, USA) sous anesthésie à l'isoflurane (1.5% --2%; Harvard Apparatus, Holliston, MA, USA). et implanté avec une sonde de microdialyse verticale faite maison (membrane de dialyse ≈3 mm de surface libre; Melis et al., 2003) et dirigés unilatéralement vers les compartiments mPFC, PrL et IL (coordonnées: 3.0 mm antérieur et 0.7 mm latéral à bregma et 5.5 mm ventral à dura; Paxinos et Watson, 2004). Le jour de l’expérience, les animaux ont été transférés pendant la phase sombre du cycle dans la cage d’accouplement (45 cm × 30 cm × 24 cm) située dans une pièce insonorisée éclairée par une lumière rouge tamisée et se trouvant à l’intérieur d’un autre petite cage en plexiglas (15 cm × 15 cm × 15 cm) avec trous 25 (Ø 2 mm) dans les parois verticales pour permettre une interaction visuelle, olfactive et acoustique mais pas directe. Après une période d'accoutumance de 2 h, la sonde de microdialyse a été connectée à une pompe de micro-infusion CMA / 100 (Harvard Apparatus, Holliston, MA, États-Unis) avec un tube en polyéthylène et perfusée avec une solution de Ringer (147 mM NaCl, 3 mM KCl et 1.2 mM CaCl2, pH 6.5), à un débit de 2.5 μl / min. Après une période d’équilibrage de 2 h du milieu de perfusion avec le liquide extracellulaire, des aliquotes de dialysat de 37.5 μL ont été collectées toutes les minutes 15 au cours de l’expérience dans des tubes en polyéthylène refroidis à la glace pour la mesure de la concentration en dopamine, DOPAC et NA, comme décrit au dessous de. Après la collecte d'au moins quatre aliquotes de dialysat, une rat femelle réceptive a été introduite dans la petite cage située à l'intérieur de la cage d'accouplement pour 30 min. Au cours de ces 30 min, deux autres aliquotes de dialysat ont été recueillies. Dans ces conditions, les rats mâles ne peuvent pas interagir directement avec la femelle, mais présentent des érections sans contact (voir ci-dessous). Après cette période, la petite cage a été retirée, la copulation a été autorisée pendant 75 min et cinq autres aliquotes de dialysat ont été recueillies. À la fin de cette période, la femelle a ensuite été retirée de la cage d’accouplement et une aliquote supplémentaire de dialysat a été recueillie (Pfaus et Everitt, 1995; Melis et al., 2003; Sanna et al., 2015). Les paramètres sexuels liés aux phases d'anticipation et de consommation du comportement sexuel ont été enregistrés tout au long de l'expérience (voir ci-dessous).
Comportement sexuel
Plusieurs paramètres de la motivation sexuelle et de la performance copulatoire liés aux phases d'anticipation et de consommation du comportement sexuel ont été enregistrés tout au long de l'expérience par un observateur non informé des conditions expérimentales spécifiques, par exemple, ceux qui ne connaissaient pas la ligne et le niveau d'expérience sexuelle. des animaux utilisés dans cette expérience (voir ci-dessous). En bref, la latence jusqu’à la première érection sans contact (NCPEL, calculée à partir de l’introduction de la femelle réceptive dans la petite cage interne) et leur fréquence (NCPEF, le nombre d’érections péniennes sans contact qui se produisent pendant la période au cours de laquelle la femme est présents dans la cage interne) ont été enregistrés. Ces érections du pénis provoquées par des phéromones, qui surviennent chez des rats mâles sexuellement puissants en présence d'une femelle réceptive inaccessible, sont considérées comme un indice important de l'excitation sexuelle (Sachs et al., 1994; Sachs, 2000; Melis et al., 2003). Lorsque l'interaction sexuelle était autorisée, par exemple pendant la copulation, latence pour monter et s'introduire (ML et IL, à compter de l'enlèvement de la petite cage interne jusqu'à la première montée ou la première intromission, respectivement); fréquence de montage et d'intrusion (MF et IF, le nombre de montages et d'intromissions, respectivement, dans la première série d'activités de copulation et pendant toute la période de copulation); latence à l'éjaculation (EL, à partir de la première intromission de la première série jusqu'à l'éjaculation); la fréquence de l'éjaculation (EF, nombre total d'éjaculations au cours du test de copulation) et l'intervalle post-éjaculatoire (PEI, programmé de la première éjaculation à la prochaine intromission) ont été enregistrés. En outre, l'efficacité copulatoire (CE; le nombre d'intromissions d'une série donnée divisée par la somme du nombre de montages et d'intromissions d'une même série) et l'intervalle d'inter-intromission (III), le rapport entre le temps de latence de l'éjaculation d'une série donnée. et le nombre d’intromissions de cette série) ont également été calculés pour la première série d’activités copulatoires (Sachs et Barfield, 1976; Meisel et Sachs, 1994; Melis et al., 2003; Sanna et al., 2014a,b, 2015).
Détermination des concentrations de dopamine, de DOPAC et de noradrénaline dans le dialysat du mPFC
Les concentrations de dopamine, DOPAC et NA ont été mesurées dans 20 μL de la même aliquote de dialysat provenant du mPFC par chromatographie liquide à haute pression (HPLC) couplée à la détection électrochimique à l'aide d'une cellule double 4011 (Coulochem II, ESA, Cambridge, MA, USA). déjà décrit (Melis et al., 2003). La détection a été réalisée en mode réduction à + 350 et -180 mV. La CLHP a été équipée d’une colonne Supelcosil C18 (7.5 cm x 3.0 mm id, taille de particule 3; Supelco, Supelchem, Milan, Italie), éluée avec du citrate / acétate 0.06 µm, contenant du méthanol 4.2% v / v, 20. EDTA mM, triéthylamine 0.1 uM et dodécyl sulfate de sodium 1 mM sous forme de phase mobile, à un débit de 0.03 mL / min et à la température ambiante. La sensibilité du test était 0.6 pg pour la dopamine, 0.125 pg pour DOPAC et 0.1 pg pour NA.
Histologie
À la fin des expériences, les rats ont été tués par décapitation, les cerveaux immédiatement retirés du crâne et immergés dans du formaldéhyde aqueux à 4% pendant 12 – 15 jours. Après cette période, des coupes cérébrales coronales de 40 en µm ont été préparées avec un microtome à congélation, colorées au rouge neutre et inspectées au microscope à contraste de phase. La position de la pointe de la sonde a ensuite été localisée dans la mPFC en suivant le trajet de la sonde à travers une série de coupes au cerveau (voir la figure 1). Seuls les rats dont la partie active de la membrane de dialyse était correctement positionnée dans les compartiments PrL et IL de la mPFC ont été pris en compte pour l'évaluation statistique des résultats (un rat de chaque groupe expérimental a été écarté au cours de cette phase).
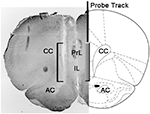 Figure 1. Représentation schématique d'une coupe coronale du cerveau de rat montrant la trace de la sonde de microdialyse dans les parties PrL et IL du cortex préfrontal médial (mPFC; Paxinos et Watson, 2004). Le crochet de la microphotographie indique la partie de la section teintée au rouge neutre montrant la partie active de la membrane de dialyse de la sonde de microdialyse. Abréviations: PrL, zone prélimbique; IL, zone infralimbique; AC, commissura antérieure; CC, corps calleux.
Figure 1. Représentation schématique d'une coupe coronale du cerveau de rat montrant la trace de la sonde de microdialyse dans les parties PrL et IL du cortex préfrontal médial (mPFC; Paxinos et Watson, 2004). Le crochet de la microphotographie indique la partie de la section teintée au rouge neutre montrant la partie active de la membrane de dialyse de la sonde de microdialyse. Abréviations: PrL, zone prélimbique; IL, zone infralimbique; AC, commissura antérieure; CC, corps calleux.
Statistique
Des analyses statistiques de données biochimiques (dopamine, DOPAC et NA) et comportementales (NCPEL et NCPEF, ML, IL et EL, MF, IF et EF et PEI) ont été effectuées, incluant tous les sujets expérimentaux (comme le faisaient traditionnellement les études sur les rats mâles). comportement copulatoire) ou en excluant les sujets qui n’ont pas copulé avec l’éjaculation au cours de l’expérience de microdialyse. Dans le premier cas, lorsque tous les animaux ont été inclus dans les analyses, les animaux ne présentant pas de NCPE dans le temps où la femelle était inaccessible ou qui ne montaient pas, n'introduisaient pas ou n'éjaculaient pas avec la femelle disponible se voyaient attribuer les scores respectifs de la plage complète: 1800 s le mâle n'a pas affiché de NCPE dans le 30 min dans lequel la femelle était inaccessible; 900 s pour ML et IL si le mâle ne monte pas ou n’intromit pas avec la femelle disponible; 1800 pour EL si le mâle n’a pas atteint l’éjaculation et 600 pour PEI si le mâle n’est pas intromit après la première éjaculation. Dans le second cas, les animaux qui ne copulaient pas avec l'éjaculation ont été exclus des analyses. Cette étude visait à déterminer si les différences de comportement sexuel pouvaient être corrélées aux différences de concentrations de dopamine extracellulaire, de DOPAC et de NA dans la mPFC des lignées de rats romains au cours des deux phases de l'activité sexuelle, ce qui exclut toute possibilité de confusion pouvant entraîner des interférences dues à l'inclusion. des sujets qui n’ont pas montré de comportement sexuel en leur attribuant des valeurs fixes pour les paramètres sexuels analysés.
Plusieurs analyses statistiques ont été réalisées avec des ANOVA afin de détecter et de mieux caractériser les différences possibles entre les conditions expérimentales utilisées. Avant de réaliser des ANOVA, les ensembles de données de chacune des différentes variables expérimentales ont été examinés pour vérifier l’homogénéité des variances entre les quatre groupes expérimentaux (réalisés avec tous les animaux ou avec des rats copulant uniquement à l’éjaculation) avec le test de Bartlett ou de Levine, selon le cas. Lorsque des différences significatives dans les variances ont été trouvées, les ensembles de données ont été transformés en logarithme (c'est-à-dire que les valeurs expérimentales Y ont été modifiées en valeurs Log Y), vérifiés de nouveau pour vérifier l'homogénéité des variances, puis analysés par ANOVA. En bref, les paramètres comportementaux obtenus avant (par exemple avec la femme inaccessible) et au cours de la première série d'activités copulatoires (du premier montage / intromission au premier montage / intromission après la première éjaculation) de rats RHA et RLA mâles naïfs et sexuellement expérimentés pendant la microdialyse ont été analysés par ANOVA à deux voies, en utilisant la lignée de rat et le niveau d'expérience sexuelle entre les facteurs du sujet (les valeurs moyennes des paramètres comportementaux sont reportées dans le tableau). 1 et par F valeurs et niveaux de signification des analyses ANOVA dans le tableau 2).
 Tableau 1. Paramètres de copulation mesurés dans la première série d'activité copulatoire (qui commence par la première monture / intromission lorsque la femme est rendue accessible au mâle et se termine après l'intervalle post-éjaculatoire avec la première monture / intramission de la deuxième série) et le pénis sans contact érections de rats sexuellement naïfs et expérimentés RHA et RLA.
Tableau 1. Paramètres de copulation mesurés dans la première série d'activité copulatoire (qui commence par la première monture / intromission lorsque la femme est rendue accessible au mâle et se termine après l'intervalle post-éjaculatoire avec la première monture / intramission de la deuxième série) et le pénis sans contact érections de rats sexuellement naïfs et expérimentés RHA et RLA.
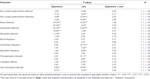 Tableau 2. F les valeurs et les niveaux de signification de l'ANOVA bidirectionnelle réalisée sur les données reportées dans le tableau 1 en utilisant la lignée de rat (RHA vs. RLA) et le niveau d'expérience sexuelle (naïf vs. expérimenté) comme facteur de sujet.
Tableau 2. F les valeurs et les niveaux de signification de l'ANOVA bidirectionnelle réalisée sur les données reportées dans le tableau 1 en utilisant la lignée de rat (RHA vs. RLA) et le niveau d'expérience sexuelle (naïf vs. expérimenté) comme facteur de sujet.
En outre, une analyse globale des données obtenues de chaque rat au cours de la microdialyse a été réalisée en calculant d'abord les AUC obtenues en traçant les valeurs des concentrations de dopamine, DOPAC ou NA ou le nombre d'érections, de montages, d'intromissions et d'éjaculations sans contact. Temps (commençant à partir de 1 h après l'introduction du rat mâle dans la cage d'accouplement jusqu'à la fin de l'expérience) -180 min divisé en fractions de 15 min pour les valeurs neurochimiques ou au moment où la femelle a été introduite dans la cage d'accouplement pour les paramètres comportementaux) et ensuite en comparant les valeurs calculées par ANOVA à deux voies en utilisant la lignée de rat et le niveau d'expérience sexuelle entre les facteurs du sujet (les valeurs moyennes des AUC des paramètres neurochimiques et comportementaux sont rapportées dans le tableau 4 et par F valeurs et niveaux de signification des analyses ANOVA dans le tableau 5). Enfin, une analyse point par point plus détaillée de chaque ensemble de données (c'est-à-dire les valeurs des concentrations de dopamine, DOPAC, NA et le nombre d'érections, de montages, d'intromissions et d'éjaculations sans contact en fonction du temps) a été effectuée par analyse factorielle. ANOVA pour mesures répétées, en utilisant la lignée de rat et le niveau d'expérience sexuelle entre les facteurs du sujet et le temps (c.-à-d. Les fractions de dialysat) comme facteur intra-sujet (le facteur F les valeurs et les niveaux de signification de ces analyses ANOVA sont reportés dans le tableau 6). Des analyses similaires ont également été menées en considérant uniquement les valeurs de base des paramètres neurochimiques (les quatre dernières aliquotes de dialysat recueillies avant l’introduction dans la cage d’accouplement de la femelle réceptive), dont les valeurs moyennes sont reportées dans le tableau 3. Des interactions de premier ordre, mais non de second ordre, ont été trouvées lors de l'exécution de l'ANOVA factorielle générale pour des mesures répétées, en particulier des interactions Ligne × Heure et Expérience × Temps pour les paramètres neurochimiques (voir le tableau 1). 6), des ensembles d'ANOVA à deux voies avec ligne ou niveau d'expérience sexuelle entre les sujets et le temps entre les sujets ont été réalisés sur ces ensembles de données en comparant directement des rats HRS naïfs ou expérimentés, sexuellement expérimentés ou sexuellement rats naïfs RHA ou sexuellement expérimentés vs rats naïfs RLA. Les résultats de la post hoc Les contrastes par paires effectués à l'aide du test HSD de Tukey sur les interactions significatives révélées par ces ANOVA à deux voies sont rapportés à la figure 2. Dans tous les autres cas, post hoc les comparaisons n'ont pas été rapportées, les ANOVA n'ayant révélé aucune interaction significative entre la lignée de rat, le niveau d'expérience sexuelle et l'heure. Les analyses statistiques ont toutes été effectuées avec Graph Pad 5 (PRISM, San Diego, Californie, États-Unis) et STATISTICA 12 (Statsoft, Tulsa, OK, États-Unis), le niveau de signification étant fixé à P <0.05.
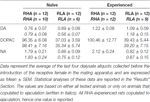 Tableau 3. Concentrations de dopamine basale (DA), d’acide 3,4-dihydroxyphénylacétique (DOPAC) et de noradrénaline (NA) (nM) dans le dialysat du cortex préfrontal médial (mPFC) de rats sexuellement naïfs et expérimentés RHA et RLA.
Tableau 3. Concentrations de dopamine basale (DA), d’acide 3,4-dihydroxyphénylacétique (DOPAC) et de noradrénaline (NA) (nM) dans le dialysat du cortex préfrontal médial (mPFC) de rats sexuellement naïfs et expérimentés RHA et RLA.
 Tableau 4. Évaluation globale des différences entre les concentrations de DA, de DOPAC et de NA et de comportement sexuel entre les rats RHA et RLA sexuellement naïfs et expérimentés par analyse de la moyenne de la SSC obtenue à partir des résultats présentés dans les figures 2 ainsi que 3.
Tableau 4. Évaluation globale des différences entre les concentrations de DA, de DOPAC et de NA et de comportement sexuel entre les rats RHA et RLA sexuellement naïfs et expérimentés par analyse de la moyenne de la SSC obtenue à partir des résultats présentés dans les figures 2 ainsi que 3.
 Tableau 5. F les valeurs et les niveaux de signification des ANOVA à deux voies effectuées sur les données reportées dans le tableau 4 en utilisant la lignée de rat (RHA vs. RLA) et le niveau d'expérience sexuelle (naïf vs. expérimenté) comme facteur de sujet.
Tableau 5. F les valeurs et les niveaux de signification des ANOVA à deux voies effectuées sur les données reportées dans le tableau 4 en utilisant la lignée de rat (RHA vs. RLA) et le niveau d'expérience sexuelle (naïf vs. expérimenté) comme facteur de sujet.
 Tableau 6. F valeurs et niveaux de signification des ANOVA factorielles générales pour les mesures répétées effectuées sur les résultats présentés dans les figures 2 ainsi que 3 en utilisant la lignée de rat (L; RHA vs. RLA) et le niveau d’expérience sexuelle (E) (naïf vs. expérimenté) comme facteur du sujet et le temps (T) (fractions de dialysat) comme facteur intra-sujet.
Tableau 6. F valeurs et niveaux de signification des ANOVA factorielles générales pour les mesures répétées effectuées sur les résultats présentés dans les figures 2 ainsi que 3 en utilisant la lignée de rat (L; RHA vs. RLA) et le niveau d’expérience sexuelle (E) (naïf vs. expérimenté) comme facteur du sujet et le temps (T) (fractions de dialysat) comme facteur intra-sujet.
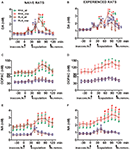 Figure 2. Concentrations de dopamine (DA), de DOPAC et de noradrénaline (NA) dans les dialysats de mPFC provenant de naïfs sexuels (ACE) et des rats mâles expérimentés RHA et RLA (B, D, F) pendant l'activité sexuelle avec une femme réceptive. Sexuellement naïfs (c'est-à-dire jamais exposés auparavant à une femme sexuellement réceptive) et sexuellement expérimentés (ayant subi cinq tests de copulation) des deux lignées avec une sonde de microdialyse implantée stéréotaxiquement dans le mPFC, ont été placés individuellement dans la cage d'accouplement. La sonde de microdialyse a été perfusée avec le tampon de dialyse comme décrit dans la section «Matériels et méthodes». Après la collecte de quatre aliquotes de dialysat pour la détermination des valeurs basales, une femelle réceptrice inaccessible a ensuite été placée dans la petite cage de l’appareil d’accouplement (heure = 0, inaccess.fe). Après 30 min, la petite cage a été retirée et la copulation a été autorisée pendant 75 min (copulation), après quoi la femelle a été retirée de la cage d'accouplement (fe.remov). Au cours de l'expérience, les érections sans contact et les paramètres de copulation ont été mesurés et des aliquotes de dialysat ont été recueillies toutes les minutes de 15 et analysées pour la dopamine, la DOPAC et la NA, comme décrit dans la section «Matériels et méthodes». Les valeurs sont des moyennes ± SEM des valeurs obtenues par tous les rats 12 par groupe (RHA_all = lignes vertes pleines, RLA_all = lignes brunes pleines) ou celles qui ne copulaient que pour l'éjaculation (RHA_cop = lignes rouges en pointillés; RLA_cop = lignes bleues en pointillés). Chez les rats RHA expérimentés, tous les animaux ont atteint la copulation et les valeurs sont identiques. *P <0.05 par rapport aux valeurs basales (pas de femelle) du groupe (vert pour RHA_all; rouge pour RHA_cop, marron pour RLA_all, bleu pour RLA_cop); #P <0.05 par rapport aux valeurs correspondantes du groupe RLA (rouge, RHA_all vs RLA_all; vert, RHA_cop vs RLA_cop); §P <0.05 par rapport aux valeurs appariées dans le temps des rats sexuellement naïfs (verts, expérimentés RHA_all vs naïfs RHA_all; rouge, expérimentés RHA_cop vs naïfs RHA_cop; brun, expérimentés RLA_all vs naïfs RLA_all; bleu, expérimentés RLA_cop vs naïfs RLA_cop) (ANOVA bidirectionnelles effectuées sur les données présentées après leur transformation logarithmique, comme expliqué dans «Matériels et méthodes», sous-section «Statistiques», suivi des tests HSD de Tukey).
Figure 2. Concentrations de dopamine (DA), de DOPAC et de noradrénaline (NA) dans les dialysats de mPFC provenant de naïfs sexuels (ACE) et des rats mâles expérimentés RHA et RLA (B, D, F) pendant l'activité sexuelle avec une femme réceptive. Sexuellement naïfs (c'est-à-dire jamais exposés auparavant à une femme sexuellement réceptive) et sexuellement expérimentés (ayant subi cinq tests de copulation) des deux lignées avec une sonde de microdialyse implantée stéréotaxiquement dans le mPFC, ont été placés individuellement dans la cage d'accouplement. La sonde de microdialyse a été perfusée avec le tampon de dialyse comme décrit dans la section «Matériels et méthodes». Après la collecte de quatre aliquotes de dialysat pour la détermination des valeurs basales, une femelle réceptrice inaccessible a ensuite été placée dans la petite cage de l’appareil d’accouplement (heure = 0, inaccess.fe). Après 30 min, la petite cage a été retirée et la copulation a été autorisée pendant 75 min (copulation), après quoi la femelle a été retirée de la cage d'accouplement (fe.remov). Au cours de l'expérience, les érections sans contact et les paramètres de copulation ont été mesurés et des aliquotes de dialysat ont été recueillies toutes les minutes de 15 et analysées pour la dopamine, la DOPAC et la NA, comme décrit dans la section «Matériels et méthodes». Les valeurs sont des moyennes ± SEM des valeurs obtenues par tous les rats 12 par groupe (RHA_all = lignes vertes pleines, RLA_all = lignes brunes pleines) ou celles qui ne copulaient que pour l'éjaculation (RHA_cop = lignes rouges en pointillés; RLA_cop = lignes bleues en pointillés). Chez les rats RHA expérimentés, tous les animaux ont atteint la copulation et les valeurs sont identiques. *P <0.05 par rapport aux valeurs basales (pas de femelle) du groupe (vert pour RHA_all; rouge pour RHA_cop, marron pour RLA_all, bleu pour RLA_cop); #P <0.05 par rapport aux valeurs correspondantes du groupe RLA (rouge, RHA_all vs RLA_all; vert, RHA_cop vs RLA_cop); §P <0.05 par rapport aux valeurs appariées dans le temps des rats sexuellement naïfs (verts, expérimentés RHA_all vs naïfs RHA_all; rouge, expérimentés RHA_cop vs naïfs RHA_cop; brun, expérimentés RLA_all vs naïfs RLA_all; bleu, expérimentés RLA_cop vs naïfs RLA_cop) (ANOVA bidirectionnelles effectuées sur les données présentées après leur transformation logarithmique, comme expliqué dans «Matériels et méthodes», sous-section «Statistiques», suivi des tests HSD de Tukey).
Résultats
Les rats des RHA et RLA présentent un nombre différent d'érections sans contact et de modèles de comportement copulatoire différents
Conformément aux études précédentes (Sanna et al., 2014a,b, 2015), un nombre différent de rats RHA et RLA mâles naïfs sexuellement ont commencé une activité sexuelle lorsqu’ils ont été réunis avec une femelle réceptive lors de la collecte d’aliquots de dialysat provenant de la mPFC par microdialyse intracérébrale. En résumé, dans cette étude, 10 sur des rats RHA mâles sexuellement naïfs (12%) ont accouplé à l’éjaculation lors de leur premier test copulatoire, contre seulement 83 sur des rats NLA naïfs RLA (6%) au cours de l’expérience de microdialyse. Cette différence a également été constatée chez des rats RHA et RLA mâles expérimentés sexuellement (après cinq tests de copulation), bien que atténuée, tous les rats 12 RHA atteignant l'éjaculation contre 50 sur des rats 12 RLA pendant la microdialyse. Toujours en accord avec les études précédentes, les deux lignées de rats romains présentaient également des latences et des fréquences différentes d’érections péniennes sans contact lorsqu’elles étaient exposées à une femme réceptrice inaccessible, ainsi que des comportements différents en matière de copulation lors des relations sexuelles. Ces différences ont été constatées soit en considérant les données de tous les animaux de laboratoire d’un groupe donné, qu’ils aient ou non copulé pour l’éjaculation (par exemple, en attribuant des scores complets aux animaux qui n’ont pas montré le comportement, c’est-à-dire des rats qui n’ont pas copulé. éjaculation) ou lorsqu’on considère les données des animaux qui ne montrent que le comportement d’un groupe donné (par exemple, des animaux qui ont copulé avec l’éjaculation; Tableau 1). En conséquence, les analyses statistiques des valeurs des érections sans contact (NCPE) et des paramètres de copulation mesurés dans la première série d'activité de copulation par ANOVA à deux voies ont révélé des différences significatives entre les deux lignées de rats, que ce soit chez tous les rats expérimentaux ou chez les rats en copulation. dans les quatre groupes expérimentaux (voir tableau 2). En fait, lorsque les données obtenues chez tous les animaux de laboratoire ont été prises en compte, le nombre d'érections sans contact était supérieur et les NCPEL, ML, IL et PEI étaient significativement plus courtes chez les rats RHA que chez les rats RLA. De plus, les valeurs EF et CE étaient plus élevées, tandis que les valeurs III étaient significativement plus courtes chez les rats RHA que chez les rats RLA. Certaines des différences ci-dessus entre les deux lignées de rats romains ont tendance à diminuer ou à disparaître avec des tests de copulation répétés. Néanmoins, certaines de ces différences étaient encore présentes après la stabilisation du comportement sexuel par des expériences sexuelles répétées. Des résultats similaires ont été obtenus en considérant uniquement les valeurs des animaux des quatre groupes expérimentaux qui ont copulé pour l'éjaculation, à l'exception du FE (voir Tableaux). 1, 2).
Concentrations basales de dopamine extracellulaire, de DOPAC et de noradrénaline dans des dialysats de mPFC provenant de rats RHA et RLA sexuellement naïfs et expérimentés
Dans les conditions expérimentales actuelles, les quantités de dopamine, de DOPAC et de NA dans les dialysats obtenus à partir de la mPFC de tous les rats (par exemple, qu'ils co-génèrent ou non à l'éjaculation) sexuellement naïfs sont les suivantes: 2.32 pg et 2.11 pg pour la dopamine, 322.56 pg et 124.42 pg pour DOPAC et 6.05 pg et 2.24 pg pour NA, respectivement, dans 20 μl de dialysat. Des quantités similaires ont été mesurées dans les dialysats obtenus à partir de la mPFC de rats RHA et RLA expérimentés sexuellement (dopamine: 3.73 pg et 3.33 pg, DOPAC: 353.62 pg et 133.32 pg, NA: 7.17 pg et 2.78 pg dans des rats RHA et RLA, respectivement). . Ces valeurs indiquent une concentration de ≅0.8 – 1.2 nM et 95 – 100 nM pour la dopamine extracellulaire et la DOPAC, respectivement, et 1.8 – 2.2 nM pour la NA extracellulaire, dans le mPFC des rats RHA, et une concentration en 0.8 – 1.2 et ≅35 – 40 nM pour la dopamine extracellulaire et DOPAC, respectivement, et 0.6 – 0.9 nM pour la NA extracellulaire, dans la mPFC de rats RLA (Tableau 3). Les valeurs ci-dessus ont été obtenues après une période d'équilibrage 2 h du tampon de dialyse avec le fluide extracellulaire de mPFC. Étant donné que la récupération de dopamine authentique, de DOPAC et de NA des sondes de dialyse a été estimée proche de 20%, les concentrations de dopamine extracellulaire, de DOPAC et de NA peuvent être estimées proches de X4 – 5 nM dans les deux lignées pour la dopamine, 500 et ≅ 200 nM pour DOPAC et ≅10 et ≅4 nM pour NA dans la mPFC de rats RHA et RLA, respectivement. Les ANOVA factorielles pour les mesures répétées effectuées sur les valeurs ci-dessus après la transformation du logarithme ont révélé des différences significatives dans les niveaux de base de dopamine entre les rats naïfs et les sexuellement expérimentés (F(1,44,132) = 26.05, P <0.001), et dans les niveaux basaux de DOPAC (F(1,44,132) = 63.36, P <0.001) et de NA (F(1,44,132) = 42.14, P <0.001) entre rats RHA et RLA (quatre derniers échantillons prélevés avant l'introduction de la femelle dans la petite cage). Des valeurs similaires ont été trouvées en considérant uniquement les rats qui ont copulé à l'éjaculation au cours de l'expérience de microdialyse (tableau 3). De plus, dans ce cas, les analyses de variance factorielles effectuées après des mesures répétées sur les valeurs après la transformation du logarithme ont révélé des différences significatives entre les taux basaux de dopamine entre les rats naïfs et les sexuellement expérimentés (F(1,33,99) = 26.97, P <0.001), et dans les niveaux basaux de DOPAC (F(1,33,99) = 42.95, P <0.001) et de NA (F(1,33,99) = 27.63, P <0.001) entre les rats RHA et RLA.
Les concentrations de dopamine extracellulaire, de DOPAC et de noradrénaline dans les dialysats de mPFC de rats RHA et RLA sexuellement naïfs et expérimentés changent de manière différentielle au cours de l'activité sexuelle
La présence de la femelle réceptrice inaccessible dans la petite cage intérieure et l’interaction sexuelle directe qui en a résulté ont augmenté les concentrations de dopamine extracellulaire, de DOPAC et de NA dans les dialysats de mPFC obtenus à partir de rats RHA et RLA mâles naïfs et expérimentés, bien que des différences significatives aient été observées entre les rats. deux lignées de rat et le niveau d’expérience, soit en considérant tous les animaux de laboratoire, soit uniquement ceux ayant copulé pour l’éjaculation (Figure 2). Les ANOVA à deux voies des concentrations de dopamine, de DOPAC et de NA, montrent que le contenu global en dopamine, DOPAC et NA de l’ensemble du test est significativement plus élevé chez les rats RHA que chez les rats RLA, et chez rats expérimentés par rapport aux rats naïfs (voir le tableau 4 pour les valeurs et tableau de l'ASC 5 en F valeurs et niveau de signification). Ces différences ont ensuite été confirmées par des ANOVA factorielles point par point pour des mesures répétées de la dopamine, de la DOPAC et de la NA de deux lignées de rats sexuellement naïfs et expérimentés le long de l'expérience, qui ont révélé des effets principaux significatifs de Line, Time, et Line × Time. et Expérience × Interactions de temps au premier ordre (voir le tableau 6 en F valeurs et niveau de signification).
Les concentrations de dopamine extracellulaire, de DOPAC et de noradrénaline dans les dialysats de mPFC obtenus à partir de rats RHA et RLA sexuellement naïfs changent de manière différentielle au cours de l'activité sexuelle
Chez les rats sexuellement naïfs RHA et RLA, la dopamine extracellulaire, mais pas la DOPAC, augmentait d'abord lorsqu'elle était mise en présence de la femelle inaccessible, tandis que la NA augmentait uniquement chez les rats RHA. Chez les rats naïfs RHA, la dopamine extracellulaire a encore augmenté lors de la première interaction 15 min de la même manière que celle trouvée avec DOPAC et NA. Les augmentations en dopamine extracellulaire, DOPAC et NA ont duré pendant tout le temps de copulation, avec dopamine, DOPAC et NA atteignant une valeur maximale à 60 min, 75 min et 75 min, respectivement, puis dopamine extracellulaire et, dans une moindre mesure, DOPAC et NA , diminué à des valeurs similaires à celles de base après le retrait de la femelle.
Par ailleurs, la première augmentation significative et la valeur maximale de la dopamine extracellulaire, de la DOPAC et de la NA se sont produites chez des rats RLA naïfs au cours de la première minute de copulation 15. Cependant, à la différence des rats RHA, chez les rats RLA, la dopamine extracellulaire, la DOPAC et la NA ont eu tendance à revenir à des valeurs similaires à celles de la base au cours de la première minute 30 d'interaction directe avec la femelle (voir Figures). 2A, C, E).
Enfin, lors de la copulation, les augmentations de dopamine extracellulaire étaient plus importantes et plus persistantes chez les rats RHA naïfs sexuellement que chez les rats RLA (voir la Figure). 2A) alors que, en l'absence de femelles, leurs concentrations étaient similaires, bien que non identiques, entre les deux lignées de rats (voir ci-dessus et le tableau 1). 3). Fait intéressant, bien qu’aucune différence n’ait été constatée entre les deux lignes romaines dans l’augmentation en pourcentage de la DOPAC et, dans une moindre mesure, dans les concentrations de NA lors de la présence de la femelle réceptive, une différence de plus de deux fois les valeurs absolues des concentrations de DOPAC et de NA a été observée entre les deux lignées de rats dans des conditions basales (voir le tableau 3) et tout au long du test chez la femelle réceptive (voir Figures 2C, E).
Les concentrations de dopamine extracellulaire, de DOPAC et de noradrénaline dans les dialysats de mPFC obtenus à partir de rats RHA et RLA sexuellement expérimentés changent différemment au cours de l'activité sexuelle
Comme chez les rats RHA et RLA naïfs, la présence de la femelle inaccessible et une interaction sexuelle directe subséquente ont entraîné une augmentation de la dopamine extracellulaire et de la DOPAC dans le dialysat de mPFC obtenu à partir de rats RHA et RLA mâles expérimentés sexuellement. Cependant, dans ce cas également, des différences liées à la lignée de rat ont été observées, soit en considérant tous les animaux de laboratoire, soit, dans une moindre mesure, uniquement ceux ayant copulé jusqu'à l'éjaculation (Figure 1). 2). Chez les rats RHA et RLA expérimentés sexuellement, la première augmentation de dopamine extracellulaire s'est produite chez la femelle inaccessible. Par la suite, les concentrations de dopamine ont augmenté pendant la copulation dans les deux lignées de rats. Les concentrations de dopamine ont atteint leurs valeurs maximales après 45 – 60 min de copulation et ont diminué lentement vers les valeurs de base à la fin du test de copulation (voir Figure 2B). Comme chez les rats naïfs, les concentrations extracellulaires de dopamine étaient plus élevées chez les rats RHA expérimentés que chez les rats RLA, principalement dans les aliquotes de dialysat recueillies au cours de la partie centrale de la phase de copulation (après la copulation 30 – 45 min). Les concentrations de DOPAC ont augmenté pendant la présence de la femelle inaccessible uniquement chez les rats RHA, alors qu'elles ont augmenté dans une mesure similaire dans les deux lignées de rats pendant la copulation (valeurs maximales à 75 – 90 min) et ont eu tendance à revenir aux valeurs de base à la fin de la période de reproduction. test copulatoire (voir Figure 2D). Les concentrations de NA ont également augmenté dans les deux lignées de rats sexuellement expérimentés après l’introduction de la femelle atteignant des valeurs maximales à 90 min chez les rats RHA et à 45 min chez les rats RLA (voir 2F). À la différence de la dopamine (voir ci-dessus), une différence similaire a été observée dans les augmentations des concentrations de DOPAC et de NA chez les rats sexuellement expérimentés des deux lignées lorsque tous les animaux étaient comparés à ceux ayant atteint l'éjaculation. Cependant, comme chez les rats naïfs sexuellement, bien que les augmentations en pourcentage des concentrations de DOPAC et de NA soient similaires, des différences significatives dans les valeurs absolues de DOPAC et de NA ont été observées entre les rats RHA et RLA expérimentés sexuellement tout au long du test (c.-à-d. Avant, pendant et après présence de la femelle réceptive), les rats RHA présentant des valeurs plus élevées que les rats RLA (voir le tableau 3 pour les valeurs de base et les chiffres 2D, F pour les valeurs tout au long du test).
Expérience sexuelle influe sur les changements dans les concentrations de dopamine et de noradrénaline dans les dialysats de mPFC obtenus à partir de rats RHA et RLA au cours d'une activité sexuelle
Une comparaison des concentrations de dopamine extracellulaire et de NA chez des rats RHA et RLA sexuellement naïfs et expérimentés a montré que l'expérience sexuelle modifiait la concentration de dopamine extracellulaire et, dans une moindre mesure, de NA dans les deux lignées de rats, en considérant tous les animaux de laboratoire. ou ceux qui ont copulé à l'éjaculation seulement (Figures 2A, B, E, F). En conséquence, des différences significatives sont apparues dans les valeurs de base de la dopamine entre les rats naïfs et les rats expérimentés des deux lignées (voir le tableau 1). 3) et les valeurs de dopamine au cours de l'activité copulatoire étaient généralement plus élevées chez les rats RHA et RLA expérimentés sexuellement par rapport à leurs homologues naïfs (voir la Figure). 2B). De plus, chez les rats RHA expérimentés sexuellement, bien que l'augmentation de la dopamine constatée en présence de la femelle inaccessible ait suivi le même schéma temporel que celui observé chez les rats naïfs, des différences dans le schéma temporel ont été observées lors de la copulation. En fait, dans ce cas, contrairement à ce qui a été observé chez des rats RHA naïfs sexuellement (un pic principal à 60 min), deux valeurs de pic principales ont été trouvées, la première après 15 min et la seconde après 45 min de copulation. Après cette dernière augmentation, les valeurs de dopamine ont eu tendance à revenir aux valeurs de base (voir Figure 2B).
Une image similaire a été trouvée chez des rats RLA sexuellement naïfs et expérimentés. En fait, de manière similaire à celle trouvée chez les rats RHA, on a également observé chez les rats RLA expérimentés un schéma temporel caractérisé par trois augmentations principales de la dopamine extracellulaire: le premier chez la femelle inaccessible et les deux autres pendant la copulation, c'est-à-dire après 15 min et 60. min de copulation (voir figures 2A, B). En général, l'expérience sexuelle semble produire des changements plus durables dans le schéma temporel de la libération de dopamine dans les deux lignées de rats lors du passage de la condition naïve à la condition vécue.
Comme indiqué dans les figures 2C – F, seules de petites différences ont été détectées dans les concentrations de DOPAC et de NA entre les rats naïfs et les rats expérimentés des deux lignées. Cependant, une tendance non significative de la NA extracellulaire à des valeurs plus élevées chez les rats expérimentés par rapport aux rats naïfs a été observée chez les cellules basales (avant l’introduction de la femelle réceptive, voir le tableau 1). 3) et dans les montants globaux d'AN, tels que révélés par les valeurs de l'ASC (voir tableau 4) calculées sur les concentrations extracellulaires obtenues à partir de l’ensemble du test (avant et pendant la présence de la femelle réceptive). Enfin, le schéma temporel des concentrations de NA était très similaire lorsque l'on comparait les rats expérimentés des deux lignées de rats à leurs homologues naïfs, ce qui indique que l'expérience sexuelle peut conduire à une augmentation générale de la NA extracellulaire plutôt qu'à des changements dans le schéma de son augmentation (voir Figures). 2E, F).
Changements dans les concentrations de dopamine extracellulaire et de noradrénaline dans les dialysats de mPFC obtenus à partir de rats sexuellement naïfs et expérimentés RHA et RLA se produisant en même temps que des changements de comportement sexuel
Les différences dans les concentrations de dopamine extracellulaire, de DOPAC et de NA dans les dialysats obtenus à partir de la mPFC ont été observées chez des rats sexuellement naïfs et expérimentés RHA et RLA au cours du test (Figure 3). 2) sont survenus en même temps que des modifications de différents paramètres sexuels mesurés au cours des deux phases principales des expériences (c.-à-d. femmes inaccessibles et accessibles aux hommes, respectivement), notamment les érections du pénis sans contact (Figures 3A, B), montures (Figures 3C, D), intromissions (Figures 3E, F) et les éjaculations (Figures 3G, H). Ces différences ont été trouvées lorsque tous les animaux de laboratoire ou ceux qui ont copulé pour éjaculer sont pris en compte. En fait, une analyse préliminaire des valeurs de l’ASC de ces paramètres par ANOVA à deux voies (voir le tableau 4 pour les valeurs et tableau de l'ASC 5 en F (valeurs et niveau de signification) suivies d’une analyse point par point des valeurs de ces paramètres tout au long de l’expérience, par analyse ANOVA factorielle pour mesures répétées, ont révélé des effets principaux significatifs des interactions Ligne, Temps, Premier ordre significatives Ligne × Temps et Expérience × Temps, et une interaction significative de second ordre pour les montages (voir le tableau 6 en F valeurs et niveau de signification). En conséquence, conformément aux études précédentes (Sanna et al., 2015): (i) les rats RHA naïfs sexuellement présentaient plus d’érections, montures, intromissions et éjaculations du pénis sans contact que leurs homologues RLA; (ii) les rats RHA expérimentés sexuellement présentaient un nombre plus élevé d'érections, d'intromissions et d'éjaculations du pénis sans contact que leurs homologues RLA; et (iii) les rats des deux lignées expérimentés sexuellement, et en particulier les rats RLA, présentaient plus d'érections, intromissions et éjaculations du pénis sans contact que leurs homologues sexuellement naïfs. En fait, chez les rats RHA, la plupart des changements produits par l'expérience sexuelle se sont produits au cours du temps plutôt qu'à la fréquence des paramètres comportementaux (par exemple, les rats expérimentés ont copulé principalement dans la première moitié de l'essai, alors que les rats naïfs une tendance copulatoire similaire tout au long du test), chez les rats RLA, une amélioration générale plus marquée du comportement sexuel, principalement des performances sexuelles, a été produite par l'expérience sexuelle, comme le révèlent les modifications des valeurs des paramètres de copulation chez les rats RLA expérimentés par rapport à leur comportement sexuel antérieur. homologues naïfs.
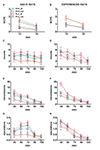 Figure 3. Changements dans le nombre d'érections péniennes sans contact (NCPE), de montures, d'intromissions et d'éjaculations enregistrées à partir de naïfs sexuels (A, C, E, G) et expérimentés rats RHA et RLA (B, D, F, H) au cours des expériences de microdialyse rapportées à la figure 2. Toutes les conditions expérimentales étaient identiques à celles décrites dans la légende de la figure 2. Les valeurs sont des moyennes ± ETM des valeurs obtenues par tous les rats 12 par groupe (y compris ceux auxquels un score à plein temps a été attribué; RHA = lignes vertes pleines, RLA = lignes brunes pleines) ou ceux qui ont copulé uniquement pour l'éjaculation (RHA = lignes rouges pointillées). ; RLA = lignes bleues en pointillés). Chez les rats RHA expérimentés, tous les animaux ont atteint la copulation et les valeurs sont identiques. En l'absence d'interactions significatives entre le facteur de lignée de rat (RHA vs. RLA), le facteur de niveau d'expérience sexuelle (naïf vs expérimenté) et le temps ont été trouvés en analysant les données avec une ANOVA à deux voies, comme indiqué dans le tableau. 6, post hoc les comparaisons n'ont pas été rapportées, comme expliqué dans la sous-section «Matériels et méthodes», «Statistiques».
Figure 3. Changements dans le nombre d'érections péniennes sans contact (NCPE), de montures, d'intromissions et d'éjaculations enregistrées à partir de naïfs sexuels (A, C, E, G) et expérimentés rats RHA et RLA (B, D, F, H) au cours des expériences de microdialyse rapportées à la figure 2. Toutes les conditions expérimentales étaient identiques à celles décrites dans la légende de la figure 2. Les valeurs sont des moyennes ± ETM des valeurs obtenues par tous les rats 12 par groupe (y compris ceux auxquels un score à plein temps a été attribué; RHA = lignes vertes pleines, RLA = lignes brunes pleines) ou ceux qui ont copulé uniquement pour l'éjaculation (RHA = lignes rouges pointillées). ; RLA = lignes bleues en pointillés). Chez les rats RHA expérimentés, tous les animaux ont atteint la copulation et les valeurs sont identiques. En l'absence d'interactions significatives entre le facteur de lignée de rat (RHA vs. RLA), le facteur de niveau d'expérience sexuelle (naïf vs expérimenté) et le temps ont été trouvés en analysant les données avec une ANOVA à deux voies, comme indiqué dans le tableau. 6, post hoc les comparaisons n'ont pas été rapportées, comme expliqué dans la sous-section «Matériels et méthodes», «Statistiques».
a lieu
Cette étude confirme et étend les conclusions d’études antérieures montrant que les rats RHA et RLA, qui présentent des styles d’adaptation très différents en réponse à des conditions aversives (Driscoll et Bättig, 1982; Giorgi et al., 2003a; Steimer et Driscoll, 2003), présentent des schémas comportementaux distincts en présence d'une femelle réceptive inaccessible et lors d'essais de copulation classiques (Sanna et al., 2014a,b, 2015). En conséquence, cette étude montre également que les rats RHA naïfs sexuellement (jamais exposés à une femelle réceptive) présentaient une motivation sexuelle supérieure et des performances sexuelles supérieures à celles des rats RLA naïfs sexuellement. Par exemple, les rats RHA présentent un nombre plus élevé d'érections péniennes sans contact (phéromone). érections péniennes induites considérées comme un indice de l'excitation sexuelle; Sachs et al., 1994; Sachs, 2000) et différents changements prosexuels dans plusieurs paramètres de copulation, comme dans des études précédentes (Sanna et al., 2014a,b, 2015). Ces différences persistaient encore dans les deux lignées de rats romains après l'acquisition de l'expérience sexuelle, c'est-à-dire après la stabilisation du comportement sexuel avec cinq expositions à et des tests de copulation avec une femelle réceptive. Cette étude montre également pour la première fois que dans les lignées de rats RHA et RLA, qu’ils soient naïfs ou expérimentés, les érections du pénis sans contact et les interactions sexuelles sont associées simultanément à une augmentation des concentrations de dopamine extracellulaire (et de son principal métabolite, la DOPAC). ) et NA dans les dialysats obtenus par microdialyse intracérébrale à partir de la mPFC des deux lignées de rats romains. Fait intéressant, ces augmentations de dopamine extracellulaire et de NA dans la mPFC semblent être liées à des différences dans le phénotype du rat ou dans le niveau d'expérience sexuelle. En conséquence, comme indiqué de manière détaillée dans la section Résultats, les rats RHA expérimentés, sexuellement naïfs, ont présenté des augmentations plus importantes et durables de la dopamine extracellulaire et de la NA, par rapport à leurs homologues RLA, tant dans la phase appétitive que consommée du comportement sexuel. De plus, les rats sexuellement expérimentés des deux lignées romaines ont présenté des augmentations plus importantes et durables de la dopamine extracellulaire et de la NA dans la mPFC dans les deux phases du comportement sexuel par rapport à leurs homologues naïfs. Enfin, toutes les différences susmentionnées de dopamine extracellulaire et de NA dans la mPFC étaient apparemment liées à des différences dans les paramètres comportementaux du comportement sexuel. Par exemple, les rats sexuellement expérimentés des deux lignées romaines présentaient une motivation sexuelle plus élevée et de meilleures performances copulatoires par rapport à leurs homologues naïfs. et les rats RHA sexuellement naïfs et expérimentés présentaient une motivation sexuelle plus élevée et de meilleures performances copulatoires par rapport à leurs homologues RLA sexuellement naïfs et expérimentés.
En ce qui concerne les augmentations de dopamine extracellulaire trouvées dans le dialysat de mPFC au cours de l'activité sexuelle, la première augmentation a eu lieu au cours de la première minute 15 après l'introduction de la femelle sexuellement réceptive dans l'appareil de reproduction, lorsque la femelle était inaccessible au mâle, ce qui montre dans cette condition, érections du pénis sans contact. Une deuxième augmentation plus importante de la dopamine extracellulaire est survenue au cours des premières minutes 15 après que la femme ait été rendue accessible au mâle pour la copulation. Fait intéressant, alors que dans l'état naïf, la dopamine extracellulaire augmentait principalement dans la première partie du test avec la femelle accessible avec une tendance à revenir aux valeurs de base dans la seconde partie, dans l'état dopé, la dopamine restait élevée tout au long du test, atteignant des valeurs maximales après 45 – 60 min de la copulation dans les deux lignées de rats romains.
Outre les différences susmentionnées de dopamine extracellulaire au cours des différentes phases de l'activité sexuelle entre les rats RHA et RLA dans l'état naïf et expérimenté, cette étude montre également des différences inattendues importantes et hautement significatives dans la concentration en DOPAC extracellulaire entre les deux lignées de rats romains auparavant (c'est-à-dire , valeurs basales) et après l’introduction de la femelle réceptive dans l’appareil d’accouplement. En conséquence, les valeurs de base de la DOPAC extracellulaire dans le dialysat de mPFC se sont avérées chez les rats RHA environ environ plus élevées que celles trouvées chez les rats RLA. Cette différence entre les rats RHA et RLA s'est produite et a persisté dans les conditions sexuellement naïves et expérimentées malgré des différences très modestes dans les valeurs de base de la dopamine extracellulaire dans les dialysats de mPFC obtenus à partir des deux lignées de rats romains dans ces conditions expérimentales. Prises ensemble, ces différences pourraient indiquer un chiffre d'affaires de la dopamine différent au niveau de la mPFC entre les deux lignées de rats romains. En conséquence, les concentrations de DOPAC reflètent généralement la quantité de dopamine libérée puis recapturée par les terminaisons nerveuses dopaminergiques et convertie en DOPAC par la monoaminooxydase (MAO; Carlsson, 1975). Par conséquent, les concentrations de DOPAC de base plus élevées observées chez les rats RHA suggèrent que de plus grandes quantités de dopamine sont libérées et recapturées par les terminaisons nerveuses dopaminergiques dans la mPFC des rats RHA, par exemple une activité basale supérieure du système dopaminergique mésocortical des rats RHA par rapport à RLA les rats. Un tonus dopaminergique mésocortical plus élevé chez les rats RHA que chez les rats RLA est également soutenu par les concentrations plus élevées de dopamine extracellulaire trouvées pendant l'activité sexuelle dans le dialysat de mPFC de rats RHA naïfs et expérimentés par rapport à ceux de leurs homologues RLA. À cet égard, il convient de rappeler qu’un tonus dopaminergique plus élevé est considéré comme responsable, du moins en partie, de nombreux traits de comportement différents et même opposés présents chez les rats RHA et RLA. En conséquence, les rats RHA sont des copers actifs, très impulsifs, à la recherche de nouveautés et de sensations, et sont prédisposés à l'absorption et à l'abus de plusieurs classes de drogues, alors que les rats RLA sont des copers réactifs, hyperémotifs et susceptibles de développer des symptômes de type dépressif (Zeier et al., 1978; Giorgi et al., 1994, 2003b, 2007; Corda et al., 1997, 2014; Escorihuela et al., 1999; Steimer et Driscoll, 2003; Lecca et al., 2004; Giménez-Llort et al., 2005; Carrasco et al., 2008; Fattore et al., 2009; Moreno et al., 2010; Coppens et al., 2012; Díaz-Morán et al., 2012; Sabariego et al., 2013; Manzo et al., 2014a,b; Oliveras et al., 2015), y compris la plus grande motivation sexuelle et les meilleures performances de copulation des rats RHA expérimentés et naïfs sexuellement par rapport aux rats RHA (Sanna et al., 2015). L'augmentation plus élevée des concentrations de dopamine extracellulaire dans le dialysat à partir de la mPFC de rats RHA sexuellement naïfs et expérimentés ressemble aux concentrations de dopamine extracellulaire plus élevées trouvées dans le dialysat à partir du noyau accumbens de rats RHA sexuellement naïfs et expérimentés, en ce qui concerne leurs homologues RLA (Sanna et al., 2015). Cependant, contrairement à la mPFC, les taux de base de dopamine extracellulaire et de DOPAC dans le dialysat du noyau accumbens des rats RHA et RLA sexuellement naïfs et expérimentés ne différaient pas significativement (Sanna et al., 2015). Ainsi, le tonus dopaminergique mésolimbique plus élevé dans le noyau accumbens de rats RHA expérimentés et naïfs peut être déduit que par les concentrations de dopamine extracellulaires plus élevées trouvées dans les dialysats du noyau accumbens des rats RHA par rapport aux homologues RLA en présence du récepteur femelle, et non par une activité dopaminergique basale différente révélée par les concentrations basales plus élevées de DOPAC chez les rats RHA et les rats RLA, respectivement, comme cela a été constaté dans le mPFC dans cette étude. Cela concorde également avec les résultats de rapports antérieurs indiquant que les taux de dopamine extracellulaires dans le dialysat provenant de la mPFC des rats RHA étaient supérieurs à ceux des rats RLA, tandis que des taux similaires de dopamine étaient observés dans le dialysat de la coquille du noyau accumbens. des rats RHA et RLA dans différentes conditions expérimentales (D'Angio et al., 1988; Scatton et al., 1988; Willig et al., 1991; Giorgi et al., 2003a, 2007). En dépit des différences susmentionnées entre la mPFC et le noyau accumbens, l'expérience sexuelle semble produire dans la mPFC des augmentations plus durables de la configuration temporelle de la libération de dopamine dans les deux lignées de rats romains lors du passage de la condition naïve étaient généralement plus élevés chez les rats RHA que chez les rats RLA. Ceci diffère quelque peu de ce que l'on trouve dans le noyau accumbens, où l'expérience sexuelle tendait à déplacer l'augmentation de la dopamine extracellulaire vers la première partie de l'essai de copulation chez les rats RHA, tout en l'augmentant pendant tout le test de copulation chez les rats RLA (Sanna et al., 2015).
À notre connaissance, cette étude montre également pour la première fois que non seulement la dopamine extracellulaire, mais aussi la NA extracellulaire augmentent au cours de l'activité sexuelle dans le dialysat à partir de la mPFC de rats RHA et RLA, comme avec la dopamine, mais aussi dans ce cas avec différences liées à la lignée de rat romain et à l'expérience sexuelle. En particulier, les taux basaux de NA extracellulaire dans le dialysat provenant de la mPFC des rats RHA et RLA étaient significativement plus élevés que ceux des concentrations basiques de dopamine qui se trouvaient très similaires dans le dialysat. ) que ceux des rats RLA. Les raisons de ces différences sont inconnues, mais comme discuté ci-dessus pour la dopamine et la DOPAC, ces résultats peuvent indiquer qu'un tonus noradrénergique basal plus élevé existe au moins dans le cortex mPFC des rats RHA par rapport aux rats RLA. Un tel ton noradrénergique plus élevé peut également être impliqué dans les traits de comportement différents et souvent opposés présents chez les rats RHA et RLA, comme indiqué ci-dessus pour la dopamine. Les résultats ont montré que les différences entre les niveaux de NA extracellulaire de base persistaient également pendant l’activité sexuelle dans des conditions sexuellement naïves et expérimentées, par exemple, des taux de NA extracellulaire augmentés chez les rats RHA de la RPAC. le dialysat de mPFC chez les rats RHA lorsqu’il est exposé à la femelle inaccessible et pendant toute la période de copulation bien plus que chez les rats RLA, où les niveaux de NA n’augmentaient qu’au cours de la première minute 2,5 de la période de copulation, après quoi les niveaux de NA revenaient à des valeurs basales . Ces changements dans les niveaux de NA extracellulaire ont été observés à la fois chez les personnes sexuellement naïves et expérimentées, mais les augmentations des niveaux de NA étaient plus élevées chez les rats RHA et RLA expérimentés sexuellement que chez leurs homologues naïfs. Ainsi, l'expérience sexuelle induit apparemment une potentialisation supplémentaire de l'activité noradrénergique dans la mPFC des rats RHA et, dans une moindre mesure, des rats RLA, comme cela a déjà été discuté pour la dopamine. Les nuances concomitantes noradrénergiques et dopaminergiques supérieures dans la mPFC des rats RHA par rapport aux rats RLA méritent quelques commentaires. En fait, il a été rapporté que l’activité noradrénergique dans la mPFC peut affecter la libération de dopamine par différents mécanismes (voir par exemple: Carboni et al., 1990, 2006; Gresch et al., 1995; Westernik et al., 1998 et références y figurant). L’un d’eux est lié à l’activité de la NET, qui s'est avérée lier la dopamine avec une affinité encore plus grande que celle de la NA dans les synaptosomes obtenus à partir d’homogénats du PFC (Corne, 1973). Si cela devait se produire dans le CPFM in vivo, la dopamine libérée dans la mPFC pourrait être recapturée non seulement par les terminaisons nerveuses dopaminergiques mais également noradrénergiques à une vitesse supérieure à celle de la NA. Cela pourrait entraîner à son tour une augmentation de la libération de dopamine par les terminaux dopaminergiques (par exemple, un tonus dopaminergique accru) pour compenser la quantité de dopamine retirée de la fente synaptique; ainsi, le ton noradrénergique plus élevé trouvé chez les rats RHA pourrait contribuer, au moins en partie, au ton dopaminergique plus élevé trouvé dans la mPFC des rats RHA par rapport aux rats RLA. Des études complémentaires sont nécessaires pour vérifier cette possibilité. Notamment, la différence d'activité noradrénergique identifiée dans cette étude dans la mPFC entre les rats RHA et RLA pourrait également jouer un rôle dans leur réponse différente au traitement antidépresseur. En fait, les rats RHA sont considérés comme un modèle de résilience et les rats RLA, un modèle de vulnérabilité à la dépression. En conséquence, un traitement aigu ou chronique avec des antidépresseurs tels que la désipramine, la fluoxétine et la chlorimipramine a significativement amélioré les réponses comportementales lors du test de nage forcée chez les rats RLA sans affecter les réponses des rats RHA (Piras et al., 2010, 2014).
Enfin, cette étude confirme et étend les résultats antérieurs montrant que la CPFm est impliquée dans le contrôle du comportement sexuel, bien que le rôle exact de cette région du cerveau dans le comportement sexuel soit loin d’être clair (Fernández-Guasti et al., 1994; Agmo et Villalpando, 1995; Agmo et al., 1995; Hernández-Gonzáles et al., 1998, 2007; Kakeyama et al., 2003; Balfour et al., 2006; Afonso et al., 2007; Davis et al., 2010; Febo, 2011). Récemment, le tir sélectif de cellules dans le CPFm lors de l’approche du comportement d’un rat mâle vers une femelle sexuellement réceptive inaccessible a été démontré à l’aide d’un paradigme d’enregistrement de tir cellulaire unique (Febo, 2011). Fait intéressant, les neurones qui ne répondaient pas lors de la première exposition du mâle à la femelle réceptive inaccessible, deviennent actifs lors de la seconde exposition, comme si l'expérience précédente était capable d'induire des modifications plastiques conduisant à une variation des réponses comportementales. Néanmoins, des lésions avec l'acide iboténique de la mPFC se sont avérées incapables de modifier le comportement sexuel de rats mâles avec une femelle sexuellement réceptive, ni l'expression de la préférence du lieu conditionné pour la récompense sexuelle. Cependant, chez ces animaux lésés, la capacité de former une aversion conditionnée à l’égard de l’activité sexuelle quand elle était associée à des stimuli aversifs (Davis et al., 2010). Ceci suggère que l’activation de mPFC pendant le comportement sexuel joue un rôle dans l’intégration d’informations internes et externes pour l’exécution et le contrôle de comportements orientés vers un objectif plutôt que dans l’expression de réponses innées à des renforçateurs naturels (voir plus loin). Goto et Grace, 2005). Plus important encore pour ce travail, plusieurs études ont montré que les régions cérébrales impliquées dans la motivation sexuelle et le comportement sexuel, tels que le noyau accumbens, la région tegmentale ventrale, la région préoptique médiale, le noyau du lit de la stria terminalis, l’amygdale basolatérale et le noyau thalamique subparafasciculaire parvocellulaire reçoivent des entrées mPFC pendant une activité sexuelle (voir Balfour et al., 2006). Nombre de ces zones du cerveau participent à un circuit neuronal complexe impliqué dans le contrôle du comportement sexuel, de la motivation et de la récompense sexuelles à la performance sexuelle. Ce circuit comprend des neurones ocytocinergiques qui prennent leur origine dans le PVN de l'hypothalamus (PVN) et se projettent dans la région tégumentale ventrale, noyau accumbens, hippocampe, amygdala, PFC, noyau de la strie terminale, médulla oblongata et de la colonne vertébrale, mésolimbique / dopant neurones faisant saillie de la région tegmentale ventrale au noyau accumbens et au PFC, neurones dopaminergiques incertohypothalamiques et neurones glutamatergiques qui participent au niveau local et à celui du système dans plusieurs zones du circuit (voir Melis et Argiolas, 1995, 2011; Melis et al., 2003, 2007, 2009, 2010; Succu et al., 2007, 2008, 2011). Ainsi, l'augmentation de la dopamine extracellulaire (mais aussi de la NA) dans les dialysats du mPFC observée au cours de l'activité sexuelle pourrait indiquer que le mPFC est une partie active de ce circuit, c'est-à-dire que les neurones dopaminergiques mésocorticaux participent ensemble au contrôle de l'activité sexuelle. avec les neurones noradrénergiques, dopaminergiques mésolimbiques, ocytocinergiques et glutamatergiques, bien que cela ne semble pas être strictement nécessaire pour l'expression du comportement sexuel (Davis et al., 2010). Conformément à cette hypothèse, cette étude montre que les différences de libération de dopamine et de NA dans la mPFC au cours de l'activité sexuelle sont concomitantes avec des différences dans le nombre d'érections du pénis sans contact et de modifications des paramètres copulatoires, avec une libération plus élevée de dopamine et de NA au cours de les phases d'appétit et de consommation liées à une motivation sexuelle plus élevée et à de meilleures performances de copulation dans les deux lignées de rats romains ainsi que dans les états naïfs et expérimentés.
La discussion donnée ci-dessus est basée principalement sur l'augmentation bien connue de la dopamine extracellulaire qui se produit dans le noyau accumbens de rats mâles au cours de l'activité sexuelle (Pfaus et al., 1990; Pleim et al., 1990; Pfaus et Phillips, 1991; Damsma et al., 1992; Wenkstern et al., 1993). Cependant, la dopamine et d’autres neurotransmetteurs pourraient être libérés dans la mPFC (et dans le noyau accumbens) dans d’autres conditions expérimentales, telles que pendant le stress ou pour y faire face (Thierry et al., 1976; Fadda et al., 1978), qui ne sont pas strictement liés au comportement sexuel. On peut donc soutenir que l’augmentation de la dopamine observée dans la dopamine extracellulaire dans le mPFC (cette étude) ou dans le noyau accumbens (Sanna et al., 2015), est davantage liée au stress lié à la présence ou à l’interaction avec la femme sexuellement réceptive, ou à la gestion de la présence de celle-ci que de l’activité sexuelle. Cela pourrait avoir une certaine pertinence chez les rats RHA et RLA, qui présentent des styles d'adaptation nettement différents et une activation différente de l'axe hypothalamo-hypophyso-surrénalien en réponse à des conditions aversives (les rats RLA montrent une activation de cet axe bien supérieure à celle des rats RHA; voir Carrasco et al., 2008; Díaz-Morán et al., 2012). Cela soulève également la possibilité que les hormones de stress (c.-à-d. Les corticostéroïdes) puissent influer sur l'activité dopaminergique dans les mPFC et d'autres régions du cerveau. En effet, les rats RLA sont des réactions réactives et présentent un comportement hyper-émotionnel caractérisé par l'hypomotilité et le gel, tandis que les rats RHA présentent un comportement d'adaptation proactif visant à maîtriser le facteur de stress (Driscoll et Bättig, 1982; Willig et al., 1991; Escorihuela et al., 1999; Steimer et Driscoll, 2003; Giorgi et al., 2007). Bien qu'il soit impossible d'exclure complètement que cela puisse se produire chez les rats sexuellement naïfs (qui n'ont jamais interagi avec une femelle réceptive auparavant) et chez les rats RLA sexuellement naïfs en particulier (voir ci-dessus), cela est peu probable. Dans nos conditions expérimentales, tout est fait pour éviter tout type de stress (voir section «Matériel et méthodes») et les expériences sont organisées de telle manière que les mâles n'interagissent pas immédiatement avec la femelle, mais seulement après 30 min d'exposition à elle , au cours de laquelle l'augmentation mesurée de la dopamine est bien inférieure à celle qui se produit lors de l'interaction sexuelle. Si l'augmentation de la dopamine trouvée dans le mPFC (et dans le noyau accumbens) des rats romains (les rats RHA et RLA sexuellement naïfs ont des niveaux basaux de dopamine extracellulaire dans le dialysat du mPFC et du noyau accumbens, très similaires) étaient vraiment secondaires au stress dû à la présence de / interaction avec la femelle ou la gestion de celle-ci: (i) l'augmentation de la dopamine aurait été beaucoup plus élevée dans la première période de temps où les mâles sont mis en présence de la femelle et pas plus tard, tel que trouvé pendant la copulation; et (ii) on s'attend à ce que l'augmentation de la dopamine disparaisse ou soit fortement réduite après l'acquisition d'une activité sexuelle stable, c'est-à-dire lorsque les processus d'apprentissage (y compris l'adaptation à la nouveauté) ont été achevés et ne jouent qu'un rôle mineur dans l'exécution des l'activité sexuelle, alors qu'en revanche elle continue à se produire lorsque l'activité sexuelle est répétée. En d'autres termes, la dopamine extracellulaire dans le mPFC (et dans le noyau accumbens) augmente toujours pendant la copulation, même après que le comportement sexuel a été appris. D'autres études sont nécessaires pour clarifier le rôle fonctionnel de cette augmentation de l'activité dopaminergique dans le mPFC (et dans le noyau accumbens; voir la section «Introduction et références»).
En conclusion, cette étude montre pour la première fois que la présence, et plus encore, de l’interaction avec une femelle sexuellement réceptive entraîne une augmentation de la dopamine extracellulaire et de la NA dans le dialysat du mPFC de naïf sexuellement (jamais exposé à des stimuli sexuels). ) et sexuellement expérimentés (ayant subi cinq tests de copulation préliminaires et montrant des performances sexuelles stables), les rats RHA et RLA, qui présentent des styles d'adaptation nettement différents en réponse à des conditions aversives et des modèles de comportement copulatoire différents avec une femelle sexuellement réceptive. En conséquence, les concentrations de dopamine et de NA dans le dialysat étaient plus élevées chez les rats sexuellement naïfs et expérimentés que leurs homologues de RLA pendant les phases d’anticipation et de consommation de l’activité sexuelle. Ces résultats peuvent être dus en partie à un ton dopaminergique et noradrénergique dans la mPFC des rats RHA supérieur à celui des rats RLA, comme indiqué pour la dopamine dans le noyau accumbens (Sanna et al., 2015). De plus, la dopamine et la NA extracellulaires de mPFC étaient également plus élevées chez les rats RHA expérimentés sexuellement et, dans une moindre mesure, chez les rats RLA par rapport à leurs homologues naïfs sexuellement dans des conditions basales ainsi que pendant les phases d'appétit et de consommation du comportement sexuel. Cela suggère que l'expérience sexuelle induit des processus plastiques qui renforcent davantage la neurotransmission de la dopamine et de la NA dans le mPFC, comme dans le cas de la dopamine dans le noyau accumbens des deux lignées de rats romains (Sanna et al., 2015). Les différences susmentionnées dans la neurotransmission dopaminergique et noradrénergique dans la mPFC des deux lignées romaines peuvent jouer un rôle non seulement dans les différents modèles de comportement sexuel, mais également dans les traits de comportement différents et souvent opposés qui caractérisent ces deux lignées de rat.
Contributions d'auteur
Le projet a été conçu par FS, AA, MRM, OG et MGC. FS et JB ont conçu, réalisé et analysé les données d'expériences de comportement sexuel et de microdialyse. MAP, OG et MGC ont sélectionné et élevé des rats romains. FS, AA, MRM, OG et MGC ont supervisé l’étude. FS, AA, MRM, OG et MGC ont écrit le manuscrit. Tous les auteurs ont discuté des résultats et commenté le manuscrit.
Financement
Ce travail a été partiellement financé par des subventions du ministère italien de l'Université et de la Recherche (MIUR) (Indépendance scientifique des jeunes chercheurs, SIR 2014, numéro de code RBSI14IUXXUMX) à FS, de la région autonome de Sardaigne (ARS) (LR 7 / 7 «Promotion de la recherche scientifique et de l'innovation technologique en Sardaigne», Fonds social européen, 2007 – 2007, code de projet CRP-2013) à OG, et de l'Université de Cagliari à AA, MRM, FS, OG et MGC.
Déclaration de conflit d'intérêts
Les auteurs déclarent que la recherche a été menée en l'absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d'intérêts potentiel.
Remerciements
Dr. Barbara Tuveri, Université de Cagliari, pour l'hébergement et les soins des animaux.
Bibliographie
Afonso, VM, Sison, M., Lovic, V. et Fleming, AS (2007). Les lésions médiales du cortex préfrontal chez le rat femelle affectent le comportement sexuel et maternel et leur organisation séquentielle. Comportement Neurosci. 121, 515 – 526. doi: 10.1037 / 0735-7044.121.3.515
Agmo, A. et Villalpando, A. (1995). Les stimulants du système nerveux central facilitent le comportement sexuel chez les rats mâles atteints de lésions du cortex préfrontal médian. Cerveau Res. 696, 187–193. doi: 10.1016/0006-8993(95)00853-i
Agmo, A., Villalpando, A., Picker, Z. et Fernández, H. (1995). Lésions du cortex préfrontal interne et comportement sexuel chez le rat mâle. Cerveau Res. 696, 177–186. doi: 10.1016/0006-8993(95)00852-h
Argiolas, A. et Melis, MR (1995). Neuromodulation de l'érection du pénis: aperçu du rôle des neurotransmetteurs et des neuropeptides. Programme. Neurobiol. 47, 235–255. doi: 10.1016/0301-0082(95)00020-8
Argiolas, A. et Melis, MR (2005). Contrôle central de l'érection du pénis: rôle du noyau paraventriculaire de l'hypothalamus. Programme. Neurobiol. 76, 1 – 21. doi: 10.1016 / j.pneurobio.2005.06.002
Argiolas, A. et Melis, MR (2013). Neuropeptides et contrôle central du comportement sexuel du passé au présent: une revue. Programme. Neurobiol. 108, 80 – 107. doi: 10.1016 / j.pneurobio.2013.06.006
Balfour, ME, Brown, JL, Yu, L. et Coolen, LM (2006). Contributions potentielles d'efférents du cortex préfrontal médian à l'activation neuronale à la suite d'un comportement sexuel chez le rat mâle. Neuroscience 137, 1259 – 1276. doi: 10.1016 / j.neuroscience.2005.11.013
Balfour, ME, Yu, L. et Coolen, LM (2004). Le comportement sexuel et les signaux environnementaux associés au sexe activent le système mésolimbique chez les rats mâles. Neuropsychopharmacology 29, 718 – 730. doi: 10.1038 / sj.npp.1300350
Beloate, LN, Omrani, A., Adan, RA, Webb, IC et Coolen, LM (2016). L'activation des cellules de la dopamine dans la région tegmentale ventrale pendant le comportement sexuel chez le rat mâle régule la neuroplasticité et la sensibilisation croisée à la d-amphétamine après l'abstinence sexuelle. J. Neurosci. 36, 9949 – 9961. doi: 10.1523 / JNEUROSCI.0937-16.2016
Berridge, K. et Robinson, T. (1998). Quel est le rôle de la dopamine dans la récompense: impact hédonique, apprentissage de la récompense ou saillance incitative? Brain Res. Tour. 28, 309–369. doi: 10.1016/s0165-0173(98)00019-8
Bignami, G. (1965). Sélection pour les taux élevés et les taux faibles de conditionnement d'évitement chez le rat. Anim. Comportement 13, 221–227. doi: 10.1016/0003-3472(65)90038-2
Broadhurst, PL et Bignami, G. (1965). Effets corrélatifs de la sélection psychogénétique: étude des souches romaines d'évitement élevé et faible du rat. Comportement Res. Ther. 3, 273–280. doi: 10.1016/0005-7967(64)90033-6
Carboni, E., Silvagni, A., Vacca, C. et Di Chiara, G. (2006). Effet cumulatif du blocage des transporteurs de noradrénaline et de dopamine sur l'augmentation de la dopamine extracellulaire dans la coquille du noyau accumbens, le noyau du lit de stria terminalis et le cortex préfrontal. J. Neurochem. 96, 473 – 481. Doi: 10.1111 / j.1471-4159.2005.03556.x
Carboni, E., Tanda, GL, Frau, R. et Di Chiara, G. (1990). Le blocage du transporteur de noradrénaline augmente les concentrations de dopamine extracellulaire dans le cortex préfrontal: preuve que la dopamine est absorbée in vivo par les terminaux noradrénergiques. J. Neurochem. 55, 1067–1070. doi: 10.1111/j.1471-4159.1990.tb04599.x
Carlsson, A. (1975). «Contrôle du métabolisme de la dopamine par les récepteurs», dans Récepteurs pré et post-synaptiques, Eds E. Usdin et WE Bunney (Marcel Deker, New York, NY), 49 – 65.
Carrasco, J., C. Márquez, R. Nadal, A. Tobeña, A., A. Fernández-Teruel et A. Armario (2008). Caractérisation des composants centraux et périphériques de l'axe hypothalamus-hypophyso-surrénalien chez les souches consanguines de rats romains. psychoneuroendocrinologie 33, 437 – 445. doi: 10.1016 / j.psyneuen.2008.01.001
Coppens, CM, de Boer, SF, Steimer, T. et Koolhaas, JM (2012). Impulsivité et comportement agressif chez les rats romains à faible ou à faible évitement: différences initiales et changements induits par le stress social chez les adolescents. Physiol. Comportement 105, 1156 – 1160. doi: 10.1016 / j.physbeh.2011.12.013
Corda, MG, D. Lecca, G. Piras, G. Di Chiara et O. Giorgi (1997). Paramètres biochimiques de la neurotransmission dopaminergique et GABAergique dans le SNC des rats à évitement élevé et à évitement faible. Comportement Genet. 27, 527 – 536. doi: 10.1023 / A: 1021452814574
Corda, MG, Piras, G., Piludu, MA et Giorgi, O. (2014). Effets différentiels de la consommation volontaire d'éthanol sur la production de dopamine dans la coquille de noyau accumbens de rats romains à risque d'évitement élevé et faible: étude de microdialyse comportementale et cérébrale. Monde J. Neurosci. 4, 279 – 292. doi: 10.4236 / wjns.2014.43031
Dahlstrom, A. et Fuxe, K. (1964). Preuve de l'existence de neurones contenant une monoamine dans le système nerveux central. I. Démonstration de monoamines dans les corps cellulaires des neurones du tronc cérébral. Acta Physiol. Scand. Suppl. 62, 1-54.
Damsma, G., Pfaus, J., D. Wenkstern, A. Phillips et A. Fibiger (1992). Le comportement sexuel augmente la transmission de la dopamine dans le noyau accumbens et le striatum de rats mâles: comparaison avec la nouveauté et la locomotion. Comportement Neurosci. 106, 181 – 191. doi: 10.1037 / 0735-7044.106.1.181
D'Angio, M., Serrano, A., Driscoll, P. et Scatton, B. (1988). Les stimuli environnementaux stressants augmentent les taux de DOPAC extracellulaires dans le cortex préfrontal de rats hypoémotifs (évitement élevé à la romaine) mais non hyperémotionnels (évitement à basse évasion de Romain). un in vivo étude voltamétrique Cerveau Res. 451, 237–247. doi: 10.1016/0006-8993(88)90768-8
Davis, JF, Loos, M., Di Sebastiano, AR, Brown, JL, Lehman, MN et Coolen, LM (2010). Les lésions du cortex préfrontal interne provoquent un comportement sexuel inadapté chez le rat mâle. Biol. Psychiatrie 67, 1199 – 1204. doi: 10.1016 / j.biopsych.2009.12.029
S. Díaz-Morán; M. Palència; C. Mont. Cardona; T. T. Cañete; G. Blázquez; E. Martínez-Membrives; et al. (2012). Style d'adaptation et réponses hormonales au stress chez des rats génétiquement hétérogènes: comparaison avec les souches de rats romains. Behav. Cerveau Res. 228, 203 – 210. doi: 10.1016 / j.bbr.2011.12.002
Driscoll, P. et Bättig, K. (1982). "Profils comportementaux, émotionnels et neurochimiques de rats sélectionnés pour leurs différences extrêmes de performances d'évitement actif et bidirectionnel", dans Génétique du cerveau, éd. I. Lieblich (Amsterdam: Elsevier), 95 – 123.
Dunlop, BW et Nemeroff, CB (2007). Le rôle de la dopamine dans la physiopathologie de la dépression. Cambre. Psychiatrie générale 64, 327 – 337. doi: 10.1001 / archpsyc.64.3.327
Escorihuela, RM, Fernández-Teruel, A., Gil, L., Aguilar, R., Tobeña, A. et Driscoll, P. (1999). Rats consanguins à évitement élevé et faible: différences dans les comportements d'anxiété, de recherche de nouveauté et de boîte navette. Physiol. Comportement 67, 19–26. doi: 10.1016/S0031-9384(99)00064-5
Everitt, BJ (1990). Motivation sexuelle: analyse neuronale et comportementale des mécanismes sous-jacents aux réponses appétitive et copulatoire de rats mâles. Neurosci. Biobehav. Tour. 14, 217–232. doi: 10.1016/s0149-7634(05)80222-2
Everitt, BJ et Robbins, TW (2005). Systèmes neuronaux de renforcement pour la toxicomanie: des actions aux habitudes en passant par la contrainte. Nat. Neurosci. 8, 1481 – 1489. doi: 10.1038 / nn1579
Fadda, F., Argiolas, A., Melis, MR, Tissari, AH, Onali, PL et Gessa, GL (1978). Augmentation induite par le stress des niveaux d'acide 3,4-dihydroxyphénylacétique (DOPAC) dans le cortex cérébral et n.accumbens: inversion par le diazépam. Life Sci. 23, 2219–2224. doi: 10.1016/b978-0-08-023768-8.51934-4
Fattore, L., Piras, G., Corda, MG et Giorgi, O. (2009). Les lignées de rat romaines à évitement élevé et faible se différencient par l'acquisition, le maintien, l'extinction et la réintégration de l'auto-administration de cocaïne par voie intraveineuse. Neuropsychopharmacology 34, 1091 – 1101. doi: 10.1038 / npp.2008.43
Febo, M. (2011). Cellules préfrontales en train de tirer chez des rats mâles lors de leur approche vers une femelle sexuellement réceptive: interactions avec la cocaïne. Synapse 65, 271 – 277. doi: 10.1002 / syn.20843
Fernández-Guasti, A., I. Omaña-Zapata, M. Luján et M. Condés-Lara (1994). Actions de la ligature du nerf sciatique sur le comportement sexuel de rats mâles sexuellement expérimentés et inexpérimentés: effets de la décortication du pôle frontal. Physiol. Comportement 55, 577–581. doi: 10.1016/0031-9384(94)90119-8
Fernández-Teruel, A., Driscoll, P., Gil, L., Aguilar, R., Tobeña, A. et Escorihuela, RM (2002). Effets persistants de l'enrichissement de l'environnement sur la recherche de nouveauté, la consommation de saccharine et d'éthanol chez deux lignées de rats (RHA / Verh et RLA / Verh), différant par leur comportement en matière de recherche d'incitation. Pharmacol. Biochem. Behav. 73, 225–231. doi: 10.1016/s0091-3057(02)00784-0
L. Giménez-Llort, T. Cañete, M. Guitart-Masip, A., Fernández-Teruel et A. Tobeña (2005). Deux phénotypes distincts induits par l'apomorphine chez les rats romains à évitement élevé et faible. Physiol. Comportement 86, 458 – 466. doi: 10.1016 / j.physbeh.2005.07.021
Giorgi, O., Lecca, D., Piras, G. et Corda, MG (2005). L'activation différentielle de la libération de dopamine dans le noyau accumbens après des injections d'amphétamines aiguës ou répétées: une étude comparative dans les lignées de rats à évitement élevé et à évitement roman. Neuroscience 135, 987 – 998. doi: 10.1016 / j.neuroscience.2005.06.075
Giorgi, O., Lecca, D., Piras, G., Driscoll, P. et Corda, MG (2003a). Dissociation entre la libération de dopamine mésocorticale et les comportements liés à la peur dans deux lignées de rats sélectionnées de manière psychogénique dont les stratégies d'adaptation aux conditions aversives diffèrent. EUR. J. Neurosci. 17, 2716 – 2726. Doi: 10.1046 / j.1460-9568.2003.02689.x
Giorgi, O., Piras, G., Lecca, D., Hansson, S., Driscoll, P. et Corda, MG (2003b). Propriétés neurochimiques différentielles de la transmission sérotoninergique centrale chez le rat romain à évitement élevé et faible. J. Neurochem. 86, 422 – 431. Doi: 10.1046 / j.1471-4159.2003.01845.x
Giorgi, O., Orlandi, M., Escorihuela, RM, Driscoll, P., Lecca, D. et Corda, MG (1994). Transmission GABAergique et dopaminergique dans le cerveau de rats romains à évitement élevé et à évitement faible. Cerveau Res. 638, 133–138. doi: 10.1016/0006-8993(94)90642-4
Giorgi, O., Piras, G. et Corda, MG (2007). Les lignées de rat romaines à évitement élevé et à évitement choisies psychogénétiquement: un modèle pour étudier la vulnérabilité individuelle à la toxicomanie. Neurosci. Biobehav. Tour. 31, 148 – 163. doi: 10.1016 / j.neubiorev.2006.07.008
Goto, Y. et Grace, AA (2005). Modulation dopaminergique de la pulsion limbique et corticale du noyau accumbens du comportement dirigé. Nat. Neurosci. 8, 805 – 812. doi: 10.1038 / nn1471
Gresch, PJ, Sved, AF, Zigmond, MJ et Finlay, JM (1995). Influence locale de la norépinéphrine endogène sur la dopamine extracellulaire dans le cortex préfrontal médial du rat. J. Neurochem. 65, 111 – 116. Doi: 10.1046 / j.1471-4159.1995.65010111.x
Hernández-Gonzáles, M., Guevara, MA, Cervantes, M., G. Morali et Corsi-Cabrera, M. (1998). Bandes de fréquences caractéristiques de l'EEG cortico-frontal lors de l'interaction sexuelle du rat mâle à la suite d'une analyse factorielle. J. Physiologie 92, 43–50. doi: 10.1016/s0928-4257(98)80022-3
Hernández-Gonzáles, M., Prieto-Beracoechea, CA, Arteaga-Silva, M. et Guevara, MA (2007). Différentes fonctionnalités du cortex préfrontal médial et orbital lors d’une tâche à motivation sexuelle chez le rat. Physiol. Comportement 90, 450 – 458. doi: 10.1016 / j.physbeh.2006.10.006
Corne, AS (1973). Relations structure-activité pour l'inhibition de l'absorption de catécholamine dans les synaptosomes par les neurones noradrénergiques et dopaminergiques dans les homogénats de cerveau de rat. Br. J. Pharmacol. 47, 332–338. doi: 10.1111/j.1476-5381.1973.tb08331.x
Hull, EM, Du, J., Lorrain, DS et Matuszewich, L. (1995). Dopamine extracellulaire dans la région préoptique médiane: implications pour la motivation sexuelle et le contrôle hormonal de la copulation. J. Neurosci. 15, 7465-7471.
Hull, EM, Lorrain, DS, Du, J., Matuszewich, L., Lumley, LA, Putnam, SK, et al. (1999). Interactions hormone-neurotransmetteur dans le contrôle du comportement sexuel. Behav. Cerveau Res. 105, 105–116. doi: 10.1016/s0166-4328(99)00086-8
Hull, EM, Weber, MS, Eaton, RC, Dua, R., Markowski, VP, Lumley, L., et al. (1991). Les récepteurs de la dopamine dans la région tegmentale ventrale affectent les composants moteurs, mais non le facteur motivationnel ou réflexif, de la copulation chez le rat mâle. Cerveau Res. 554, 72–76. doi: 10.1016/0006-8993(91)90173-S
Ikemoto, S. et Panksepp, J. (1999). Le rôle du noyau accumbens dopamine dans le comportement motivé: une interprétation unificatrice avec une référence particulière à la recherche de récompense. Brain Res. Tour. 31, 6–41. doi: 10.1016/S0165-0173(99)00023-5
Kakeyama, M., Sone, H., Miyabara, Y. et Tohyama, C. (2003). L'exposition périnatale à 2,3,7,8-tétrachlorodibenzo-p-dioxine modifie l'expression, dépendante de l'activité, de l'ARNm de BDNF dans le néocortex et le comportement sexuel du rat mâle à l'âge adulte. Neurotoxicologie 24, 207–217. doi: 10.1016/S0161-813x(02)00214-0
Lecca, D., Piras, G., Driscoll, P., Giorgi, O. et Corda, MG (2004). Une activation différentielle de la production de dopamine dans la coquille et le noyau du noyau accumbens est associée aux réponses motrices aux drogues provoquant une dépendance: une étude de dialyse cérébrale chez le rat romain à évitement élevé et faible. Neuropharmacologie 46, 688 – 699. doi: 10.1016 / j.neuropharm.2003.11.011
Manzo, L., Gómez, MJ, Callejas-Aguilera, JE, Donaire, R., Sabariego, M., Fernández-Teruel, A., et al. (2014a). Relation entre préférence éthanol et recherche de sensation / nouveauté. Physiol. Comportement 133, 53 – 60. doi: 10.1016 / j.physbeh.2014.05.003
Manzo, L., Gómez, MJ, Callejas-Aguilera, JE, A. Fernández-Teruel, A., Papini, MR et Torres, C. (2014b). Auto-médication anti-anxiété induite par une perte d’incitation chez le rat. Physiol. Comportement 123, 86 – 92. doi: 10.1016 / j.physbeh.2013.10.002
Masana, M., Bortolozzi, A. et Artigas, F. (2011). Renforcement sélectif de la transmission dopaminergique mésocorticale par les médicaments noradrénergiques: opportunités thérapeutiques dans la schizophrénie. Int. J. Neuropsychopharmacol. 14, 53 – 68. doi: 10.1017 / s1461145710000908
Meisel, RL et Sachs, BD (1994). «La physiologie du comportement sexuel masculin», dans Physiologie de la reproductionVol. 2, 2nd Edn., Éd. E. Knobil et J. Neil (New York, NY: Raven Press), 3 – 96.
Melis, MR et Argiolas, A. (1995). Dopamine et comportement sexuel. Neurosci. Biobehav. Tour. 19, 19–38. doi: 10.1016/0149-7634(94)00020-2
Melis, MR et Argiolas, A. (2011). Contrôle central de l'érection du pénis: une nouvelle visite du rôle de l'ocytocine et de son interaction avec la dopamine et l'acide glutamique chez le rat mâle. Neurosci. Biobehav. Tour. 35, 939 – 955. doi: 10.1016 / j.neubiorev.2010.10.014
Melis, MR, T. Melis, C. Cocco, S. Succu, F. Sanna, G. Pillolla, et al. (2007). L'ocytocine injectée dans la région tegmentale ventrale induit l'érection du pénis et augmente la dopamine extracellulaire dans le noyau accumbens et le noyau nerveux paraventriculaire de l'hypothalamus de rats mâles. EUR. J. Neurosci. 26, 1026 – 1035. Doi: 10.1111 / j.1460-9568.2007.05721.x
Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., et al. (2010). L'ocytocine induit l'érection du pénis lorsqu'elle est injectée dans le subiculum ventral: rôle de l'oxyde nitrique et de l'acide glutamique. Neuropharmacologie 58, 1153 – 1160. doi: 10.1016 / j.neuropharm.2010.02.008
Melis, MR, S. Succu, MS Mascia, L. Cortis et A. Argiolas (2003). La dopamine extracellulaire augmente dans le noyau paraventriculaire des rats mâles au cours de l'activité sexuelle. EUR. J. Neurosci. 17, 1266 – 1272. Doi: 10.1046 / j.1460-9568.2003.02558.x
Melis, MR, Succu, S., Sanna, F., Boi, A. et Argiolas, A. (2009). L'ocytocine injectée dans le subiculum ventral ou dans le noyau cortical postéro-médian de l'amygdale provoque l'érection du pénis et augmente les taux de dopamine extracellulaire dans le noyau accumbens de rats mâles. EUR. J. Neurosci. 30, 1349 – 1357. Doi: 10.1111 / j.1460-9568.2009.06912.x
Moreno, M., D. Cardona, MJ Gómez, F. Sánchez-Santed, A. Tobeña, A. Fernández-Teruel et autres. (2010). Caractérisation de l'impulsivité chez les souches de rat romaines à évitement élevé et faible: différences comportementales et neurochimiques. Neuropsychopharmacology 35, 1198 – 1208. doi: 10.1038 / npp.2009.224
Oliveras, I., C. Río-Álamos, T. Cañete, G., Blázquez, E. Martínez-Membrives, E., Giorgi, et al. (2015). L'inhibition de la prépulse prédit la performance de la mémoire de travail spatiale chez les rats consanguins à évitement élevé et à évitement élevé et chez les rats NIH-HS génétiquement hétérogènes: pertinence pour l'étude des anomalies pré-attentives et cognitives dans la schizophrénie De face. Comportement Neurosci. 9: 213. doi: 10.3389 / fnbeh.2015.00213
Paxinos, G. et Watson, C. (2004). Le cerveau de rat en coordonnées stéréotaxiques, 4th Edn, New York: Presse académique.
Pfaus, JG (2010). Dopamine: aider les hommes à copuler pendant au moins 200 millions d'années: commentaire théorique sur Kleitz-Nelson et al. (2010). Comportement Neurosci. 124, 877 – 880. doi: 10.1037 / a0021823
Pfaus, JG, G. Damsma, Nomikos, GG, Wenkstern, DG, Blaha, CD, Phillips, AG, et al. (1990). Le comportement sexuel améliore la transmission centrale de la dopamine chez le rat mâle. Cerveau Res. 530, 345–348. doi: 10.1016/0006-8993(90)91309-5
Pfaus, JG et Everitt, BJ (1995). «La psychopharmacologie du comportement sexuel», dans Psychopharmacologie: la quatrième génération de progrès, FE Bloom et DJ Kupfer (New York, NY: Raven Press), 742 – 758.
Pfaus, JG et Phillips, AG (1991). Rôle de la dopamine dans les aspects d'anticipation et de consommation du comportement sexuel chez le rat mâle. Comportement Neurosci. 105, 727 – 747. doi: 10.1037 / 0735-7044.105.5.727
Piras, G., Giorgi, O. et Corda, MG (2010). Effets des antidépresseurs sur les performances au test de la nage forcée de deux lignées de rats sélectionnées de manière psychogénique dont les stratégies d'adaptation aux conditions aversives diffèrent. Psychopharmacologie 211, 403–414. doi: 10.1007/s00213-010-1904-x
Piras, G., Piludu, MA, Giorgi, O. et Corda, MG (2014). Effets des traitements antidépresseurs chroniques dans un modèle génétique présumé de vulnérabilité (rats romains à faible risque d'évitement) et de résistance (rats romains à évitement élevé) à la dépression induite par le stress. Psychopharmacologie 231, 43–53. doi: 10.1007/s00213-013-3205-7
Pitchers, KK, Frohmader, KS, V. Vialou, K., Mouzon, EJ Nestler, Lehman, MN, et al. (2010). Le ΔFosB dans le noyau accumbens est essentiel pour renforcer les effets de la récompense sexuelle. Gènes Brain Behav. 9, 831–840. doi: 10.1111/j.1601-183X.2010.00621.x
Pitchers, KK, Coppens, CM, Beloate, LN, Fuller, J., Van, S., Frohmader, KS, et al. (2014). La neuroplasticité endogène induite par les opioïdes des neurones dopaminergiques dans la région tégmentale ventrale influence la récompense naturelle et celle des opiacés. J. Neurosci. 34, 8825 – 8836. doi: 10.1523 / JNEUROSCI.0133-14.2014
Pichets, KK, V. Vialou, EJ, Nestler, SR, SR, Lehman, MN et Coolen, LM (2013). Les récompenses naturelles et médicamenteuses agissent sur les mécanismes de plasticité neuronale courants avec ΔFosB en tant que médiateur clé. J. Neurosci. 33, 3434 – 3442. doi: 10.1523 / JNEUROSCI.4881-12.2013
Pleim, E., Matochik, J., Barfield, R. et Auerbach, S. (1990). Corrélation entre la libération de dopamine dans le noyau accumbens et le comportement sexuel masculin chez le rat. Cerveau Res. 524, 160–163. doi: 10.1016/0006-8993(90)90507-8
Robbins, TW et Arnsten, AFT (2009). La neuropsychopharmacologie de la fonction fronto-exécutive: modulation monoaminergique. Ann. Rev. Neurosci. 32, 267 – 287. doi: 10.1146 / annurev.neuro.051508.135535
Sabariego, M., I. Morón, MJ Gómez, R. Donaire, A., Tobeña, A. Fernández-Teruel, et al. (2013). Perte d’encouragement et expression du gène de l’hippocampe chez des rats d’évitement romains (RHA-I) et bas (RLA-I) consanguins. Behav. Cerveau Res. 257, 62 – 70. doi: 10.1016 / j.bbr.2013.09.025
Sachs, BD (2000). Approches contextuelles de la physiologie et de la classification de la fonction érectile, de la dysfonction érectile et de l'excitation sexuelle. Neurosci. Biobehav. Tour. 24, 541–560. doi: 10.1016/S0149-7634(00)00022-1
Sachs, BD, Akasofu, K., Citro, JK, Daniels, SB et Natoli, JH (1994). La stimulation sans contact des femelles de l'oestrus évoque l'érection du pénis chez le rat. Physiol. Comportement 55, 1073–1079. doi: 10.1016/0031-9384(94)90390-5
Sachs, BD et Barfield, RJ (1976). Analyse fonctionnelle du comportement copulateur masculin chez le rat. Adv. Goujon. Comportement 7, 91–154. doi: 10.1016/s0065-3454(08)60166-7
Salamone, JD, M. Pardo, SE Yohn, L. López-Cruz, N. San Miguel et M. Correa (2016). La dopamine mésolimbique et la régulation du comportement motivé. Curr. Haut. Comportement Neurosci. 27, 231–257. doi: 10.1007/7854_2015_383
Sanna, F., Corda, MG, Melis, MR, Piludu, MA, Giorgi, O. et Argiolas, A. (2014a). Les rats masculins à faible et à faible évitement présentent des schémas de comportement copulatoire différents: comparaison avec les rats Sprague Dawley. Physiol. Comportement 127, 27 – 36. doi: 10.1016 / j.physbeh.2014.01.002
Sanna, F., Piludu, MA, Corda, MG, Argiolas, A., Giorgi, O. et Melis, MR (2014b). La dopamine est impliquée dans les différents modèles de comportement copulatoire des rats romains d'évitement élevé et faible: études portant sur l'apomorphine et l'halopéridol. Pharmacol. Biochem. Behav. 124, 211 – 219. doi: 10.1016 / j.pbb.2014.06.012
Sanna, F., Piludu, MA, Corda, MG, Melis, MR, Giorgi, O. et Argiolas, A. (2015). Implication de la dopamine dans les différences de comportement sexuel entre les rats romains à évitement élevé et faible: étude de microdialyse intracérébrale. Behav. Cerveau Res. 281, 177 – 186. doi: 10.1016 / j.bbr.2014.12.009
Scatton, B., D'Angio, M., Driscoll, P. et Serrano, A. (1988). Un in vivo Etude voltamétrique de la réponse des neurones dopaminergiques mésocorticaux et mésoaccumbens aux stimuli environnementaux chez des souches de rats présentant différents niveaux d’émotivité. Ann. NY Acad. Sci. 537, 124–137. doi: 10.1111/j.1749-6632.1988.tb42101.x
Steimer, T. et Driscoll, P. (2003). Différentes réponses au stress et styles d’adaptation chez les rats à évitement élevé (RHA) et faible (RLA) romains sélectionnés psychogénétiquement: aspects comportemental, neuroendocrinien et développemental. Stress 6, 87 – 100. doi: 10.1080 / 1025389031000111320
Succu, S., Sanna, F., Argiolas, A. et Melis, MR (2011). L'ocytocine injectée dans le subiculum ventral de l'hippocampe induit l'érection pénienne chez les rats mâles en augmentant la neurotransmission glutamatergique dans la région tégmentale ventrale. Neuropharmacologie 61, 181 – 188. doi: 10.1016 / j.neuropharm.2011.03.026
Succu, S., Sanna, F., Cocco, C., Melis, T., Boi, A., Ferri, GL, et al. (2008). L'ocytocine induit l'érection du pénis lorsqu'elle est injectée dans la région tegmentale ventrale de rats mâles: rôle de l'oxyde nitrique et du GMP cyclique. EUR. J. Neurosci. 28, 813 – 821. Doi: 10.1111 / j.1460-9568.2008.06385.x
Succu, S., Sanna, F., Melis, T., Boi, A., Argiolas, A. et Melis, MR (2007). La stimulation des récepteurs de la dopamine dans le noyau paraventriculaire de l'hypothalamus de rats mâles induit l'érection du pénis et augmente la dopamine extracellulaire dans le noyau accumbens: implication de l'ocytocine centrale. Neuropharmacologie 52, 1034 – 1043. doi: 10.1016 / j.neuropharm.2006.10.019
Thierry, AM, Tassin, JP, Blanc, G. et Glowinski, J. (1976). Activation sélective du système DA mésocortical par le stress. Nature 263, 242 – 244. doi: 10.1038 / 263242a0
Wenkstern, D., Pfaus, J. et Fibiger, H. (1993). La transmission de la dopamine augmente dans le noyau accumbens des rats mâles lors de leur première exposition à des rats femelles sexuellement réceptifs. Cerveau Res. 618, 41–46. doi: 10.1016/0006-8993(93)90426-N
Westernik, BHC, P. De Boer, De Vries, JB et Long, S. (1998). Les médicaments antipsychotiques induisent des effets similaires sur la libération de dopamine et de noradrénaline dans le cortex préfrontal médial du cerveau de rat. EUR. J. Pharmacol. 361, 27–33. doi: 10.1016/s0014-2999(98)00711-0
Willig, F., M'Harzi, M., C. Bardelay, D. Viet et D. Delacour, J. (1991). Les souches romaines en tant que modèle psychogénétique pour l'étude de la mémoire de travail: données comportementales et biochimiques. Pharmacol. Biochem. Behav. 40, 7–16. doi: 10.1016/0091-3057(91)90313-q
Mots-clés: comportement sexuel, dopamine, noradrénaline, mPFC, microdialyse, rats RHA et RLA
Citation: Sanna F, J Bratzu, MA Piludu, MG Corda, MR Melis, O Giorgi et Argiolas A (2017), dopamine, noradrénaline et différences de comportement sexuel entre les rats à faible et à faible évitement romains: étude de microdialyse dans le cortex préfrontal médial . De face. Comportement Neurosci. 11: 108. doi: 10.3389 / fnbeh.2017.00108
Reçu: 22 décembre 2016; Accepté: 19 May 2017;
Publié: 07 June 2017.
 Fabrizio Sanna
Fabrizio Sanna Jessica Bratzu
Jessica Bratzu Maria A. Piludu
Maria A. Piludu Maria G. Corda
Maria G. Corda Maria R. Melis
Maria R. Melis Osvaldo Giorgi
Osvaldo Giorgi Antonio Argiolas
Antonio Argiolas