Commentaires: Cette revue a été produite par la responsable de NIDA, Nora Volkow, et son équipe. Il ne fait aucun doute que les dépendances chimiques et comportementales partagent des mécanismes et des circuits neuronaux identiques ou similaires. Cela est parfaitement logique puisque les addictions chimiques détournent les circuits neuronaux pour nouer des liens, avoir des relations sexuelles et manger. Étant donné que le sexe libère deux fois plus de dopamine que de manger votre aliment préféré, et qu'un internaute peut maintenir la dopamine à niveau pendant des heures, il est fou de proposer que la dépendance au porno ne puisse exister.
Curr Top Behav Neurosci. 2011 Oct 21.
ND de Volkow, Wang GJ, Fowler JS, D Tomasi, Baler R.
Identifier
Institut national de lutte contre l'abus des drogues, 6001 Executive Boulevard 6001, salle 5274, Bethesda, MD, 20892, USA, [email protected].
Abstract
La toxicomanie et l'obésité peuvent tous deux être définis comme des troubles dans lesquels la valeur prédominante d'un type de récompense (médicaments et nourriture, respectivement) augmente anormalement par rapport aux autres et au détriment de ceux-ci. Ce modèle est cohérent avec le fait que les médicaments et les aliments ont de puissants effets de renforcement - en partie médiés par des augmentations de dopamine dans le système limbique - qui, dans certaines circonstances ou chez des individus vulnérables, pourraient submerger les mécanismes de contrôle homéostatique du cerveau. Ces parallèles ont généré un intérêt significatif pour la compréhension des vulnérabilités partagées et des trajectoires entre la dépendance et l'obésité. À présent, les découvertes en imagerie cérébrale ont commencé à mettre au jour des caractéristiques communes à ces deux conditions et à délimiter certains des circuits cérébraux qui se chevauchent et dont les dysfonctionnements pourraient expliquer des déficits comportementaux stéréotypiques et apparentés chez l'homme. TCes résultats suggèrent que les individus obèses et toxicomanes souffrent de déficiences des voies dopaminergiques régulant les systèmes neuronaux associées non seulement à la sensibilité à la récompense et à la motivation, mais également au conditionnement (mémoire / apprentissage), au contrôle des pulsions (inhibition comportementale) et à la réactivité au stress. et conscience interoceptive. Ici, nous intégrons des résultats principalement issus de la tomographie à émission de positrons qui mettent en lumière le rôle de la dopamine dans la toxicomanie et l'obésité, et proposons un modèle de travail actualisé pour aider à identifier des stratégies de traitement pouvant bénéficier à ces deux conditions.
1 Contexte
2 Le rôle de la dopamine dans la récompense aiguë des médicaments et des aliments
3 Imaging DA en réponse aux drogues et aux signaux conditionnés de la toxicomanie
4 L'impact de la dysfonction dans le contrôle inhibiteur
5 Implication de circuits de motivation
6 Implication de circuits interoceptifs
7 Le circuit de l'aversion
8 Médicament pathologique et récompense alimentaire: un modèle de travail actualisé
1 Contexte
La dopamine (AD) est considérée comme un élément clé des effets bénéfiques des récompenses naturelles et liées aux médicaments. Cependant, son rôle dans la perte de contrôle et les comportements compulsifs associés à la dépendance et à l'obésité est beaucoup moins clair. Les études PET ont joué un rôle crucial dans la caractérisation du rôle des systèmes DA du cerveau dans la toxicomanie (en plus de son rôle dans la récompense du médicament) et dans l'obésité. En effet, les drogues d'abus (y compris l'alcool) sont consommées par les humains ou auto-administrées par des animaux de laboratoire car elles sont intrinsèquement gratifiantes, un effet qui est médiatisé par leurs propriétés améliorant le DA dans le système mésolimbique (Wise 2009). HToutefois, dans le cas de la dépendance, des études d'imagerie ont révélé que le trouble affecte non seulement le circuit de récompense des DA, mais également d'autres voies de DA impliquées dans la modulation du conditionnement / des habitudes, de la motivation et des fonctions exécutives (contrôle inhibiteur, attribution de la saillance et décision). prise) et que les déficits en DA peuvent également participer à la réactivité accrue au stress et à la perturbation de la conscience interoceptive associée à la dépendance. Des études précliniques et cliniques ont également révélé la présence d’autres neurotransmetteurs (et neuropeptides) jouant un rôle important dans le traitement des toxicomanies et la toxicomanie. (c.-à-d. cannabinoïdes, opioïdes) et sont intimement impliqués dans les changements neuroplastiques qui suivent une consommation répétée de drogue (c.-à-d. glutamate, opioïdes, GABA, facteur de libération de corticotropine). Le système glutamatergique est particulièrement important à cet égard car il atténue les perturbations à la fois de la potentialisation à long terme et de la dépression à long terme qui ont été observées dans des modèles animaux d'administration chronique de médicaments. (Thomas et al. 2008) Des critiques relatives à ces systèmes supplémentaires sont disponibles ailleurs (Kalivas 2009; Koob 1992).
Étant donné que les médicaments activent les mêmes systèmes de récompense que ceux qui sous-tendent la récompense alimentaire, il n’est pas totalement surprenant que, d’une manière générale, les études d’imagerie cérébrale aient confirmé l’idée que les déficiences dans les circuits à modulation DA seraient également impliquées dans des comportements alimentaires pathologiques et compulsifs.. Les signaux alimentaires, tels que les médicaments, augmentent la DA extracellulaire striatale et incitent à adopter les comportements nécessaires pour se procurer et manger de la nourriture, ce qui constitue la preuve de son implication non seulement dans la récompense alimentaire, mais aussi dans la motivation non hédonique. les propriétés des aliments (besoins caloriques) et la diminution du contrôle inhibiteur observée lors de la suralimentation compulsive (Avena et al. 2008; Volkow et al. 2008).
Nous passons ici en revue les conclusions d’études en imagerie qui se concentrent spécifiquement sur les chevauchements dans les circuits cérébraux perturbés par l’obésité et la toxicomanie. Il convient toutefois de rappeler que la réglementation des comportements alimentaires est beaucoup plus complexe que la réglementation de la consommation de drogues. Le dernier est principalement médiatisé par les effets gratifiants des médicaments, tandis que le premier est modulé non seulement par ses effets gratifiants (facteurs hédoniques) mais également par de multiples facteurs centraux périphériques et centraux qui détectent les besoins nutritionnels de l'organisme nécessaires à la survie (facteurs homéostatiques). De manière intéressante, il est de plus en plus évident que des facteurs homéostatiques (par exemple, l’insuline, la leptine, la ghréline) modulent l’apport alimentaire en augmentant ou en diminuant la sensibilité des circuits de récompense cérébrale aux stimuli alimentaires (Volkow et al. 2011).
2 Le rôle de la dopamine dans la récompense aiguë des médicaments et des aliments
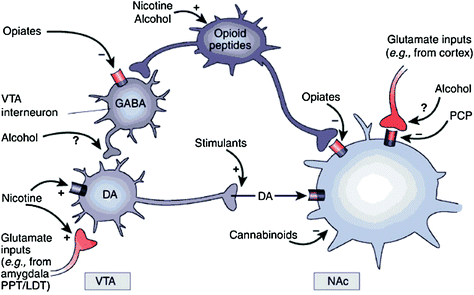
Que ce soit directement ou indirectement, toutes les drogues entraînant une dépendance montrent une capacité à augmenter la DA dans le noyau accumbens (NAc) via des interactions spécifiques avec différentes cibles moléculaires (Nestler 2004) (Figue. 1) La voie DA mésolimbique [cellules DA situées dans la région tegmentale ventrale (VTA) projetée dans l’ANc] semble être cruciale pour la récompense du médicament (Wise 2009) Cependant, comme décrit ci-dessous, d'autres voies DA (les cellules DA mésostriatales dans la substantia nigra se projetant dans le striatum dorsal) et les cellules mésocorticales (les cellules DA dans le VTA se projetant dans le cortex frontal) contribuent également à la récompense du médicament et à la dépendance (Wise 2009) Dans l’ensemble, il semble que les effets bénéfiques et conditionnels des médicaments résultent principalement de l’allumage phasique de cellules DA, ce qui entraîne une augmentation importante et transitoire de la DA. En revanche, les modifications en aval de la fonction exécutive qui surviennent dans l’addiction sont liées aux modifications du déclenchement des cellules toniques de DA et donnent lieu à des niveaux de DA plus bas mais plus stables (Grace 2000; Wanat et al. 2009) Ceci, à son tour, pointe vers les récepteurs D1 (D1R), récepteurs DA de faible affinité qui stimulent la signalisation de l'AMP cyclique, étant impliqués à la fois dans la récompense médicamenteuse aiguë et dans le conditionnement, car ils sont associés aux fortes concentrations en DA nécessaires pour stimuler D1R. En revanche, les D2R, qui inhibent la signalisation de l'AMP cyclique, sont stimulés à la fois par le DA phasique et tonique. Notez que, en raison de l’absence de radiotraceurs spécifiques pour l’imagerie par TEP des récepteurs DA des types D1, D3, D4 et D5, la plupart des études sur les effets de drogues d’abus et de dépendances sur le cerveau humain se sont concentrées sur les D2R.
Fig. 1 Les drogues d'abus agissent sur les circuits de récompense et les circuits auxiliaires par le biais de mécanismes différents. Cependant, elles entraînent toutes des effets dopaminergiques similaires dans la VTA et l'ANc.. Ainsi, les stimulants stimulent directement la DA accolée, tandis que les opiacés agissent de la sorte en diminuant le tonus inhibiteur des interneurones GABAergiques sur la DA signalant à la fois dans la VTA ou dans la NAc. Bien que les mécanismes d'autres drogues d'abus soient moins clairs, il existe des preuves suggérant que la nicotine pourrait activer la DA de la VTA directement par le récepteur nicotinique de l'acétylcholine (NAChR) sur ces neurones et indirectement par la stimulation de ses récepteurs aux terminaisons nerveuses glutamatergiques qui innervent les cellules du DA. L'alcool semble inhiber les terminaux GABAergiques dans la VTA, conduisant à la désinhibition des neurones DA dans la VTA. Les cannabinoïdes agissent, entre autres, par l’activation des récepteurs CB1 sur les terminaisons nerveuses glutamatergiques et GABAergiques de la NAc et sur les neurones de la NAc eux-mêmes. La phencyclidine (PCP) peut agir en inhibant les récepteurs postsynaptiques du glutamate de NMDA dans le NAc. En outre, certaines preuves suggèrent que la nicotine et l'alcool peuvent également interagir avec les voies des opioïdes et des cannabinoïdes endogènes (non présenté). PPT / LDT, pontine pédonculaire tegmentum / tegmentum latéral dorsal. Réimprimé avec permission Nestler (2005)
Chez l’homme, des études par PET ont montré que plusieurs médicaments [stimulants (Drevets et al. 2001; Volkow et al. 1999b), la nicotine (Brody et al. 2009), l’alcool (Boileau et al. 2003) et de la marijuana (Bossong et al. 2009)] augmenter DA dans le striatum dorsal et ventral (où est situé le NAc). Ces études tirent parti de plusieurs radiotraceurs, tels que [11C] le raclopride, qui se lie au D2R, mais uniquement lorsque ceux-ci ne sont pas liés au DA endogène (inoccupé), ce qui, dans les conditions initiales, correspond à 85 – 90% du D2R striatal (Abi-Dargham et al. 1998) Ainsi, une comparaison de [11La liaison du C] raclopride après le placebo et après l'administration du médicament peut nous aider à estimer les diminutions de la disponibilité de D2R induites par le médicament (ou d'autres stimuli pouvant augmenter le DA). Ces diminutions de [11Les liaisons de C] raclopride sont proportionnelles aux augmentations de DA (Breier et al. 1997). Ces études ont montré que les augmentations de DA induites par les médicaments dans le striatum sont proportionnelles à l'intensité de l'expérience subjective d'euphorie ou «élevée» [voir la revue (Volkow et al. 2009)] (Figue. 2).
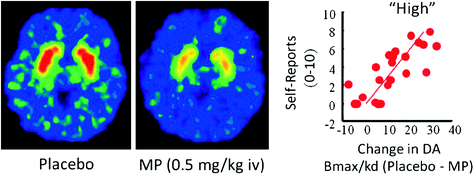
Fig. 2 Effets du méthylphénidate (MP) par voie intraveineuse sur la fixation du raclopride et relation entre l'augmentation de la DA striatale induite par la MP dans le striatum et l'auto-déclaration «élevé». Modifié à partir de Volkow et al. (1999b)
Les études PET ont également révélé une relation claire et directe entre le profil pharmacocinétique d'un médicament (c'est-à-dire la vitesse à laquelle il entre et sort du cerveau) et ses effets renforçateurs. Plus précisément, plus un médicament atteint rapidement les concentrations maximales dans le cerveau, plus l'intensité est élevée (Volkow et al. 2009). Par exemple, pour un niveau équivalent de cocaïne atteignant le cerveau (évalué par la TEP), lorsque la cocaïne pénétrait rapidement dans le cerveau (fumée ou administration intraveineuse), elle provoquait un «high» plus intense que lorsqu'elle entrait plus lentement (sniffée). (Volkow et al. 2000). Cela concorde avec les études précliniques montrant une corrélation similaire entre le profil pharmacocinétique d’un médicament et ses propriétés renforçantes (Balster et Schuster 1973). jeIl est raisonnable de supposer que de telles augmentations brusques et importantes de DA provoquées par des drogues abusives peuvent imiter les augmentations rapides et importantes de DA résultant du tir de DA phasique qui a été associé, dans le cerveau, au traitement des informations relatives à la récompense et à la saillance. (Schultz 2010). De telles augmentations du DAc induites par les drogues peuvent être nécessaires à la toxicomanie, mais le fait qu'elles se produisent également chez des personnes non toxicomanes indique qu'elles ne suffisent pas à expliquer le comportement impulsif et compulsif de la toxicomanie caractéristique de la toxicomanie.
Il est maintenant prouvé que des réponses dopaminergiques comparables sont liées à une récompense alimentaire et que ces mécanismes sont également susceptibles de jouer un rôle dans la consommation excessive de nourriture et l'obésité. Il est bien connu que certains aliments, en particulier ceux riches en sucres et en gras, sont puissamment enrichissants (Lenoir et al. 2007). Les aliments riches en calories peuvent favoriser une consommation excessive (alimentation découplée des besoins énergétiques) et déclencher des associations apprises entre le stimulus et la récompense (conditionnement). En termes évolutifs, cette propriété des aliments au goût agréable était avantageuse dans les environnements où les sources de nourriture étaient rares et / ou peu fiables, car elle garantissait que les aliments étaient consommés lorsqu'ils étaient disponibles, ce qui permettait de stocker de l'énergie dans le corps (sous forme de graisse) pour une utilisation future. . Malheureusement, dans des sociétés comme la nôtre, où la nourriture est abondante et disponible en permanence, cette adaptation est devenue un handicap.
Plusieurs neurotransmetteurs, dont l'AD, les cannabinoïdes, les opioïdes et la sérotonine, ainsi que des hormones et des neuropeptides impliqués dans la régulation homéostatique de la prise alimentaire, tels que l'insuline, l'orexine, la leptine et la ghréline, ont été impliqués dans les effets bénéfiques de l'alimentation (Atkinson 2008; Cason et al. 2010; Cota et al. 2006). Parmi ceux-ci, DA a été le plus étudié et est le mieux caractérisé. Des expériences sur des rongeurs ont montré que, lors de la première exposition à une récompense alimentaire, le déclenchement des neurones DA dans la VTA augmente avec une augmentation résultante de la libération de DA dans NAc (Norgren et al. 2006). De même, chez des sujets sains et de poids normal, l’ingestion d’aliments agréables au goût libère du DA dans le striatum dorsal proportionnellement au degré de plaisir des repas (Small et al. 2003) (Figue. 3). Cependant, et comme cela a été observé dans les études sur les toxicomanes, les augmentations de DA dans le striatum induites par les aliments ne peuvent à elles seules expliquer la différence entre une consommation alimentaire normale et une consommation alimentaire compulsive excessive, car elles se produisent également chez les personnes en bonne santé qui ne mangent pas excessivement. Ainsi, comme dans le cas de la toxicomanie, les adaptations en aval seront probablement impliquées dans la perte de contrôle de la prise alimentaire.
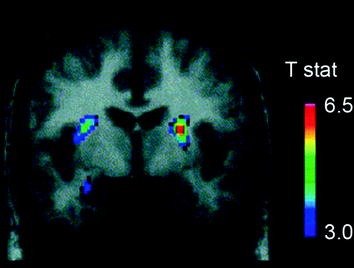
Fig. 3 Libération de dopamine induite par l'alimentation. Coupe coronale de la carte en T des réductions statistiquement significatives de [11Potentiel de liaison (PB) du raclopride C] après l’alimentation. La barre de couleur représente les valeurs statistiques t. (Réimprimé avec la permission de Small et al. 2003)
3 Imaging DA en réponse aux drogues et aux signaux conditionnés de la toxicomanie
Le rôle de DA dans le renforcement est plus complexe que le simple codage de la récompense en soi (plaisir hédonique); par exemple, les stimuli qui entraînent une augmentation rapide et importante de la DA entraînent également des réponses conditionnées et suscitent une motivation incitative pour les acquérir (Owesson-White et al. 2009). Ceci est important car, à travers le processus de conditionnement, les stimuli neutres qui sont liés au renforçateur (qu’il soit un renforçateur naturel ou médicamenteux) acquièrent la capacité d’augmenter eux-mêmes la DA dans le striatum (y compris le NAc) en prévision de la récompense, engendrant ainsi une forte motivation à rechercher le médicament (Owesson-White et al. 2009). Cependant, dissocier les mécanismes de récompense et de conditionnement dans le processus de toxicomanie est plus difficile que pour la consommation d'aliments, car les drogues d'abus, par leurs effets pharmacologiques, activent directement les neurones DA (à savoir la nicotine) ou augmentent la libération de DA (à savoir l'amphétamine).
Des études d'imagerie cérébrale comparant les augmentations de DA induites par le méthylphénidate (MP) ou l'amphétamine (AMPH), un médicament stimulant, chez les sujets dépendants à la cocaïne par rapport aux témoins ont montré une nette atténuation des augmentations de DA induites par MP ou AMPH dans le striatum (% de 50 moins et 80% chez les toxicomanes actifs) et une auto-évaluation plus faible des effets gratifiants de la drogue par rapport aux contrôles non toxicomanes (Martinez et al. 2007; Volkow et al. 1997) (Figue. 4). Cela était surprenant puisque MP et AMPH sont respectivement pharmacologiquement similaires à la cocaïne et à la méthamphétamine et que les toxicomanes ne peuvent pas les distinguer lorsqu'ils sont administrés par voie intraveineuse. Etant donné que les diminutions marquées des augmentations de DA induites par la drogue ont été observées que les consommateurs de cocaïne aient été désintoxiquées ou non, cela indique que l'état de sevrage n'est pas un facteur de confusion (Volkow et al. 2011b). Ceux-ci et les résultats connexes (Volkow et al. 2009) concordent avec l’hypothèse selon laquelle la réponse hédonique devient déficiente chez les toxicomanes, et renforcent encore la notion selon laquelle les effets aigus améliorant la DA pharmacologique du médicament dans NAc ne peuvent expliquer par eux-mêmes la motivation accrue de les consommer.
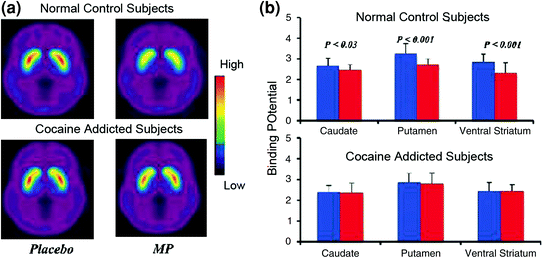
Fig. 4 Modifications de la DA induites par la MP iv chez les témoins et chez les sujets dépendants à la cocaïne actifs. un images de potentiel biding moyen (BPND) moyen de [11C] le raclopride chez les sujets dépendants à la cocaïne actifs (n = 19) et chez les témoins (n = 24) testés après le placebo et après la MP iv. b Disponibilité de D2R (BPND) dans le striatum caudé, putamen et ventral après le placebo (en bleu) et après la MP (en rouge) chez les sujets témoins et les cocaïnomanes. MP réduit le D2R chez les témoins mais pas chez les sujets dépendants à la cocaïne. Notez que les usagers de cocaïne présentent à la fois une diminution de la disponibilité de D2R striatale de base (mesure du placebo) et une diminution de la libération de DA lorsque administrée par voie intraveineuse (mesurée par une diminution de la disponibilité de D2R par rapport à la valeur de départ). Bien que l'on puisse se demander dans quelle mesure la faible disponibilité de D2R à l'état strié chez les sujets dépendants à la cocaïne limite la capacité de détecter des diminutions ultérieures de MP de MP sur [11La liaison C] raclopride reflète une diminution de la libération de DA. Réimprimé avec permission (Volkow et al. 1997; Wang et al. 2010)
La réponse des neurones VTA DA à un stimuli gratifiant change avec une exposition répétée.
Alors que les cellules DA se déclenchent lors de la première exposition à une nouvelle récompense, une exposition répétée à la DA force les neurones à cesser de déclencher lors de la consommation de récompenses et à se déclencher lorsqu'ils sont exposés à des stimuli prédictifs de la récompense. (Schultz et al. 1997). Cela sous-tend probablement le rôle de DA dans l'apprentissage et le conditionnement. En effet, la signalisation de phase DA induite par un médicament peut éventuellement déclencher des neuroadaptations dans des circuits auxiliaires liées à la formation d'habitudes et au conditionnement comportemental. TCes changements sont principalement induits par la signalisation D1R et les modifications synaptiques des récepteurs NMDA et AMPA modulés par le glutamate (Luscher et Malenka 2011; Zweifel et al. 2009). Le recrutement de ces circuits est important pour la progression de la maladie car les réponses conditionnées qui en découlent aident à expliquer le désir intense de la drogue (envie) et l’usage compulsif qui se produit lorsque des sujets dépendants sont exposés à des signaux associés à la drogue. Cette hypothèse est cohérente avec des observations indépendantes (Volkow et al. 2006b; Wong et al. 2006) qui démontrent le pouvoir de l’exposition aux signaux associés à la cocaïne d’augmenter les niveaux de DA dans le striatum dorsal et d’entraîner une augmentation concomitante de l’expérience subjective de soif de toxicomanes chez les toxicomanes toxicomanes détoxifiés (Fig. 5). Comme le striatum dorsal joue un rôle dans l’apprentissage des habitudes (Belin et al. 2009; Yin et al. 2004), l’association est susceptible de refléter le renforcement des habitudes à mesure que progresse la chronicité de la dépendance. Cela suggère qu'une perturbation fondamentale de la dépendance pourrait être liée aux réponses conditionnées déclenchées par la DA qui entraînent des habitudes entraînant une soif intense et une consommation compulsive de drogues. Fait intéressant, chez les sujets toxicomanes à la cocaïne, les augmentations de DA déclenchées par des signaux conditionnés semblent être encore plus importantes que celles produites par le médicament stimulant lui-même, évaluées dans deux groupes de sujets distincts (Volkow et al. 2011b, 2006b), suggérant que les réponses conditionnées peuvent entraîner la signalisation par le DA qui maintient la motivation à prendre le médicament même lorsque ses effets pharmacologiques semblent être réduits. Ainsi, bien que les médicaments puissent initialement induire des sentiments de récompense immédiate par le biais de la libération de DA dans le striatum ventral, avec un usage répété, et à mesure que l'habitude se développe, il semble que le médicament passe du stimulus conditionné. Selon des études chez des animaux de laboratoire, des projections glutamatergiques du cortex préfrontal et de l’amygdale vers VTA / SN et NAc induisent ces réponses conditionnées (Kalivas 2009). De cette manière, la simple prévision d’une récompense peut éventuellement devenir la récompense qui motive le comportement nécessaire à la consommation de drogue (ou d’aliments).
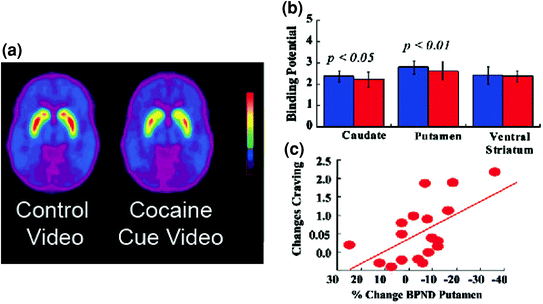
Fig. 5 Changements de DA induits par des signaux conditionnés chez des sujets dépendants actifs à la cocaïne. a Images de potentiel de liaison moyen non utilisable (BPND) du raclopride [11C] chez des sujets dépendants à la cocaïne (n = 17) testées lors du visionnage d’une vidéo neutre (scènes de la nature) et lors du visionnage de cocaïne (sujets recevant de la cocaïne). b Disponibilité de D2R (BPND) dans le striatum caudé, putamen et ventral pour la vidéo neutre (bleu) et la vidéo Indices de la cocaïne (rouge). Les signaux de cocaïne ont diminué D2R chez le caudé et le putamen. c Corrélations entre les changements de D2R (reflétant l'augmentation de DA) et les auto-déclarations de soif de cocaïne induite par la vidéo d'indices de cocaïne. Modifié de la réf. (Volkow et al. 2006b)
IIl est intéressant de noter que ce type de «commutateur» fonctionnel a également été signalé pour les renforçateurs naturels, susceptibles d'induire un déplacement progressif et équivalent de l'augmentation des DA, des régions ventrales aux régions plus dorsales du striatum lors de la transition d'un nouveau stimulus intrinsèquement lié. gratifiant à celui des indices associés qui le prédisent. Cette transition est transmise par la signalisation DA, qui semble coder pour une «erreur de prédiction de récompense» (Schultz 2010). Les afférences glutamatergiques étendues des neurones DA des régions impliquées dans le traitement des informations sensorielles (insula ou cortex gustatif primaire), homéostatiques (hypothalamus), de la récompense (NAc), émotionnelles (amygdala et hippocampe) et multimodales (cortex orbitofrontal pour la reconnaissance) , modulent leur activité en réponse aux récompenses et aux signaux conditionnés (Geisler et Wise 2008). Plus spécifiquement, les projections de l'amygdale et du cortex orbitofrontal (OFC) vers les neurones DA et vers l'ANc sont impliquées dans les réponses conditionnées à l'alimentation (Petrovich 2010). En effet, des études d'imagerie ont montré que lorsqu'on demandait à des sujets masculins non obèses de freiner leur envie de se nourrir - alors qu'ils étaient exposés à des signaux alimentaires -, ils présentaient une activité métabolique diminuée dans l'amygdale et l'OFC (ainsi que dans l'hippocampe), l'insula et le striatum. et que les diminutions de CFO étaient associées à une réduction du besoin alimentaire (Wang et al. 2009). Une inhibition similaire de l'activité métabolique au sein de l'OFC (et également de l'ANc) a été observée chez les consommateurs de cocaïne lorsqu'on leur a demandé d'inhiber leur envie de prendre de la drogue lorsqu'ils étaient exposés à des signaux de cocaïne (Volkow et al. 2009b).
Néanmoins, l'émergence de telles envies puissamment conditionnées, qui se produisent également chez les individus en bonne santé qui ne mangent pas trop, ne serait pas aussi dévastatrice si elles ne s'accompagnaient pas de déficits croissants dans la capacité du cerveau à inhiber les comportements mésadaptés.
4 L'impact de la dysfonction dans le contrôle inhibiteur
La capacité d’inhiber les réponses prépotentes contribue inévitablement à empêcher un individu de se livrer à des comportements inappropriés, tels que prendre de la drogue ou manger au-delà du seuil de satiété, et accroître ainsi sa vulnérabilité à la dépendance (ou à l’obésité) (Volkow et Fowler). 2000; Volkow et al. 2008).
Des études TEP ont mis au jour des réductions significatives de la disponibilité de D2R dans le striatum de sujets dépendants persistantes pendant des mois après une détoxification prolongée [rapporté dans (Volkow et al. 2009)]. De même, des études précliniques chez des rongeurs et des primates non humains ont montré que l’exposition répétée à des médicaments était associée à une réduction des taux de D2R striatal (Nader et al. 2006; Thanos et al. 2007; Volkow et al. 2001). Dans le striatum, les D2R médient la signalisation dans la voie indirecte striatale qui module les régions préfrontales; et il a été démontré que sa régulation à la baisse renforçait la sensibilisation aux effets des médicaments chez les modèles animaux (Ferguson et al. 2011). Chez les humains toxicomanes, la réduction du D2R striatal est associée à une diminution de l'activité des régions préfrontales, comme en témoigne une diminution du métabolisme glycémique initial (un marqueur de la fonction cérébrale) dans l'OFC, le gyrus cingulaire antérieur (ACC) et le cortex préfrontal dorsolatéral ) (Volkow et al. 2001, 1993, 2007) (Figue. 6). Dans la mesure où OFC, ACC et DLPFC sont impliqués dans l'attribution de la saillance, le contrôle inhibiteur / la régulation des émotions et la prise de décision, respectivement, il a été postulé que leur régulation inappropriée par la signalisation de l'AD médiée par D2R chez les sujets dépendants pourrait sous-tendre la valeur motivationnelle accrue des drogues dans leur comportement et la perte de contrôle de leur consommation (Volkow et Fowler 2000). De plus, les déficiences de l'OFC et de l'ACC étant associées à des comportements compulsifs et à l'impulsivité (Fineberg et al. 2009), La modulation de DA de ces régions avec facultés affaiblies est susceptible de contribuer à la prise de drogues compulsive et impulsive observée lors de toxicomanie (Goldstein et Volkow 2002). En effet, chez les consommateurs de méthamphétamine, un taux de D2R à faible striatisme était associé à une impulsivité (Lee et al. 2009), et il a également prédit une administration compulsive de cocaïne chez les rongeurs (Everitt et al. 2008). Un scénario inverse, dans lequel une vulnérabilité initiale liée à la consommation de drogues préexistante dans les régions préfrontales et dans laquelle une utilisation répétée de drogues déclenche une nouvelle diminution du taux de D2R striatal, est également possible. En effet, une étude réalisée chez des sujets qui, malgré un risque élevé d'alcoolisme (antécédents familiaux positifs d'alcoolisme familial) n'étaient pas des alcooliques, a révélé une disponibilité de D2R striatale supérieure à la normale, associée au métabolisme normal de l'OFC, de l'ACC et de la DLPFC (Volkow). et al. 2006). Cela suggère que, chez ces sujets à risque d'alcoolisme, la fonction préfrontale normale était liée à une meilleure signalisation striatale D2R, qui à son tour aurait pu les protéger de l'abus d'alcool.
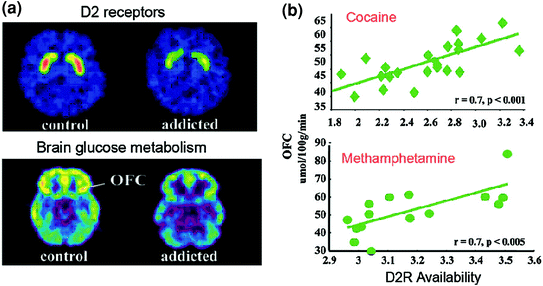
Fig. 6 Corrélations entre la disponibilité et le métabolisme de D2R striatal dans les régions préfrontales du cerveau. Images du cerveau axial pour un contrôle et pour un sujet dépendant de la cocaïne pour des images de base de disponibilité de D2R dans le striatum (obtenu avec [11C] (raclopride) et du métabolisme du glucose cérébral dans l’OFC (obtenu avec [18FDG). b Corrélations entre le D2R striatal et le métabolisme dans les COF chez les sujets dépendants à la cocaïne et à la méthamphétamine. Repris de Volkow et al. (2009) Copyright (2009), avec l'autorisation d'Elsevier
De manière prévisible, des signes de dysrégulation dans les circuits de contrôle ont également été trouvés chez les individus obèses. Des études précliniques et cliniques ont toutes deux mis en évidence une diminution de la signalisation D2R striatale, ce qui, comme mentionné ci-dessus, est lié à la récompense (NAc) mais également à l'établissement d'habitudes et de routines (striatum dorsal) chez les patients obèsesy (Geiger et al. 2009; Wang et al. 2001). Fait important, la diminution de la disponibilité de D2R dans le striatum a été liée à la prise alimentaire compulsive chez les rongeurs obèses (Johnson et Kenny 2010) et avec une activité métabolique diminuée dans OFC et ACC chez les humains obèses (Volkow et al. 2008b) (Figue. 7a – c). Étant donné que le dysfonctionnement de l'OFC et de l'ACC entraîne une compulsivité [voir compte rendu (Fineberg et al. 2009)], cela pourrait faire partie du mécanisme par lequel la signalisation D2R à faible striatage facilite l'hyperphagie (Davis et al. 2009). De plus, étant donné qu'une diminution de la signalisation liée à D2R est également susceptible de réduire la sensibilité à d'autres récompenses naturelles, ce déficit chez les personnes obèses pourrait également contribuer à une suralimentation compensatoire. (Geiger et al. 2008).
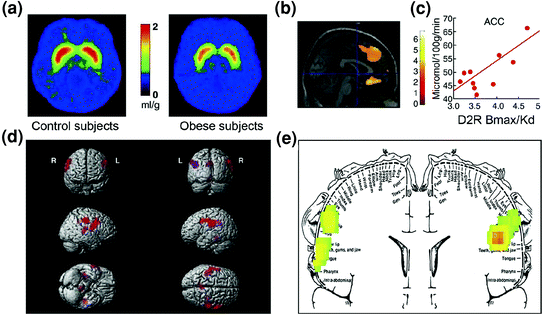
Fig. 7 L’hyperphagie pourrait résulter d’une volonté de compenser un circuit de récompense affaibli (traité par des circuits corticostriataux régulés par la dopamine), associé à une sensibilité accrue à la sapidité (propriétés hédoniques des aliments transformés en partie par le cortex somatosensoriel). a Images moyennes de la disponibilité du récepteur DA D2 (D2R) chez les témoins (n = 10) et chez les sujets souffrant d'obésité morbide (n = 10). b Résultats de la SPM (Statistical Parametric Mapping) identifiant les zones du cerveau où le D2R était associé au métabolisme du glucose, notamment l'OFC médial, l'ACC et le PFC dorsolatéral (région non représentée). c Pente de régression entre le D2R striatal et l'activité métabolique en ACC chez les sujets obèses. d Images SPM rendues en trois dimensions montrant les zones à métabolisme plus élevé chez les sujets obèses que chez les sujets maigres (P <0.003, non corrigée). e Résultats SPM à code couleur affichés dans un plan coronal avec un diagramme superposé de l'homoncule somatosensoriel. Les résultats (valeur z) sont présentés à l'aide de l'échelle arc-en-ciel où rouge> jaune> vert. Par rapport aux sujets maigres, les sujets obèses avaient un métabolisme de base plus élevé dans les zones somatosensorielles où la bouche, les lèvres et la langue sont représentées et qui sont impliquées dans la transformation de l'appétence des aliments. Modifié, avec permission, de Volkow et al. (2008) (a – c) et Wang et al. (2002) (d, e)
Cette hypothèse est cohérente avec les preuves précliniques montrant qu'une diminution de l'activité de la DA dans la VTA entraîne une augmentation spectaculaire de la consommation d'aliments riches en graisses (Stoeckel et al. 2008). De même, par rapport aux individus de poids normal, les sujets obèses à qui on a présenté des images d'aliments riches en calories (stimuli auxquels ils sont conditionnés) ont présenté une activation neuronale accrue dans des régions faisant partie de circuits de récompense et de motivation (ANC, striatum dorsal, OFC). , ACC, amygdale, hippocampe et insula) (Killgore et Yurgelun-Todd 2005). En revanche, chez les témoins de poids normal, l’activation de l’ACC et de l’OFC (régions impliquées dans l’attribution de la saillance qui se projettent dans le NAc) lors de la présentation d’un aliment hypercalorique était corrélée négativement à leur indice de masse corporelle (IMC) ( Stice et al. 2008b). Ceci suggère une interaction dynamique entre la quantité de nourriture consommée (reflétée en partie dans l'IMC) et la réactivité des régions de récompense aux aliments riches en calories (reflétée par l'activation de l'OFC et de l'ACC) chez les individus de poids normal, perdue chez obésité.
De manière surprenante, les individus obèses présentaient moins d'activation des circuits de récompense provenant de la consommation alimentaire réelle (appelée récompense alimentaire consommée) que les individus maigres, alors qu'ils présentaient une plus grande activation des régions corticales somatosensorielles qui traitent la palatabilité lorsqu'elles anticipaient la consommation (Stice et al. 2008b). Cette dernière observation correspondait à des régions où une étude précédente avait révélé une activité accrue chez un sujet obèse testé au départ (non stimulé) (Wang et al. 2002) (Figue. 7d, e). Une activité accrue des régions qui traitent l’appétence au goût pourrait inciter les sujets obèses à préférer la nourriture aux autres renforçateurs naturels, tandis que la diminution de l’activation des cibles dopaminergiques par la consommation réelle de nourriture pourrait conduire à une surconsommation comme moyen de compenser la faible signalisation induite par D2R (Stice et al. 2008). Cette réponse réduite du circuit de récompense à la consommation alimentaire chez les sujets obèses rappelle les augmentations réduites de DA provoquées par la consommation de drogue chez les toxicomanes par rapport aux sujets non dépendants.
Le cortex préfrontal (CPF) joue un rôle crucial dans la fonction exécutive, y compris le contrôle inhibiteur (Miller et Cohen 2001). Ces processus sont modulés par D1R et D2R (vraisemblablement aussi D4R) et, par conséquent, la diminution de l'activité des PFC, à la fois dans la dépendance et dans l'obésité, est susceptible de contribuer à un contrôle médiocre et à une compulsivité élevée. La disponibilité inférieure à la normale de D2R dans le striatum des individus obèses, qui a été associée à une activité réduite des PFC et des ACC (Volkow et al. 2008b) est donc susceptible de contribuer à un contrôle déficient de la prise alimentaire. En effet, la corrélation négative entre l'IMC et le D2R striatal a été rapportée chez les obèses (Wang et al. 2001) et en surpoids (Haltia et al. 2007) personnes soutient cela. Une meilleure compréhension des mécanismes qui conduisent à une altération de la fonction des PFC dans l'obésité (ou la toxicomanie) pourrait faciliter l'élaboration de stratégies pour améliorer, voire inverser, des déficiences spécifiques dans des domaines cognitifs cruciaux. Par exemple, l’escompte de retard, qui correspond à la tendance à dévaluer une récompense en fonction du retard temporel dans sa livraison, est l’une des opérations cognitives les plus étudiées en ce qui concerne les troubles associés à l’impulsivité et à la compulsivité. La réduction des retards a fait l’objet d’une enquête exhaustive sur les toxicomanes qui manifestent une préférence exagérée pour des récompenses modestes mais immédiates par rapport aux récompenses importantes mais différées (Bickel et al. 2007). Cependant, les quelques études réalisées sur des personnes obèses ont également mis en évidence une préférence pour des récompenses immédiates élevées, malgré un risque accru de subir des pertes futures plus importantes (Brogan et al. 2010; Weller et al. 2008). Et plus récemment, une autre étude a mis en évidence une corrélation positive entre l'IMC et l'actualisation hyperbolique, selon laquelle les paiements futurs négatifs sont actualisés moins que les résultats positifs futurs (Ikeda et al. 2010). Fait intéressant, l’escompte de retard semble dépendre de la fonction du striatum ventral (Gregorios-Pippas et al. 2009) et du PFC, y compris l’OFC latéral (Bjork et al. 2009) et sensible aux manipulations de DA (Pine et al. 2010). Plus précisément, l’amélioration de la signalisation DA (avec le traitement à la DOPA L) augmentait l’impulsivité et l’actualisation temporelle.
5 Implication de circuits de motivation
La signalisation dopaminergique module également la motivation. Les caractéristiques comportementales telles que la vigueur, la persistance et le fait de déployer des efforts soutenus pour atteindre un objectif sont toutes sujettes à une modulation par le DA agissant dans plusieurs régions cibles, comprenant NAc, ACC, OFC, DLPFC, amygdala, striatum dorsal et pallidum ventral (Salamone et al. 2007). La signalisation DA dérégulée est associée à une motivation accrue à acheter des médicaments, caractéristique de la dépendance, ce qui explique pourquoi les toxicomanes adoptent souvent des comportements extrêmes pour obtenir des médicaments, même lorsqu'ils entraînent des conséquences graves et néfastes connues (Volkow and Li 2005). Parce que la toxicomanie devient la principale motivation de la toxicomanie (Volkow et al. 2003), les sujets dépendants sont excités et motivés par le processus d'obtention du médicament, mais ont tendance à devenir retirés et apathiques lorsqu'ils sont exposés à des activités non liées au médicament. Ce changement a été étudié en comparant les schémas d’activation cérébrale se produisant lors d’une exposition à des signaux conditionnés avec ceux se produisant en l’absence de tels signaux. Contrairement aux diminutions de l’activité préfrontale signalées chez les toxicomanes désintoxiquant la cocaïne qui ne sont pas stimulés par une drogue ou des signaux de drogue [voir la revue (Volkow et al. 2009)], ces régions préfrontales sont activées lorsque les consommateurs de cocaïne sont exposés à des stimuli provoquant le besoin impérieux (drogues ou signaux) (Grant et al. 1996; Volkow et al. 1999; Wang et al. 1999). Ce résultat rappelle l’observation selon laquelle les consommateurs de cocaïne, étudiés peu de temps après un épisode de consommation de cocaïne, ont montré une augmentation de l’activité métabolique dans OFC et ACC (également le striatum dorsal), associée à un état de manque (Volkow et al. 1991).
En outre, lorsque l'on compare les réponses au MP iv chez les toxicomanes cocaïnomanes et non toxicomanes, les premiers réagissent en augmentant le métabolisme du CAC ventral et de l'OFC médian (un effet associé à l'état de manque), tandis que les seconds manifestent une réponse inverse, à savoir une diminution du métabolisme. métabolisme dans ces régions (Volkow et al. 2005). Ceci suggère que l'activation de ces régions préfrontales avec l'exposition au médicament peut être spécifique à la dépendance et associée au désir accru pour le médicament. En outre, une étude qui a poussé les sujets dépendants à la cocaïne à inhiber délibérément l’état de manque lorsqu’ils étaient exposés à des signaux de drogue a montré que les sujets qui réussissaient à inhiber l’état de manque présentaient une diminution du métabolisme dans les CFO médianes (ce qui traite la valeur récompense) (Volkow et al. 2009b). Ces résultats corroborent davantage l'implication de l'OFC, de l'ACC et du striatum dans la motivation accrue à acheter le médicament observé dans la toxicomanie.
De manière prévisible, l’OFC a également été impliquée dans l’attribution de la valeur de saillance à la nourriture (Grabenhorst et al. 2008; Rolls et McCabe 2007), aidant à évaluer l’agréabilité et la palatabilité attendues en fonction du contexte. Des études PET sur le FDG visant à mesurer le métabolisme du glucose dans le cerveau chez des individus de poids normal ont montré que l'exposition à des signaux alimentaires augmentait l'activité métabolique dans les COF, ce qui était un effet associé à la perception de la faim et au désir de nourriture (Wang et al. 2004). L'activation accrue de l'OFC par la stimulation alimentaire est susceptible de refléter les effets dopaminergiques en aval et de participer à la participation de la DA à la tendance à la consommation alimentaire. L’OFC joue un rôle dans l’apprentissage des associations de stimulation-renforcement et du conditionnement (Cox et al. 2005; Gallagher et al. 1999), prend en charge l’alimentation induite par les signaux conditionnés (Weingarten 1983), et contribue probablement à la suralimentation, indépendamment des signaux de faim (Ogden et Wardle 1990). En effet, le dysfonctionnement de l’OFC a été associé à la suralimentation (Machado et Bachevalier 2007).
Malgré certaines incohérences entre les études, les données d'imagerie cérébrale appuient également la notion selon laquelle des changements structurels et fonctionnels dans les régions cérébrales impliquées dans la fonction exécutive (y compris le contrôle inhibiteur) peuvent être associés à un IMC élevé chez des individus par ailleurs en bonne santé. Par exemple, une étude d'IRM réalisée chez des femmes âgées, utilisant une morphométrie à base de voxel, a révélé une corrélation négative entre l'IMC et les volumes de substance grise (y compris les régions frontales), ce qui, dans l'OFC, était associé à une altération de la fonction exécutive (Walther et al. 2010). En utilisant la TEP pour mesurer le métabolisme du glucose dans le cerveau chez des contrôles sains, nous avons signalé une corrélation négative entre l'IMC et l'activité métabolique dans le DLPFC, l'OFC et l'ACC. Dans cette étude, l'activité métabolique dans les régions préfrontales a prédit la performance des sujets dans les tests de la fonction exécutive (Volkow et al. 2009c). De même, une étude spectroscopique par résonance magnétique nucléaire (RMN) menée chez des témoins sains d'âge moyen et âgés a montré que l'IMC était associé négativement aux niveaux de N-acétyl-aspartate (marqueur de l'intégrité neuronale) dans le cortex frontal et l'ACC (Gazdzinski et al. 2008; Volkow et al. 2009c).
Des études d'imagerie cérébrale comparant des individus obèses et maigres ont également signalé une densité de matière grise inférieure dans les régions frontales (opercule frontal et gyrus frontal moyen) et dans le gyrus et le putamen post-centraux (Pannacciulli et al. 2006). Une autre étude, n'a trouvé aucune différence dans les volumes de matière grise entre les sujets obèses et maigres, cependant, il a en effet enregistré une corrélation positive entre le volume de matière blanche dans les structures cérébrales basales et les ratios tour de taille par rapport à la hanche, tendance qui a été partiellement inversée par un régime (Haltia et al. 2007b). Il est intéressant de noter que des zones corticales, telles que la DPFC et l'OFC, impliquées dans le contrôle inhibiteur, se sont également révélées être activées dans les régimes à la diète efficaces en réponse à la consommation de repas (DelParigi et al. 2007), suggérant une cible potentielle pour la reconversion comportementale dans le traitement de l'obésité (et également dans la toxicomanie).
6 Implication de circuits interoceptifs
Des études de neuroimagerie ont révélé que l'insula moyenne joue un rôle essentiel dans les envies de manger, de cocaïne et de cigarettes (Bonson et al. 2002; Pelchat et al. 2004; Wang et al. 2007). Une étude a mis en évidence l’importance de l’insula: les fumeurs souffrant de lésions dans cette région (mais non les fumeurs témoins ayant subi des lésions extra-insulaires) ont été en mesure de cesser de fumer facilement et sans éprouver de fringales ou de rechutes (Naqvi et al. . 2007). L’insula, en particulier ses régions antérieures, est connecté réciproquement à plusieurs régions limbiques (par exemple, le cortex préfrontal ventromédial, l’amygdale et le striatum ventral) et semble avoir une fonction interoceptive, intégrant l’information autonome et viscérale avec émotion et motivation, fournissant ainsi conscience consciente de ces pulsions (Naqvi et Bechara 2009). En effet, les études sur les lésions cérébrales suggèrent que le PFC ventromédial et l’insula sont des composants nécessaires des circuits distribués qui soutiennent la prise de décision émotionnelle (Clark et al. 2008). Conformément à cette hypothèse, les études d'imagerie montrent systématiquement une activation différentielle de l'insula pendant l'état de manque (Brody et al. 2009; Goudriaan et al. 2010; Naqvi et Bechara 2009; Wang et al. 1999). En conséquence, il a été suggéré que la réactivité de cette région cérébrale pourrait servir de biomarqueur pour aider à prédire la rechute (Janes et al. 2010).
L'insula est également une zone gustative principale, qui participe à de nombreux aspects des comportements alimentaires, tels que le goût. De plus, l’insula rostrale (connectée au cortex gustatif primaire) fournit des informations au BCE qui influencent sa représentation multimodale de la valeur de l’agrément ou de la récompense des aliments entrants (Rolls). 2008). En raison de l'implication de l'insula dans le sens interoceptif du corps, dans la conscience émotionnelle (Craig 2003) et en motivation et émotion (Rolls 2008), on pouvait s’attendre à une altération de l’obésité insulaire. En effet, la distension gastrique entraîne l'activation de l'insula postérieure, ce qui est susceptible de refléter son rôle dans la conscience des états corporels (dans ce cas de plénitude) (Wang et al. 2008). De plus, chez les sujets maigres mais pas chez les obèses, la distension gastrique a entraîné une activation de l'amygdale et une désactivation de l'insula antérieure (Tomasi et al. 2009). L'absence de réponse de l'amygdale chez les sujets obèses pourrait refléter une conscience interoceptive émoussée des états corporels liés à la satiété (estomac plein). Bien que la modulation de l'activité insulaire par DA ait été peu étudiée, il est reconnu que DA intervient dans la réponse au goût des aliments au goût agréable médiés par l'insula (Hajnal et Norgren 2005). Des études d'imagerie humaine ont montré que la dégustation d'aliments au goût agréable activait les régions de l'insula et du mésencéphale (DelParigi et al. 2005; Frank et al. 2008). Cependant, la signalisation DA peut également être nécessaire pour détecter la teneur en calories des aliments. Par exemple, lorsque les femmes de poids normal goûtaient un édulcorant contenant des calories (saccharose), les régions insula et dopaminergique du cerveau moyen s’activaient alors que la dégustation d’un édulcorant sans calorie (sucralose) n’activait que l’insula (Frank et al. 2008). Les sujets obèses présentent une plus grande activation insulaire que les témoins normaux lors de la dégustation d’un repas liquide composé de sucre et de graisse (DelParigi et al. 2005). En revanche, lors de la dégustation de saccharose, les sujets qui ont guéri de l'anorexie mentale présentent moins d'activation dans l'insula et aucune association de sensation de plaisir avec l'activation insulaire observée chez les témoins normaux (Wagner et al. 2008). Lorsqu'ils sont combinés, ces résultats permettent de penser qu'une dysrégulation de l'insula en réponse à des stimuli gustatifs pourrait être impliquée dans le contrôle altéré de divers comportements d'appétit.
7 Le circuit de l'aversion
Comme mentionné précédemment, l'entraînement (conditionnement) sur un signal qui prédit la récompense conduit à des cellules dopaminergiques à se déclencher en réponse à la prédiction de la récompense, et non à la récompense elle-même. D’autre part, et conformément à cette logique, il a été observé que les cellules dopaminergiques se déclenchent moins que la normale si la récompense attendue ne se matérialise pas (Schultz et al. 1997). Preuves cumulatives (Christoph et al. 1986; Lisoprawski et al. 1980; Matsumoto et Hikosaka 2007; Nishikawa et al. 1986) indique que l’habenula est l’une des régions contrôlant la diminution du tir de cellules dopaminergiques dans la VTA qui peut être provoquée par l’absence de récompense attendue (Kimura et al. 2007). Ainsi, une sensibilité accrue de l'habenula, résultant d'expositions chroniques à des médicaments, pourrait sous-tendre une réactivité accrue aux signaux de médicaments. En effet, l'activation de l'habenula, chez les sujets dépendants à la cocaïne, a été associée à une rechute comportementale liée à la prise de drogue lors d'une exposition à un signal (Brown et al. 2011; Zhang et al. 2005). Dans le cas de la nicotine, les récepteurs nicotiniques α5 dans la habénule semblent moduler les réponses aversives à de fortes doses de nicotine (Fowler et al. 2011) et les récepteurs α5 et α2 de l’habenula sont impliqués dans le sevrage de la nicotine (Salas et al. 2009). En raison de la réponse opposée de l'habenula à celle des neurones DA pour la récompense (désactivation) et de son activation lors de l'exposition à des stimuli aversifs, nous nous référons ici à la signalisation de l'habenula comme étant une transmission d'une entrée «anti-arrière».
L'habenula semble jouer un rôle similaire en ce qui concerne la récompense alimentaire. Un régime alimentaire très appétant peut induire l’obésité chez le rat, l’augmentation de poids étant en corrélation avec l’augmentation de la liaison du peptide opioïde μ dans l’amygdale basolatérale et basomédiale. Il est intéressant de noter que la Habenula médiale montrait une liaison peptidique μ opioïde significativement plus élevée (d’environ 40%) après une exposition à la nourriture au goût agréable chez les rats grossissant (ceux consommant plus de nourriture) mais pas chez ceux qui n’en avaient pas (Smith et al. 2002). Ceci suggère que l'habenula peut être impliquée dans la suralimentation dans des conditions de disponibilité d'aliments au goût agréable. De plus, les neurones du noyau tégmental rostromédial, qui reçoivent une contribution majeure de l’habenula latéral, se projettent vers les neurones VTA DA et sont activés après la privation de nourriture (Jhou et al. 2009). Ces résultats concordent avec le rôle joué par l'habenula dans la médiation des réponses aux stimuli aversifs ou à des états tels que ceux qui se produisent lors d'un régime ou du sevrage de drogue.
L’implication de l’habenula en tant que plaque tournante dans les réseaux émotionnels est conforme aux modèles théoriques antérieurs de toxicomanie qui supposaient des réactions anti-récompense sensibilisées (médiées par une sensibilité accrue de l’amygdale et une signalisation accrue par le facteur de libération de la corticotropine) en tant que facteur déterminant de la prise de drogue dans la toxicomanie. (Koob et Le Moal 2008). Des réponses antérieurs similaires peuvent également contribuer à une consommation excessive de nourriture lors d'obésité.
8 Médicament pathologique et récompense alimentaire: un modèle de travail actualisé
TLa capacité de résister à la tentation de consommer une drogue ou de manger au-delà du point de satiété nécessite le bon fonctionnement des circuits neuronaux impliqués dans le contrôle descendant afin de s’opposer aux réponses conditionnées qui prédisent les bénéfices de l’ingestion de la nourriture / du médicament et le désir d'ingérer le produit. nourriture / drogue. Ici, nous avons mis en évidence six de ces circuits: récompense / saillance, conditionnement / habitudes, contrôle inhibiteur / fonction exécutive, motivation / entraînement, interception, évitement de l’aversion / réactivité au stress (Fig. 8). Sur la base des données d’imagerie présentées ici, nous postulons qu’il s’agit de la différence entre les effets attendus des effets médicament / aliment (réponses conditionnelles) et les effets neurophysiologiques atténués qui entretiennent la prise de médicaments ou la surconsommation d’aliments dans le but d’atteindre récompense attendue. En outre, qu’ils soient testés au début ou pendant des périodes prolongées d’abstinence / de régime, les sujets dépendants / obèses présentent une D2R plus faible dans le striatum (y compris le NAc), ce qui est associé à une diminution de l’activité de base dans les régions frontales du cerveau impliquées dans l’attribution de la saillance (cortex orbitofrontal) et inhibitrice. contrôle (ACC et DLPFC), dont la perturbation entraîne compulsivité et impulsivité. FEn fin de compte, des éléments de preuve sont également apparus sur le rôle des circuits interoceptifs et aversifs dans les déséquilibres systémiques entraînant la consommation compulsive de drogues ou d’aliments.
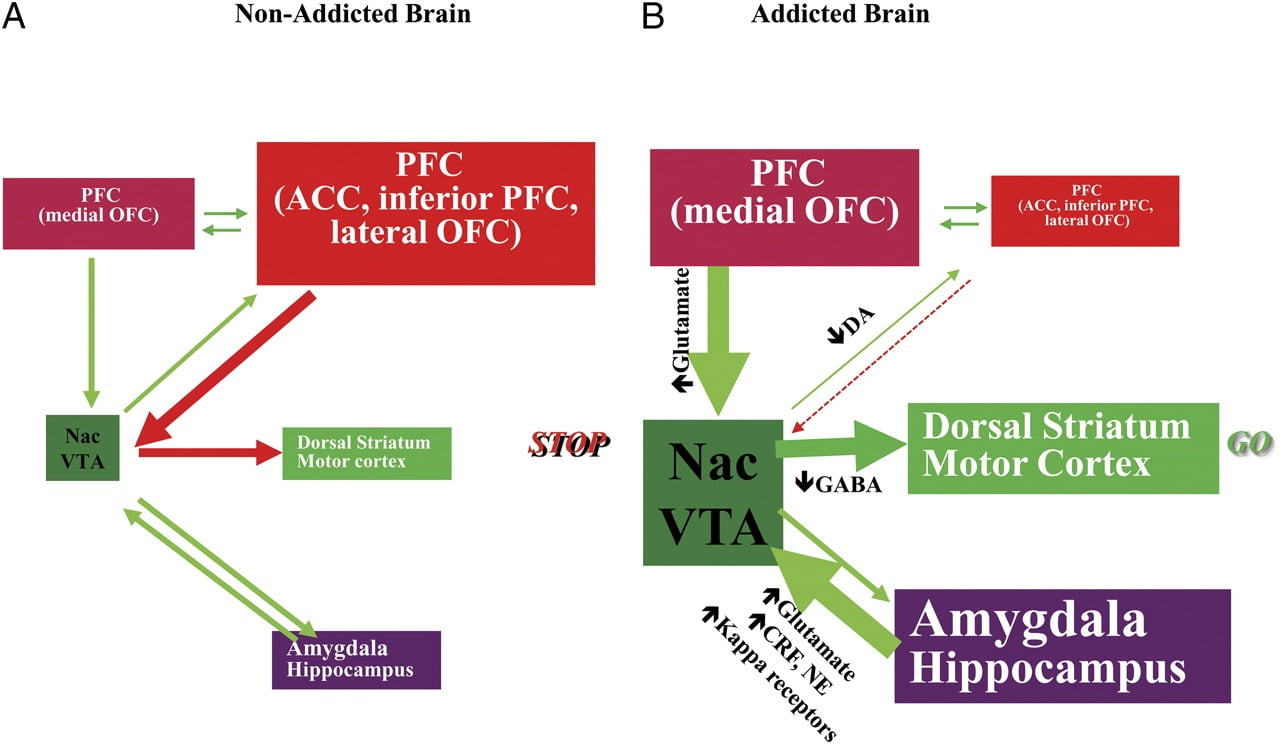
Fig. 8 Modèle proposant un réseau de circuits en interaction, des perturbations qui contribuent à l'ensemble complexe de comportements stéréotypiques sous-jacents à la toxicomanie et à la suralimentation chronique: récompense (noyau accumbens, VTA et pallidum ventral), conditionnement / mémoire (amygdale, OFC médial pour attribution de saillance, hippocampe et striatum dorsal pour habitudes), contrôle exécutif (DLPFC, ACC, cortex frontal inférieur et OFC latéral), motivation / motivation (OFC médian pour l'attribution de la saillance, de l'ACC ventral, de la VTA, du SN, du striatum dorsal et du cortex moteur). Nac, noyau accumbens, interoception (Insula et ACC) et aversion / évitement (Habenula). a Lorsque ces circuits sont équilibrés, il en résulte un contrôle inhibiteur et une prise de décision appropriés. b Au cours de la dépendance, lorsque la valeur escomptée accrue du médicament dans les circuits de récompense, de motivation et de mémoire dépasse le circuit de contrôle, favorisant ainsi une boucle de rétroaction positive initiée par la consommation du médicament et perpétuée par une activation accrue de la motivation / du lecteur. et des circuits de mémoire. Ces circuits interagissent également avec les circuits impliqués dans la régulation de l'humeur, y compris la réactivité au stress (impliquant l'amygdale, l'hypothalamus, l'habenula) et l'interoception (impliquant l'insula et l'ACC et contribuant à la prise de conscience de l'état de manque). Plusieurs neurotransmetteurs sont impliqués dans ces neuroadaptations, notamment le glutamate, le GABA, la noradrénaline, le facteur de libération de la corticotropine et les récepteurs opioïdes. CRF, facteur de libération de corticotropine; NE, noradrénaline. Modifié avec l'autorisation de Volkow et al. (2011b)
En raison de la perturbation séquentielle de ces circuits, les utilisateurs peuvent ressentir 1), ce qui accroît la valeur motivationnelle du médicament / aliment (secondaire aux associations apprises par le biais du conditionnement et des habitudes) au détriment des autres renforçateurs (secondaire à la sensibilité réduite du circuit de récompense). ), 2) une capacité altérée à inhiber les actions intentionnelles (dirigées vers un objectif) déclenchées par le fort désir de prendre le médicament / aliment (secondaire à une fonction exécutive altérée) ayant pour résultat une consommation compulsive de médicament / aliment et 3) une réactivité de stress accrue et évitement aversif qui aboutit à la prise de drogue impulsive pour échapper à l'état aversif.
Ce modèle suggère une approche thérapeutique à plusieurs volets de la toxicomanie conçue pour diminuer les propriétés renforçantes du médicament / aliment, rétablir / améliorer les propriétés enrichissantes des renforçateurs naturels, inhiber les associations apprises conditionnées, renforcer la motivation pour des activités non liées au médicament / à l'alimentation, diminuer la réactivité au stress , améliore l’humeur et renforce le contrôle inhibiteur général.
Remerciements
Les auteurs souhaitent remercier le soutien du programme intra-muros NIAAA des National Institutes of Health.
Bibliographie