Rapports scientifiques le volume 9, Numéro de l'article: 16918 (2019)
Abstract
Une consommation excessive de saccharose provoque une envie de dépendance qui peut sous-tendre l'épidémie d'obésité. Les opioïdes et la dopamine assurent la médiation des effets gratifiants des drogues d'abus et des récompenses naturelles des stimuli tels que les aliments agréables au goût. Nous avons étudié les effets du saccharose en utilisant l'imagerie TEP avec [11C] carfentanil (agoniste des récepteurs opioïdes μ) et [11C] raclopride (antagoniste des récepteurs de la dopamine D2 / 3) chez sept femelles de porcs anesthésiés de Göttingen. Nous avons ensuite donné aux miniporcs accès à une solution de saccharose pendant une heure pendant 12 jours consécutifs et avons effectué une nouvelle imagerie 24 heures après l'accès final au saccharose. Dans un échantillon plus petit de cinq miniporcs, nous avons effectué une [11C] Séance de PET carfentanil après la première exposition au saccharose. Nous avons calculé les potentiels de liaison au voxel (BPND) en utilisant le cervelet comme région de liaison non déplaçable, analysé les différences avec une cartographie statistique non paramétrique et effectué une analyse régionale. Après 12 jours d'accès au saccharose, BPND des deux traceurs avaient diminué de manière significative dans le striatum, le noyau accumbens, le thalamus, l'amygdale, le cortex cingulaire et le cortex préfrontal, conformément à la régulation négative de la densité des récepteurs. Après une seule exposition au saccharose, nous avons constaté une diminution de la liaison de [11C] carfentanil dans le noyau accumbens et le cortex cingulaire, compatible avec la libération d'opioïdes. La moindre disponibilité des récepteurs opioïdes et dopaminergiques peut expliquer le potentiel addictif associé à la consommation de saccharose.
Introduction
Cinq pour cent de la population mondiale sont cliniquement obèses1. En tant que caractéristique du syndrome métabolique, l'obésité est associée au diabète de type 2, aux maladies cardiovasculaires, aux problèmes respiratoires et au risque de dépression et éventuellement de démence2. La consommation accrue d'aliments riches en énergie a exagéré la distinction physiologique entre la faim homéostatique qui suit la privation de nourriture et la faim hédonique, ou «envie», qui se produit en l'absence de privation3,4. Comme la régulation homéostatique ne peut à elle seule expliquer l'augmentation actuelle de l'obésité, il est obligatoire de tester l'effet sur les mécanismes cérébraux de récompense et de plaisir des propriétés addictives des aliments très appétents.
La consommation de saccharose est associée à l'obésité, et le saccharose est de plus en plus considéré comme une substance provoquant une dépendance5. Certaines conclusions sont en contradiction avec cette allégation en raison des difficultés à séparer la consommation d'aliments non agréables au goût des réponses alimentaires hédoniques, et à déterminer l'ingrédient addictif dans les aliments transformés, ainsi que les différents mécanismes par lesquels les aliments modifient les circuits cérébraux par des voies naturelles6. Néanmoins, dans des contextes spécifiques, la consommation de saccharose induit une récompense et une envie, comparables en ampleur à celles induites par les drogues addictives, qui conduisent à une surconsommation et à une éventuelle obésité6,7.
La faim est associée au «désir» qui est étroitement lié aux effets de la neurotransmission dopaminergique dans un certain nombre de circonstances de récompense8, mais on ne sait pas comment l'action de la dopamine (DA) est modulée en réponse à l'alimentation compulsive. La consommation d'aliments appétents est liée au «goût», médié principalement par le système opioïde endogène, en particulier le récepteur μ-opioïde (μOR)9,10, qui peut favoriser la surconsommation en cas de déréglementation. Dans le présent rapport, nous testons l'allégation selon laquelle le saccharose entraîne une libération d'opioïdes et de dopamine qui diminue la disponibilité des récepteurs μOR et DA D2 / 3. La disponibilité est un indice du nombre de récepteurs inoccupés disponibles pour la liaison du traceur et ne fait en principe aucune distinction entre l'occupation du ligand et la densité des récepteurs11.
L'apparition de l'alimentation compulsive dépend de plusieurs facteurs, et les études causales chez l'homme soulèvent des problèmes éthiques. La majorité des études se concentrent donc sur le comportement alimentaire des rats12. Bien que les rats aient une «dent sucrée», leurs mécanismes homéostatiques importants pour la prise de poids, le métabolisme et le type d'accumulation de graisse diffèrent considérablement de ceux des humains. Le miniporc de Göttingen est un grand animal omnivore avec un cerveau gyrencéphalique bien développé, qui peut être imagé à une résolution suffisante. Ses régions corticales sous-corticales et préfrontales bien définies13 permettre une traduction plus directe de la fonction cérébrale humaine. Ici, nous utilisons l'imagerie par tomographie par émission de positons (TEP) pour tester in vivo μOR et DA D2 / 3 disponibles dans un modèle miniporc d'exposition subchronique au saccharose. Dans un échantillon plus petit, nous avons étudié les effets immédiats sur l'occupation des μOR après la première exposition au saccharose. Enfin, nous avons testé la relation entre les changements dans la disponibilité des récepteurs des deux traceurs.
Résultats
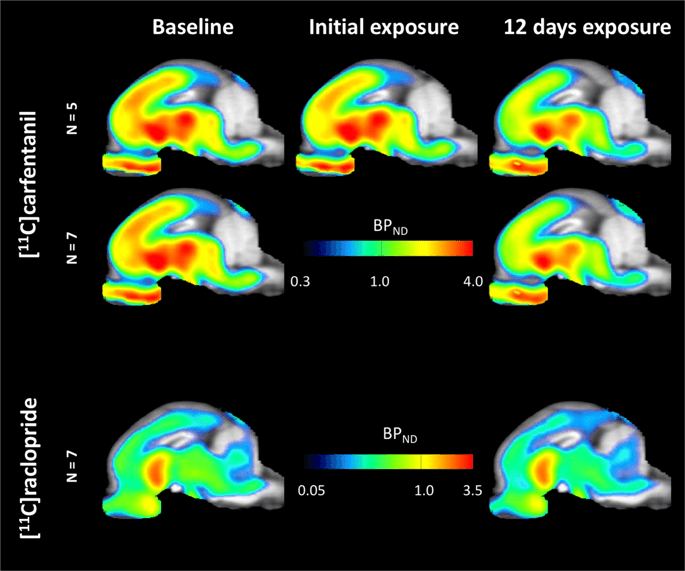
Cartes paramétriques moyennes de [11C] carfentanil et [11C] potentiel de liaison au raclopride (BPND) sont illustrés à la Fig. 1. Analyser les changements survenus après la première exposition au saccharose dans cinq miniporcs par rapport à la ligne de base et un jour après le 12th accès au saccharose dans sept miniporcs par rapport à la ligne de base, nous avons utilisé la théorie de la permutation et l'analyse du cerveau entier non limitée régionalement, la méthode préférée pour les échantillons de cette taille14.
Potentiel de liaison moyen non déplaçable au niveau du voxel (BPND) cartes superposées aux images IRM en vue sagittale. Les données sont présentées pour [11C] carfentanil BPND des 5 miniporcs imagés au départ, après une exposition initiale au saccharose et après 12 jours d'exposition au saccharose (rangée du haut). [11C] carfentanil BPND des 7 miniporcs imagés au départ et après 12 jours d'accès au saccharose sont présentés dans la rangée du milieu. [11C] raclopride BPND des 7 miniporcs imagés au départ et après 12 jours d'accès au saccharose sont indiqués dans la rangée du bas. Notez que l'échelle de couleurs est exponentielle pour mettre en surbrillance le [11C] raclopride BPND dans les régions extrastriatales.
Exposition initiale au saccharose
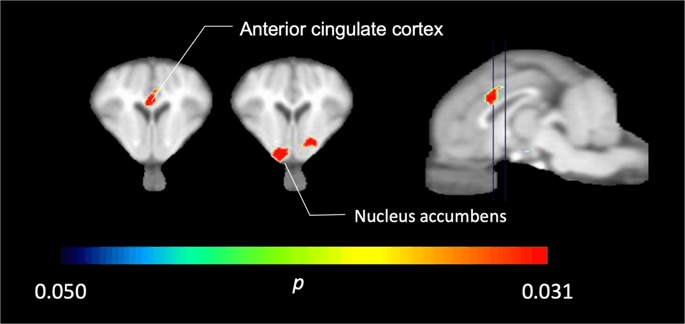
Dans les cinq miniporcs imagés avec [11C] carfentanil au départ et immédiatement après la première exposition au saccharose, nous avons constaté une réduction significative de la liaison du traceur dans le cortex cingulaire antérieur et le noyau accumbens en réponse au saccharose, illustré en couleur sur la Fig. 2, indiquant p <0.05. Nous avons détecté jusqu'à 14% de diminution de la liaison du traceur dans les deux zones par rapport à la ligne de base.
Baisse significative de [11C] carfentanil BPND après la première exposition à l'eau de saccharose par rapport à la ligne de base (n = 5). Seuls les voxels avec une importante (p <0.05) les diminutions sont indiquées par des zones colorées projetées sur des coupes IRM pondérées en T1 au niveau du cortex cingulaire antérieur (à gauche) et du noyau accumbens (au milieu) à partir d'un atlas cérébral stéréotaxique minipig. Notez que le niveau de signification maximal pouvant être atteint avec 5 animaux est de 2-5 ≈ 0.031 (voir la barre de couleur). Les données sont présentées sur les coupes coronales du cerveau de porc aux niveaux indiqués sur l'image sagittale (à droite).
12 jours d'accès au saccharose
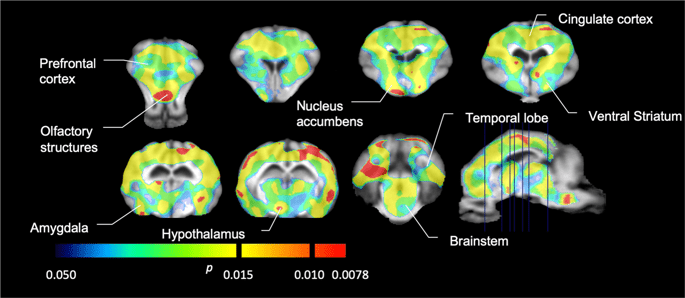
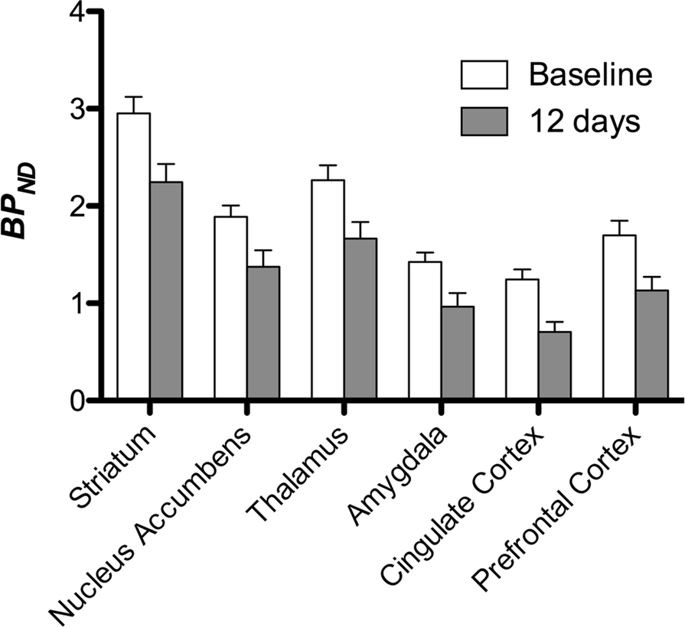
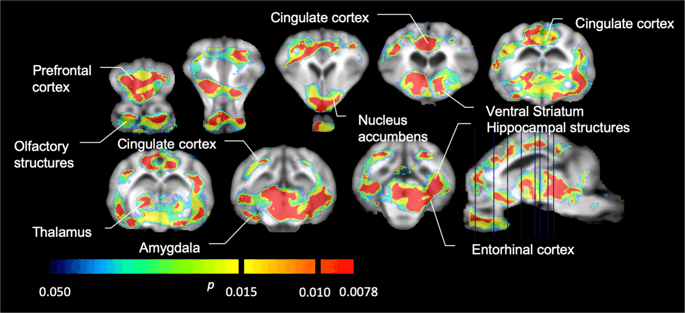
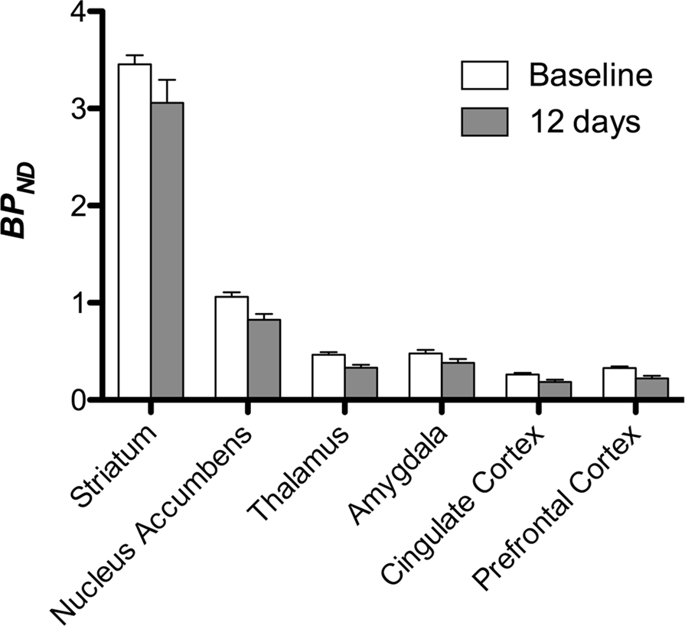
Nous avons ensuite effectué l'analyse de sept miniporcs imagés avec [11C] carfentanil au départ et après 12 jours d'accès au saccharose et a trouvé une réduction significative de la liaison du traceur chez les animaux exposés au saccharose par rapport au départ. Les régions les plus fortement affectées sont représentées en rouge sur la Fig. 3 (p <0.01) et comprennent des parties des structures olfactives, le noyau accumbens / striatum ventral et le cortex / lobe temporal, suivis des zones en jaune (p <0.015) qui comprenaient des parties du cortex préfrontal, du cortex cingulaire, de l'amygdale et du tronc cérébral . Afin d'obtenir BPND et évaluer la variation en pourcentage, nous avons effectué une analyse régionale et obtenu des valeurs moyennes dans chaque région au départ et après la consommation de saccharose (Fig. 4).
Baisse significative de [11C] Potentiel de liaison du carfentanil (BPND) entre l'inclusion et après 12 jours d'exposition à l'eau de saccharose (n = 7). Les voxels avec d'importantes (p <0.05) les diminutions sont représentées par des zones colorées projetées sur des coupes IRM pondérées en T1 à partir d'un atlas cérébral stéréotaxique minipig. Les données sont présentées sur des coupes coronales cérébrales aux niveaux indiqués sur l'image sagittale (en bas à droite). Notez que le niveau de signification maximal pouvant être atteint avec 7 animaux est de 2-7 ≈ 0.0078 (voir la barre de couleur).
Nous avons utilisé [11C] raclopride en tant que traceur des récepteurs DA D2 / 3 dans les régions cérébrales striatales et extrastriatales chez les miniporcs au départ et après 12 jours d'accès au saccharose (Fig. 1). Nous avons trouvé une diminution de la liaison du traceur chez les animaux exposés au saccharose, par rapport à la ligne de base avec des effets les plus importants (p <0.01) dans les zones du cortex préfrontal, du noyau accumbens / striatum ventral, du cortex cingulaire, de l'amygdale, du thalamus, du mésencéphale, des régions hippocampiques et des zones olfactives. (Figure. 5). Les données de l'analyse régionale sont présentées sur la Fig. 6.
Baisse significative de [11C] potentiel de liaison au raclopride (BPND) entre l'inclusion et après 12 jours d'exposition à l'eau de saccharose (n = 7). Les voxels avec d'importantes (p <0.05) les diminutions sont représentées par des zones colorées projetées sur des coupes IRM pondérées en T1 à partir d'un atlas cérébral stéréotaxique minipig. Les données sont présentées sur des coupes coronales du cerveau de porc aux niveaux indiqués sur l'image sagittale (en bas à droite). Notez que le niveau de signification maximal pouvant être atteint avec 7 animaux est de 2-7 ≈ 0.0078 (voir la barre de couleur).
Corrélations entre [11C] le raclopride et [11C] données sur le carfentanil
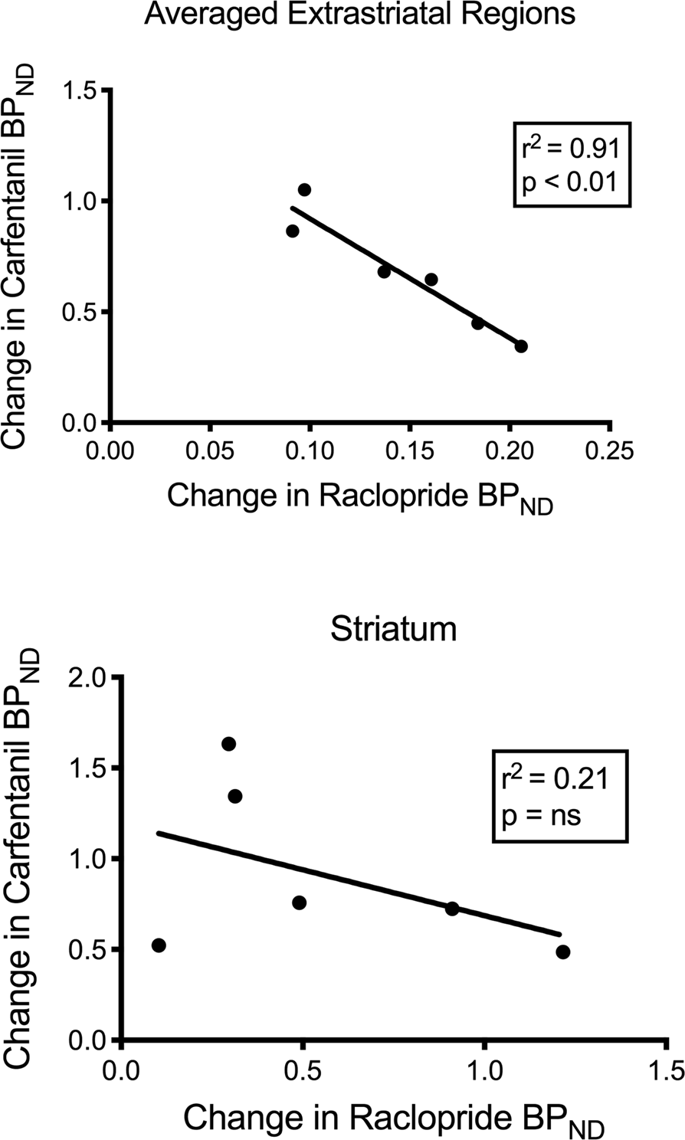
Nous avons testé la corrélation potentielle entre [11C] le raclopride et [11C] valeurs de carfentanil de BPND dans les régions striatales et non striatales chez les mini-porcs au départ et après 12 jours de consommation de saccharose, sans association observée. Nous avons ensuite testé si les déclins de la liaison du traceur étaient corrélés, et nous avons comparé les changements de BPND pour [11C] raclopride avec les changements de BPND pour [11C] carfentanil uniquement chez les miniporcs qui avaient une TA plus faibleND des deux traceurs après la consommation de saccharose (n = 6). Nous avons trouvé des corrélations négatives importantes dans la moyenne extrastriatale (r2 = 0.91, p <0.01), mais pas dans les régions striatales (Fig. 7).
Corrélations entre les diminutions pré- et post-décroissantes de [11C] le raclopride et [11C] potentiels de liaison du carfentanil (BPND) chez les cochons nains avec une diminution de la liaison du traceur après la consommation de saccharose (n = 6). Les données des régions extrastriatales moyennes (en haut) et du striatum (en bas) sont présentées. Le coefficient de détermination (r2) et les valeurs de p sont affichées pour chaque graphique.
a lieu
Nous avons déterminé les effets de l'accès intermittent répété au saccharose sur la neurotransmission opioïde et DA dans le cerveau des mammifères. Longitudinal in vivo L'imagerie TEP des récepteurs μOR et DA D2 / 3 a révélé une disponibilité réduite des récepteurs dans tout le circuit de récompense, y compris le noyau accumbens, le cortex préfrontal et le cortex cingulaire antérieur. Les résultats démontrent clairement que le saccharose affecte les mécanismes de récompense d'une manière similaire à celle des drogues d'abus.
L'apport de saccharose en tant que substance appétente est connu pour libérer de l'AD et induire une dépendance chez les rongeurs15, le saccharose étant encore plus agréable que la cocaïne chez les rongeurs dans certains contextes. Ainsi, les rongeurs travaillent plus intensément pour obtenir du saccharose que de la cocaïne, même en l'absence de privation alimentaire5. Cependant, les effets du saccharose sont régulés à la fois par le système homéostatique et par les circuits de récompense hédoniques16,17 qui peuvent arbitrer la distinction entre les aspects nutritionnels et hédoniques de l'action du saccharose18. Nous avons opté pour un horaire d'une heure par jour afin de favoriser le «binging», car des études antérieures chez le rat avaient révélé un apport plus élevé au cours de la première heure d'accès quotidien dans un horaire intermittent15,19. Les études comportementales de l'apport alimentaire ciblent souvent les animaux à alimentation restreinte, mais la conception ne reflète pas nécessairement les mêmes mécanismes neuronaux actifs dans l'obésité. Les porcs de la présente étude n'étaient pas soumis à des restrictions alimentaires et ont été nourris avec les quantités habituelles de leur alimentation normale en plus de l'accès au saccharose.
Les récepteurs opioïdes (OR) sont largement exprimés dans le cerveau, en particulier dans les structures connues pour moduler les processus alimentaires et de récompense20. Il a été démontré que les RUP jouent un rôle important dans les effets gratifiants et récidivants de la cocaïne21,22,23,24. Les altérations de la liaison ont également été liées aux réponses homéostatiques à l'alimentation et au plaisir associé à une nourriture agréable au goût25. En particulier, le «goût» des aliments est lié au système opioïde endogène, en particulier le μOR9,10 dans la coquille du noyau accumbens et du pallidum ventral26. Les infusions d'un agoniste μOR dans des parties distinctes du noyau accumbens et du pallidum ventral améliorent fortement les comportements de «sympathie», y compris les saillies de la langue et le léchage des pattes, après une augmentation de la consommation de nourriture agréable au goût27,28,29. Des preuves supplémentaires de la signalisation opioïde dans le traitement de la régulation hédonique proviennent d'antagonistes μOR qui atténuent la consommation de nourriture agréable au goût dans les deux cas. ad libitum-animaux nourris et soumis à des restrictions alimentaires, mais avec un effet plus limité sur la consommation de pellets standard non appétents30,31. Chez l'homme, les antagonistes μOR diminuent l'apport alimentaire à court terme et réduisent l'agréabilité des aliments appétents32,33,34. La signalisation des opioïdes dans l'amygdale basolatérale contribue également au «manque» d'aliments par la modulation de la recherche de récompenses et la valeur incitative des aliments35.
Avec [11C] carfentanil, nous avons obtenu des images de la liaison du traceur qui est sensible à la fois aux niveaux μOR et à la libération par le cerveau d'opioïdes endogènes36,37. Nous avons détecté une perte immédiate de disponibilité de μOR dans les zones du noyau accumbens et du cortex cingulaire antérieur, régions cérébrales spécifiques de la voie de récompense, après la consommation initiale de saccharose par cinq miniporcs, compatible avec la libération endogène d'opioïdes. Des études antérieures ont montré que la nourriture agréable au goût peut entraîner des sensations de plaisir38 en stimulant la libération d'opioïdes. Après 12 jours d'accès au saccharose, nous avons observé une diminution [11Fixation C] carfentanil, qui a plusieurs explications possibles39 y compris la libération et la liaison d'opioïdes endogènes à μOR, l'internalisation de μOR en raison de l'augmentation de la liaison aux opioïdes et de l'activation accrue des récepteurs DA D2 / 3 conduisant à une désensibilisation hétérologue de μOR40.
À l'appui des présentes conclusions, [11C] études sur le carfentanil chez des patients boulimiques41, obésité42,43,44et troubles de l'hyperphagie boulimique45, montrent une diminution de la disponibilité des récepteurs. Cependant, ce sont des conditions chroniques alors que les miniporcs n'ont reçu du saccharose que pendant 12 jours. Dans une étude du comportement alimentaire aigu chez des hommes en bonne santé, l'alimentation a conduit à une libération d'opioïdes cérébraux endogènes robuste et généralisée, en présence et en l'absence d'hédonie, ce qui suggère que la libération d'opioïdes reflète des réponses métaboliques et homéostatiques, ainsi qu'hédoniques.25. Cette étude, avec une autre qui a imaginé des patients après un repas liquide au chocolat44, est directement pertinente pour l'étude aiguë de cinq miniporcs après la première exposition au saccharose, mais diffère de l'étude d'exposition chronique au saccharose sur 12 jours où la disponibilité réduite des récepteurs reflète plus probablement une surstimulation répétée et une régulation négative concomitante de μOR.
Le cortex préfrontal est important dans la prise de décision et l'attribution de valeur aux articles et, par conséquent, le μOR dans le cortex préfrontal peut être responsable de la modification de l'évaluation de la saillance des aliments, ce qui peut augmenter le potentiel de dépendance des aliments. Nous avons constaté une diminution de la liaison dans le cortex préfrontal, conformément aux études précédentes montrant qu'un régime riche en graisses réduit les niveaux d'ARNm μOR dans le cortex préfrontal46 et que la perfusion d'un agoniste μOR dans le cortex préfrontal augmente la consommation d'aliments sucrés47. Encore une fois, cependant, la question se pose de savoir si le régime riche en graisses est une maladie plus chronique qui intervient plus probablement dans la régulation à la baisse des récepteurs, par rapport à la conception d'alimentation à court terme en saccharose, suggérant une libération prolongée d'opioïdes endogènes qui déplace le traceur carfentanil lié à μOR , même après 12 jours de saccharose.
DA a été impliqué dans les récompenses à la fois des drogues et du comportement. La consommation chronique de cocaïne inhibe la signalisation de l'AD48. Les niveaux des récepteurs DA D1 et D2 / 3 sont modifiés par la nicotine dans le cerveau de porc49et chez les primates non humains ayant des antécédents d'abus de cocaïne50, compatible avec la régulation négative des récepteurs D2 / 3 dans le cerveau des toxicomanes humains51,52. Quant aux drogues d'abus, il a été démontré que le saccharose régule positivement les récepteurs DA D119 et augmenter la version DA53, renforçant le rôle du DA dans le «vouloir» par rapport à la nourriture agréable au goût. Des études antérieures sur la TEP ont démontré une diminution de la disponibilité des récepteurs striataux DA D2 / 3 dans l'obésité morbide par rapport au poids moyen54,55, d'une ampleur similaire à la réduction du nombre de patients toxicomanes56, et chez l'animal avec des modèles d'obésité57. Dans les études sur les rongeurs, le renversement des récepteurs D2 / 3 dans le striatum favorise le développement de la recherche compulsive de nourriture chez les rats ayant accès à une nourriture agréable au goût57.
Nos observations d'une diminution de la disponibilité des récepteurs D2 / 3 du porc peuvent indiquer une augmentation des niveaux de DA en réponse à la saillance incitative associée à la consommation de saccharose depuis que la DA est libérée dans le cadre du manque de drogues d'abus et d'autres activités agréables52,58,59,60. Comme les porcs étaient anesthésiés pendant l'imagerie et n'avaient pas reçu de saccharose depuis 24 heures, la diminution de la PA D2 / 3ND reflète plus probablement une réduction du nombre de récepteurs en réponse à l'augmentation prolongée de la libération de DA à chacun des 12 jours d'accès au saccharose. La réduction peut augmenter les seuils de récompense cérébrale, associés à une régulation négative des récepteurs striataux DA D2. Cela peut expliquer la sensibilité accrue aux drogues d'abus observée dans les études précédentes de rats mangeant trop de saccharose qui a conduit à une sensibilisation croisée à la cocaïne, à l'hyperactivité après une faible dose d'amphétamine, à une consommation accrue d'alcool en s'abstenant de saccharose et à une tolérance aux effets analgésiques des opiacés6.
Une étude précédente de l'obésité chez le miniporc de Göttingen a identifié une diminution du flux sanguin cérébral dans le noyau accumbens, la zone tegmentale ventrale (VTA) et le cortex préfrontal, avec une tomographie par émission de photons unique (SPECT) du cerveau61. Conformément à ces résultats, nous avons observé une réduction de la liaison à DA D2 / 3 dans la région ventroforebrain contenant le noyau accumbens et dans le cortex préfrontal. Les niveaux extracellulaires de DA sont multipliés par 3 dans le noyau accumbens après la prise de saccharose chez des rats en mouvement libre subissant une microdialyse62. Chez les animaux dépendants du saccharose, l'apport répété de saccharose peut conduire à la libération de DA à partir de la coquille du noyau accumbens63. Les animaux nourris avec un régime restreint avec un accès limité au saccharose avaient une liaison plus faible aux récepteurs DA D2 dans la coque du noyau accumbens et le striatum dorsal64. Les régimes restreints riches en graisses et en saccharose peuvent conduire à une régulation négative prolongée des ARNm des récepteurs D1 et D2 dans le noyau accumbens65. Une étude de microdialyse des effets des aliments appétents a révélé une augmentation de la libération de DA dans le noyau accumbens et le cortex préfrontal lorsque l'aliment était encore considéré comme nouveau; une fois que les rats se sont habitués à la nouvelle nourriture, la libération accrue a été émoussée dans le noyau accumbens, mais pas dans le cortex préfrontal66. La sensibilité différentielle à l'habituation et au conditionnement de l'activité dans deux régions peut expliquer l'augmentation plus importante observée dans le cortex préfrontal que dans le noyau accumbens des miniporcs exposés à la même substance agréable au goût qui a perdu de la nouveauté après douze jours. Cependant, comme nous n'avons pas imaginé de mini-cochons avec [11C] raclopride après la première administration de saccharose, cette explication est spéculative.
Le cortex préfrontal module la fonction exécutive, la prise de décision et la maîtrise de soi67. La neurotransmission DA dysfonctionnelle dans le cortex préfrontal altère la modulation du traitement des récompenses, suggérant une altération de la fonction exécutive et des compétences décisionnelles chez les personnes obèses68,69. De plus, une étude TEP humaine a corrélé une diminution du métabolisme du cortex frontal avec une diminution de la liaison striatale D2 dans l'obésité70. Ici, nous trouvons une disponibilité réduite des récepteurs D2 / 3 dans le cortex préfrontal, y compris le cortex orbitofrontal des porcs exposés au régime de saccharose.
Les neurones dopaminergiques du VTA envoient des projections à l'hippocampe et à l'amygdale, où ils soutiennent des comportements de type habitude71 et médiation de l'encodage et de la récupération du conditionnement à la drogue72,73 et des indices alimentaires74,75. L'imagerie du cerveau humain a montré une activation hippocampique en réponse à l'envie et à la dégustation de nourriture76. Conformément à nos résultats d'une réduction de la disponibilité des récepteurs hippocampiques et amygdaliens D2 / 3 en réponse au saccharose, la cartographie du cerveau humain avec [18Le f] fallypride a montré une libération de DA induite par la cocaïne dans l'amygdale et l'hippocampe77. Dans le cerveau des rongeurs, l'exposition à la cocaïne a déclenché la libération de DA dans l'amygdale78et les altérations des niveaux d'amygdale DA ont influencé le comportement de recherche de cocaïne induit par les signaux79.
Dans une étude d'individus obèses, l'association entre les disponibilités D2 / 3 et μOR, connue pour exister dans les régions striatales des individus maigres, a été perturbée dans le striatum ventral80. Nous avons comparé les valeurs de BPND des deux traceurs pour tester si les données reproduisent cet effet. Contrairement aux humains maigres, le cerveau actuel des porcs n'avait aucune corrélation entre les valeurs de la PAND des deux traceurs, au départ ou après l'exposition au saccharose. Nous avons ensuite testé si les animaux présentant les déclins les plus importants de la liaison du raclopride traceur auraient également les plus fortes diminutions de la liaison du tracer carfentanil, mais au lieu de cela, nous avons trouvé une corrélation négative dans les régions extrastriatales moyennes, suggérant que les animaux présentant le plus grand changement du potentiel de liaison de le raclopride traceur présentait la variation la plus faible du potentiel de liaison du traceur carfentanil. La relation inverse entre les changements suggère que les effets de l'apport en saccharose sur les disponibilités des récepteurs respectifs sont régulés dans des directions opposées. Il est connu que la consommation excessive d'aliments ou de médicaments agréables au goût peut être motivée par le désir ou le goût, ou les deux.60,81. Il est possible que l’ampleur du désir provoqué par la dopamine annule l’ampleur du goût entraîné par les opioïdes, ou vice versa. Des preuves récentes indiquent les rôles du GABAA récepteurs dans le VTA et terminaux cholinergiques dans le striatum et éventuellement le cortex qui agissent comme des commutateurs entre les mécanismes d'action des opioïdes dépendants de la dopamine et indépendants de la dopamine82,83 cela peut expliquer la réciprocité de la dopamine et des effets opioïdes dans les régions extrastriatales porcines déterminées ici.
Un défaut de la TEP, également chez des animaux comparativement grands, est la résolution spatiale limitée de la tomographie qui affecte les résultats de petites régions cérébrales impliquées dans les comportements associés aux aliments. Cependant, malgré ces préoccupations, [11La liaison au raclopride C] a été enregistrée précédemment dans les régions striatales et extrastriatales84,85,86,87. L'utilisation de [11Le raclopride C] pour étiqueter le même type de récepteurs ne soulève aucune préoccupation concernant les différences d'affinité potentielles qui peuvent affecter l'utilisation de traceurs séparés pour les mêmes récepteurs dans différentes régions. Des études récentes ont inclus des dossiers de liaison extrastriatale de [11C] raclopride. Alakurtti et al. trouvé une bonne reproductibilité des mesures de la liaison du raclopride striatale dans le striatum, avec seulement une reproductibilité bonne à modérée dans le cortex85. Dans une étude ultérieure, Svensson et al. discuté de plusieurs questions affectant l'utilisation de [11C] raclopride en tant que marqueur des récepteurs extrastriataux D2 / 3 dans une étude sur des humains en bonne santé, y compris une mauvaise reproductibilité dans le cortex et un déclin limité de la liaison extrastriatale dans le cortex frontal en réponse à un agent bloquant D2 / 388. Les comparaisons test-retest ont révélé des variabilités de 4 à 7% dans le striatum et de 13 à 59% dans les régions corticales, mais le temps entre les examens était en moyenne de 20 jours, contrairement aux 1 à 2 jours les plus informatifs de la plupart des études. Un certain nombre de facteurs dans la vie de ces sujets peuvent avoir eu le temps d'influencer les résultats. En effet, nous montrons ici que le simple fait d'ajouter la consommation de saccharose à une routine matinale pendant 12 jours peut avoir influencé les mesures contraignantes obtenues deux semaines plus tard. D'autres facteurs aussi communs que les jeux vidéo, le shopping, la création de nouvelles relations amoureuses et l'activité sexuelle, la consommation de drogues ou le changement de régime alimentaire et l'exercice peuvent influencer les niveaux de dopamine extrastriataux avec un potentiel de grande variation des ensembles de données. L'étude actuelle sur les miniporcs a introduit une configuration bien contrôlée, la seule variable étant l'absence ou la présence de saccharose dans l'alimentation. Dans ce contexte, les données de sept animaux présentaient une variabilité suffisamment faible dans les régions extrastriatales pertinentes pour identifier une réduction statistiquement significative de la liaison en réponse au saccharose.
L’une des limites de la présente étude est l’utilisation d’anesthésiques nécessaires pour garantir l’immobilité in vivo imagerie des animaux. Les effets d'anesthésiques spécifiques et leurs interactions avec des médicaments ou d'autres interventions peuvent perturber la liaison des radioligands89,90. La kétamine est un médicament anti-glutamatergique avec des effets antidépresseurs rapides à des doses sous-anesthésiques91,92,93, qui ne réduisent pas le striatal [11C] liaison au raclopride chez l'homme94. Cependant, il a été constaté que la S-kétamine réduit la disponibilité de liaison des récepteurs dopaminergiques D2 / 3 dans le striatum de primates non humains conscients.95. L'isoflurane est un anesthésique courant dans la TEP animale. Dans des études précédentes, nous avons trouvé une accumulation striatale de [11C] SCH23390, un radioligand des récepteurs de la dopamine D1 significativement plus élevé chez les miniporcs anesthésiés à l'isoflurane plutôt qu'au propofol, suggérant une sensibilité de la neurotransmission dopaminergique aux effets de l'anesthésie96. Dans la présente étude, tous les porcs miniatures ont été imagés aux deux moments sous pré-médicament à la kétamine et sous anesthésie à l'isoflurane, ce qui rend les présentes comparaisons valides.
Conclusion
Une consommation excessive d'aliments appétents peut à la fois provoquer et devenir le résultat d'une addiction ayant des conséquences directes sur la santé par l'obésité. Nous avons testé l'affirmation selon laquelle les opioïdes et la dopamine médient des récompenses, importantes pour la survie ainsi que pour l'abus de drogues. Les miniporcs avec un accès intermittent à une solution de saccharose pendant 12 jours consécutifs ont démontré une diminution de la disponibilité des récepteurs dopaminergiques D2 / 3 et μ-opioïdes dans les régions cérébrales striatales et extrastriatales, ce qui implique que les aliments riches en saccharose influencent le circuit de récompense cérébrale de manière similaire à ceux observés lors de la toxicomanie sont consommés. L'exposition unique initiale au saccharose était compatible avec la libération d'opioïdes dans les régions cérébrales actives en récompense. Les changements de la disponibilité des opioïdes et de la dopamine expliquent le potentiel addictif du saccharose consommé en excès.
Matériels et méthodes
Ethique animale
Cette étude a été approuvée et réglementée par l'Inspection danoise des expérimentations animales et toutes les expériences ont été menées conformément à la directive 2010/63 / UE du Parlement européen et du Conseil sur la protection des animaux utilisés à des fins scientifiques et aux lignes directrices ARRIVE. Nous avons utilisé sept miniporcs de Göttingen femelles de 6 mois (Ellegaard, Dalmose, Danemark). Les miniporcs ont reçu un régime alimentaire en granulés (2 dL, XNUMX fois par jour, Special Diets Services, Aarhus, Danemark) avec de l'eau du robinet disponible ad libitum. La température ambiante était de 20 à 22 ° C, l'humidité relative de 50 à 55% et l'air était changé huit fois par heure.
Consommation intermittente de saccharose
Nous avons imaginé sept mini-cochons avec [11C] le raclopride et [11C] carfentanil au départ, et à nouveau un jour après 12 jours consécutifs d'exposition à l'eau de saccharose. L'exposition au saccharose consistait en une heure d'accès à l'eau (saccharose, Dansukker, Copenhague, Danemark) (500 grammes de saccharose dans 2 litres d'eau), quotidiennement pendant une période de 12 jours. La quantité de saccharose ingérée a été enregistrée et tous les miniporcs ont consommé 2 litres chaque jour. Nous avons également imaginé cinq des mêmes mini-cochons avec [11C] carfentanil, 30 minutes après le premier accès au saccharose, afin d'étudier la libération aiguë d'opioïdes.
Les miniporcs ont gagné en moyenne 13.6% de poids corporel de 25.4 kg (± 0.73 SEM) au départ à 28.9 kg (± 0.69 SEM) après l'exposition de 12 jours au saccharose, ce qui était significativement plus élevé (test t unilatéral, p < 0.001) que les augmentations observées dans un échantillon de miniporcs témoins obtenus dans les études précédentes, où les poids n'ont augmenté en moyenne que de 4.9%, au cours de la même période de développement.
Imagerie cérébrale TEP
Nous avons jeûné les porcs pendant la nuit avec un accès gratuit à l'eau avant l'imagerie. Nous avons pré-médicamenté et anesthésié les miniporcs comme décrit précédemment97 et les a placés en décubitus dorsal dans un appareil TEP / TDM (Siemens Biograph 64 Truepoint PET). Nous avons effectué une tomodensitométrie à faible dose avant chaque acquisition TEP pour la définition anatomique et la correction d'atténuation des données d'émission de TEP. Nous avons administré par voie intraveineuse [11C] raclopride à l'inclusion (360 ± 18 MBq, activité spécifique 77 ± 76 GBq / μmol, masse injectée 0.12 ± 0.08 μg / kg) et après 12 jours de saccharose (374 ± 54 MBq, activité spécifique 127 ± 85 GBq / μmol, masse injectée 0.06 ± 0.05 μg / kg), et [11C] carfentanil au départ (377 ± 43 MBq, activité spécifique 311 ± 195 GBq / μmol, masse injectée 0.03 ± 0.02 μg / kg) et après 12 jours de saccharose (337 ± 71 MBq, activité spécifique 177 ± 157 GBq / μmol, masse injectée 0.06 ± 0.08 μg / kg) par la veine de l'oreille, dans 10 ml de solution saline, pendant la première minute d'un balayage de 90 minutes. Nous avons reconstruit des données TEP en utilisant TrueX 3D OSEM (3 itérations, 21 sous-ensembles), une matrice 256 × 256 × 109 et un filtre Gauss de 2 mm, en utilisant une structure temporelle de 5 × 60, 3 × 300, 4 × 600 , 2 × 900 secondes (14 images au total, 90 minutes). Au départ et après 12 jours de saccharose, les miniporcs ont été imagés avec les deux traceurs injectés à au moins 100 minutes d'intervalle, en raison de la demi-vie de [11C] Traceurs PET. À la fin de la dernière séance de TEP, nous avons euthanasié des miniporcs sous anesthésie profonde par une surdose intraveineuse de pentobarbital (100 mg / kg).
Analyses et statistiques quantitatives
Nous avons effectué des étapes de prétraitement à l'aide de PMOD 3.7 (PMOD Technologies Ltd, Zurich, Suisse). Pour définir les paramètres de transformation stéréotaxique à partir d'images TEP à moyenne temporelle, nous avons utilisé des modèles spécifiques au ligand. Nous avons appliqué les matrices de transformation et les champs de déformation générés à la série temporelle TEP dynamique correspondante. Nous avons généré des images paramétriques de [11C] potentiel de liaison au raclopride (BPND) au moyen de la méthode des tissus de référence multilinéaires d'Ichise et de ses collaborateurs98. Nous avons créé un masque sur mesure du cervelet qui excluait le vermis pour obtenir la radioactivité des tissus cérébelleux au fil du temps dans une région de densité de récepteur DA D2 / 3 négligeable. Nous avons généré des images paramétriques de [11C] carfentanil utilisant une implémentation du modèle tissulaire de référence Logan99,100 avec t * = 30 min. Études de [11La liaison du C] carfentanil dans le cerveau humain a utilisé le cortex occipital comme région de référence36; cependant, chez le porc, selon les courbes d'activité temporelle, la liaison non déplaçable était plus faible dans le cervelet que dans le cortex occipital, conformément aux résultats d'une étude d'autoradiographie chez le rat.101. Nous avons donc sélectionné le cervelet comme région de référence dans la présente étude.
analyses statistiques
Nous avons soumis les cartes à une analyse au niveau du voxel avec la cartographie statistique non paramétrique (SnPM v13.01, http://warwick.ac.uk/snpm) Boîte à outils SPM qui utilise la théorie de la permutation non paramétrique pour fournir un cadre pour l'inférence statistique, une approche qui fonctionne bien pour les petits échantillons en raison d'un contrôle strict des faux positifs14 et appliqué comme décrit précédemment102. Un expert en neuroanatomie porcine (DO) a comparé les images obtenues avec un seuil de signification de 5% à un atlas de miniporcs de Göttingen haute résolution103,104 pour définir et étiqueter les régions de diminution de DA D2 / 3 et μOR BPND de la ligne de base à l'état post-saccharose. Nous avons ensuite effectué une analyse de la région d'intérêt (ROI) afin d'extraire BPND valeurs de régions spécifiques jugées intéressantes d'après l'analyse SnPM, y compris le striatum, le noyau accumbens, le thalamus, l'amygdale, le cortex cingulaire et le cortex préfrontal. Aucune statistique supplémentaire n'a été réalisée sur l'analyse du retour sur investissement, car ces régions se sont déjà révélées significatives à l'aide de SnPM.
Bibliographie
- 1.
Smyth, S. & Heron, A. Diabète et obésité: les épidémies jumelles. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Prévalence et tendances de l'obésité chez les adultes américains, 1999–2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, Californie et al. Dopamine pour «vouloir» et opioïdes pour «aimer»: une comparaison d'adultes obèses avec et sans frénésie alimentaire. L'obésité (Silver Spring) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obésité et environnement alimentaire: densité énergétique alimentaire et coûts de l'alimentation. Journal américain de médecine préventive 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH La douceur intense surpasse la récompense de la cocaïne. PLoS ONE 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. et Guillem, K. In Les neurosciences au 21e siècle (éd. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Autres développements dans la neurobiologie de l'alimentation et des addictions: mise à jour sur l'état de la science. Nutrition 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. Dans Plaisirs du cerveau (sous la direction de Kringelbach, ML et Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET De l'hédonique du goût à la motivation: récepteurs mu-opioïdes centraux et comportement de frénésie alimentaire. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Récompense alimentaire: substrats cérébraux du vouloir et de l'aimer. Examen neuroscientifique et biocomportemental 20, 1 – 25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Cartographie des neurorécepteurs au travail: sur la définition et l'interprétation des potentiels de liaison après 20 ans de progrès. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Modèles animaux de consommation excessive de sucre et de graisse: relation avec la dépendance alimentaire et augmentation du poids corporel. Méthodes Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. et al. Le cortex préfrontal dans le cerveau du mini-porc de Göttingen défini par les critères de projection neuronale et la cytoarchitecture. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Tests de permutation non paramétriques pour la neuroimagerie fonctionnelle: une amorce avec des exemples. Hum Brain Mapp 15, 1 – 25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Preuve de la dépendance au sucre: effets comportementaux et neurochimiques d'un apport intermittent et excessif en sucre. Examen neuroscientifique et biocomportemental 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al. Système de récompense alimentaire: perspectives actuelles et futurs besoins de recherche. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Auto-administration de sucrose et activation du SNC chez le rat. Am J Physiol Régul Intégral Comp Physiol 300, R876 à 884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. Des circuits séparés codent les valeurs hédoniques et nutritionnelles du sucre. Neuroscience de la nature 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. Un apport excessif en sucre modifie la liaison à la dopamine et aux récepteurs mu-opioïdes dans le cerveau. Neuroreport 12, 3549 – 3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Récepteur d'opiacés: localisation autoradiographique dans le cerveau de rat. Proc Natl Acad Sci États-Unis 73, 3729 – 3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Récompense de la cocaïne et hyperactivité chez le rat: sites de modulation des récepteurs opioïdes mu. Neuroscience 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC La bêta-funaltrexamine affecte l'auto-administration de cocaïne chez les rats répondant selon un calendrier de renforcement progressif. Pharmacologie, biochimie et comportement 75, 301 – 307 (2003).
- 23.
Schroeder, JA et al. Un rôle pour les récepteurs opioïdes mu dans l'activité induite par la cocaïne, la sensibilisation et la récompense chez le rat. Psychopharmacologie 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW La réintégration induite par la cocaïne nécessite une stimulation endogène des récepteurs mu-opioïdes dans le pallidum ventral. The Journal of neuroscience: le journal officiel de la Society for Neuroscience 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. L'alimentation libère des opioïdes endogènes chez l'homme. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Circuit limbique opioïde pour récompense: interaction entre les points chauds hédoniques du noyau accumbens et du pallidum ventral. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Site d'opioïdes dans la coquille du noyau accumbens médiatise l'alimentation et le «goût» hédonique pour la nourriture: carte basée sur des panaches de Fos par micro-injection. Brain Res 863, 71 – 86 (2000).
- 28.
Zhang, M. & Kelley, AE La consommation de solutions de saccharine, de sel et d'éthanol est augmentée par perfusion d'un agoniste opioïde mu dans le noyau accumbens. Psychopharmacologie 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA et Kelley, AE La consommation d'aliments riches en graisses est sélectivement augmentée par la stimulation des récepteurs opioïdes mu dans le noyau accumbens. Le Journal de pharmacologie et thérapeutique expérimentale 285, 908 – 914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ La naloxone bloque cette partie de l'alimentation motivée par le goût sucré chez les rats soumis à une restriction alimentaire. Am J Physiol 268, R248-252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioïdes et prise alimentaire: voies neuronales fonctionnelles distribuées? Neuropeptides 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Un antagoniste des opioïdes, la naltrexone, réduit la préférence pour le saccharose chez l'homme. Am J Physiol 251, R91 à 96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS L'effet de la naltrexone sur la détection du goût et le seuil de reconnaissance. Appétit 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA La naloxone, un bloqueur d'opiacés, réduit la consommation d'aliments sucrés riches en graisses chez les femmes obèses et maigres grignoteuses. Am J Clin Nutr 61, 1206 – 1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Des circuits opioïdes distincts déterminent l'appétence et l'opportunité d'événements enrichissants. Proc Natl Acad Sci États-Unis 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al. Libération endogène d'opioïdes dans le système de récompense du cerveau humain induite par l'administration aiguë d'amphétamines. Biol Psychiatry 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, moi et al. Amphétamine induit une libération d'opioïdes endogènes dans le cerveau humain détectée avec le [11C] carfentanil PET: réplication dans une cohorte indépendante. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Les peptides opioïdes et le contrôle du comportement d'ingestion humaine. Examen neuroscientifique et biocomportemental 26, 713 – 728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR De quoi apprendre in vivo imagerie cérébrale opioidergique? Eur J douleur 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Interactions dopamine-opioïdes dans le striatum de rat: un rôle modulateur pour les récepteurs de la dopamine D1 dans la transduction du signal médiée par les récepteurs delta opioïdes. Neuropharmacologie 39, 372 – 381 (2000).
- 41.
Benchérif, B. et al. La liaison régionale aux récepteurs mu-opioïdes dans le cortex insulaire est diminuée dans la boulimie nerveuse et est en corrélation inversement avec le comportement à jeun. Journal of Nuclear Medicine: publication officielle, Society of Nuclear Medicine 46, 1349 – 1351 (2005).
- 42.
Karlsson, HK et al. L'obésité est associée à une diminution de la disponibilité des récepteurs dopaminergiques mu-opioïdes D2 dans le cerveau. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. La perte de poids après une chirurgie bariatrique normalise les récepteurs opioïdes cérébraux dans l'obésité morbide. Psychiatrie Mol 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Les mécanismes opioïdes endogènes sont impliqués dans l'obésité et la perte de poids chez l'homme. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. Dopamine et neurotransmission opioïde dans les dépendances comportementales: une étude comparative TEP dans le jeu pathologique et la frénésie alimentaire. Neuropsychopharmacology 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Un régime chronique riche en graisses entraîne la régulation épigénétique postnatale du récepteur mu-opioïde dans le cerveau. Neuropsychopharmacologie: publication officielle de l'American College of Neuropsychopharmacology 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Induction de l'hyperphagie et de l'apport en glucides par stimulation des récepteurs mu-opioïdes dans les régions circonscrites du cortex frontal. The Journal of neuroscience: le journal officiel de la Society for Neuroscience 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. La cocaïne chronique atténue la signalisation de la dopamine pendant l'intoxication à la cocaïne et déséquilibre la signalisation des récepteurs D1 sur D2. The Journal of neuroscience: le journal officiel de la Society for Neuroscience 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al. Effets de la nicotine aiguë sur l'hémodynamique et la liaison du raclopride [11C] aux récepteurs de la dopamine D2,3 dans le cerveau de porc. NeuroImage 19, 1127 – 1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Effet de l'auto-administration de cocaïne sur les récepteurs dopaminergiques D2 chez les singes rhésus. Synapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. Indices de cocaïne et dopamine dans le striatum dorsal: mécanisme de la soif dans la dépendance à la cocaïne. The Journal of neuroscience: le journal officiel de la Society for Neuroscience 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. Augmentation de l'occupation des récepteurs de la dopamine dans le striatum humain lors d'un besoin de cocaïne provoqué par des signaux. Neuropsychopharmacology 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. La stimulation orale du sucrose augmente la dopamine accumbens chez le rat. Am J Physiol Régul Intégral Comp Physiol 286, R31 à 37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Imagerie du rôle de la dopamine dans l'abus de drogues et la toxicomanie. Neuropharmacologie 56(Supplément 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Dopamine cérébrale et obésité. Lancette 357, 354 – 357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Similarité entre l'obésité et la toxicomanie telle qu'évaluée par l'imagerie neurofonctionnelle: une revue de concept. Journal des maladies addictives 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Dopamine D2 receptors in addiction-like récompense dysfonctionnement et alimentation compulsive chez les rats obèses. Neuroscience de la nature 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Neuroscience affective du plaisir: récompense chez l'homme et l'animal. Psychopharmacologie 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Systèmes de plaisir dans le cerveau. Neuron 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Signal de récompense prédictif des neurones dopaminergiques. J Neurophysiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Modifications de l'activité cérébrale après une obésité d'origine alimentaire. Obésité 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens mécanismes de dopamine dans l'apport en saccharose. Brain Res 904, 76 – 84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Une frénésie quotidienne de sucre libère à plusieurs reprises de la dopamine dans la coquille des accumbens. Neuroscience 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR et Hajnal, A. L'accès répété au sucrose influence la densité des récepteurs de la dopamine D2 dans le striatum. Neuroreport 13, 1575 – 1578 (2002).
- 65.
Aussi, J. et al. L'expression du gène du récepteur de la dopamine D1 diminue dans le noyau accumbens lors d'une exposition à long terme à des aliments agréables au goût et diffère selon le phénotype d'obésité induite par l'alimentation chez le rat. Neuroscience 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G.Influence différentielle des mécanismes d'apprentissage associatif et non associatif sur la réactivité de la transmission préfrontale et accombale de la dopamine aux stimuli alimentaires chez les rats nourris ad libitum. J Neurosci 17, 851 – 861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Circuits neuronaux déséquilibrés dans la dépendance. Acteur Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexie, boulimie et obésité: déficits de prise de décision partagée sur l'Iowa Gambling Task (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Déficits décisionnels et suralimentation: un modèle de risque pour l'obésité. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Les récepteurs striataux D2 à faible dopamine sont associés au métabolisme préfrontal chez les sujets obèses: facteurs contributifs possibles. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Le noyau central de l'amygdale interagit avec le striatum dorsolatéral pour réguler l'acquisition des habitudes. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, s. et al. Activation des circuits de mémoire lors d'une envie de cocaïne déclenchée par des signaux. Proc Natl Acad Sci États-Unis 93, 12040 – 12045 (1996).
- 73.
Childress, AR et al. Activation limbique lors d'une envie de cocaïne induite par des signaux. Am J Psychiatry 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC Quoi et quand «vouloir»? Focalisation basée sur l'amygdale de la saillance incitative sur le sucre et le sexe. Psychopharmacologie 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiologie de la dépendance: une analyse des neurocircuits. Lancet Psychiatrie 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Activation corticale en réponse à des stimuli gustatifs purs pendant les états physiologiques de faim et de satiété. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotros, A. et al. Libération de dopamine induite par la cocaïne dans l'amygdale et l'hippocampe: une étude à haute résolution du fallypride TEP [(1) (8) F] chez des participants dépendants de la cocaïne. Neuropsychopharmacology 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. Contrôle du comportement de recherche de cocaïne par des stimuli associés au médicament chez le rat: effets sur la récupération des niveaux de dopamine extracellulaires et extracellulaires éteints dans l'amygdale et le noyau accumbens. Proc Natl Acad Sci États-Unis 97, 4321 – 4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE L'antagonisme des récepteurs de la dopamine D1 ou D2 au sein de l'amygdale basolatérale modifie de manière différentielle l'acquisition des associations cocaïne-queues nécessaires à la réintégration induite par la demande de cocaïne. Neuroscience 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Interaction dopamine-opiacés mésolimbique aberrante dans l'obésité. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Signaux comportementaux de dopamine. Tendances Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR et van der Kooy, D. La neurobiologie de la motivation aux opiacés. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Régulation des récepteurs nicotiniques et opioïdes de la transmission médiée par les récepteurs striataux de la dopamine D2. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. Diminution liée à l'âge de la disponibilité des récepteurs de la dopamine D2 / 3 mesurée avec le raclopride [C-11] dans les régions cérébrales humaines non striatales: comparaison de quatre méthodes. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al. Fiabilité à long terme test-retest de la liaison aux récepteurs striataux et extrastriataux de la dopamine D2 / 3: étude avec le raclopride [(11) C] et le PET à haute résolution. Métab de débit sanguin J Cereb 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Libération de dopamine endogène après des défis pharmacologiques dans la maladie de Parkinson. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al. Déficits cognitifs et libération de dopamine striato-frontale dans la maladie de Parkinson. Cerveau 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Validité et fiabilité de la quantification de la liaison extrastriatale [(11) C] raclopride dans le cerveau humain vivant. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al. L'anesthésie à l'isoflurane améliore les effets inhibiteurs de la cocaïne et du GBR12909 sur le transporteur de dopamine: études TEP en combinaison avec la microdialyse dans le cerveau du singe. Brain Res 849, 85 – 96 (1999).
- 90.
Hassoun, W. et al. Étude TEP de la liaison du raclopride [11C] dans le striatum du chat éveillé: effets des anesthésiques et rôle du flux sanguin cérébral. Revue européenne de médecine nucléaire et d'imagerie moléculaire 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Le rôle de la kétamine dans la dépression résistante au traitement: une revue systématique. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. Effets antidépresseurs de la kétamine chez les patients déprimés. Biol Psychiatry 47, 351 – 354 (2000).
- 93.
Browne, CA & Lucki, I. Effets antidépresseurs de la kétamine: mécanismes sous-jacents aux nouveaux antidépresseurs à action rapide. Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Alto, S. et al. La kétamine ne diminue pas la liaison striatale au récepteur de la dopamine D2 chez l'homme. Psychopharmacologie 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H.Reduction of dopamine D2 / 3 receptor binding in the striatum after a single administration of esketamine, but not R-ketamine: a PET étude chez les singes conscients. Clinique de psychiatrie Eur Arch Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al. Effets de l'anesthésie et des espèces sur l'absorption ou la liaison des radioligands in vivo dans le miniporc de Göttingen. BioMed recherche internationale 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. Imagerie TEP monoaminergique longitudinale de l'inhibition chronique du protéasome chez les miniporcs. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Stratégies pour améliorer l'estimation des paramètres des neurorécepteurs par analyse de régression linéaire. Métab de débit sanguin J Cereb 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logane, J. et al. Rapports de volume de distribution sans prélèvement de sang à partir de l'analyse graphique des données TEP. Métab de débit sanguin J Cereb 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Quantification des récepteurs cérébraux mu-opioïdes avec [11C] carfentanil: méthodes de référence-tissu. Nucl Med Biol 30, 177 – 186 (2003).
- 101.
Panksepp, J. & Bishop, P. Une carte autoradiographique de la liaison de (3H) diprénorphine dans le cerveau de rat: effets de l'interaction sociale. Brain Res Bull 7, 405 – 410 (1981).
- 102.
Landau, AM et al. La stimulation électroconvulsive affecte différentiellement la liaison de [(11) C] MDL100,907 aux récepteurs corticaux et sous-corticaux 5HT2A dans le cerveau porcin. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Le télencéphale du minipig de Göttingen, cytoarchitecture et anatomie de la surface corticale. Fonction cérébrale 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Atlas histologique en ligne du cerveau minipig de Göttingen. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Remerciements
Une «subvention de développement de projets AU Ideas» de l'Université d'Aarhus à AML a financé l'étude. Nous sommes reconnaissants pour le soutien technique du personnel du centre de TEP de l'hôpital universitaire d'Aarhus et de la ferme universitaire d'Aarhus pour l'aide au traitement des animaux. Nous remercions le professeur Morten Kringelbach, le professeur Jørgen Scheel-Kruger et le professeur agrégé Arne Møller pour leur aide dans le démarrage de ces études.
Déclarations éthiques
Intérêts concurrents
Les auteurs ne déclarent aucun intérêt concurrent.
Plus d'Infos
Note de l'éditeur Springer Nature reste neutre en ce qui concerne les revendications juridictionnelles dans les cartes publiées et les affiliations institutionnelles.
Droits et permissions
Open Access Cet article est sous licence Creative Commons Attribution 4.0 International License, qui permet l'utilisation, le partage, l'adaptation, la distribution et la reproduction dans n'importe quel support ou format, tant que vous accordez le crédit approprié aux auteurs originaux et à la source, fournissez un lien vers la licence Creative Commons et indiquer si des modifications ont été apportées. Les images ou tout autre matériel tiers dans cet article sont inclus dans la licence Creative Commons de l'article, sauf indication contraire dans une ligne de crédit pour le matériel. Si le matériel n'est pas inclus dans la licence Creative Commons de l'article et que votre utilisation prévue n'est pas autorisée par la réglementation ou dépasse l'utilisation autorisée, vous devrez obtenir la permission directement du détenteur des droits d'auteur. Pour afficher une copie de cette licence, visitez http://creativecommons.org/licenses/by/4.0/.