COMENTÁRIOS DO YBOP: O efeito Coolidge está por trás do poder do pornô na Internet. O efeito Coolidge é um fenômeno observado em espécies de mamíferos, em que os machos (e em menor grau as fêmeas) exibem um interesse sexual renovado se introduzidos em novos parceiros sexuais receptivos, mesmo depois de recusar o sexo de parceiros sexuais anteriores, mas ainda disponíveis. A novidade sexual substitui essa habituação pela excitação renovada causada pelo aumento da dopamina. Um fluxo contínuo de novidades é o que torna a pornografia na Internet tão diferente da pornografia do passado.
- Dennis F. Fiorino,
- Ariane Coury, e
- Anthony G. Phillips
- The Journal of Neuroscience, 15 de junho de 1997, 17 (12): 4849-4855;
Sumário
O efeito Coolidge descreve a reinicialização do comportamento sexual em um animal "sexualmente saciado" em resposta a um novo companheiro receptivo. Dado o papel do sistema dopaminérgico mesolímbico (DA) na iniciação e manutenção do comportamento motivado, a microdiálise foi usada para monitorar a transmissão do N do núcleo accumbens (NAC) durante a cópula, a saciedade sexual e a reinicialização do comportamento sexual. De acordo com relatos anteriores, a apresentação de uma fêmea de estro por trás de uma tela e cópula foi associada a aumentos significativos no efluxo de NAC DA. O retorno das concentrações de NAC DA aos valores basais coincidiu com um período de saciedade sexual, embora as concentrações dos metabolitos DA, ácido di-hidroxifenilacético e ácido homovanílico permanecessem elevadas. A apresentação de uma nova fêmea receptiva por trás de uma tela resultou em um ligeiro aumento na NAC DA, que foi aumentada significativamente durante a renovação da cópula com a nova fêmea. Os presentes dados sugerem que as propriedades de estímulo de uma nova fêmea receptiva podem servir para aumentar a transmissão de NAC DA em um rato macho sexualmente saciado, e isso, por sua vez, pode estar relacionado à reinicialização do comportamento sexual.
Introdução
Um rato macho que tenha copulado para saciedade pode ser induzido a acasalar novamente se a fêmea inicial for substituída por uma nova fêmea receptiva. Isto veio a ser conhecido como o efeito Coolidge e foi observado em várias espécies de mamíferos (Wilson et al., 1963). Fatores gerais como fadiga ou depressão motora não são suficientes para explicar o estado aparente da saciedade sexual, porque os estímulos de uma fêmea nova ainda podem induzir a cópula. A saciedade sexual também pode ser “revertida” farmacologicamente, em um grau significativo, pela administração de uma variedade de drogas que podem atuar em diferentes sistemas de neurotransmissores. Estas drogas incluem ioimbina, 8-OH-DPAT (Rodriguez-Manzo e Fernandez-Guasti, 1994, 1995a), nalaxona (Pfaus e Gorzalka, 1987; Rodriguez-Manzo e Fernandez-Guasti, 1995a,b) e apomorfina (Mas et al., 1995c). Embora a ação periférica dessas drogas não possa ser descartada (por exemplo, efeitos adrenérgicos sobre a função erétil), os efeitos sobre os mecanismos centrais subjacentes à saciedade sexual têm sido propostos com base em experimentos seletivos de lesão noradrenérgica central (Rodriguez-Manzo e Fernandez-Guasti, 1995a) e experimentos de microdiálise que monitoraram o metabolismo dopaminérgico na região pré-óptica medial (Mas et al., 1995a,b).
Dado que os mecanismos centrais podem mediar a reinicialização do comportamento sexual característico do efeito Coolidge, um provável candidato é o sistema de dopamina mesolímbica (DA), projetando-se da área tegmental ventral para o NAC. O DA mesolímbico parece atuar como um modulador primário em processos integrativos complexos que envolvem a avaliação de estímulos ambientais, como dicas de uma mulher sexualmente receptiva, e a organização de comportamentos direcionados por objetivos, incluindo a cópula (Fibiger e Phillips, 1986; Blackburn et al., 1992; Phillips e outros, 1992; LeMoal, 1995; Salamone, 1996).
Embora os neurônios DA do mesencéfalo respondam às recompensas primárias e às pistas que predizem a recompensa, estímulos ambientais novos ou imprevisíveis induzem a ativação neuronal de forma mais robusta em repetidas sessões de treinamento (Fabre et al., 1983; Schultz, 1992; Mirenowicz e Schultz, 1994). Há uma grande quantidade de evidências que apóiam um importante papel facilitatório para DA mesolímbico na iniciação e manutenção do comportamento sexual de ratos (Pfaus e Everitt, 1995), e vários estudos de microdiálise relatam aumentos no efluxo de NAC DA durante fases apetitivas e consumatórias do comportamento sexual masculino (Pfaus et al., 1990; Pleim et al., 1990; Damsma et al., 1992; Wenkstern e outros, 1993; Fumero e outros, 1994; Mas et al., 1995b). Há, no entanto, relativamente poucos dados sobre os correlatos neuroquímicos da saciedade sexual e a reinicialização do comportamento sexual. A aplicação de in vivo A microdiálise para monitorar a neurotransmissão mesolímbica DA durante o efeito Coolidge oferece uma oportunidade única para examinar o papel do NAC DA na cópula, na saciedade sexual e no reinício da cópula.
Um experimento de microdiálise foi conduzido para determinar o seguinte: (1) se o início da saciedade sexual é acompanhado pelo retorno de concentrações de DA extracelular no NAC aos valores pré-clopédicos ou abaixo, e (2) se a reintegração do comportamento copulatório em um Rato macho sexualmente saciado com uma nova fêmea receptiva está correlacionado com aumentos no efluxo de NAC DA.
MATERIAIS E MÉTODOS
Assuntos. Ratos Sprague Dawley machos, obtidos a partir do Centro de Cuidados Animais (na Universidade de British Columbia), e ratos Long-Evans fêmeas, obtidos de Charles River Canada (St. Constant, Quebeque, Canadá), foram alojados em gaiolas de rede de arame (18 × 25 × 65 cm; cinco por gaiola) em salas de colônia separadas. As salas de colônia foram mantidas a uma temperatura de ∼20 ° C em um ciclo 12 hr de luz / escuridão reverso. Os ratos tinham acesso ilimitado à comida (Purina Rat Chow) e água.
Cirurgia e testes comportamentais antes da microdiálise cerebral.As ratas foram ovariectomizadas bilateralmente sob anestesia com gás halotano (Fluothane, Ayerst Laboratories) pelo menos 4 semanas antes do teste. A receptividade sexual nas fêmeas do estímulo foi induzida por injecções subcutâneas de benzoato de estradiol (10 μg) e progesterona (500 μg), 48 e 4 h, respectivamente, antes de cada sessão de teste. Ratos machos foram examinados quanto ao comportamento sexual em duas ocasiões, separados por 4, em câmaras de Plexiglas (35 × 35 × 40 cm) com piso de tela metálica. Apenas ratos machos que atingiram um critério de desempenho, que incluiu intromissão dentro de 5 min da apresentação da fêmea e ejaculação dentro de 15 min da primeira intromissão, durante os dois testes de rastreio foram implantados com cânulas guia de sonda de microdiálise.
Ratos machos (n = 5) foram anestesiados com cloridrato de cetamina (100 mg / kg, ip) e xilazina (10 mg / kg, ip) antes da cirurgia estereotáxica. As cânulas guia da sonda de microdiálise (calibre 19) foram implantadas bilateralmente sobre o NAC (coordenadas de bregma: anterior, + 1.7 mm; medial, ± 1.1 mm; ventral, −1.0 mm; crânio achatado) e fixadas ao crânio com acrílico dentário e parafusos do joalheiro. Os implantes de cânulas guias bilaterais foram utilizados para maximizar a oportunidade de um experimento de microdiálise bem-sucedido. Felizmente, no presente experimento, apenas uma cânula foi necessária para cada rato. Ratos machos foram alojados individualmente em grandes gaiolas plásticas com cama de polvo de milho durante o restante do experimento. Uma semana após a cirurgia, os ratos foram testados quanto ao comportamento sexual. Durante esta parte do treinamento, a câmara de testes foi equipada com uma tela de Plexiglas deslizante que dividia a câmara em compartimentos grandes e pequenos. Ratos machos foram introduzidos no compartimento grande e 15 min depois, uma fêmea foi colocada atrás da tela. Após um período preparatório 15 min, a tela foi removida, e os ratos foram autorizados a copular para 30 min. Três sessões de treinamento foram realizadas, uma a cada 4 d. Todos os ratos atingiram o critério de desempenho durante todas as sessões.
Experiência de efeito Coolidge. Os ratos foram implantados unilateralmente com sondas de microdiise 12-18 h antes da expericia do efeito Coolidge e colocados no grande compartimento da cara de teste com acesso livre a alimento e ua. Na manhã do experimento, amostras de microdiálise foram coletadas a cada 15 min. O experimento consistiu nas seguintes sete fases consecutivas: (1) linha de base (pelo menos 60 min); (2) 1 fêmea por trás da tela (15 min); (3) copulação com 1 fêmea até um período mínimo de 30 passado sem uma montagem; (4) reintrodução de 1 feminino por trás da tela (15 min); (5) acesso a 1 fêmea por um período 15 min, desde que não houvesse montagem (se a montagem ocorreu, esta fase foi tratada como fase 3); (6) introdução de 2 feminino por trás da tela (15 min); 7) copulação com 2 fêmea para 60 min.
O comportamento foi filmado sob baixa iluminação usando um sistema de vídeo JVC e observado em um monitor de vídeo localizado fora da sala de testes. As medidas padrão de comportamento sexual foram registradas usando um computador e software apropriado (Holmes et al., 1987).
Após a experiência com a microdiálise, os animais receberam uma overdose de hidrato de cloral e perfundidos intracardialmente com solução salina e formalina (4%). Os cérebros foram cortados e congelados e, subsequentemente, secções coronais foram coradas com violeta de cresilo para determinar a colocação de sondas de microdiálise. Apenas ratos com colocações de sonda dentro do NAC foram utilizados para análises comportamentais e neuroquímicas.
Microdiálise e detecção eletroquímica por HPLC. Sondas de microdiálise foram concêntricas no projeto com uma membrana de fibra oca semipermeável (2 mm membrana exposta, 340 μm diâmetro externo, 65000 corte de peso molecular, 12 Filtral, Hospal) na extremidade distal. As sondas foram perfundidas a 1.0 μl / min com uma solução de Ringer modificada (tampão fosfato de sódio 0.01 m, pH 7.4, 1.3 mmCaCl2, 3.0 mm KCl, 1.0 mmMgCl2, 147 mm NaCl) utilizando uma seringa estanque aos gases (Hamilton, Reno, NV) e uma bomba de seringa (modelo 22, Harvard Apparatus, South Natick, MA). Um colar guia da sonda de microdiálise foi usado para fixar a sonda de microdiálise dentro da cânula guia. Uma bobina de aço, presa a uma articulação líquida (Instech 375s) montada na parte superior da câmara de teste, foi usada para proteger a tubulação da sonda (Fiorino et al., 1993).
Os analitos de microdialisado, que incluíram DA e seus metabolitos ácido di-hidroxifenilacético (DOPAC) e ácido homovanílico (HVA), foram separados por cromatografia de fase reversa (coluna Ultrasphere; Beckman, Fullerton, CA, ODS 5, 15 cm, 4.6 mm, diâmetro interno ) usando um tampão de acetato de sódio 0.083m, pH 3.5 (5% metanol). As concentrações de analito foram quantificadas por detecção eletroquímica (EC). O aparelho consistia de uma bomba Bio-Rad (Richmond, CA), um injetor de duas posições EC10W da Valco Instruments (Houston, TX), um detector EC Coulochem II ESA (Bedford, MA) e um registrador gráfico dual channel (Kipp e Zonen, Bohemia, NY). Os parâmetros do detector eletroquímico foram os seguintes: eletrodo 1, + 450 mV; eletrodo 2, −300 mV; e célula de guarda, −450 mV. Recuperações de sondas típicas, conduzidas in vitro e à temperatura ambiente, foram 22% para DA, 18% para DOPAC e 18% para HVA.
PREÇO/ RESULTADOS
Comportamento
Medidas comportamentais do experimento do efeito Coolidge são apresentadas na Tabela 1. As latências para montar, intrometer e ejacular, bem como o intervalo pós-ejaculatório após a primeira ejaculação, foram semelhantes aos da sessão de treino anterior (dados não mostrados). Isso sugere que o procedimento de microdiálise não alterou o comportamento sexual normal. O desenvolvimento da saciedade sexual, como indicado pelo número médio de ejaculações antes do critério foi atingido (7.8 ± 0.5), uma diminuição progressiva no número de intromissões que precedem cada ejaculação, e um aumento progressivo no intervalo pós-degenerado (dados não mostrados) , foi semelhante ao relatado em estudos anteriores (Praia e Jordânia, 1956; Fowler e Whalen, 1961; Fisher, 1962; Bermant et al., 1966; Rodriguez-Manzo e Fernandez-Guasti, 1994; Mas et al., 1995d). A variabilidade individual foi observada em relação ao número de ejaculações obtidas com 1 feminino, o tempo gasto copulando com 1 feminino, e o número de apresentações de 1 feminino necessário para atingir o critério de saciedade (Tabela 1, inferior). Alguns ratos necessitaram de numerosas reintroduções de 1 fêmeas até a fase 5 estar completa (n = 3). Os atos de colocar o 1 fêmea por trás da tela e a remoção da partição podem ter servido como sinais primitivos de apetite, levando à copulação. Também deve ser notado que um critério de saciedade de 30 min sem uma montagem, embora usado anteriormente (Beach and Jordan, 1965; Mas et al., 1995b), é arbitrário e não garante que um rato não teria montado dado mais tempo. Mesmo assim, atrasos ou procedimentos de remoção e substituição não resultaram de forma confiável na renovação da copulação com 1 fêmea (por exemplo, fases 4 e 5).

Comportamento durante o experimento do efeito Coolidge
Todos os ratos exibiram o efeito Coolidge. A atividade associada à colocação de 2 feminino por trás da tela e, em particular, a remoção da partição pode ter contribuído para esse resultado, mas, novamente, esses eventos não foram por si só suficientes para renovar a cópula no início do experimento. Comparações entre medidas de comportamento sexual com 1 feminino e 2 feminino foram feitas usando t testes com uma correção de Bonferroni. Embora as latências de montagem e intromissão em resposta à 2 feminina não tenham sido significativamente diferentes daquelas na primeira copulatória com 1 feminino, em geral, o comportamento sexual com 2 feminino foi menos robusto, como indicado por significativamente menos ejaculações (média, 0.6 vs 4.2; F = 49.86;p <0.01) e intromissões (média = 11.2 vs 37.0;F = 20.17; p <0.05) durante a primeira hora. O número de montagens na primeira hora com as fêmeas 1 e 2 não diferiu significativamente.
É importante notar que as fêmeas usadas durante a porção de saciação do experimento (isto é, 1 feminino) ainda exibiam forte comportamento protelativo (isto é, pular e arremessar) e receptivo (isto é, lordose) durante toda a duração do contato com o macho. .
Neuroquímica
As concentrações nanomolares basais de DA e seus metabólitos em microdiálise, apresentadas como média ± EPM, das três primeiras amostras de base foram: DA, 3.0 ± 0.7; DOPAC, 619.1 ± 77.7; e HVA, 234.2 ± 49.0 (não corrigido para recuperação de sondas;n = 5). Esses valores representaram pontuações de linha de base 100%.
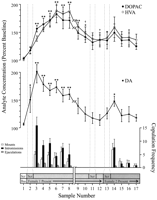
Dados comportamentais definidos, correspondentes a cada fase do experimento e comuns a todos os ratos, foram utilizados para análises neuroquímicas. Estes incluíram o seguinte: (1) sete amostras após a primeira introdução de 1 fêmea, (2) quatro amostras acompanhando a ausência de comportamento copulatório com 1 fêmea e (3) cinco amostras após apresentação de 2 fêmea. Figura 1 ilustra mudanças nas concentrações de DA (gráfico linear, meio) e metabolitos DA (gráfico linear, topo) paralelismo do comportamento copulatório (gráfico de barras, fundo) durante o ensaio do efeito Coolidge.
Ver versão ampliada:
FIG. 1.
Nucleus accumbens correlatos neuroquímicos do comportamento sexual durante o efeito Coolidge. As primeiras oito amostras representam pontos de dados cronologicamente contínuos das fases 1 a 3. A amostra 1 é a quarta e última amostras de linha de base de precopulação (Meia). Amostra 2 representa introdução de 1 fêmea por trás da tela (Scr). Após 15 min, a tela foi removida e os ratos foram autorizados a copular (amostras 3-8). oquebrar na xO eixo corresponde à exclusão de dados de três ratos que copularam por longos períodos com a fêmea inicial. As últimas nove amostras também foram cronologicamente contínuas. As amostras 9 e 10 correspondem ao período de saciação da fase 3 (ou seja, 30 min sem montagem). A fêmea 1 foi então reinserida atrás da tela (amostra 11) e, 15 min depois, a tela foi removida (amostra 12). Após 15 min sem copulação, 2 fêmea foi colocada atrás da tela (amostra 13). As amostras 14 – 17 correspondem à cópula com 2 fêmea. O número de montagens, intromissões ou ejaculações associadas a cada amostra de microdiálise 15 min é mostrado na gráfico de barras inferior. Os dados neuroquímicos são expressos em termos de porcentagem das concentrações da linha de base. Alterações no NAC DA (praças fechadas), DOPAC (círculos fechados) e HVA (círculos abertos) eflux são apresentados como gráficos de linha. As seguintes comparações foram feitas: amostra de base 1 versus amostras 2 – 10; nova amostra de base 10 versus amostras 11 e 12; nova amostra de base 12 versus amostras 13 – 17 (*p <0.05; ** p <0.01). Independente t Testes foram feitos entre valores de linha de base (amostras 1, 10 e 12). Para diferenças significativas da primeira linha de base (amostra 1), †p <0.05.
Foram realizadas ANOVAs one-way separadas, de medidas repetidas, em dados neuroquímicos associados a 1 feminina (amostras 1 – 12) e 2 feminina (amostras 12 – 17). A priori comparações foram feitas usando o teste de comparação múltipla de Dunn (Bonferroni t). As seguintes três principais comparações foram feitas: (1) linha de base inicial (amostra 1) versus amostras 2 – 10 (primeira exposição a 1 fêmea), (2) segunda linha de base (amostra 10) versus amostras 11 e 12 (reexposição a 1 feminina) e (3) terceira linha de base (amostra 12) versus amostras 13 – 17 (exposição a 2 feminina).
Houve uma mudança global significativa no efluxo DA em resposta a 1 [F (11,44) = 8.48; p <0.001] e 2 mulheres [F (5,20) = 2.83;p <0.05]. Um aumento significativo no efluxo DA foi encontrado quando a fêmea 1 estava presente atrás da tela (+ 44%,p <0.05; amostra 2). Durante a cópula, as concentrações de DA aumentaram ainda mais, atingindo um valor máximo (+ 95%;p <0.01) durante a primeira sessão copulatória (amostra 3). DA permaneceu elevada durante a cópula e só voltou às concentrações de linha de base no período de 30 minutos em que nenhuma montagem ocorreu (amostras 9 e 10). Nem a reintrodução da fêmea 1 atrás da tela (amostra 11) nem a oportunidade de interagir fisicamente, mas sem montagem (amostra 12), concentrações elevadas de DA em relação ao segundo valor de linha de base (amostra 10). A presença da mulher 2 atrás da tela (amostra 13) resultou em um pequeno aumento no efluxo de DA (12%) a partir do terceiro valor da linha de base (amostra 12) que não atingiu significância estatística. A cópula renovada com a fêmea 2 resultou em um aumento significativo (34%) (p <0.05) no efluxo DA durante a primeira amostra de cópula (amostra 14). Embora o comportamento copulador fraco tenha continuado nas três amostras seguintes, as concentrações de DA diminuíram para os valores da linha de base (amostras 15–17). Independente t Testes conduzidos entre amostras de “linha de base” (isto é, 1, 10 e 12) demonstraram que esses valores não eram significativamente diferentes.
Nos três ratos que retomaram a cópula quando a 1 fêmea foi reintroduzida, as concentrações NAC DA aumentaram quando 1 fêmea esteve presente atrás da tela (variação, 25-47%) e durante a cópula (variação, 13-37%), em relação à amostra apenas antes da reintrodução da fêmea. Estes aumentos, no entanto, só ocorreram quando o comportamento sexual era vigoroso e levou à ejaculação.
Mudanças globais significativas no DOPAC [F (11,44) = 9.57; p <0.001] e HVA [F (11,44) = 12.47; p Concentrações <0. 001] foram encontradas em resposta à fêmea 1, mas não à fêmea 2. As concentrações de metabólitos aumentaram ligeiramente (+ 15% em ambos os casos) durante a apresentação da fêmea 1 atrás da tela (amostra 2), mas isso não foi significativo estatisticamente. Houve, no entanto, aumentos significativos nas concentrações de DOPAC e HVA durante a cópula (amostras 3–8), atingindo valores máximos (+80 e + 86%, respectivamente; p <0.01) após 60 min (amostra 6 em ambos os casos). Embora as concentrações de metabólitos tenham diminuído durante o período de inatividade sexual no final do contato com a fêmea 1 (amostras 9 e 10), as concentrações ainda permaneceram elevadas em relação à linha de base (p <0.05 em ambos os casos). A reintrodução da fêmea 1 atrás da tela (amostra 11), o acesso à fêmea 1 após a remoção da tela (amostra 12) e a introdução da fêmea 2 (amostra 13) não resultaram em quaisquer alterações nas concentrações de metabólitos. Ligeiros, mas estatisticamente insignificantes, aumentos nas concentrações de DOPAC e HVA (+ 23% em ambos os casos) em relação à linha de base (amostra 12) corresponderam ao primeiro ataque de cópula com a fêmea 2 (amostra 14). Esse aumento teve vida curta, no entanto, diminuiu para os valores basais para as três amostras restantes (15–17). Independente tos testes realizados entre as amostras “baseline” (ie, 1, 10 e 12) indicaram que o segundo e terceiro valores basais (amostras 10 e 12, respectivamente), embora não diferentes entre si, permaneceram elevados significativamente em comparação com a primeira amostra para DOPAC e HVA (p <0.05 em ambos os casos).
Histologia
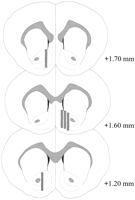
Sondas de microdiálise foram localizadas no NAC (Fig.2) em um intervalo que se estende de + 1.20 a + 1.70 mm de bregma (crânio plano). Houve variabilidade também no plano médio-lateral; os dados refletem a amostragem das sub-regiões shell e core do NAC.
Ver versão ampliada:
FIG. 2.
Localização de sondas de microdiálise dentro do NAC de ratos machos utilizados no experimento do efeito Coolidge. Retângulos sombreados correspondem à área da membrana exposta das sondas de microdiálise. Secções cerebrais coronais em série foram redesenhadasPaxinos e Watson (1986).
DISCUSSÃO
De acordo com relatos anteriores, os presentes resultados demonstram uma transmissão de DA mesolímbica aumentada associada a componentes apetitivos e consumatórios do comportamento sexual de ratos machos, avaliado porin vivo microdiálise (Mas et al., 1990; Pfaus et al., 1990;Pleim et al., 1990; Damsma et al., 1992; Wenkstern e outros, 1993; Fumero e outros, 1994; Mas et al., 1995a,b,d). Além disso, esses resultados fornecem um correlato neuroquímico para a saciedade sexual e a subsequente reinicialização da cópula em resposta a uma nova fêmea receptiva (o efeito Coolidge). Os presentes dados sugerem que as propriedades de estímulo de uma nova fêmea receptiva podem servir para aumentar a transmissão de NAC DA em um rato macho sexualmente saciado que, por sua vez, pode estar relacionado à reinicialização do comportamento sexual. Isto é em primeiro lugar evidente no ligeiro aumento da NAC DA durante a apresentação de uma nova fêmea por trás do ecrã e ocorre de forma mais convincente como um aumento mais pronunciado durante a renovação da cópula com 2 fêmea (Fig.1).
A presença da primeira fêmea receptiva por trás da tela resultou em um aumento apetitivo robusto no efluxo de NAC DA (44% da linha de base) semelhante em magnitude ao que foi relatado em experimentos anteriores usando um design similar (30%, Pfaus et al., 1990; 35%,Damsma et al., 1992) Também de acordo com esses estudos estava a observação de que o efluxo de NAC DA foi aumentado ainda mais durante a cópula (para> 95% acima da linha de base no presente experimento). Embora possamos ver os comportamentos consumatórios como associados à versão aprimorada do NAC DA (Wenkstern e outros, 1993; Wilson et al., 1995), é importante examinar os termos “apetitivo” e “consumatório” no contexto do comportamento sexual. Enquanto a fase em que a fêmea está presente atrás da tela é exclusivamente apetitiva ou preparatória, o comportamento durante a fase de copulação não pode ser considerado puramente consumatório. Como o “apetitivo” pode ser usado para descrever todos os comportamentos que levam à consumação de um comportamento motivado (copulação), o comportamento primário que o macho exibe enquanto ativo na fase “consumatória” é melhor descrito como apetitivo; o macho passa a maior parte de seu tempo e esforço perseguindo a fêmea para copular. A este respeito, podemos correlacionar a transmissão máxima de NAC DA com o consumo assim como componentes apetitivos intensos do comportamento sexual de ratos machos.
O acesso à segunda e nova fêmea resultou em renovada cópula em todos os assuntos. Estudos prévios mostraram que a maioria dos ratos com permissão para copular à saciedade, usando um protocolo comportamental semelhante ao usado no presente experimento, não voltou a acasalar quando testado 24 h mais tarde (Praia e Jordânia, 1956). É provável que a presença das novas propriedades de estímulo da 2 feminina, que podem ter incluído pistas olfativas e visuais e auditivas, resultasse em cópula renovada. Uma questão interessante, que ainda precisa ser respondida, é por qual mecanismo um rato macho distingue uma fêmea nova de uma fêmea com a qual ele se casou recentemente. Um local para esse mecanismo pode estar no principal sistema olfativo. Foi relatado que a integridade deste sistema é essencial para o efeito Coolidge em hamsters (Johnston e Rasmussen, 1984). O sistema olfatório acessório-vomeronasal, no entanto, em que um processo de memória feromonal foi descrito recentemente em camundongos (Kaba et al., 1994), também é um excelente candidato. A este respeito, vale ressaltar que os aumentos na transmissão da NAC DA foram mensurados in vivo voltametria em ratos machos com cama exposta a fêmeas em estro (Louillot et al., 1991; Mitchell e Gratton, 1992). Além disso, a aplicação de K+ diretamente para a camada nervosa vomeronasal do bulbo olfatório acessório, bem como para o próprio bulbo olfatório acessório, foi suficiente para aumentar a transmissão NAC DA (Mitchell e Gratton, 1992).
O primeiro 15 min cout de copulação com 2 feminino foi associado com um aumento significativo em NAC DA. Em contraste com a 1 feminina, a interação com a 2 feminina não produziu aumentos na NAC DA da mesma magnitude durante as fases apetitiva (12%) ou consumatória (34%). Estes pequenos aumentos no NAC DA, no entanto, correlacionam-se bem com o nível reduzido de comportamento sexual exibido com o 2 feminino em comparação com o 1 feminino. As concentrações de metabólitos permaneceram elevadas durante a fase de saciedade, resultando em novas concentrações de linha de base (amostras 10 e 12) que foram elevadas significativamente a partir do valor inicial inicial (amostra 1).
O atraso temporal no aumento das concentrações de DOPAC e HVA durante a cópula é consistente com a sua formação como metabolitos do composto original, DA. Tem sido sugerido que as concentrações de metabólitos de microdiálise, pelo menos durante um comportamento natural que não é farmacologicamente dirigido, fornecem um índice útil de atividade neural (Damsma et al., 1992; Fumero e outros, 1994). O fato de que as concentrações de metabólito permanecessem elevadas mesmo durante os períodos de inatividade sexual neste experimento, quando as concentrações de DA retornaram aos valores pré-teste da linha de base, lança dúvidas sobre essa sugestão.
A elevação persistente das concentrações de metabólitos de DA observadas neste experimento espelha o perfil da área pré-óptica medial (mPOA) dos metabólitos de DA observados em ratos no primeiro dia após terem copulado para saciedade (Mas et al., 1995a,b). Elevações sustentadas das concentrações de DOPAC e HVA no NAC ou mPOA nem sempre são observadas quando o período de acasalamento é de duração fixa, muito mais curto que o tempo necessário para atingir a saciedade. Por exemplo, muitos estudos mostraram que as concentrações de DOPAC foram aumentadas e permaneceram elevadas durante a cópula, mas declinaram para valores iniciais logo após a remoção da fêmea (Pfaus et al., 1990; Pleim et al., 1990; Damsma et al., 1992;Hull e outros, 1993; Wenkstern e outros, 1993; Hull e outros, 1995). No estudo de Mas et al. (1995b)As concentrações basais extracelulares de DOPAC e HVA no mPOA permaneceram elevadas em 4 dias consecutivos correspondentes a um período de inatividade sexual. No quarto dia, pouco antes de os animais retomarem a cópula, as concentrações basais dos metabólitos estavam próximas dos valores de pré-concentração. Os autores compararam o padrão de alterações neuroquímicas às observadas após a administração de bloqueadores do receptor DA (Zetterström et al., 1984; Imperato e DiChiara, 1985) e sugeriram que o estado de inatividade sexual pode ser mediado via liberação de prolactina, que pode atuar como um “neuroléptico endógeno” (Mas et al., 1995a,b,d). É claro que a administração neuroléptica é acompanhada por aumentos nas concentrações de metabolitos extracelulares e efluxo de DA (Zetterström et al., 1984; Imperato e DiChiara, 1985). Infelizmente, Mas et al. (1995a,b) não foram capazes de detectar concentrações de mPOA DA. No presente estudo, as concentrações de DA no NAC retornaram aos valores de pré-população, enquanto as concentrações de DOPAC e HVA permaneceram elevadas. Esse padrão é inconsistente com o papel de um neuroléptico endógeno atuante no NAC para induzir a saciedade sexual.
Dado o envolvimento de neurônios DA mesolímbicos no comportamento motivado (Fibiger e Phillips, 1986; Blackburn et al., 1992; Kalivas e outros, 1993; LeMoal, 1995) e sua sensibilidade a novos estímulos ambientais (Fabre et al., 1983; Schultz, 1992; Mirenowicz e Schultz, 1994), os aumentos observados nas concentrações extracelulares de NAC DA em resposta à nova fêmea são consistentes com a hipótese de que a atividade neste sistema de DA é importante para a reinicialização do comportamento sexual. Além disso, relatos de aumento apetitivo e consumatório na transmissão de DAHull e outros, 1993, 1995;Mas et al., 1995b; Sato et al., 1995) e atividade neuronal (Shimura et al., 1994) no mPOA de ratos machos durante o comportamento sexual sugerem que essa estrutura também pode contribuir para a renovação da copulação característica do efeito Coolidge.
De acordo com um papel geral do sistema DA mesolímbico no comportamento motivado, está bem estabelecido que as concentrações extracelulares de DA também são elevadas antes, durante e imediatamente após o consumo de uma refeição, com um retorno aos valores iniciais ∼30 min mais tarde (Wilson et al., 1995). É bem sabido que a saciedade induzida pela comida é influenciada por suas propriedades sensoriais. Os seres humanos e animais rejeitam a comida na qual eles foram alimentados à saciedade e ingerem outros alimentos que não foram comidos (Rolos, 1986). Isso levanta a questão de saber se o efluxo extracelular de DA no NAC seria aumentado seletivamente pela apresentação de um novo tipo de alimento, mas não por alimentos consumidos recentemente à saciedade de maneira análoga à relatada no presente estudo no contexto de motivação sexual. Se confirmada, esta relação geral entre as propriedades sensoriais das recompensas naturais, saciedade e transmissão mesolímbica de DA implicaria um papel crítico para este sistema neural na regulação de processos motivacionais, cuja desordem pode levar a sérios distúrbios de alimentação e função sexual. .
REFERÊNCIAS
- ↵
- Beach FA,
- Jordan L
(1956) Exaustão sexual e recuperação no rato macho. QJ Exp Psychol 8: 121-133.
- ↵
- Bermant G,
- Lott DF,
- Anderson L
(1966) Características temporais do efeito Coolidge no comportamento copulatório de ratos machos. J Comp Physiol Psiquiatria 65: 447-452.
- ↵
- Blackburn JR,
- Pfaus JG,
- Phillips AG
(1992) A dopamina funciona em comportamentos apetitivos e defensivos. Prog Neurobiol 39: 247-279.
- ↵
- Damsma G,
- Pfaus JG,
- Wenkstern D,
- Phillips AG,
- Fibiger HC
(1992) O comportamento sexual aumenta a transmissão de dopamina no núcleo accumbens e estriado de ratos machos: comparação com novidade e locomoção. Behaviour Neurosci 106: 181-191.
- ↵
- Fabre M,
- Rolls ET,
- Ashton JP,
- Williams G
(1983) Atividade de neurônios na região tegmentar ventral do macaco que se comporta. Behav Brain Res 9: 213-235.
- ↵
- Fibiger HC,
- Phillips AG
(1986) Recompensa, motivação, cognição: psicobiologia dos sistemas de dopamina mesotelencefálica. no Manual de fisiologia: o sistema nervoso IV, eds Bloom FE, Geiger SD (Sociedade Americana de Fisiologia, Bethesda, MD), pp 647-675.
- ↵
- Fiorino DF,
- Coury AG,
- Fibiger HC,
- Phillips AG
(1993) A estimulação elétrica de sítios de recompensa na área tegmentar ventral aumenta a transmissão de dopamina no núcleo accumbens do rato. Behav Brain Res 55: 131-141.
- ↵
- Fisher A
(1962) Efeitos da variação do estímulo na saciedade sexual no rato macho. J Comp Physiol Psiquiatria 55: 614-620.
- ↵
- Fowler H,
- Whalen RE
(1961) Variação no estímulo de incentivo e comportamento sexual no rato macho. J Comp Physiol Psiquiatria 54: 68-71.
- ↵
- Fumero B,
- Fernendez-Vera JR,
- Gonzalez-Mora JL,
- Mas M
(1994) Alterações no turnover de monoamina em áreas do prosencéfalo associadas ao comportamento sexual masculino: um estudo de microdiálise. Brain Res. 662: 233-239.
- ↵
- Holmes GM,
- Holmes DG,
- Sachs BD
(1987) Um sistema de coleta de dados baseado em IBM-PC para registro de comportamento sexual de roedores e gravação de eventos em geral. Physiol Behav 44: 825-828.
- ↵
- Casco EM,
- Eaton RC,
- Moisés J,
- Lorrain DS
(1993) A cópula aumenta a atividade da dopamina na área pré-óptica medial de ratos machos. Vida Sci 52: 935-940.
- ↵
- Casco EM,
- Jianfang D,
- Lorrain DS,
- Matuszewich L
(1995) Dopamina extracelular na região pré-óptica medial: implicações para a motivação sexual e controle hormonal da cópula. J Neurosci 15: 7465-7471.
- ↵
- Imperato A,
- DiChiara G
(1985) Liberação de dopamina e metabolismo em ratos acordados após neurolépticos sistêmicos como estudados por diálise transstriatal. J Neurosci 5: 297-306.
- ↵
- Johnston RE,
- Rasmussen K
(1984) Reconhecimento individual de hamsters femininos pelos machos: papel das pistas químicas e dos sistemas olfativo e vomeronasal. Physiol Behav 33: 95-104.
- ↵
- Kaba H,
- Hayashi Y,
- Higuchi T,
- Nakanishi S
(1994) Indução de uma memória olfativa pela ativação de um receptor de glutamato metabotrópico. Ciência 265: 262-264.
- ↵
- Kalivas PW,
- Sorg BA,
- Ganchos MS
(1993) A farmacologia e circuitos neurais da sensibilização aos psicoestimulantes. Behav Pharmacol 4: 315-334.
- ↵
- LeMoal M
(1995) Neurônios dopaminérgicos mesocorticolímbicos. Papéis funcionais e regulatórios. em Psicofarmacologia: a quarta geração do progresso, eds Bloom FE, Kupfer DJ (Raven, Nova York), pp 283-294.
- ↵
- Louillot A,
- Gonzalez-Mora JL,
- Guadalupe T,
- Mas M
(1991) Os estímulos olfatórios relacionados ao sexo induzem um aumento seletivo na liberação de dopamina no nucleus accumbens de ratos machos. Brain Res. 553: 313-317.
- ↵
- Mas M,
- Gonzalez-Mora JL,
- Louillot A,
- Solteira C,
- Guadalupe T
(1990) Aumento da liberação de dopamina no nucleus accumbens de ratos machos copulando evidenciados pela voltametria in vivo. Neurosci Lett 110: 303-308.
- ↵
- Mas M,
- Fumero B,
- Fernandez-Vera JR,
- Gonzalez-Mora JL
(1995a) Correlatos neuroquímicos de esgotamento sexual e recuperação avaliados por microdiálise in vivo. Brain Res. 675: 13-19.
- ↵
- Mas M,
- Fumero B,
- Gonzalez-Mora JL
Monitoramento de voltametria e microdiálise da liberação de neurotransmissores monoamínicos cerebrais durante interações sociossociais. Behav Brain Res 71: 69-79.
- ↵
- Mas M,
- Fumero B,
- Perez-Rodriguez I
(1995c) Indução do comportamento de acasalamento por apomorfina em ratos sexualmente saciados. Eur J Pharmacol 280: 331-334.
- ↵
- Mas M,
- Fumero B,
- Perez-Rodriguez I,
- Gonzalez-Mora JL
(1995d) A neuroquímica da saciedade sexual. Um modelo experimental de desejo inibido. em A farmacologia da função e disfunção sexual, ed Bancroft J (Raven, Nova York), pp 115-126.
- ↵
- Mirenowicz J,
- Schultz W
(1994) Importância da imprevisibilidade para respostas de recompensa em neurônios dopaminérgicos de primata. J Neurophysiol 72: 1024-1027.
- ↵
- Mitchell JB,
- Gratton A
(1992) Liberação mesolímbica de dopamina induzida pela ativação do sistema olfatório acessório: estudo cronoamperométrico de alta velocidade. Neurosci Lett 140: 81-84.
- ↵
- Paxinos G,
- Watson C
(1986) O cérebro de rato em coordenadas estereotáxicas (2nd ed). (Acadêmico, San Diego).
- ↵
- Pfaus JG,
- Damsma G,
- Nomikos GG,
- Wenkstern D,
- Blaha CD,
- Phillips AG,
- Fibiger HC
(1990) O comportamento sexual aumenta a transmissão central de dopamina no rato macho. Brain Res. 530: 345-348.
- ↵
- Pfaus JG,
- Everitt BJ
(1995) A psicofarmacologia do comportamento sexual. em Psicofarmacologia: a quarta geração do progresso, eds Bloom FE, Kupfer DJ (Raven, Nova York), pp 743-758.
- ↵
- Pfaus JG,
- Gorzalka BB
(1987) Opioides e comportamento sexual. Neurosci Biobehav Rev 11: 1-34.
- ↵
- Phillips AG,
- Blaha CD,
- Pfaus JG,
- Blackburn JR
(1992) Correlatos neurobiológicos de estados emocionais positivos: dopamina, antecipação e recompensa. na revisão internacional de estudos sobre emoção, ed Strongman (Wiley, Nova York), pp 31-50.
- ↵
- Pleim ET,
- Matochik JA,
- Barfield RJ,
- Auerbach SB
(1990) Correlação da liberação de dopamina no nucleus accumbens com o comportamento sexual masculino em ratos. Brain Res. 524: 160-163.
- ↵
- Rodriguez-Manzo G,
- Fernandez-Guasti A
(1994) Reversão do esgotamento sexual por agentes serotoninérgicos e noradrenérgicos. Behav Brain Res 62: 127-134.
- ↵
- Rodriguez-Manzo G,
- Fernandez-Guasti A
(1995a) Participação do sistema noradrenérgico central no restabelecimento do comportamento copulatório de ratos sexualmente exauridos por ioimbina, naloxona e 8-OH-DPAT. Brain Res. Bol. 38: 399-404.
- ↵
- Rodriguez-Manzo G,
- Fernandez-Guasti A
(1995b) Antagonistas de opiáceos e o fenômeno da saciedade sexual. Psychopharmacol 122: 131-136.
- ↵
- Rolls BJ
(1986) saciedade sensorial específica. Nutr Rev 44: 93-101.
- ↵
- Salamone JD
(1996) A neuroquímica comportamental da motivação: questões metodológicas e conceituais em estudos da atividade dinâmica do nucleus accumbens dopamine. J Neurosci Methods 64: 137-149.
- ↵
- Sato Y,
- Wada H,
- Horita H,
- Suzuki N,
- Shibuya A,
- Adachi H,
- Kato R,
- Tsukamoto T,
- Kumamoto Y
(1995) Liberação de dopamina na região pré-óptica medial durante o comportamento copulatório em ratos. Brain Res. 692: 66-70.
- ↵
- Schultz W
(1992) Atividade de neurônios dopaminérgicos no primata comportado. Semin Neurosci 4: 129-138.
- ↵
- Shimura T,
- Yamamoto T,
- Shimokochi M
(1994) A área pré-óptica medial está envolvida tanto na excitação sexual quanto no desempenho em ratos machos: reavaliação da atividade dos neurônios em animais que se movimentam livremente. Brain Res. 640: 215-222.
- ↵
- Wenkstern D,
- Pfaus JG,
- Fibiger HC
(1993) A transmissão de dopamina aumenta no núcleo accumbens de ratos machos durante sua primeira exposição a ratas sexualmente receptivas. Brain Res. 618: 41-46.
- ↵
- Wilson C,
- Nomikos GG,
- Collu M,
- Fibiger HC
(1995) Correlatos dopaminérgicos de comportamento motivado: importância da pulsão. J Neurosci 15: 5169-5178.
- ↵
- Wilson JR,
- Kahn RE,
- Beach FA
(1963) Modificação no comportamento sexual de ratos machos produzidos pela mudança do estímulo feminino. J Comp Physiol Psiquiatria 56: 636-644.
- ↵
- Zetterström T,
- Sharp T,
- Ungerstedt U
(1984) Efeito de drogas neurolépticas na liberação e metabolismo de dopamina no estriado em ratos acordados estudados por diálise intracerebral. Eur J Pharmacol 106: 27-37.
Artigos citando este artigo
- Neuroplasticidade Endógena Induzida por Opióide de Neurônios Dopaminérgicos na Área Tegmentar Ventral Influencia a Recompensa Natural e Opiáceos Jornal de Neurociência, 25 June 2014, 34 (26): 8825-8836
- Desequilíbrio na sensibilidade a diferentes tipos de recompensas no jogo patológico Cérebro, 1 Agosto 2013, 136 (8): 2527-2538
- As recompensas naturais e de drogas atuam em mecanismos comuns de plasticidade neural com {Delta} FosB como um mediador chave Jornal de Neurociência, 20 Fevereiro 2013, 33 (8): 3434-3442
- Respostas neuronais no Nucleus Accumbens Shell durante o comportamento sexual em ratos machos Jornal de Neurociência, 1 Fevereiro 2012, 32 (5): 1672-1686
- Amor romântico: um sistema cerebral de mamíferos para escolha de parceiros Transações Filosóficas da Royal Society B: Ciências Biológicas, 29 Dezembro 2006, 361 (1476): 2173-2186
- Pontos quentes hedônicos no cérebro O Neurocientista, 1 Dezembro 2006, 12 (6): 500-511
- Modulação pelos Núcleos Central e Basolateral da Amígdala dos Correlatos Dopaminérgicos da Alimentação à Saciedade no Núcleo de Ratos Accumbens e no córtex pré-frontal medial Jornal de Neurociência, 15 Dezembro 2002, 22 (24): 10958-10965
- Freqüência de Concentração de Dopamina Transientes Aumento no Estriado Dorsal e Ventral de Ratos Masculinos durante a Introdução de Espécies Específicas Jornal de Neurociência, 1 Dezembro 2002, 22 (23): 10477-10486
- Resenha: Dinâmica da Dopamina Extracelular nas Ações Agudas e Crônicas da Cocaína O Neurocientista, 1 August 2002, 8 (4): 315-322
- Envolvimento Diferencial dos Receptores de NMDA, AMPA / Kainate e Dopamina no Núcleo Accumbens na Aquisição e Desempenho do Comportamento da Abordagem Pavloviana Jornal de Neurociência, 1 Dezembro 2001, 21 (23): 9471-9477
- Controle do comportamento de procura de cocaína por estímulo associado a drogas em ratos: efeitos na recuperação de níveis de dopamina extintos e de resposta operante extinta na amígdala e no núcleo accumbens PNAS, 11 abril 2000, 97 (8): 4321-4326
- Facilitação do Comportamento Sexual e Efluxo Aprimorado de Dopamina no Núcleo Accumbens de Ratos Masculinos após Sensibilização Comportamental Induzida por D-Anfetamina Journal of Neuroscience, 1 Janeiro 1999, 19 (1): 456-463
- NEUROCIÊNCIA: Obtendo a atenção do cérebro Ciência, 3 Outubro 1997, 278 (5335): 35-37
- Correlatos dopaminérgicos da saciedade sensorial específica no córtex pré-frontal medial e núcleo acumbente do rato Jornal de Neurociência, 1 Outubro 1999, 19 (19): RC29