COMENTÁRIOS: Excelente revisão de quase todas as pesquisas relevantes sobre receptores androgênicos, dopamina e função sexual. Desenho fantástico das inter-relações do circuito hipotálamo-recompensa.
Horm Behav. 2008 de maio; 53(5): 647-658.
Publicado on-line 2008 fevereiro 13. doi: 10.1016 / j.yhbeh.2008.01.010
Sumário
A adolescência está associada ao aumento dos comportamentos de busca de prazer, que, por sua vez, são moldados pela ativação puberal do eixo hipotalâmico-hipofisário-gonadal. Em modelos animais de comportamentos naturalmente recompensadores, como o sexo, os andrógenos testiculares contribuem para o desenvolvimento e a expressão do comportamento no sexo masculino. Para efetuar a maturação comportamental, o cérebro sofre remodelação significativa durante a adolescência, e muitas das alterações são igualmente sensíveis aos andrógenos, presumivelmente atuando através dos receptores androgênicos (AR). Dada a delicada interação dos hormônios gonadais e o desenvolvimento do cérebro, não é surpresa que a interrupção dos níveis hormonais durante esse período sensível altere significativamente o comportamento de adolescentes e adultos. Em hamsters machos, a exposição à testosterona durante a adolescência é necessária para a expressão normal do comportamento sexual adulto. Machos privados de andrógenos durante a puberdade apresentam déficits sustentados no acasalamento. Por outro lado, os androgênios isoladamente não são suficientes para induzir o acasalamento em machos pré-púberes, embora o RA cerebral esteja presente antes da puberdade. Neste contexto, o uso generalizado de esteróides anabólicos androgênicos (AAS) durante a adolescência é uma preocupação significativa. O abuso de EAA tem o potencial de alterar o tempo e os níveis de andrógenos em adolescentes do sexo masculino. Nos hamsters, a exposição do adolescente AAS aumenta a agressividade e causa mudanças duradouras nos sistemas de neurotransmissores. Além disso, os EAA são reforçados, como demonstrado pela auto-administração de testosterona e outros AAS. No entanto, evidências recentes sugerem que os efeitos reforçadores dos andrógenos podem não exigir AR clássica. Portanto, um exame mais aprofundado das interações entre andrógenos e comportamentos de recompensa no cérebro adolescente é necessário para uma melhor compreensão do abuso de AAS.
Visão geral
A adolescência desperta o cérebro tanto para o prazer quanto para o risco. Em adolescentes humanos, isso freqüentemente assume a forma de experimentação com drogas e sexo. Nos Estados Unidos, a idade mediana para a primeira relação sexual no sexo masculino é de 16.4 anos e 65% tiveram relações sexuais com 12th grau (Fundação da Família Kaiser, 2005). Da mesma forma, esta população tem as maiores taxas de uso de drogas ilícitas nos Estados Unidos. De acordo com a Pesquisa Nacional 2004 sobre Uso de Drogas e Saúde, 38% dos homens com idade entre 18 e 25 usaram uma droga ilícita no ano passado (SAMHSA / OAS, 2005). Além disso, 31% dos meninos adolescentes usaram drogas ou álcool durante seu último encontro sexual (Fundação da Família Kaiser, 2005). Além disso, a adolescência é um momento crucial na etiologia de certas psicopatologias, como depressão, ansiedade, desordens alimentares e distúrbios de conduta. Nós postulamos que a secreção puberal de hormônios gonadais, sua ativação de receptores de esteróides no cérebro e a interação entre o hormônio e a experiência no desenvolvimento do cérebro de adolescentes contribuem para as mudanças de comportamento observadas durante a adolescência.
Nosso objetivo aqui é revisar as evidências de que andrógenos gonadais medeiam a maturação adolescente e o desempenho adulto de comportamentos motivados, bem como as propriedades recompensadoras desses comportamentos. Também apresentamos evidências de que a própria testosterona é gratificante, o que provavelmente contribui para mudanças maturacionais em comportamentos motivados durante a adolescência, quando os níveis de testosterona aumentam. O foco deste artigo é sobre nossos estudos de circuitos neurais subjacentes ao comportamento sexual masculino, particularmente no hamster sírio, com ênfase especial na interação entre testosterona e dopamina (DA). Nós propomos que os andrógenos da puberdade têm efeitos tanto transitórios quanto a longo prazo em circuitos de recompensa e comportamento motivado. Além disso, hipotetizamos que a suplementação com andrógenos exógenos na forma de anabólicos esteróides androgênicos (EAA) aumenta as influências normais dos andrógenos da puberdade, afetando adversamente o desenvolvimento do cérebro e do comportamento do adolescente.
Adolescência como um período sensível para o desenvolvimento do cérebro
Em última análise, o cérebro é tanto um gatilho quanto um alvo para a ação androgênica durante a adolescência. Em meninos (<12 anos) e hamsters jovens (<28 dias de idade), os androgênios circulantes e as gonadotrofinas estão em níveis basais. Como a secreção do hormônio luteinizante da glândula pituitária anterior aumenta em resposta ao hormônio liberador de gonadotrofina hipotalâmica, as concentrações de testosterona circulante aumentam significativamente. Isso ocorre no estágio II / III de Tanner (14 anos) em meninos e aos 28 dias de idade em hamsters. No momento em que os meninos atingem o estágio IV / V de Tanner (cerca de 16 anos de idade) ou quando os hamsters têm 50–60 dias de idade, a testosterona endógena está na faixa dos homens adultos. A secreção do hormônio puberal coincide com o período da adolescência, que ocorre aproximadamente dos 12 aos 20 anos de idade no homem. Os hormônios da puberdade atuam não apenas nos tecidos periféricos para causar o aparecimento de características sexuais secundárias que são os sinais evidentes da puberdade, mas também atuam centralmente para influenciar tanto a remodelação do cérebro adolescente quanto a maturação comportamental. Além disso, as mudanças fisiológicas e neurológicas provocadas pelos hormônios da puberdade levam a mudanças significativas na experiência de um indivíduo, que podem alterar profundamente o curso do desenvolvimento do cérebro. Assim, o aumento puberal dos hormônios esteróides sexuais, impulsionado pela maturação cronometrada do desenvolvimento do eixo neuroendócrino reprodutivo, por sua vez molda o desenvolvimento comportamental do adolescente por meio de influências diretas e indiretas no sistema nervoso.
A adolescência humana é agora reconhecida como um período importante e dinâmico de desenvolvimento neural durante o qual circuitos comportamentais são remodelados e refinados. Embora o cérebro de uma criança de 5 anos de idade já é 90% do seu tamanho adulto (Dekaban, 1978), a remodelação significativa ainda está por vir. Este conceito foi estimulado por pesquisas em humanos e animais documentando que muitos dos processos básicos de desenvolvimento que ocorrem durante o desenvolvimento perinatal do cérebro são recapitulados durante a adolescência. Esses processos incluem neurogênese (Eckenhoff e Rakic, 1988; Ele e as tripulações, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segóvia e Guillamon, 2001; Rankin, Partlow, McCurdy, Giles e Fisher, 2003), morte celular programada (Nunez, Lauschke e Juraska, 2001; Nunez, Sodhi e Juraska, 2002), elaboração e poda de arborizações e sinapses dendríticas (Andersen, Rutstein, Benzo, Hostetter e Teicher, 1997; Huttenlocher e Dabholkar, 1997; Lenroot e Giedd, 2006; Sowell, Thompson, Leonard, Bem-vindo, Kan e Toga, 2004), mielinização (Benes, Turtle, Khan e Farol, 1994; Paus, Collins, Evans, Leonard, Pike e Zijdenbos, 2001; Sowell, Thompson, Tessner e Toga, 2001) e diferenciação sexual (Chung, De Vries e Swaab, 2002; Davis, Shryne e Gorski, 1996; Nunez et al., 2001). Assim, a trajetória desenvolvimental do cérebro pós-natal não é linear, mas é caracterizada por uma explosão de mudanças rápidas na adolescência e envolve eventos progressivos e regressivos. Como qualquer biólogo do desenvolvimento sabe, períodos de rápida mudança no desenvolvimento sinalizam maior sensibilidade e vulnerabilidade tanto à mudança dependente da experiência quanto às conseqüências adversas da perturbação e do insulto, e não há razão para pensar que o desenvolvimento do cérebro humano adolescente seja uma exceção (Andersen, 2003; Lança, 2000). Assim, seria previsível que as perturbações no momento das influências do hormônio puberal no cérebro adolescente tivessem consequências duradouras para o comportamento adulto.
Andrógenos e circuitos neurais para comportamento motivado
Como a adolescência é uma fase de desenvolvimento transitória e dinâmica, seria difícil avaliar o cérebro e o comportamento do adolescente isoladamente. Em vez disso, para apreciar o caráter único da adolescência, é útil contrastá-lo com o cérebro e o comportamento de adultos maduros. Assim, com o foco deste artigo sobre o comportamento e recompensa sexual masculina, é importante introduzir os circuitos neurais para a cópula e a motivação sexual em homens adultos, incluindo o papel dos hormônios esteróides gonadais na ativação comportamental e na distribuição de receptores para andrógenos. (AR) e estrogênios (ER).
AR estão presentes em grupos celulares que formam os circuitos neurais mediando comportamentos sociais recompensadores, como o sexo. Além disso, os AR cerebrais são expressos antes da puberdade em hamsters e são regulados por andrógenos em machos jovens e adultos (Kashon, Hayes, Shek e Sisk, 1995; Submisso, Romeo, Novak e Sisk, 1997). No cérebro de roedores, há substancial sobreposição na distribuição de RA e ER (Madeira e Newman, 1995) e aromatase (Celotti, Negri-Cesi e Poletti, 1997), incluindo as formas α e β do receptor de estrogênio (Shughrue, Lane e Merchenthaler, 1997). Após a ligação ao ligante, a AR e ER “clássicas” funcionam como fatores de transcrição para induzir a transcrição e a síntese de novas proteínas. Não surpreendentemente, esses efeitos seguem um curso de tempo relativamente lento, com um início tardio de ação. Estimulação esteróide do comportamento sexual do hamster masculino (Nobre e Alsum, 1975) é consistente com ações através de ações genômicas clássicas. Por exemplo, 2 semanas de exposição a esteróides é necessário para restaurar o acasalamento em castrados de longo prazo. Estudos mais recentes em ratos também demonstraram rápidos efeitos celulares de andrógenos em regiões cerebrais que possuem poucos receptores clássicos (Mermelstein, Becker e Surmeier, 1996). Acredita-se que estas ações esteroides sejam mediadas por receptores não genômicos. Considerando que a distribuição de AR e ER clássicos no cérebro de hamster é relativamente restrita (Wood e Swann, 1999), os potenciais alvos cerebrais para ação androgênica não genômica são muito mais amplos.
A área pré-óptica medial (MPOA) desempenha um papel central na copulação em machos de peixes dourados para humanos (revisado em Casco, Madeira e McKenna, 2006). Além disso, o hamster MPOA transduz hormônios esteroides gonadais via AR e ER abundantes, e implantes de testosterona em MPOA são suficientes para restaurar a atividade sexual em castrados de longa duração (Wood e Swann, 1999). Em ratos machos, os esteróides gonadais atuam no MPOA para regular a liberação basal de DA (Putnam, Sato e Hull, 2003) e estimular o acasalamento (Casco, Du, Lorrain e Matuszewich, 1995). Inicialmente, há um aumento modesto no DA quando uma mulher é apresentada por trás de uma tela. Durante a cópula, o MPOA DA aumenta ainda mais (+ 50% da linha de base), e este efeito requer andrógenos (Hull e outros, 1995; Putnam et al., 2003). Não surpreendentemente, em machos castrados que não acasalam, o MPOA DA não aumenta (Hull e outros, 1995). É um tanto difícil interpretar esse resultado, já que a falta de liberação do DA é confundida pela ausência de atividade sexual. No entanto, a liberação de DA no MPOA se correlaciona com a perda de acasalamento em castrados de curto prazo (Hull e outros, 1995) e com a restauração da atividade sexual induzida pela testosterona em castrados de longa duração (Du, Lorrain e Hull, 1998; Putnam, Du, Sato e Hull, 2001).
Dentro do MPOA de roedores, os metabólitos androgênicos e estrogênicos da testosterona desempenham papéis específicos na regulação do acasalamento (Putnam et al., 2003; Putnam, Sato, Riolo e Hull, 2005). A latência para iniciar a cópula (montar ou intrometer) é uma medida da motivação sexual. A latência para a atividade sexual é sensível aos estrogênios, através da manutenção da sintase do óxido nítrico de MPOA, que por sua vez, mantém os níveis basais de DA. As castradas tratadas com estrogênio apresentam altos níveis basais de DA, que se correlacionam fortemente com a capacidade de iniciar a cópula. No entanto, eles não mostram aumentos induzidos por fêmeas e cópulas na liberação de DA, que se correlacionam fortemente com o desempenho sexual. Consequentemente, seu desempenho sexual está abaixo dos níveis intactos. Por outro lado, os castrados tratados apenas com andrógenos não aromatizáveis não apresentam níveis basais elevados de DA e não iniciam a cópula. Para o desempenho sexual normal, portanto, ambos os estrógenos e andrógenos são necessários. O desempenho sexual é geralmente expresso como medidas de freqüência de montarias, intromissões e ejaculações. Somente quando estrogênios e andrógenos são substituídos, os machos castrados exibem níveis elevados de DA (e medidas de latência mais curtas) e DA induzida por fêmeas e cópulas aumentam (e aumentam as medidas de frequência). Desta forma, os estrogênios no MPOA contribuem para a motivação sexual, e ambos os estrogênios e andrógenos para o desempenho sexual.
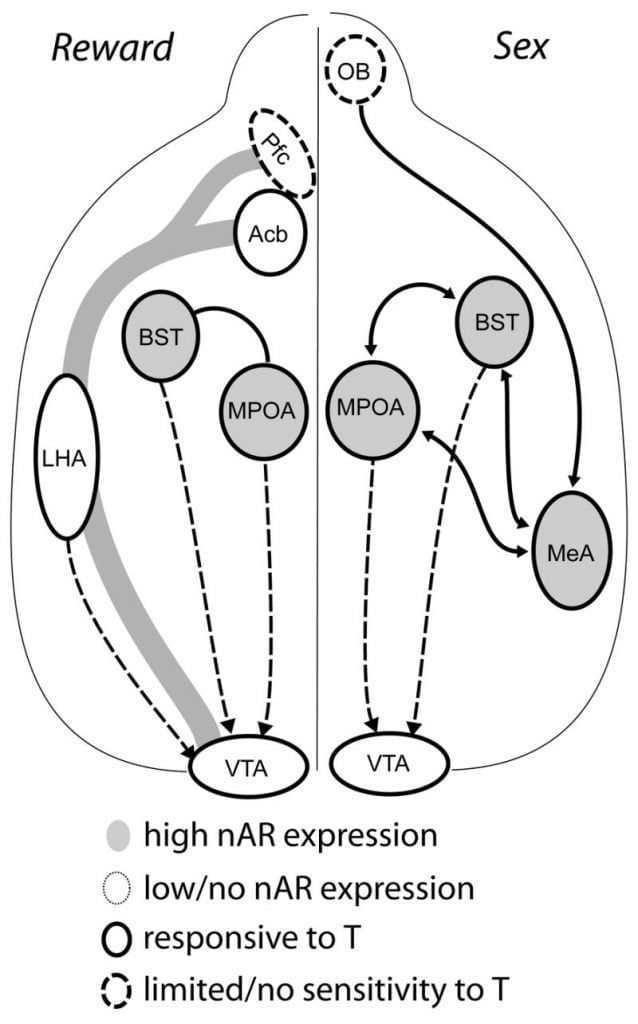
Embora a testosterona seja necessária para a liberação de MPOA DA durante o comportamento copulatório masculino e para o acasalamento em si, nem a testosterona nem o acasalamento por si só podem provocar DA no MPOA. Em vez disso, pistas quimiossensoriais de fêmeas coespecíficas também são necessárias para liberação de DA no MPOA. Em roedores, os estímulos quimiossensoriais são a modalidade sensorial primária para iniciar o comportamento sexual masculino (FIG. 1). Sugestões quimiossensoriais são transmitidas dos bulbos olfatórios para MPOA através do núcleo amigdalóide medial e do núcleo do leito da estria terminal, estruturas com abundante AR e ER (Wood e Swann, 1999). Para determinar o papel das pistas quimiossensoriais na DA induzida pelo acasalamento, nós medimos a MPOA DA durante o acasalamento em hamsters machos intactos com gônadas com bulbectomia olfativa unilateral (UBx, Triemstra, Nagatani e Madeira, 2005). Embora a remoção bilateral dos bulbos olfatórios elimine a atividade sexual e a liberação de MPOA DA, a bulboectomia unilateral não interfere no acasalamento. Neste estudo, a cópula induziu liberação de MPOA DA quando medida contralateralmente ao bulbo olfatório lesionado, mas não no hemisfério ipsilateral (FIG. 2). Resultados semelhantes foram observados em ratos machos com lesões da amígdala medial (Dominguez, Riolo, Xu e Hull, 2001). Em um estudo relacionado, a estimulação química da amígdala medial em ratos induziu liberação de MPOA DA equivalente àquela durante a cópula (Dominguez e Hull, 2001). Em conjunto, esses dados sugerem que a testosterona cria um ambiente permissivo que permite que estímulos sensoriais externos atinjam o MPOA e induzam a liberação de DA durante a cópula.

FIG. 2
Em última análise, o comportamento sexual e outras recompensas naturais ativam os caminhos da recompensa neural. O circuito DA mesocorticolímbico consiste na área tegmentar ventral (VTA), núcleo accumbens (Acb) e córtex pré-frontal (Pfc). Corpos celulares dopaminérgicos que residem no projeto VTA rostralmente para o Acb e Pfc (Koob e Nestler, 1997). Em ratos, o DA é liberado no Acb durante o sexo (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips e Fibiger, 1990). Muitas drogas de abuso também atuam no sistema DA mesolímbico para aumentar a liberação de DA (anfetaminas) ou inibir a recaptação de DA (cocaína, Di Chiara e Imperato, 1988), reforçando assim as suas propriedades aditivas. Desta forma, a testosterona tem o potencial de afetar a liberação de DA em Acb, tanto através de seu aprimoramento do comportamento sexual, como através de suas ações como uma droga de abuso (veja abaixo).
Evidências atuais sugerem que o sistema DA mesocorticolímbico amadurece durante a adolescência. As densidades de fibras de Acb DA aumentam dramaticamente durante a adolescência em gerbils, sugerindo que a maturação significativa de projeções dopaminérgicas de VTA ao Acb ocorre durante o período da adolescência (Lesting, Neddens e Teuchert-Noodt, 2005). Além disso, a entrada dopaminérgica em células GABA (ácido γ-aminobutírico) no córtex pré-frontal medial de rato é enriquecida e modulada por sistemas serotoninérgicos durante o desenvolvimento puberal (Benes, Taylor e Cunningham, 2000), e manipulação de andrógenos em ratos adultos leva a alterações na densidade axonal dopaminérgica no córtex pré-frontal (Kritzer, 2003). O Pfc, o Acb e o VTA têm poucos AR ou ER, embora o ERβ esteja presente na VTA (Shughrue e outros, 1997). Portanto, parece provável que os andrógenos afetem o sistema DA mesocorticolímbico através de aferentes sensíveis ao androgênio ou através do ERβ na VTA como no hipotálamo (Handa et al., Este número). Nossos dados mostram que as células sensíveis a andrógenos em hamsters machos se projetam para o VTA a partir de estruturas associadas a comportamentos sensíveis a esteróides. Por exemplo, tanto o MPOA como o núcleo do leito da estria terminal (BST) contêm um grande número de células positivas para AR projetando-se para o VTA (Sato e Madeira, 2006). O pallidum ventral, o principal alvo eferente de Acb (Zahm e Heimer, 1990), também contém muitas células positivas para AR projetando-se para o VTA. Essas projeções fornecem uma oportunidade para os andrógenos modificarem a atividade do sistema DA mesocorticolímbico.
Organização de comportamento dependente de esteróides durante a adolescência
A visão tradicional da ação hormonal sobre o comportamento do adolescente é baseada nos efeitos ativadores dos hormônios esteróides, que se referem à capacidade dos esteróides para facilitar o comportamento em contextos sociais específicos pela ação dentro das células-alvo nos circuitos neurais subjacentes ao comportamento. Efeitos ativadores são transitórios no sentido de que eles vêm e vão com a presença e ausência de hormônio, e eles são tipicamente associados com a expressão do comportamento adulto. Em contraste, os efeitos organizacionais referem-se à capacidade dos esteróides para esculpir a estrutura do sistema nervoso durante o desenvolvimento. A organização estrutural é permanente, persiste além do período de exposição ao hormônio e determina respostas neurais e comportamentais aos esteróides na vida adulta. Nossa compreensão da relação de desenvolvimento entre os efeitos organizacionais e ativadores dos hormônios esteróides evoluiu nos últimos anos da 50. Phoenix e seus colegas propuseram pela primeira vez que as respostas comportamentais (ativadas) dos adultos aos hormônios esteróides são programadas (organizadas) por hormônios esteróides durante um período de desenvolvimento perinatal extremamente sensível (Phoenix, Goy, Gerall e Young, 1959). Mais tarde, Scott e seus colegas estabeleceram as bases teóricas para a existência de múltiplos períodos sensíveis para a organização progressiva do sistema nervoso, e observaram que períodos sensíveis são mais prováveis de ocorrer durante períodos de mudança rápida de desenvolvimento (1974). Posteriormente, Arnold e Breedlove apontaram que a organização dependente de esteróides do cérebro pode ocorrer fora de períodos sensíveis de desenvolvimento (Arnold e Breedlove, 1985). Nos últimos anos 15, pesquisas que empregam uma variedade de modelos animais e sistemas comportamentais deixam claro que o cérebro adolescente é sensível aos efeitos ativadores e organizacionais dos esteróides gonadais (revisto em Sisk e Zehr, 2005). E, como outros períodos de mudança rápida no desenvolvimento, a adolescência representa uma janela de oportunidade definida para a remodelação cerebral dependente de esteróides.
Nosso trabalho usando o hamster como modelo animal fornece evidências de que os comportamentos sociais masculinos são modificados por esteróides durante a adolescência (Schulz, Menard, Smith, Albers e Sisk, 2006; Schulz e Sisk, 2006). Antes da puberdade, o tratamento com testosterona não pode ativar o comportamento sexual em hamsters, sugerindo que processos maturacionais que tornam os circuitos neurais suscetíveis à ativação ou organização por hormônios esteróides ainda não ocorreram (Meek e outros, 1997; Romeo, Richardson e Sisk, 2002a). Por outro lado, enquanto a expressão aberta do comportamento reprodutivo masculino na idade adulta não requer absolutamente a presença de esteróides gonadais durante a adolescência, a expressão máxima do comportamento requer. Comparando o comportamento reprodutivo masculino em machos castrados na pré-puberdade (NoT@P) ou pós-púbere (T@P) e depois tratados com testosterona na idade adulta, castrados NoT@P pré-púberes têm pelo menos 50% de déficit no comportamento masculino em comparação com machos castrados após a adolescência (FIG. 3, Schulz, Richardson, Zehr, Osetek, Menard e Sisk, 2004). Além disso, os déficits no comportamento reprodutivo são duradouros e não podem ser superados pelo tratamento prolongado com testosterona ou pela experiência sexual na vida adulta (Schulz et al., 2004). Da mesma forma, após o tratamento com estrogênio e progesterona, os machos NoT@P exibem latências de lordose mais curtas e durações de lordose mais longas do que os machos castrados quando adultos.Schulz et al., 2004), sugerindo que os castrados pré-púberes são menos defeminizados do que os machos expostos à testosterona puberal.

FIG. 3
Pode ser que os machos NoT@P sofram de diminuição da motivação sexual. Uma maneira de abordar esta questão é comparar as latências para se envolver tanto na investigação anogenital (AGI) quanto na montagem entre homens gonadectomizados antes (NoT@P) e após a puberdade (T@P). Se a motivação sexual depende da exposição ao hormônio gonadal durante a adolescência, podemos prever latências mais longas para se envolver em comportamento sexual em homens NoT@P. De fato, com a exposição repetida a fêmeas em estro, os machos NoT@P demoram mais para iniciar a AGI e a monta em comparação com os machos T@P (FIG. 4). Assim, além de organizar os aspectos do desempenho sexual, parece que os hormônios da puberdade também organizam os aspectos recompensadores do comportamento sexual. Em apoio a essa possibilidade, a administração central do agonista DA apomorfina na idade adulta restaura o comportamento crescente de homens NoT@P a níveis típicos de adultos, sugerindo que a testosterona durante a adolescência normalmente organiza os circuitos neurais dopaminérgicos (Salas-Ramirez, Montalto e Sisk, 2006 ). No entanto, muitas questões interessantes permanecem. Um macho NoT@P pressionaria uma fêmea no estro ou desenvolveria uma preferência de local condicionada por um local de acasalamento? Pesquisas futuras explorarão o papel dos hormônios da puberdade na organização da motivação sexual e do desempenho sexual.

FIG. 4
Latências e durações de investigação anogenital (AGI) exibidas por hamsters machos gonadectomizados antes da puberdade (NoT@P) ou após a puberdade (T@P). Todos os homens receberam testosterona na idade adulta 7 semanas após a gonadectomia e uma semana antes do primeiro teste de comportamento. A. Os machos T@P mostraram latências de AGI semelhantes nos três testes com uma fêmea em estro, enquanto os machos NoT@P aumentaram as latências de AGI durante o terceiro teste com uma fêmea em estro. Os machos B. T@P diminuíram as latências de monta nos três testes de comportamento com uma fêmea em estro, enquanto os machos noT@P não mostraram alteração na latência de monta nos três testes de comportamento. Esses dados sugerem que os hormônios gonadais da puberdade têm efeitos duradouros e facilitadores na motivação do homem adulto para se envolver em comportamento sexual com uma mulher. (Dados não publicados de sujeitos animais em Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA e Sisk, CL, 2004).
Respostas comportamentais pré-púberes aos esteróides
Um dos enigmas duradouros do desenvolvimento comportamental adolescente é por que a ativação do comportamento reprodutivo em resposta à exposição a esteróides é atenuada em hamsters machos pré-púberes. Se baixos níveis de andrógenos antes da puberdade limitam a expressão do comportamento sexual masculino em machos pré-púberes, a suplementação de andrógenos endógenos em machos pré-púberes deve provocar o acasalamento. Isto acaba por não ser o caso (Meek e outros, 1997; Romeo, Cook-Wiens, Richardson e Sisk, 2001; Romeo, Wagner, Jansen, Diedrich e Sisk, 2002b), apesar do número e distribuição de RA e ER ao longo do circuito de acasalamento serem similares em castrados pré-púberes e adultos tratados com hormônios (Meek e outros, 1997; Romeo, Diedrich e Sisk, 1999; Romeo e outros, 2002a). Portanto, parece que andrógenos e RA são necessários, mas não suficientes para a expressão do comportamento sexual masculino.
Esforços para identificar fatores que limitam a atividade sexual antes da puberdade foram até agora misturados. As respostas de Fos a estímulos quimiossensoriais de fêmeas de cio são semelhantes em hamsters pré-púberes e machos adultos (Romeo, Parfitt, Richardson e Sisk, 1998). Estes dados demonstram que os mecanismos de transdução sensorial estão maduros antes da puberdade. Assim, os machos juvenis são capazes de detectar sinais quimiossensoriais das fêmeas; onde eles diferem dos adultos é em como eles respondem a essas sugestões. Uma possível explicação é que os machos pré-púberes não são motivados a se envolver em comportamento sexual. Descobrimos que hamsters masculinos pré-púberes não apresentam respostas dopaminérgicas aumentadas no MPOA em resposta a feromônios femininos, enquanto homens adultos sexualmente ingênuos exibem respostas dopaminérgicas robustas de MPOA aos mesmos estímulos (FIG. 5, Schulz, Richardson, Romeo, Morris, Lookingland e Sisk, 2003). Da mesma forma, os machos pré-púberes não mostram o aumento típico de adultos na testosterona circulante após a exposição a feromônios femininos (Parfitt, Thompson, Richardson, Romeo e Sisk, 1999). Assim, os feromônios femininos parecem ser um estímulo incondicionado para respostas neuroquímicas e neuroendócrinas em homens adultos, mas não pré-púberes, sugerindo que a saliência desses estímulos sensoriais socialmente relevantes muda com o desenvolvimento puberal, possivelmente relacionado à aquisição de propriedades recompensadoras e motivação sexual. Além disso, embora a testosterona facilite a AGI de uma fêmea em machos pré-púberes, esse efeito depende se o macho teve ou não exposição prévia a uma fêmea de cio. Talvez surpreendentemente, o tratamento com testosterona diminui a latência e aumenta a duração da AGI apenas em homens pré-puberes sexualmente ingênuos (FIG. 6). Além disso, os machos pré-púberes que tiveram uma experiência anterior com uma mulher apresentam latências AGI muito mais longas e durações de AGI mais curtas do que os machos interagindo com fêmeas receptivas pela primeira vez (FIG. 6). Estes dados sugerem que as interações com uma fêmea de cio são aversivas ao invés de recompensadoras antes da puberdade, eliminando assim quaisquer efeitos facilitadores da testosterona na AGI durante as interações subsequentes com uma fêmea. Seria interessante saber se as conseqüências comportamentais negativas da exposição precoce a uma fêmea de estro persistem na adolescência e na idade adulta, especialmente considerando que a exposição repetida a fêmeas de cio durante adolescência geralmente facilita a expressão do comportamento reprodutivo masculino (Molenda-Figueira, Salas-Ramírez, Schulz, Zehr, Montalto e Sisk, 2007).

FIG. 5
Respostas dopaminérgicas pré-púberes e da área pré-óptica medial do homem adulto (MPOA) a feromônios femininos contidos nas secreções vaginais. Machos adultos apresentam aumentos da atividade dopaminérgica da MPOA com a exposição a secreções vaginais femininas, enquanto que os machos pré-púberes não apresentam respostas dopaminérgicas aumentadas de MPOA a feromônios femininos. (Redesenhado de Schulz, KM, Richardson, HN, Romeu, RD, Morris, JA, Lookingland, KJ e Sisk, CL, 2003).

Embora o tratamento androgênico pré-puberal não possa induzir a cópula, trabalhos recentes de nosso laboratório sugerem que o sistema nervoso do hamster é sensível às ações organizacionais da testosterona sobre o comportamento reprodutivo antes da adolescência (Schulz, Zehr, Salas-Ramirez e Sisk, 2007). Castração mais 19 dias de exposição à testosterona antes ou durante mas não depois da adolescência facilitou o comportamento de montagem quando a testosterona foi substituída na idade adulta. Os machos expostos à testosterona pré-puberal também apresentaram mais intromissões na vida adulta do que os machos expostos à testosterona durante ou após a puberdade (Schulz et al., 2007). Esses dados sugerem que a capacidade da testosterona em organizar circuitos neurais comportamentais diminui com a idade e que a adolescência marca o fim de um período sensível pós-natal prolongado para a exposição à testosterona.
Andrógenos farmacológicos
Os dados precedentes sugerem que os esteróides gonadais endógenos aumentam os comportamentos motivados durante a adolescência. Agora, o que acontece se alguém se auto-administra andrógenos em níveis até concentrações fisiológicas normais de 100x? Este é o problema do abuso de esteróides anabólicos androgênicos (AAS) (revisado em Brower, 2002; Clark e Henderson, 2003). Uma breve digressão é apropriada aqui: todos os AAS são derivados da testosterona, todos os AAS têm um esqueleto de carbono com anéis fundidos 4, a maioria tem carbono 19. AAS são utilizados principalmente para os seus efeitos anabólicos (construção muscular). No entanto, como o nome indica, o AAS também possui propriedades androgênicas. A testosterona é uma escolha lógica em estudos com animais para explorar os mecanismos fundamentais da recompensa dos andrógenos. Ele continua sendo uma escolha popular entre os usuários humanos, na maioria das vezes na forma de ésteres de testosterona de ação prolongada, como o propionato de testosterona. Em 2006, a testosterona foi a substância banida mais comum detectada em testes de urina em laboratórios credenciados pela WADA (WADA, 2006). A testosterona foi responsável pela maior fração (34%) de testes de urina AAS-positivos nos Jogos Olímpicos de Sydney 2000 (Van Eenoo e Delbeke, 2003). Da mesma forma, em testes de urina de usuários de AAS, 41% testou positivo para testosterona (Brower, Catlin, Golpe, Eliopulos, Beresford, 1991). Em doses elevadas, os AAS produzem mudanças comportamentais significativas. Em particular, devido à sua estreita relação com a testosterona, o uso de EAA na adolescência parece perturbar o ambiente esteróide normal do sistema nervoso adolescente humano em desenvolvimento, incluindo a quantidade, o tempo e o tipo de exposição a esteróides.
Tal como acontece com outras drogas ilícitas, o abuso de EAA é um problema da adolescência. De acordo com o Inquérito Nacional às Famílias 1994 sobre o Uso de Drogas (SAMHSA / OAS, 1996), o uso de esteróides atinge o pico no final da adolescência aos 18 anos de idade. Além disso, na pesquisa Monitorando o Futuro (Johnston, O'Malley e Bachman, 2003), a incidência ao longo da vida do uso de esteróides entre os idosos do ensino médio (2.7%) foi comparável à do crack (3.5%) ou heroína (1.4%). O uso de esteróides também é cada vez mais comum em idades mais jovens: 2.5% de estudantes de 8th (13-14 anos) usaram esteróides, semelhante à incidência de crack (2.5%) e uso de heroína (1.6%). Essa tendência em relação ao uso de EAA no início da adolescência é particularmente preocupante em vista das preocupações de que adolescentes possam ser particularmente vulneráveis a abuso de EAA e 1) de que a exposição de adolescentes a EAs em níveis farmacológicos tenha o potencial de alterar substancialmente a maturação normal do cérebro e comportamento para produzir respostas morfológicas e comportamentais exageradas, agudamente e cronicamente.
A agressão inadequada é a resposta comportamental mais frequentemente associada ao abuso de EAA em humanos. Em relatos de casos publicados, o uso de esteróides tem sido implicado em vários assassinatos violentos (Conacher e Workman, 1989; Papa e Katz, 1990; Pope, Kouri, Powell, Campbell e Katz, 1996; Schulte, Hall e Boyer, 1993). Em pesquisas com usuários atuais de EAA, agressividade e irritabilidade elevadas foram os efeitos colaterais comportamentais mais comuns do uso de EAA (Bond, Choi e Pope, 1995; Galligani, Renck e Hansen, 1996; Midgley, Heather e Davies, 2001; Parrott, Choi e Davies, 1994; Perry, Kutscher, Lund, Yates, Holman e Demers, 2003). No entanto, dada a variedade de exposições androgênicas, a variedade de sintomas psiquiátricos e o potencial de disfunção psiquiátrica pré-existente, é difícil determinar o papel preciso dos EAA nesses casos de agressão humana. Os resultados de estudos prospectivos de voluntários humanos recebendo injeções de AAS foram misturados: Tricker e outros (1996) e O'Connor et al (2004) relataram nenhum aumento no comportamento de raiva, enquanto outros estudos observaram aumento da agressão (Daly, Su, Schmidt, Pickar, Murphy e Rubinow, 2001; Hannan, Friedl, Zold, Kettler e Plymate, 1991; Kouri, Lukas, Pope e Oliva, 1995; Papa e Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz e Rubinow, 1993). No entanto, é importante ter em mente que as doses administradas a voluntários humanos são muito menores do que as doses preconizadas em sites de musculação, e a duração do tratamento é geralmente curta. Assim, no final, parece justo concluir que os EAAs têm o potencial de melhorar o comportamento agonístico, pelo menos em indivíduos suscetíveis. Pope et al (1994) descobriram que os EAA provocam sintomas psiquiátricos em indivíduos vulneráveis.
Estudos em animais também forneceram evidências convincentes de agressão induzida por AAS. Hamsters machos adolescentes tratados cronicamente com altas doses de esteróides têm latências de ataque mais curtas e um maior número de ataques e mordidas em relação a um intruso masculino em comparação com machos não tratados (Harrison, Connor, Nowak, Nash e Melloni, 2000; Melloni, Connor, Hang, Harrison e Ferris, 1997). Da mesma forma, uma provocação leve (cauda-pinça) produz um aumento persistente na agressão em ratos machos adolescentes, incluindo a agressão contra as fêmeas (Cunningham e McGinnis, 2006). De maior preocupação, a exposição de adolescentes a AAS em hamsters causa aumentos duradouros no comportamento agonístico que persistem após o uso de esteróides ser interrompido (Grimes e Melloni, 2006). Essas alterações comportamentais são acompanhadas por uma remodelação duradoura dos circuitos neurais no hipotálamo anterior. Em particular, a exposição do adolescente AAS em hamsters aumenta a arginina vasopressina (AVP, Grimes e Melloni, 2006) e regula negativamente a serotonina e os receptores serotoninérgicos 5HT1A e 5HT1B (Ricci, Rasakham, Grimes e Melloni, 2006). Não é de surpreender que os AAS também alterem os níveis cerebrais de RA. A exposição crônica a testosterona ou nandrolona aumenta a AR nuclear de células em ratos machos (Menard e Harlan, 1993; Wesson e McGinnis, 2006). Assim, existe o potencial de AAS para melhorar os comportamentos dependentes de andrógenos, tanto pela suplementação de andrógenos endógenos quanto pelo aumento da responsividade androgênica via expressão aumentada de AR.
Comparado com o comportamento agonístico, o AAS tem um efeito menos marcado no comportamento de acasalamento em roedores machos, e a resposta depende do esteróide particular usado (revisto em Clark e Henderson, 2003). Em hamsters machos consumindo testosterona em soluções orais, as ejaculações aumentaram de uma maneira dependente da dose (Wood, 2002). No entanto, nem a testosterona nem o nandrolona aumentaram o acasalamento em ratos machos adolescentes. O estanozolol, um AAS relativamente menos potente com atividade androgênica mínima, na verdade inibiu tanto o acasalamento quanto a agressão (Farrell e McGinnis, 2003), presumivelmente pela redução dos níveis androgênicos endógenos.
É particularmente importante notar que os hamsters adolescentes e adultos podem apresentar diferentes respostas comportamentais à exposição ao EAA. Enquanto o AAS acentuou acentuadamente o comportamento agonístico em adolescentes do sexo masculino, o mesmo tratamento na vida adulta produziu apenas um modesto aumento no comportamento agressivo e reduziu significativamente o comportamento sexual (Salas-Ramirez, Montaldo e Sisk, 2008). Isso é consistente com o conceito de adolescência como um período sensível para a ação androgênica. Além disso, assim como os hamsters machos adultos adquirem tolerância à testosterona exógena (Peters e Wood, 2005acreditamos que os machos em desenvolvimento adquirem tolerância à testosterona à medida que amadurecem. Assim, os efeitos da alteração do EAA no desenvolvimento do adolescente e a exposição do adolescente AAS podem causar padrões excessivos de comportamento agressivo e sexual que podem persistir até a idade adulta.
Reforçar os efeitos dos andrógenos
Acasalamento e luta são recompensadores (pelo menos se você ganhar a luta). Ratos machos pressionarão uma alavanca repetidamente para copular com uma fêmea (Everitt e Stacey, 1987). Da mesma forma, camundongos machos e hamsters fêmeas formarão uma preferência de lugar condicionada (CPP) para locais onde eles já venceram as lutas (Martinez, Guillen-Salazar, Salvador e Simon, 1995; Meisel e Joppa, 1994). Se o AAS puder melhorar os comportamentos sociais recompensadores acima dos níveis normalmente observados nos machos intactos das gônadas, é lógico esperar que a própria testosterona possa ser recompensadora. Isto foi testado usando dois modelos animais bem estabelecidos para recompensa e reforço: CPP e autoadministração. Os resultados destes estudos demonstram que a testosterona está reforçando em um contexto experimental onde os efeitos anabólicos e o desempenho atlético são irrelevantes. Com o CPP, a substância de teste é repetidamente emparelhada com um ambiente único (por exemplo, uma câmara particular no aparelho de teste). Uma vez que o animal associa a substância de teste de reforço a esse ambiente, ele procurará o ambiente mesmo na ausência de recompensa. Os primeiros relatos de recompensa de andrógenos em animais de laboratório usaram injeções sistêmicas de testosterona para induzir CPP em camundongos machos (Arnedo, Salvador, Martinez-Sanchis e Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis e Pellicer, 2002) e ratos (Alexander, Packard e Hines, 1994; de Beun, Jansen, Slangen e Van de Poll, 1992). Posteriormente, nosso laboratório utilizou a autoadministração de testosterona para demonstrar o reforço andrógeno (Johnson e Wood, 2001). Descobrimos que hamsters machos consomem voluntariamente soluções orais de testosterona usando tanto os testes 2 de escolha de mamadeira quanto o consumo induzido por alimentos. Em estudos posteriores, demonstramos auto-administração intravenosa em ratos e hamsters machos (Wood, Johnson, Chu, Schad e Self, 2004). A administração intravenosa elimina potenciais efeitos confusionais do paladar ou do preenchimento intestinal na ingestão de andrógenos.
No contexto do abuso de EAA, é importante diferenciar entre os efeitos centrais e periféricos dos andrógenos. Como a testosterona tem efeitos generalizados em todo o corpo, pode-se argumentar que a recompensa e o reforço com injeções sistêmicas de testosterona são secundários às ações anabólicas e androgênicas sistêmicas da testosterona. Em outras palavras, talvez a testosterona reduza a fadiga muscular e melhore a função das articulações de modo que os animais sentir Melhor. De fato, essa explicação tem sido usada na literatura clínica (embora sem evidência experimental) para argumentar contra o potencial de dependência e dependência de EAA (DiPasquale, 1998). No entanto, Packard et al (Packard, Cornell e Alexander, 1997) mostrou que injeções de testosterona diretamente no cérebro de ratos podem induzir CPP. Da mesma forma, nosso laboratório demonstrou autoadministração intracerebroventricular (icv) de testosterona em hamsters machos (Wood et al., 2004). A CPP intracerebral e a autoadministração icv com testosterona defendem os alvos centrais mediadores do reforçamento andrógeno.
É notável que o reforço de testosterona não siga necessariamente os mesmos mecanismos previamente estabelecidos para efeitos esteroides no comportamento sexual. Como discutido anteriormente, o MPOA é um local chave para a organização do comportamento sexual de roedores masculinos (Casco, Meisel e Sachs, 2002). Em hamsters, o MPOA possui abundantes receptores de esteróides e os implantes de testosterona no MPOA restauram a atividade sexual em castrados de longa duração (Wood e Swann, 1999). O tempo de duração destes efeitos esteróides é lento: o comportamento de montagem persiste durante semanas após a orquidectomia, e a exposição esteroidal prolongada é necessária para restaurar o acasalamento em castrados de longa duração (Nobre e Alsum, 1975). No entanto, injeções de testosterona em MPOA de ratos machos falham em induzir CPP (King, Packard e Alexander, 1999). Isso sugere que outras regiões do cérebro são importantes para o reforço de andrógenos.
Em contraste, ratos machos irão formar um CPP para injeções de testosterona em Acb (Packard e outros, 1997). Tal como com outros fármacos de abuso, a DA é provavelmente um neurotransmissor chave para o reforço da testosterona: a CPP induzida pela injeção sistémica de testosterona é bloqueada pelos antagonistas do receptor de dopamina D1 e D2 (Schroeder e Packard, 2000). No entanto, ao contrário de outras drogas de abuso, nossos estudos em hamsters sugerem que a testosterona não induz a liberação de Acb DA (Triemstra, Sato e Wood, na imprensa). Da mesma forma, estudos em ratos machos mostram que os andrógenos não têm efeito sobre os níveis basais de DA ou liberação de DA estimulada por anfetamina (Birgner, Kindlundh-Hogberg, Nyberg e Bergstrom, 2006; mas também veja Clark, Lindenfeld e Gibbons, 1996). Além disso, a testosterona exerce uma influência relativamente pequena nos níveis teciduais de Acb DA (Thiblin, Finn, Ross e Stenfors, 1999). Juntos, esses dados sugerem que, embora o reforço da testosterona possa, em última instância, alterar a atividade da AD em Acb, os mecanismos podem ser distintos daqueles da cocaína ou de outros estimulantes. A este respeito, dados recentes sugerem que a exposição crônica a AAS pode alterar a sensibilidade ao DA pela alteração do metabolismo do DA (Kurling, Kankaanpaa, Ellermaa, Karila e Seppala, 2005), níveis de receptores DA (Kindlundh, Lindblom, Bergstrom, Wikberg e Nyberg, 2001; Kindlundh, Lindblom e Nyberg, 2003) ou o transportador DA (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom e Nyberg, 2002).
Atualmente, os sinais, receptores e locais cerebrais de ação específicos para o reforço de testosterona são desconhecidos. Com base em um estudo recente de hamsters do nosso laboratório, os efeitos de reforço da testosterona parecem ser mediados por andrógenos e estrogênios (DiMeo e Wood, 2006). AAS comumente utilizados incluem andrógenos aromatizáveis e não aromatizáveis (Gallaway, 1997; WADA, 2006). Isto implica que tanto o AR como o ER podem transduzir estímulos esteróides para recompensa. Existe a possibilidade adicional de que o reforço de testosterona possa ser mediado por uma combinação de receptores clássicos e não genômicos.
Diversas linhas de evidência apontam para a ação de receptores não genômicos nos efeitos reforçadores de AAS. Além da distribuição esparsa de AR em Acb e VTA, o curso de tempo do reforço androgênico é rápido (<30 min), e o processamento do sinal por meio do AR clássico pode não ser rápido o suficiente para o reforço. Assim, para testar o papel do AR não genômico no reforço de AAS, utilizamos duas técnicas complementares (FIG. 7). Em um experimento (Sato, Johansen, Jordan e Wood, 2006), permitimos que ratos com a mutação de feminização testicular (Tfm, ver esta edição) auto-administrassem a diidrotestosterona (DHT), um andrógeno não aromatizável. A mutação Tfm diminui grandemente a ligação do ligante em AR. No entanto, os ratos Tfm e seus irmãos do sexo masculino se auto-administraram aproximadamente a mesma quantidade de DHT. Isto argumenta para os efeitos não genômicos da DHT. Em um estudo subseqüente, determinamos se hamsters machos poderiam se auto-administrar DHT conjugado com albumina de soro bovino (BSA, FIG. 8, Sato e Madeira, 2007). Os conjugados de DHT-BSA são impermeáveis à membrana; assim, seus efeitos são limitados à superfície da célula. Hamsters auto-administrados DHT, como demonstrado anteriormente (DiMeo e Wood, 2006). Eles mostraram uma preferência semelhante pelos conjugados de DHT-BSA, mas não conseguiram auto-administrar BSA sozinho.

FIG. 7
Esses dados apontam para um papel central para ARs da superfície celular no reforço andrógeno. Atualmente, a natureza exata de tais receptores não é conhecida. Tem sido sugerido que os andrógenos podem atuar na superfície da célula através da ligação à membrana AR dedicada (Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff e Doughty, 2006, veja também esta edição). Isso pode ser na forma de RA clássica extra-nuclear, conforme relatado no hipocampo (Sarkey et al., Nesta edição). Alternativamente, estudos anteriores também descreveram locais de ligação a esteróides em outros sistemas de neurotransmissores. Especificamente, uma variedade de hormônios esteróides, incluindo AAS, pode modular alostericamente o receptor GABA-A (Henderson, 2007; Lambert, Belelli, Peden, Vardy e Peters, 2003). Da mesma forma, os neuroesteróides sulfatados podem modificar a atividade de N-Metil-Dsubtipos de receptores asparticosMalayev, Gibbs e Farb, 2002) receptores. Esta é uma área importante para futuras pesquisas.
Por que deveria haver uma membrana AR? Como discutido anteriormente, existe uma estreita associação entre a secreção de andrógenos e recompensar os comportamentos sociais. Podemos especular que o aumento na secreção de testosterona que segue o acasalamento ou a luta serve para reforçar o comportamento. Se assim for, é necessário ter um rápido acoplamento de estímulo (comportamento) e recompensa (testosterona). Isto pode ser melhor conseguido através da ligação à membrana AR. A este respeito, seria interessante determinar se o clampeamento da secreção de andrógenos durante o acasalamento reduz os efeitos recompensadores do comportamento sexual.
Resumo
Aqui revisamos as evidências de que os andrógenos são mediadores potentes de comportamentos adultos motivados e, além disso, que o momento da exposição ao androgênio durante os programas de desenvolvimento motivou o comportamento dependente de andrógenos na vida adulta. Os esteróides anabolizantes estão rapidamente se tornando uma droga favorita de abuso por adolescentes nos EUA. Embora o AAS possa não ter a potência viciante da cocaína ou da heroína, estamos apenas começando a entender o potencial de reforço e dependência de andrógenos. Em particular, à medida que os esportes juvenis se tornam mais competitivos, há uma crescente pressão no desenvolvimento de atletas para o uso de esteróides, começando em idades mais jovens. Essa tendência é preocupante em vista de novas evidências de maturação neural sensível a esteróides em adolescentes.
Apesar do aumento da conscientização tanto pelas comunidades públicas quanto pelas científicas das profundas mudanças neurais que acompanham a adolescência, o estudo experimental da neurobiologia do desenvolvimento da puberdade tem sido limitado. Modelos animais de desenvolvimento de adolescentes são necessários para investigar como o momento da exposição hormonal durante o desenvolvimento aumenta o risco individual de psicopatologia e uso de drogas, e que tipos de experiências mitigam ou amplificam os efeitos comportamentais de desvios no tempo de puberdade. Por exemplo, fatores sociais, como a influência dos pares, exacerbam os efeitos do tempo da puberdade para uso de substâncias e álcool (Biehl, Natsuaki e Ge, 2007; Patton, Novy, Lee e Hickok, 2004; Simons-Morton e Haynie, 2003; Wichstrom e Pedersen, 2001). Modelos animais de tempo de puberdade também informarão os esforços de pesquisa em humanos, e potencialmente levarão a intervenções terapêuticas mais efetivas durante a adolescência.
Agradecimentos
Agradecemos a Eleni Antzoulatos, a Cortney Ballard, a Lucy Chu, a Kelly Peters, a Jennifer Triemstra, a Jane Venier, a Lisa Rogers e a Pamela Montalto pela assistência nesses estudos. Este trabalho apoiado por subvenções do NIH (DA12843 para RIW, MH68764 para CLS e MH070125 para KMS).
Notas de rodapé
Isenção de responsabilidade do editor: Este é um arquivo PDF de um manuscrito não editado que foi aceito para publicação. Como um serviço aos nossos clientes, estamos fornecendo esta versão inicial do manuscrito. O manuscrito será submetido a edição de texto, formatação e revisão da prova resultante antes de ser publicado em sua forma final citável. Observe que, durante o processo de produção, podem ser descobertos erros que podem afetar o conteúdo, e todas as isenções legais que se aplicam ao periódico pertencem a ele.
Referências
- Alexander GM, Packard MG e Hines M. Testosterone têm propriedades afetivas recompensadoras em ratos machos: implicações para a base biológica da motivação sexual. Neurociência Comportamental. 1994;108: 424 – 8. [PubMed]
- Andersen SL. Trajetórias do desenvolvimento do cérebro: ponto de vulnerabilidade ou janela de oportunidade? Neuroscience & Biobehavioral Reviews. 2003;27: 3 – 18. [PubMed]
- Andersen SL, Rutstein M. Benzo JM, Hostetter JC, Teicher MH. Diferenças sexuais na superprodução e eliminação de receptores de dopamina. Neuroreport. 1997;8: 1495 – 8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Propriedades recompensadoras de testosterona em camundongos machos intactos: um estudo piloto. Pharmacology, Biochemistry & Behavior. 2000;65: 327 – 32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Efeitos semelhantes de recompensa da testosterona em camundongos classificados como indivíduos de latência de ataque de curta e longa duração. Biologia do Vício. 2002;7: 373 – 9. [PubMed]
- Arnold AP, Breedlove SM. Efeitos organizacionais e ativadores de esteróides sexuais no cérebro e comportamento: uma reanálise. Hormônios e comportamento. 1985;19: 469 – 98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Convergência e plasticidade de sistemas monoaminérgicos no córtex pré-frontal medial durante o período pós-natal: implicações para o desenvolvimento da psicopatologia. Córtex cerebral. 2000;10: 1014 – 27. [PubMed]
- Benes FM, Tartaruga M, Khan Y, Farol P. Mielinização de uma zona chave de revezamento na formação do hipocampo ocorre no cérebro humano durante a infância, adolescência e idade adulta. Arquivos da psiquiatria geral. 1994;51: 477 – 84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. A influência do tempo puberal sobre o uso de álcool e trajetórias de consumo pesado. Jornal da Juventude e Adolescência. 2007;36: 153 – 167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F., Bergstrom L. Cartas de neurociência. 2006. Níveis extracelulares alterados de DOPAC e HVA na casca do núcleo accumbens de rato em resposta à administração sub-crónica de nandrolona e um subsequente desafio com anfetamina.
- Bond AJ, Choi PY, Papa HG, Jr. Avaliação do viés de atenção e humor em usuários e não usuários de esteróides anabólicos androgênicos. Dependência de drogas e álcool. 1995;37: 241 – 5. [PubMed]
- Brower KJ. Abuso e dependência de esteróides anabolizantes. Relatórios atuais de psiquiatria. 2002;4: 377 – 87. [PubMed]
- Brower KJ, Catlin DH, Sopro FC, Eliopulos GA, Beresford TP. Avaliação clínica e testes de urina para abuso e dependência de esteróides anabólicos androgênicos. American Journal of Drug & Alcohol Abuse. 1991;17: 161 – 171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Metabolismo de esteróides no cérebro de mamíferos: 5alfa-redução e aromatização. Boletim de Pesquisa do Cérebro. 1997;44: 365 – 75. [PubMed]
- Chung WC, De Vries GJ e Swaab DF. A diferenciação sexual do núcleo do leito da estria terminal em humanos pode se estender até a idade adulta. Journal of Neuroscience. 2002;22: 1027 – 33. [PubMed]
- Clark AS, Henderson LP. Respostas comportamentais e fisiológicas aos anabólicos esteróides androgênicos. Neuroscience & Biobehavioral Reviews. 2003;27: 413 – 36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Esteróides androgênicos anabólicos e recompensa cerebral. Pharmacology, Biochemistry & Behavior. 1996;53: 741 – 5.
- GN Conacher, DG Workman. Crime violento possivelmente associado ao uso de esteróides anabolizantes. Jornal americano da psiquiatria. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis meu. A provocação física de ratos machos expostos a esteróides androgênicos anabolizantes pubertais provoca agressividade para as fêmeas. Hormônios e comportamento. 2006;50: 410 – 6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Alterações no líquido cefalorraquidiano e no comportamento após administração de metiltestosterona: achados preliminares. Arquivos da psiquiatria geral. 2001;58: 172 – 7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Os dimorfismos sexuais estruturais no núcleo periventricular ântero-ventral do hipotálamo de rato são sensíveis aos esteróides gonadais por via perinatal, mas se desenvolvem peripubertalmente. Neuroendocrinologia. 1996;63: 142 – 8. [PubMed]
- de Beun R, Jansen E, JL Slangen, NE de Van de Poll. Testosterona como estímulo apetitivo e discriminativo em ratos: efeitos dependentes de sexo e dose. Fisiologia e comportamento. 1992;52: 629 – 34. [PubMed]
- Dekaban AS. Alterações nos pesos cerebrais durante o período da vida humana: relação dos pesos cerebrais com as alturas do corpo e os pesos corporais. Anais de Neurologia. 1978;4: 345 – 56. [PubMed]
- Di Chiara G, Imperato A. Drogas abusadas por seres humanos aumentam preferencialmente as concentrações sinápticas de dopamina no sistema mesolímbico de ratos que se movimentam livremente. Anais da Academia Nacional de Ciências dos Estados Unidos da América. 1988;85: 5274 – 8. [Artigo gratuito do PMC] [PubMed]
- DiMeo AN, Wood RI. Auto-administração de estrogênio e diidrotestosterona em hamsters machos. Hormônios e comportamento. 2006;49: 519 – 26. [PubMed]
- DiPasquale M. Esteróides Anabolizantes. Em: Tarter RE, Ammerman RT, Ott PJ, editores. Manual de Abuso de Substâncias. Plenum Press; NY: 1998. pp. 547 – 565.
- Dominguez J, Riolo JV, Xu Z, casco EM. Regulação pela amígdala medial da cópula e liberação pré-óptica medial de dopamina. Journal of Neuroscience. 2001;21: 349 – 355. [PubMed]
- Dominguez JM, Hull EM. Estimulação da amígdala medial aumenta a liberação de dopamina pré-óptica medial: implicações para o comportamento sexual de ratos machos. Pesquisa do cérebro. 2001;917: 225 – 229. [PubMed]
- Du J, Lorrain DS, Hull EM. A castração diminui o extracelular, mas aumenta a dopamina intracelular na área pré-óptica medial de ratos machos. Pesquisa do cérebro. 1998;782: 11 – 17. [PubMed]
- Eckenhoff MF, Rakic P. Natureza e destino de células proliferativas no giro denteado hipocampal durante a vida útil do macaco rhesus. Journal of Neuroscience. 1988;8: 2729 – 47. [PubMed]
- Everitt BJ, Stacey P. Estudos do comportamento instrumental com reforço sexual em ratos machos (Rattus norvegicus): II. Efeitos de lesões na área pré-óptica, castração e testosterona. Jornal de Psicologia Comparada. 1987;101: 407 – 19. [PubMed]
- Gallaway S. A Bíblia esteróide Belle International Press; Sacramento, CA: 1997.
- Galligani N, Renck A, Hansen S. Perfil de personalidade de homens que usam esteróides androgênicos anabólicos. Hormônios e comportamento. 1996;30: 170 – 5. [PubMed]
- Grimes JM, Melloni RH, Jr. Alterações prolongadas no sistema neural da serotonina após a cessação da exposição de esteróides anabólicos androgênicos adolescentes em hamsters (Mesocricetus auratus) Neurociência Comportamental. 2006;120: 1242 – 51. [PubMed]
- Hannan CJ, Jr., Friedl KE, Zold A, Kettler TM, Plymate SR. Alterações psicológicas e séricas de ácido homovanílico em homens que receberam esteróides androgênicos. Psiconeuroendocrinologia. 1991;16: 335 – 43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K e Melloni RH., Jr O tratamento anabólico androgênico esteróide crônico durante a adolescência aumenta a vasopressina hipotalâmica anterior e a agressão em hamsters intactos. Psiconeuroendocrinologia. 2000;25: 317 – 38. [PubMed]
- Ele J, tripulações FT. A neurogênese diminui durante a maturação do cérebro da adolescência para a idade adulta. Pharmacology, Biochemistry & Behavior. 2007;86: 327 – 33.
- Henderson LP. Modulação de esteróides da transmissão mediada por receptores GABAA no hipotálamo: efeitos sobre a função reprodutiva. Neurofarmacologia. 2007;52: 1439 – 53. [Artigo gratuito do PMC] [PubMed]
- Casco EM, Du J, Lorrain DS, Matuszewich L. Dopamina extracelular na área pré-óptica medial: implicações para a motivação sexual e controle hormonal da cópula. Journal of Neuroscience. 1995;15: 7465 – 7471. [PubMed]
- Casco EM, Meisel RL, Sachs BD. Comportamento sexual masculino Em: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, editores. Hormônios, Cérebro e Comportamento. Imprensa Acadêmica; Nova Iorque: 2002. pp. 3 – 137.
- Casco EM, Wood RI, McKenna KE. Neurobiologia do comportamento sexual masculino. Em: Neill JD, editor. Fisiologia da Reprodução. Vol. 1. Elsevier Press; Nova Iorque: 2006. pp. 1729 – 1824.
- Huttenlocher PR, Dabholkar AS. Diferenças regionais na sinaptogênese no córtex cerebral humano. Jornal de Neurologia Comparativa. 1997;387: 167 – 78. [PubMed]
- Johnson LR, Wood RI. Autoadministração oral de testosterona em hamsters machos. Neuroendocrinologia. 2001;73: 285 – 92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Alunos do ensino secundário (NIH Publication No. 03 – 5375) I. Bethesda, MD: Instituto Nacional sobre Abuso de Drogas; 2003. Monitorando o Futuro os resultados da pesquisa nacional sobre o uso de drogas, 1975-2002.
- Fundação da Família Kaiser. Atividade sexual adolescente nos EUA. 2005. págs. # 3040 – 02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Regulação da imunorreatividade do receptor androgênico cerebral por andrógenos em furões machos pré-púberes. Biologia da Reprodução. 1995;52: 1198 – 205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M., Blomqvist G, Langstrom B, Nyberg F. Efeitos dopaminérgicos após tratamento crônico com nandrolona visualizado em cérebro de ratos por tomografia por emissão de pósitrons. Progress in NeuroPsychopharmacology & Biological Psychiatry. 2002;26: 1303 – 8.
- Kindlundh AM, Lindblom J, L Bergstrom, Wikberg JE, Nyberg F. O decanoato de nandrolona esteróide anabólico androgênico afeta a densidade de receptores de dopamina no cérebro de ratos machos. Revista Européia de Neurociência. 2001;13: 291 – 6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. A administração crônica com decanoato de nandrolona induz alterações no conteúdo do transcrito gênico dos receptores de dopamina D (1) - e D (2) no cérebro de ratos. Pesquisa do cérebro. 2003;979: 37 – 42. [PubMed]
- Rei BE, Packard MG, Alexander GM. Propriedades afetivas de injeções intra-mediais de testosterona em áreas pré-ópticas em ratos machos. Cartas de neurociência. 1999;269: 149 – 52. [PubMed]
- Koob GF, Nestler EJ. A neurobiologia da dependência de drogas. Journal of Neuropsychiatry & Clinical Neurosciences. 1997;9: 482 – 97. [PubMed]
- Kouri EM, Lukas SE, Papa HG, Jr., Oliva PS. Resposta agressiva aumentada em voluntários do sexo masculino após a administração de doses gradualmente crescentes de cipionato de testosterona. Dependência de drogas e álcool. 1995;40: 73 – 9. [PubMed]
- Kritzer MF. A gonadectomia a longo prazo afeta a densidade dos axônios imunorreativos à tirosina hidroxilase - mas não à dopamina beta-hidroxilase, colina acetiltransferase ou serotonina nos córtices pré-frontais mediais de ratos machos adultos. Córtex cerebral. 2003;13: 282 – 296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, T Karila, Seppala T. O efeito do tratamento sub-crônico decanoato de nandrolona em sistemas neuronais dopaminérgicos e serotoninérgicos no cérebro de ratos. Pesquisa do cérebro. 2005;1044: 67 – 75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Modulação neuroesteróide de receptores GABAA. Progresso na neurobiologia. 2003;71: 67 – 80. [PubMed]
- Lenroot RK, Giedd JN. Desenvolvimento cerebral em crianças e adolescentes: insights da ressonância magnética anatômica. Neuroscience & Biobehavioral Review. 2006;30: 718 – 29.
- Lesting J, Neddens J, Teuchert-Noodt G. Ontogenia da inervação da dopamina no nucleus accumbens dos gerbilos. Pesquisa do cérebro. 2005;1066: 16 – 23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. A inibição da resposta de NMDA pelo sulfato de pregnenolona revela modulação seletiva de subtipo de receptores NMDA por esteróides sulfatados. British Journal of Pharmacology. 2002;135: 901 – 9. [Artigo gratuito do PMC] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM. Agressão intermale bem sucedida e preferência de lugar condicionada em ratos. Fisiologia e comportamento. 1995;58: 323 – 8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Ações da testosterona em hamsters machos pré-púberes e pós-púberes: dissociação de efeitos no comportamento reprodutivo e na imunorreatividade do receptor androgênico cerebral. Hormônios e comportamentos. 1997;31: 75 – 88.
- Meisel RL, Joppa MA. Preferência de lugar condicionada em hamsters femininos depois de encontros agressivos ou sexuais. Fisiologia e comportamento. 1994;56: 1115 – 8. [PubMed]
- Melloni RH, Jr., Connor DF, Pendure PT, Harrison RJ, Ferris CF. Exposição a esteróides anabólicos androgênicos durante a adolescência e comportamento agressivo em hamsters dourados. Fisiologia e Comportamento. 1997;61: 359 – 64. [PubMed]
- Menard C, Harlan R. Up-regulação da imunorreatividade do receptor de androgênio no cérebro de ratos por esteróides anabolizantes androgênicos. Pesquisa do cérebro. 1993;622: 226 – 236. [PubMed]
- Mermelstein PG, Becker JB, DJ Surmeier. O estradiol reduz as correntes de cálcio nos neurônios neoestriais de ratos através de um receptor de membrana. Journal of Neuroscience. 1996;16: 595 – 604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Níveis de agressão entre um grupo de usuários de esteróides anabólicos androgênicos. Medicina, Ciência e Direito. 2001;41: 309 – 14.
- Molenda-Figueira, HN, Salas-Ramirez, KY, Schulz, KM, Zehr, JL, Montalto, PR, Sisk, CL. A experiência social adolescente restaura o comportamento ejaculatório de adultos em hamsters sírios machos sem testosterona na puberdade. Sociedade de Neuroendocrinologia Comportamental; Pacific Grove, CA: 2007.
- Noble RG, Alsum PB. Dimorfismos sexuais dependentes de hormônios no hamster dourado (Mesocricetus auratus) Fisiologia e comportamento. 1975;14: 567 – 74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Morte celular no desenvolvimento do córtex posterior em ratos machos e fêmeas. Jornal de Neurologia Comparativa. 2001;436: 32 – 41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Hormônios ovarianos após o dia pós-natal 20 reduzem o número de neurônios no córtex visual primário de ratos. Jornal de Neurobiologia. 2002;52: 312 – 21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Efeitos da testosterona no humor, agressividade e comportamento sexual em homens jovens: um estudo duplo-cego, controlado por placebo, cruzado. Journal of Clinical Endocrinology & Metabolism. 2004;89: 2837 – 45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Recompensando propriedades afetivas de injeções intra-nucleus accumbens de testosterona. Neurociência Comportamental. 1997;111: 219 – 24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. O ARNm de GnRH aumenta com a puberdade no cérebro de hamster sírio masculino. Jornal de neuroendocrinologia. 1999;11: 621 – 7. [PubMed]
- Parrott AC, Choi PY, Davies M. Uso de esteróides anabolizantes por atletas amadores: efeitos sobre estados de humor psicológicos. Journal of Sports Medicine & Physical Fitness. 1994;34: 292 – 8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. O diagnóstico e o resultado reprodutivo após o tratamento cirúrgico do útero septado completo, cérvix duplicado e septo vaginal. American Journal of Obstetrics & Gynecology. 2004;190: 1669 – 75. 1675 – 8. [PubMed]
- Paus T, Collins DL, Evans AC, G Leonard, Pike B, Zijdenbos A. Maturação da matéria branca no cérebro humano: uma revisão de estudos de ressonância magnética. Boletim de Pesquisa do Cérebro. 2001;54: 255 – 66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, TL Holman, Demers L. Medidas de agressão e alterações de humor em levantadores de peso masculinos com e sem o uso de esteróides anabolizantes androgênicos. Jornal de Ciências Forenses. 2003;48: 646 – 51. [PubMed]
- Peters KD, Wood RI. Dependência de andrógenos em hamsters: overdose, tolerância e potenciais mecanismos opioidérgicos. Neurociência. 2005;130: 971 – 81. [PubMed]
- Pfaus JG, Damsma G, GG Nomikos, Wenkstern DG, CD Blaha, Phillips AG, Fibiger HC. O comportamento sexual aumenta a transmissão central de dopamina no rato macho. Pesquisa do cérebro. 1990;530: 345 – 348. [PubMed]
- Fênix CH, Goy RW, Gerall AA, Jovem WC. Ação de organização do propionato de testosterona administrado no período pré-natal sobre os tecidos mediando o comportamento de acasalamento na cobaia fêmea. Endocrinologia. 1959;65: 369 – 82. [PubMed]
- Pinos H, Collado P, M Rodriguez-Zafra, Rodriguez C, S Segovia, Guillamon A. O desenvolvimento de diferenças entre os sexos no locus coeruleus do rato. Boletim de Pesquisa do Cérebro. 2001;56: 73 – 8. [PubMed]
- Papa HG, Jr, Katz DL. Homicídio e quase-homicídio por usuários de esteróides anabolizantes [ver comentário] Jornal de psiquiatria clínica. 1990;51: 28 – 31. [PubMed]
- Papa HG, Jr, Katz DL. Efeitos psiquiátricos e médicos do uso de esteróides anabólicos androgênicos. Um estudo controlado de atletas 160. Arquivos da psiquiatria geral. 1994;51: 375 – 82. [PubMed]
- Papa HG Jr., Kouri EM, Powell KF, Campbell C, Katz DL. Uso de esteróides anabólicos androgênicos entre os presos da 133. Psiquiatria Abrangente. 1996;37: 322 – 7. [PubMed]
- Putnam SK, J Du, Sato S, Hull EM. A restauração de testosterona do comportamento copulatório correlaciona-se com a liberação de dopamina pré-óptica medial em ratos machos castrados. Hormônios e comportamento. 2001;39: 216 – 224. [PubMed]
- Putnam SK, Sato S e Hull EM. Efeitos de metabólitos de testosterona na copulação e liberação medial de dopamina pré-óptica em ratos machos castrados. Hormônios e comportamento. 2003;44: 419 – 26. [PubMed]
- Putnam SK, Sato S e Riolo JV, Hull EM. Efeitos dos metabólitos da testosterona na copulação, dopamina pré-óptica medial e imunorreatividade da NOS em ratos machos castrados. Hormônios e comportamento. 2005;47: 513 – 522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, ED Giles, Fisher KR. Neurogênese pós-natal no núcleo contendo vasopressina e oxitocina do hipotálamo de porco. Pesquisa do cérebro. 2003;971: 189 – 96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH, Jr. A atividade e expressão do receptor Serotonina-1A modulam a agressão induzida por esteroides anabólicos / androgênicos em adolescentes hamsters. Pharmacology, Biochemistry & Behavior. 2006;85: 1 – 11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. A dihidrotestosterona ativa o comportamento sexual em hamsters machos adultos, mas não em juvenis. Fisiologia e comportamento. 2001;73: 579 – 84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Imunorreatividade do receptor estrogênico em hamsters sírios pré-púberes e adultos. Cartas de neurociência. 1999;265: 167 – 70. [PubMed]
- Romeo RD, DB Parfitt, Richardson HN, Sisk CL. Os feromônios provocam níveis equivalentes de imunorreatividade de Fos em hamsters sírios pré-púberes e adultos. Hormônios e comportamento. 1998;34: 48 – 55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Puberdade e maturação do cérebro masculino e comportamento sexual: reformulando um potencial comportamental. Neuroscience & Biobehavioral Reviews. 2002a;26: 381 – 91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. O estradiol induz receptores de progesterona hipotalâmicos, mas não ativa o comportamento de acasalamento em hamsters machos (Mesocricetus auratus) antes da puberdade. Neurociência Comportamental. 2002b;116: 198 – 205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Esteróides androgênicos anabólicos (AAS) afetam diferencialmente comportamentos sociais em hamsters sírios adolescentes e adultos do sexo masculino. Hormônios e comportamento. 2008 na imprensa.
- SAMHSA / OEA. Publicação DHHS Não (SMA) 1996. 1994 Inquérito Domiciliar Nacional sobre Abuso de Drogas, Principais Resultados 1994; pp. 96 – 3085.
- SAMHSA / OEA. Resultados da Pesquisa Nacional 2004 sobre Uso de Drogas e Saúde: Resultados Nacionais. 2005. Série NSDUH H-28, Publicação DHHS No. SMA 05 – 4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Autoadministração de andrógenos em ratos Tfm. 10th Encontro Anual da Sociedade de Neuroendocrinologia Comportamental.2006.
- Sato SM, Wood RI. Autoadministração de esteróides androgênicos anabólicos impermeáveis à membrana (aas) em hamsters sírios. 11th Encontro Anual da Sociedade de Neuroendocrinologia Comportamental.2007.
- Schroeder JP, Packard MG. Papel dos subtipos de receptores de dopamina na aquisição de uma preferência de testosterona condicionada em ratos. Cartas de neurociência. 2000;282: 17 – 20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Violência doméstica associada ao abuso de esteróides anabolizantes. Jornal americano da psiquiatria. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Silva DA, Albers HE, Sisk CL. A exposição ao hormônio testicular durante a adolescência organiza o comportamento de marcação de flanco e a ligação do receptor de vasopressina no septo lateral. Hormônios e comportamento. 2006;50: 477 – 83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. Respostas dopaminérgicas da área pré-óptica medial aos feromônios femininos desenvolvem-se durante a puberdade no hamster sírio masculino. Pesquisa do cérebro. 2003;988: 139 – 45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Os hormônios gonadais masculinizam e defeminizam comportamentos reprodutivos durante a puberdade no hamster sírio masculino. Hormônios e comportamento. 2004;45: 242 – 9. [PubMed]
- Schulz KM, Sisk CL. Hormônios puberais, o cérebro adolescente e o amadurecimento dos comportamentos sociais: Lições do hamster sírio. Endocrinologia Molecular e Celular. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Planejador de reuniões em neurociência. Sandiego, CA: Society for Neuroscience; 2007. A adolescência é um segundo período sensível para os efeitos organizadores da testosterona no comportamento reprodutivo masculino adulto? 2007 Online.
- Scott JP, Stewart JM, De Ghett VJ. Períodos críticos na organização dos sistemas. Psicobiologia do Desenvolvimento. 1974;7: 489 – 513. [PubMed]
- Shughrue PJ, MV Lane, Merchenthaler I. Distribuição comparativa de receptor de estrogênio-alfa e beta-mRNA no sistema nervoso central do rato. Jornal de Neurologia Comparativa. 1997;388: 507 – 25. [PubMed]
- Simons-Morton BG, Haynie DL. Preditores psicossociais do aumento do tabagismo entre escolares do sexto ano. American Journal of Health Behavior. 2003;27: 592 – 602. [PubMed]
- Sisk CL, Zehr JL. Os hormônios puberais organizam o cérebro e o comportamento do adolescente. Fronteiras na Neuroendocrinologia. 2005;26: 163 – 74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Bem-vindo SE, Kan E, Toga AW. Mapeamento longitudinal da espessura cortical e crescimento cerebral em crianças normais. Journal of Neuroscience. 2004;24: 8223 – 31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. O mapeamento continuou o crescimento do cérebro e a redução da densidade da matéria cinzenta no córtex frontal dorsal: relações inversas durante a maturação cerebral pós-adolescente. Journal of Neuroscience. 2001;21: 8819 – 29. [PubMed]
- Spear LP. O cérebro do adolescente e as manifestações comportamentais relacionadas à idade. Neuroscience & Biobehavioral Review. 2000;24: 417 – 63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Efeitos neuropsiquiátricos de esteróides anabolizantes em voluntários masculinos normais. JAMA. 1993;269: 2760 – 4. [PubMed]
- Thiblin I, Finn A, Ross SB e Stenfors C. Aumento das atividades dopaminérgicas e 5-hidroxitriptaminérgicas no cérebro de ratos machos após tratamento prolongado com esteroides androgênicos anabólicos. British Journal of Pharmacology. 1999;126: 1301 – 6. [Artigo gratuito do PMC] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestina, receptores acoplados à proteína G de estrogênio e andrógeno em gônadas de peixe. Esteróides 2006;71: 310 – 6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. Os efeitos de doses suprafisiológicas de testosterona no comportamento irado em homens saudáveis eugonadais - um estudo de centro de pesquisa clínica. Journal of Clinical Endocrinology & Metabolism. 1996;81: 3754 – 8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Sugestões quimiossensoriais são essenciais para a liberação de dopamina induzida pelo acasalamento em MPOA de hamsters sírios machos. Neuropsychopharmacology. 2005;30: 1436 – 42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. A testosterona e o nucleus accumbens dopamine no hamster sírio masculino. Psiconeuroendocrinologia (no prelo)
- Van Eenoo P, Delbeke FT. A prevalência de doping na Flandres em comparação com a prevalência de doping nos esportes internacionais. Revista Internacional de Medicina Esportiva. 2003;24: 565 – 570. [PubMed]
- WADA Descobertas analíticas adversas relatadas por laboratórios acreditados. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis meu. Empilhamento de esteróides anabólicos androgênicos (EAA) durante a puberdade em ratos: avaliação neuroendócrina e comportamental. Pharmacology, Biochemistry & Behavior. 2006;83: 410 – 9.
- Wichstrom L, Pedersen W. Uso de esteróides anabólicos androgênicos na adolescência: ganhar, parecer bom ou ser ruim? Jornal de Estudos sobre Álcool. 2001;62: 5 – 13. [PubMed]
- Wood RI, Johnson LR, Chu L., Schad C, Self DW. Reforço de testosterona: administração intravenosa e intracerebroventricular em ratos e hamsters machos. Psicofarmacologia. 2004;171: 298 – 305. [PubMed]
- Wood RI, Newman SW. Receptores androgênicos e estrogênicos coexistem com neurônios individuais no cérebro do hamster sírio. Neuroendocrinologia. 1995;62: 487 – 97. [PubMed]
- Wood RI, Swann JM. Integração neuronal de sinais quimiossensoriais e hormonais que controlam o comportamento sexual masculino. Em: Wallen K, Schneider JS, editores. Reprodução no contexto. MIT Press; Cambridge: 1999. pp. 423 – 444.
- Zahm DS, Heimer L. Duas vias transpalais originadas no núcleo do rato accumbens. Jornal de Neurologia Comparativa. 1990;302: 437 – 46. [PubMed]