COMENTÁRIOS: uma revisão do principal pesquisador sobre obesidade e dependência alimentar.
Volume 69, Edição 4, 24 Fevereiro 2011, Páginas 664 – 679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Avaliações
Paul J. Kenny1, ,
1 Laboratório de Neurociência Comportamental e Molecular, Departamento de Terapêutica Molecular, Instituto de Pesquisa Scripps, Jupiter, FL 33458, EUA
________________________________________
Os alimentos são consumidos para manter o equilíbrio energético nos níveis homeostáticos. Além disso, alimentos saborosos também são consumidos por suas propriedades hedônicas, independentemente do status energético. Esse consumo relacionado à recompensa pode resultar em uma ingestão calórica que excede os requisitos e é considerado um dos principais culpados pelo rápido aumento das taxas de obesidade nos países desenvolvidos. Comparado com os mecanismos homeostáticos de alimentação, muito menos se sabe sobre como os sistemas hedônicos no cérebro influenciam a ingestão de alimentos. Curiosamente, o consumo excessivo de alimentos saborosos pode desencadear respostas neuroadaptativas em circuitos de recompensa do cérebro semelhantes a drogas de abuso. Além disso, vulnerabilidades genéticas similares nos sistemas de recompensa do cérebro podem aumentar a predisposição à dependência de drogas e à obesidade. Aqui, os recentes avanços em nossa compreensão dos circuitos cerebrais que regulam os aspectos hedônicos do comportamento alimentar serão revisados. Além disso, evidências emergentes sugerindo que a obesidade e a dependência de drogas podem compartilhar mecanismos hedônicos comuns também serão consideradas.
________________________________________
Texto principal
"Não há amor mais sincero do que o amor pela comida."
-George Bernard Shaw
Introdução
A obesidade, definida como um índice de massa corporal (IMC)> 30, é uma condição na qual a adiposidade é anormalmente alta e pode resultar de hiperfagia ou diminuição da taxa metabólica (O'Rahilly, 2009). A adiposidade excessiva é um importante fator de risco para doenças cardiovasculares, câncer, diabetes tipo 2 e transtornos relacionados ao humor, com indivíduos obesos frequentemente sofrendo estigmatização social ([Bean et al., 2008], [Centros de Controle e Prevenção de Doenças, 2009] e [Luppino et al., 2010]). De acordo com o Center for Disease Control (CDC), as despesas de saúde relacionadas à obesidade nos Estados Unidos entre 1998 e 2000 foram de aproximadamente US $ 213 bilhões. Além disso, 300,000 mortes nos Estados Unidos a cada ano podem ser atribuídas a doenças relacionadas ao sobrepeso e à obesidade (Allison et al., 1999), sendo a obesidade a segunda principal causa de morte evitável, atrás apenas do uso do tabaco. No entanto, a prevalência da obesidade nas sociedades ocidentais continua a aumentar dramaticamente, com as estimativas atuais sugerindo que mais de 30% dos adultos nos Estados Unidos são obesos (Flegal et al., 2010).
A maioria das conceituações de regulação de alimentação propõe que dois sistemas paralelos interagem para influenciar a ingestão de alimentos (Hommel et al. 2006, Lutter e Nestler 2009 e Morton et al., 2006). O sistema homeostático compreende reguladores hormonais da fome, saciedade e níveis de adiposidade, como leptina, grelina e insulina, que atuam nos circuitos hipotalâmicos e do tronco cerebral para estimular ou inibir a alimentação, a fim de manter níveis adequados de balanço energético. A disfunção em componentes do sistema homeostático, como a deficiência congênita de leptina, pode resultar em um estado persistente de balanço energético positivo e no desenvolvimento da obesidade ([Campfield et al., 1995], [Halaas e outros, 1995] e [Pelleymounter]). et al., 1995]). Os mecanismos pelos quais os reguladores hormonais da fome e da saciedade agem nos circuitos hipotalâmicos e do tronco cerebral para manter a homeostase energética foram descritos em detalhes em outros lugares, e os leitores interessados nesse tópico são referidos a muitas revisões excelentes sobre esse assunto (por exemplo, [Abizaid et al., 2006a] e [Gao e Horvath, 2007]).
Além dos sistemas metabólicos, os sistemas de recompensa do cérebro também desempenham um papel importante no comportamento alimentar ([Lutter e Nestler, 2009] e [Saper et al., 2002]). Em geral, os alimentos de sabor suave não são consumidos em excesso, ao passo que os palatáveis costumam ser consumidos mesmo depois que as necessidades energéticas são atendidas. A facilidade de acesso a alimentos palatáveis com alta densidade energética é considerada um importante fator de risco ambiental para a obesidade (Volkow e Wise, 2005), e o consumo excessivo de alimentos palatáveis é considerado um fator importante que contribui para o recente aumento da obesidade ([Finkelstein et al., 2005], [Hill et al., 2003] e [Swinburn et al., 2009]). Na verdade, obter os efeitos agradáveis de alimentos saborosos é uma força motivadora poderosa que, em certos indivíduos, pode anular os sinais homeostáticos ([Shomaker et al., 2010], [Sunday et al., 1983] e [Zheng et al., 2009]) . Quando apresentados a uma escolha, os ratos preferem consumir uma solução de sacarina sem calorias em vez de autoadministrar infusões de cocaína intravenosa (Lenoir et al., 2007). Além disso, ratos bem alimentados se expõem voluntariamente a frio extremo (−15 ° C), dor de calor nociva ou choque aversivo nas patas para obter alimentos saborosos, como bolinhos, patê de carne, manteiga de amendoim, Coca-Cola, doces M&M, chocolate chips, ou gotas de iogurte, mesmo quando ração padrão menos palatável está disponível gratuitamente ([Cabanac e Johnson, 1983], [Foo e Mason, 2005] e [Oswald et al., 2010]). Essas descobertas destacam o quão intensamente os macronutrientes em alimentos saborosos podem estimular os sistemas de recompensa do cérebro independentemente de seu valor calórico ([Wang et al., 2004a] e [Wang et al., 2004b]) e quão alta pode ser a motivação para consumir alimentos saborosos mesmo na ausência de requisitos de energia homeostática. Drogas de abuso, como cocaína ou nicotina, podem induzir níveis elevados de comportamento de consumo, embora sejam desprovidas de valor calórico ou nutritivo. Na verdade, devido às muitas semelhanças entre comer demais na obesidade e o uso excessivo de drogas na dependência (Volkow e Wise, 2005), argumentou-se que a obesidade deveria ser considerada um distúrbio cerebral e incluída como uma categoria diagnóstica na próxima quinta edição do Manual Diagnóstico e Estatístico de Transtornos Mentais (DSM-V) ([Devlin, 2007] e [Volkow e O'Brien, 2007]). Em comparação com os mecanismos homeostáticos do comportamento alimentar, muito menos se sabe sobre como os sistemas hedônicos influenciam a ingestão alimentar. Da mesma forma, a influência das alterações intrínsecas ou induzidas pela dieta sobre a capacidade de resposta dos sistemas de recompensa do cérebro e como esses efeitos contribuem para comer em excesso e obesidade permanece obscura. A seguir, estão resumidos os dados recentes que destacam os avanços em nossa compreensão dos mecanismos hedônicos da alimentação e das alterações induzidas pela dieta na atividade de recompensa do cérebro que podem contribuir para o desenvolvimento da obesidade
Ativação de Sistemas de Recompensa Cerebral em Resposta a Alimentos Palatáveis: Interações com Reguladores Hormonais de Balanço Energético
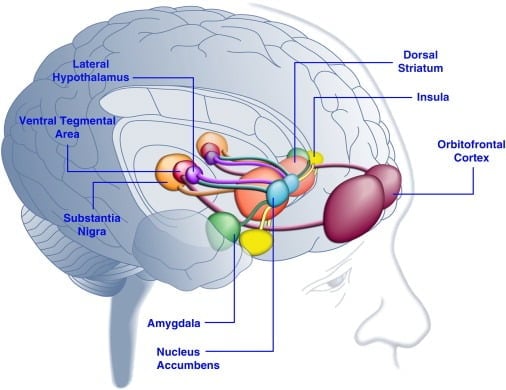
O consumo de alimentos palatáveis pode melhorar o humor em humanos (Dallman et al., 2003 e Macht e Mueller, 2007) e apoiar o estabelecimento de uma preferência de local condicionado em animais de laboratório (Imaizumi et al., 2001) e Sclafani et al., 1998]). Estes efeitos estão provavelmente relacionados com a estimulação de sistemas de recompensa do cérebro por alimentos palatáveis (Figura 1). De fato, estudos de imagens do cérebro humano mostraram que estímulos visuais ou olfativos relacionados à comida e alimentos podem ativar circuitos cerebrais corticolímbico e meso accumbens implicados na recompensa, principalmente as regiões do córtex orbitofrontal (OFC), ínsula, amígdala, hipotálamo, estriado e mesencéfalo. incluindo a área tegmentar ventral (VTA) e substantia nigra (SN) ([Bragulat e outros, 2010], [Pelchat e outros, 2004], [Schur e outros, 2009] e [Simmons e outros, 2005] ). O estriado, a ínsula, o córtex cingulado anterior e as estruturas mesencefálicas codificam o valor subjetivo das recompensas, independentemente de seu tipo (por exemplo, comida, sexo, recompensas monetárias), consistente com um papel dessa rede neuronal na representação hedônica geral (Sescousse et al. , 2010). Em contraste, o OFC parece desempenhar um papel particularmente proeminente em representações relacionadas ao valor de tipos específicos de recompensas, incluindo alimentos palatáveis ([Man et al., 2009], [Rolls, 2008] e [Sescousse et al., 2010] ). A fome pode aumentar a ativação palatável induzida por alimentos das regiões corticolímbica e mesencéfalo em humanos (LaBar et al., 2001). Por exemplo, a intensidade de ativação do corpo estriado ventral, amígdala, ínsula e OFC em resposta a alimentos palatáveis altamente calóricos foi muito maior quando os indivíduos humanos estavam com fome e não bem alimentados (Goldstone et al., 2009). Isso é consistente com o fato de que os períodos de fome e dieta aumentam as avaliações auto-relatadas do “poder” dos alimentos palatáveis e o desejo por alimentos “tentadores” (Hofmann et al., 2010) e [Rolls et al., 1983]. ). Por outro lado, a superalimentação pode reduzir as respostas neuronais a alimentos saborosos, particularmente no córtex insular e no hipotálamo (Cornier et al., 2009). Assim, o valor hedônico dos alimentos é influenciado pelo estado metabólico, sugerindo que os reguladores do metabolismo, como a leptina e a grelina, podem influenciar a atividade dos sistemas hedônicos no cérebro. Consistente com essa visão, indivíduos humanos tratados com leptina ou com o peptídeo pós-prandial derivado do intestino YY3-36 (PYY) ([Batterham et al., 2007] e [Farooqi et al., 2007]) ou aqueles que sofreram distensão gástrica imitando a ingestão de refeições (Wang et al., 2008), reduziu a atividade em regiões cerebrais relacionadas à recompensa. Por outro lado, pacientes humanos hiperfagicos com deficiência congênita de leptina demonstram atividade aumentada no córtex insular e estriado em resposta a imagens de alimentos ([Baicy et al., 2007] e [Farooqi et al., 2007]). Nestes indivíduos, a terapia de reposição de leptina atenuou a atividade insular e estriada aumentada e diminuiu a auto-avaliação de alimentos ([Baicy et al., 2007] e [Farooqi et al., 2007]). O tratamento com leptina também bloqueia as propriedades recompensadoras da sacarose em ratos com restrição alimentar semelhantes ao antagonista do receptor da dopamina α-flupentixol (Figlewicz et al., 2001). Além disso, os receptores de leptina são expressos em neurônios dopaminérgicos mesencéfalos na VTA e SN (Figlewicz et al., 2003), sugerindo que a leptina pode influenciar aspectos hedônicos do comportamento alimentar através da modulação da transmissão de dopamina mesostriatal. Confirmando esta possibilidade, as infusões de leptina na VTA inibiram a actividade dos neurónios da dopamina e diminuíram a ingestão de alimentos em ratos (Hommel et al., 2006; ver também Krügel et al., 2003). Por outro lado, o knockdown dos receptores de leptina na VTA aumentou a ingestão de alimentos, aumentou a atividade locomotora e aumentou a preferência por alimentos saborosos em ratos (Hommel et al., 2006). A leptina, portanto, exerce uma influência inibitória na transmissão da dopamina mesoacumba, um sistema neurotransmissor que tem sido fortemente implicado na recompensa e motivação, mas menos na homeostase energética ([de Araujo et al., 2010] e [Vucetic e Reyes, 2010]). Mais recentemente, a hormona grelina relacionada com a fome ([Kojima et al., 1999] e [Nakazato et al., 2001]) mostrou potenciar a activação de sistemas hedónicos no cérebro em resposta a sinais alimentares (Malik et al. , 2008). Especificamente, a grelina aumentou a ativação de OFC, amígdala, ínsula, estriato, VTA e SN em resposta a imagens de alimentos altamente palatáveis em indivíduos obesos (Malik et al., 2008). Em ratos, a grelina exerce um efeito estimulatório sobre os sistemas de dopamina do mesencéfalo ([Abizaid et al., 2006b], [Jerlhag et al., 2006] e [Jerlhag et al., 2007]) e aumenta o valor recompensador de alimentos saborosos (Perello et al., 2010).
Figura 1. Painel do Áreas do cérebro humano ativadas em resposta a alimentos palatáveis ou estímulos associados a alimentos. Acredita-se que o córtex orbitofrontal e a amígdala codifiquem informações relacionadas ao valor de recompensa dos alimentos ([Baxter e Murray, 2002], [Holland e Gallagher, 2004], [Kringelbach et al., 2003], [O'Doherty et al. , 2002] e [Rolls, 2010]). A ínsula processa informações relacionadas ao sabor dos alimentos e sua valoração hedônica ([Balleine e Dickinson, 2000] e [Small, 2010]). O núcleo accumbens e o estriado dorsal, que recebem entrada dopaminérgica da área tegmental ventral e da substância negra, regulam as propriedades motivacionais e de incentivo dos alimentos ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi et al., 2007], [Malik et al., 2008] e [Söderpalm e Berridge, 2000]). O hipotálamo lateral pode regular as respostas recompensadoras a alimentos saborosos e conduzir a comportamentos de busca por alimentos (Kelley et al., 1996). Essas estruturas cerebrais agem de maneira combinada para regular o aprendizado sobre as propriedades hedônicas dos alimentos, mudando a atenção e o esforço para obter recompensas alimentares e regulando o valor de incentivo dos estímulos ambientais que predizem a disponibilidade de recompensas alimentares (Dagher, 2009). Para fins de clareza, nem todas as interconexões entre essas estruturas são mostradas.
Regiões cerebrais semelhantes são ativadas por alimentos palatáveis no cérebro de ratos como aqueles ativados em humanos, medidos pela expressão de genes precoces imediatos (IEG), como c-fos, arc ou zif268. De fato, alimentos palatáveis ativam o corpo estriado dorsal e ventral, VTA, hipotálamo lateral (LH) e núcleos central e basolateral da amígdala e estruturas corticais relacionadas à recompensa em ratos ([Angeles-Castellanos et al., 2007], [Park e Carr, 1998] e [Schiltz et al., 2007]). Curiosamente, a imunorreatividade de Fos foi realmente diminuída na habenula lateral e medial em ratos após consumo de alimentos palatáveis (LHb) (Park e Carr, 1998). Em primatas não humanos, o LHb é ativado por estímulos aversivos ou omissão de recompensas esperadas e inibido pela entrega de uma recompensa de suco palatável (Matsumoto e Hikosaka, 2007). Além disso, a atividade de LHb inibe os neurônios contendo dopamina de mesoacumbos relacionados à recompensa por meio de uma via indireta envolvendo o núcleo tegmentar rostromedial (RMTg) (Jhou et al., 2009). A atividade habenular é, portanto, inversamente relacionada à hedonia alimentar, sugerindo que o complexo habenular pode influenciar a alimentação não homeostática. De fato, recentemente foi demonstrado que a ativação da LHb diminui o consumo de sacarose em ratos, enquanto que as lesões de LHb aumentam o comportamento de busca de sacarose (Friedman et al., 2011). Considerando que o complexo habenular é pequeno e desafiador para identificar e funcionalmente a imagem em humanos (Salas et al., 2010), isso pode explicar por que alterações na atividade habenular não foram relatadas em estudos de imagem em humanos em resposta a alimentos palatáveis.
Circuitos Cerebrais que Regulam a Alimentação Hedônica: Sistemas de Dopamina Midbrain
A via da dopamina mesoaccumbens é ativada em humanos e animais de laboratório em resposta a alimentos palatáveis ou estímulos relacionados ao apetite e leptina, grelina e outros reguladores da atividade de influência do apetite nesse sistema. Isso sugere que os sistemas dopaminérgicos do mesencéfalo desempenham um papel importante no consumo de alimentos saborosos. Talvez a indicação mais clara de que a transmissão de dopamina no mesencéfalo influencia a ingestão de alimentos palatáveis em humanos é o fato de que os pacientes com doença de Parkinson (DP), em que há degeneração de neurônios contendo dopamina no mesencéfalo, tendem a consumir menos comida do que os indivíduos não afetados (Nirenberg e Waters, 2006). Além disso, o tratamento de pacientes com DP com agonistas do receptor de dopamina pode desencadear o consumo compulsivo de alimentos saborosos ([Dagher e Robbins, 2009] e [Nirenberg e Waters, 2006]). Na verdade, os agonistas do receptor de dopamina podem induzir a alimentação hedônica mesmo em indivíduos sem DP (Cornelius et al., 2010). Em animais, as soluções de sacarose palatáveis estimulam a transmissão de dopamina no NAc (Hernandez e Hoebel, 1988), um efeito consistente com estudos de imagem do cérebro humano (Small et al., 2003). Usando voltametria cíclica de varredura rápida, foi mostrado que as pistas que prevêem a entrega de uma recompensa de sacarose ou a entrega inesperada de sacarose evocaram a transmissão de dopamina em NAc ([Roitman et al., 2004] e [Roitman et al., 2008]). Além disso, a administração inesperada de soluções nocivas de quinina teve o efeito oposto, diminuindo a transmissão de dopamina acumbal (Roitman et al., 2008). Finalmente, os camundongos nos quais a enzima tirosina hidroxilase (TH) foi inativada, causando-lhes deficiência de dopamina, ainda demonstram uma preferência marcada por soluções de sacarose (ou sacarina) em comparação com a água, mas consomem menos quantidades totais de sacarose do que os camundongos de controle Cannon e Palmiter, 2003). Isso sugere que camundongos com deficiência de dopamina ainda podem detectar palatabilidade de sacarose e preferem essas soluções à água, mas não são capazes de sustentar o consumo de soluções palatáveis. Foi, portanto, proposto que a transmissão da dopamina mesoaccumbens regula os aspectos motivacionais do comportamento alimentar que estão envolvidos na compra de alimentos e que outros sistemas de neurotransmissores provavelmente regulam os aspectos hedônicos do consumo de alimentos palatáveis.
Circuitos Cerebrais que Regulam a Alimentação Hedônica: Sistemas Striatohypothalamic
A infusão de agonistas do receptor μ-opióide, como [D-Ala2-N-Me-Phe4-gly-ol5] -enfalina (DAMGO) no NAc estimula o comportamento alimentar em ratos com acesso ad libitum a alimentos (isto é, alimentação não homeostática) ( [Peciña e Berridge, 2005] e [Zhang et al., 1998]). Por outro lado, os antagonistas do receptor opióide infundidos no NAc diminuem o consumo de alimentos preferidos sem afetar a ingestão de alternativas menos palatáveis (Kelley et al., 1996). Esses dados são consistentes com a visão de que os sistemas opioides estriados regulam as propriedades hedônicas dos alimentos palatáveis. A região do casco do NAc e, em particular, os “pontos quentes” hedônicos na região rostrodorsal da concha medial ([Peciña e Berridge, 2005] e [Peciña et al., 2006b]) desempenham um papel particularmente importante na alimentação não homeostática. Como a ativação do receptor μ-opioide resulta na inibição da atividade dos neurônios espinhosos médios no NAc, foi proposto que o invólucro do NAc exerça uma influência inibitória tônica no consumo alimentar apetecível (Kelley et al., 2005). Consistente com esta visão, estimulação dos receptores GABAA ou GABAB inibitórios ([Basso e Kelley, 1999] e [Stratford e Kelley, 1997]) ou bloqueio dos receptores de glutamato ionotrópico excitatório (Maldonado-Irizarry et al., 1995) na camada NAc aumenta o consumo de alimentos. Da mesma forma, a lesão excitotóxica da concha de NAc também aumenta o consumo de alimentos e aumenta a sensibilidade à recompensa alimentar (Johnson et al., XNumx e Maldonado-Irizarry e Kelley, XNumx). Em particular, o consumo de alimentos palatáveis densos em energia é preferencialmente desencadeado por essas manipulações ([Basso e Kelley, 1996], [Kelley et al., 1995] e [Zhang et al., 1999]).
Considerando a grande influência da sinalização acumbal na alimentação hedônica, Thompson e Swanson (2010) usaram um procedimento de rastreamento de circuitos para identificar com precisão as redes anatômicas precisas através das quais o NAc pode influenciar o consumo de alimentos saborosos. Nesses estudos elegantes, os ratos receberam duas injeções não sobrepostas de traçadores anterógrados / retrógrados (denominados COINs) em locais da concha de NAc que influenciaram poderosamente o consumo de alimentos saborosos, e foram identificadas conexões aferentes / eferentes. Foi demonstrado que os locais relacionados à alimentação no NAc estendem projeções inibitórias predominantemente para o LH anterior e o pálidio ventral (VP) (Thompson e Swanson, 2010). Ao contrário do resto do NAc, que se projeta densamente para o VTA, os pontos hedônicos relacionados ao alimento no projeto do casco do NAc ao núcleo interfascicular (IFN), uma estrutura localizada adjacente ao VTA que estende as projeções dopaminérgicas de maneira recíproca de volta ao Concha de NAc (Thompson e Swanson, 2010). Além disso, o LH anterior projeta-se para o LHb (Thompson e Swanson, 2010), sugerindo novamente que o complexo habenular pode desempenhar um papel na hedônica dos alimentos (Friedman et al., 2011).
Os dados acima mostram que o LH recebe entrada inibitória proeminente de locais em NAc que exercem uma influência inibitória tônica no consumo alimentar apetecível. O LH também tem conectividade funcional com outros locais do cérebro cortical e límbico envolvidos na organização e direcionamento do comportamento para obtenção de alimentos saborosos (Figura 1), como o OFC, ínsula e amígdala. É importante ressaltar que a inativação do LH elimina os efeitos estimulatórios das manipulações de NAc na ingestão de alimentos ([Maldonado-Irizarry et al., 1995] e [Will et al., 2003]). Além disso, a inativação do invólucro de NAc aumenta a atividade do LH, particularmente os neurônios LH que sintetizam o neuropeptídeo hipocretina (também conhecido como orexina), medido pela imunorreatividade de Fos ([Baldo et al., 2004] e [Stratford e Kelley, 1999). ]). De fato, a infusão do agonista DAMGO do receptor μ-opióide no invólucro NAc ativa os neurônios contendo hipocretina no hipotálamo (Zheng et al., 2007) e a interrupção da transmissão da hipocretina na VTA abole a ingestão alimentar apetecível desencadeada por infusões intra-NAc DAMGO (Zheng et al., 2007). Assim, os pontos quentes hedônicos no invólucro de NAc exercem uma influência inibitória tônica nos neurônios de LH e, em particular, nos neurônios contendo hipocretina (Louis et al., 2010), limitando assim o consumo de alimentos saborosos. O rompimento desse “sinal de parada”, por meio da sinalização aumentada do receptor opióide, por exemplo, resulta em aumento da atividade da LH que impulsiona o consumo não homostático de alimentos saborosos (Figura 2).
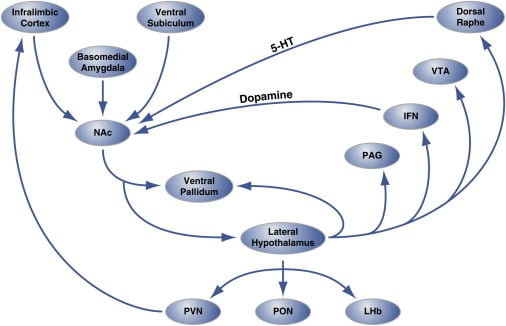
Figura 2. Organização em nível de circuito dos “Hot Spots” hedônicos no Nucleus Accumbens Shell que regulam a alimentação hedônica
A região da casca do nucleus accumbens (NAc) recebe inervação dos locais do cérebro cortical e límbico e se projeta para o hipotálamo lateral e para o pálio ventral. Por sua vez, o hipotálamo lateral também se projeta para o pálidea ventral e também para o núcleo PAG, IFN, VTA e dorsal rafe. O IFN e a ra dorsal estendem projeções dopaminérgicas e serotoninérgicas, respectivamente, de volta ao NAc. O hipotálamo lateral também inerva estruturas talâmicas (PVN e PON) e epitálmicas (LHb). Não são mostradas as projeções menores do hipotálamo lateral para áreas cerebrais septais. 5-HT, serotonina; IFN, núcleo interfascicular; LHb, habenula lateral; PON, núcleo pré-óptico; PVN, núcleo paraventricular do tálamo; VTA, área tegmentar ventral. Figura é adaptada com permissão de Thompson e Swanson (2010).
Circuitos Cerebrais que Regulam a Alimentação Hedônica: Sistemas Estriatodalóides
Além do LH, os neurônios da casca também são projetados para o VP (Figura 2). Em uma interessante série de experimentos, foi mostrado que projeções aclamativas para o VP e LH podem regular aspectos dissociáveis da alimentação não homeostática (Smith e Berridge, 2007). As infusões de DAMGO na concha de NAc ou no VP aumentaram as reações orofaciais às soluções de sacarose supostamente refletindo reações de “gostar” em ratos (isto é, resposta de palatabilidade) e também aumento do consumo de alimentos (Smith e Berridge, 2007). Infusões de naloxona em NAc ou VP diminuíram reações de afeição facial à sacarose, sugerindo que a transmissão opióide sincronizada em NAc e VP é necessária para processar a palatabilidade alimentar relacionada à informação. No entanto, a naloxona infundida no NAc, mas não no VP, diminuiu a ingestão não homeostática (Smith e Berridge, 2007), sugerindo que a alimentação não homeostática ocorre independentemente dessa conectividade NAc → VP e provavelmente depende da via NAc → LH (Smith e Berridge, 2007] e [Taha et al., 2009]). Consistente com a noção de que os aspectos da alimentação não homeostática podem ser dissociados, registros de unidade única mostraram que uma população de neurônios NAc parece codificar seletivamente informações relacionadas às propriedades reforçadoras relativas dos alimentos (ou seja, palatabilidade) (Taha and Fields, 2005) . Nos mesmos ratos, mudanças na atividade, uma segunda população de neurônios NAc pareceu coincidir com o início do comportamento alimentar (Taha e Fields, 2005).
Circuitos Cerebrais que Regulam a Alimentação Hedônica: Sistemas Amigdalares
Apoiando ainda mais a noção de que aspectos da alimentação não homeostática são dissociáveis, infusões de naloxona na concha de NA ou VP, mas não na amígdala basolateral (BLA), diminuíram a palatabilidade das soluções de sacarose (Wassum et al., 2009). No entanto, quando os antagonistas do receptor μ-opióide naloxona ou CTOP foram infundidos no BLA, mas não NAc shell ou VP, houve uma acentuada atenuação do aumento da motivação para responder por soluções de sacarose tipicamente visto em um estado de fome [Wassum et al ., 2011] e [Wassum et al., 2009]). Isto sugere que as propriedades de incentivo da sacarose são reguladas por circuitos amígdalas. No geral, os resultados acima mostram que diferentes aspectos da alimentação hedônica, como o processamento de informações relacionadas à palatabilidade dos alimentos, comportamentos de aproximação e aumentos no valor de incentivo de alimentos palatáveis em animais famintos são regulados diferencialmente por microcircuitos discretos dentro do contexto de uma dieta. circuitos corticolímbico-estrebiforme-hipotalâmico-tálamo-cortical maior (Figura 2).
Adaptações em Circuitos Hedônicos de Cérebro Conduzem o Comer Compulsivo?
A relevância funcional dos hotspots hotsônicos na camada NAc e sua influência em circuitos mais amplos relacionados à alimentação no cérebro foram considerados por Kelley et al. (2005) Eles levantam a hipótese de que a via shell NAC → LH, juntamente com as regiões do cérebro reguladoras a montante e a jusante (Figura 2), servem a uma finalidade “sentinela” (Kelley et al., 2005). Especificamente, eles propõem que mesmo em animais famintos, quando o desejo de comer é forte, a capacidade de cessar o comportamento alimentar deve ser mantida em caso de ameaças do meio ambiente (Kelley et al., 2005). Como tal, a ativação dos neurônios do invólucro NAc e a inibição concomitante dos neurônios LH podem interromper a alimentação contínua e facilitar a mudança do comportamento para respostas adaptativas mais apropriadas, como o congelamento ou escape (Kelley et al., 2005). Se este é realmente o caso, então será importante investigar se esta via de controle de LH shell → LH é comprometida pelo consumo exagerado de alimentos palatáveis ou por fatores genéticos que influenciam a vulnerabilidade à obesidade. Com isso em mente, nosso laboratório e outros recentemente relataram que o consumo excessivo de alimentos palatáveis e calóricos está associado ao surgimento do comportamento alimentar compulsivo em ratos (Johnson & Kenny, 2010), [Latagliata et al., 2010] e [Oswald et al., 2010]). Especificamente, descobrimos que o consumo alimentar apetecível em ratos obesos foi resistente à ruptura por um estímulo condicionado aversivo que previa resultado negativo (choque elétrico) (Johnson e Kenny, 2010). Assim, será importante testar se os déficits na via de shell NA → LH, desencadeada por excessos, contribuem, pelo menos em parte, para a falha conspícua de indivíduos com sobrepeso e obesidade em utilizar informações sobre as consequências deletérias de seu comportamento consumatório para moderar sua ingestão alimentar. .
Atividade alterada de recompensas cerebrais na obesidade: estudos de imagens do cérebro humano
A obtenção dos efeitos estimulatórios dos alimentos palatáveis nos sistemas de recompensa do cérebro é considerada um importante fator motivacional que contribui para o excesso de comida. Assim, uma questão importante é se alterações na função de recompensa do cérebro podem contribuir para o desenvolvimento da obesidade. Uma previsão intuitiva é que a capacidade de resposta constitutiva aprimorada dos sistemas de recompensa do cérebro a alimentos apetitosos resultaria em excessos e ganho de peso. Consistente com essa hipótese, indivíduos com altos níveis de sensibilidade à recompensa de característica exibem atividade aumentada em regiões cerebrais implicadas na recompensa alimentar, incluindo NAc, amígdala, OFC e VP, quando expostos a alimentos palatáveis como bolo de chocolate e pizza (Beaver et al. , 2006). Indivíduos obesos demonstram similarmente uma ativação aumentada de circuitos de recompensa em resposta a alimentos saborosos ou sinais associados a alimentos em comparação com controles magros ([Gautier et al., 2000], [Karhunen e outros, 1997] e [Rothemund e outros, 2007] ]). Altos níveis de sensibilidade à recompensa de características também foram correlacionados com o aumento do peso corporal em seres humanos ([Davis et al., 2004] e [Franken e Muris, 2005]). É importante ressaltar, no entanto, que mulheres obesas (IMC> 30) apresentaram níveis mais elevados de anedonia (ou seja, sensibilidade basal diminuída à recompensa) do que mulheres com sobrepeso (IMC> 25 <30) (Davis et al., 2004). Da mesma forma, Stice e colaboradores (2008b) mostraram que as adolescentes obesas aumentaram a ativação da ínsula e de outras regiões cerebrais corticais em resposta a alimentos apetecíveis ou sinais associados aos alimentos em comparação com indivíduos saudáveis, mas que a ativação da área caudal da estriado em resposta ao alimento palatável foi inversamente correlacionado com o IMC nos indivíduos obesos. Além disso, as mulheres que ganharam peso durante um mês 6 tiveram um declínio acentuado na atividade estriatal em resposta a alimentos palatáveis durante este período de tempo em comparação com mulheres que não ganharam peso (Stice et al., 2010a). Tomando tudo isto em conjunto, parece que a hipersensibilidade dos circuitos de recompensa pode predispor um indivíduo a comer em excesso e ganho de peso (Stice et al., 2010b). No entanto, à medida que o ganho de peso aumenta, podem ocorrer déficits na atividade de componentes específicos do sistema de recompensa do cérebro, particularmente no estriado. Foi proposto que o surgimento desse estado de hipossensibilidade de recompensa possa perpetuar o consumo excessivo de alimentos palatáveis, a fim de superar esses déficits de recompensa ([Stice et al., 2008a] e [Wang et al., 2002]). Por isso, muito pouca ou muita recompensa alimentar parece aumentar a vulnerabilidade a excessos e obesidade (Stoeckel, 2010). Um arcabouço conceitual atraente para reconciliar esses pontos de vista aparentemente opostos é que as áreas corticolímbicas envolvidas na organização do comportamento para obter recompensas alimentares e fazer previsões sobre a futura recompensa alimentar futura podem se tornar hiperativas em indivíduos com excesso de peso e predispostos à obesidade. Por outro lado, os locais do cérebro do estriado que processam a experiência real do prazer da alimentação hedônica podem se tornar gradualmente menos funcionais nesses mesmos indivíduos. Espera-se, portanto, que o valor motivacional relativo do alimento palatável aumente durante o desenvolvimento da obesidade, ao mesmo tempo em que o valor hedônico obtido do consumo de alimentos apetitosos diminui.
Atividade alterada de recompensa do cérebro na obesidade: estudos com roedores
Os efeitos do consumo de alimentos palatáveis em sistemas de recompensa do cérebro foram diretamente avaliados em animais de laboratório usando o procedimento de recompensa de estimulação cerebral (BSR). É bem conhecido que a estimulação elétrica do LH, que recebe estímulo inibitório tônico de pontos quentes hedônicos (Figura 2), é altamente recompensadora e os ratos trabalharão duro para auto-estimular essa região do cérebro, por exemplo, (Markou and Frank, 1987 ). Além de apoiar o comportamento de autoestimulação, a estimulação elétrica do LH também pode induzir intensos episódios de comportamento alimentar (Margules e Olds, 1962), e tem sido proposto que as propriedades recompensadoras do estímulo do LH podem estar relacionadas ao papel intrínseco deste nutriente. sítio cerebral nas propriedades apetitivas e de incentivo dos alimentos (Margules e Olds, 1962). Consistente com essa visão, a fome e a perda de peso aumentam a sensibilidade dos ratos ao valor recompensador de autoestimulação de LH ([Blundell e Herberg, 1968], [Carr e Simon, 1984] e [Margules and Olds, 1962]), um efeito que pode ser bloqueada pela infusão intracerebroventricular de leptina (Fulton et al., 2000). Por outro lado, a auto-estimulação elétrica do LH é inibida em animais saciados (Wilkinson e Peele, 1962). De fato, superalimentação de ratos através de tubo de alimentação intragástrico (Hoebel e Teitelbaum, 1962), distensão gástrica ou infusão intravenosa de glucagon que imita a saciedade pós-prandial ([Hoebel, 1969], [Hoebel e Balagura, 1967] e [Mount and Hoebel, 1967] ), todos atenuam a resposta para a estimulação de LH. De facto, os ratos que anteriormente responderam vigorosamente para recompensar a estimulação do LH responderão como se esta estimulação fosse aversiva após a ingestão de alimentos ou desenvolvimento de obesidade (Hoebel e Thompson, 1969). Assim, a restrição alimentar crônica e a perda de peso aumentam, enquanto a superalimentação diminui, a sensibilidade dos locais relacionados à recompensa no LH. A sensibilidade dos neurônios LH à recompensa da autoestimulação elétrica pode, portanto, fornecer informações importantes sobre o funcionamento dos circuitos cerebrais que regulam as respostas hedônicas aos alimentos.
Como a facilidade de acesso a alimentos palatáveis densos em energia e o consequente consumo excessivo é considerado um importante fator ambiental que contribui para a obesidade (Volkow e Wise, 2005), nosso laboratório utilizou recentemente o procedimento BSR para avaliar a atividade de recompensa cerebral em ratos com acesso prolongado a alimentos saborosos . Especificamente, registramos respostas para a estimulação elétrica do LH em ratos que tiveram acesso ad libitum somente a ração nutricional ou ração em combinação com acesso diário 18-23 hr a uma dieta palatável. Esta dieta consistia em cheesecake, bacon, salsicha e outros alimentos apetitosos (Johnson e Kenny, 2010). Descobrimos que os ratos com acesso prolongado ao alimento palatável rapidamente ganharam quantidades significativas de peso e demonstraram um déficit de recompensa cerebral progressivamente piorando (refletido como resposta diminuída à recompensa da estimulação do LH) (Johnson e Kenny, 2010; Figura 3). Isso sugere que o desenvolvimento da obesidade induzida por dieta está associado a uma diminuição gradual da capacidade de resposta dos locais de recompensa no LH (Johnson and Kenny, 2010). Déficits na sinalização de recompensa também foram relatados em ratos adultos que anteriormente tinham acesso ilimitado a sacarose ou alimentos ricos em gordura durante a adolescência ([Teegarden et al., 2009], [Vendruscolo et al., 2010a] e [Vendruscolo et al., 2010b]). Estes efeitos em ratos são reminiscentes da diminuição da activação do estriado em resposta à recompensa alimentar descrita acima em indivíduos humanos, uma vez que ganharam peso ao longo de um período de meses 6 (Stice et al., 2010a; ver Figura 4). Esses déficits de recompensa induzidos por dieta em ratos com sobrepeso e, talvez, em humanos que ganham peso, provavelmente refletem uma resposta contra-adaptativa em circuitos de recompensa alimentar para se opor à sua superestimulação por alimentos saborosos (Johnson e Kenny, 2010). Um aspecto importante deste achado é que déficits similares na função de recompensa também são detectados em ratos que consomem cocaína ou heroína ([Ahmed et al, 2002], [Kenny et al., 2006] e [Markou e Koob, 1991]; Figura 3). De fato, foi hipotetizado que a disfunção de recompensa induzida por drogas pode contribuir para a transição do uso controlado e descontrolado de drogas, fornecendo uma nova fonte de motivação para consumir a droga a fim de aliviar o estado persistente de recompensa diminuída (Ahmed e Koob , 2005] e [Koob e Le Moal, 2008]). Portanto, é possível que déficits na sensibilidade dos sítios de recompensa no LH induzido pelo excesso de comida aumentem a persistência a longo prazo do consumo de alimentos palatáveis em ratos com excesso de peso, mudando a preferência alimentar por alimentos com maior impacto hedônico para aliviar o estado persistente de recompensa.
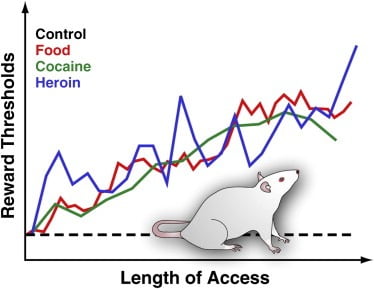
Figura 3. Limiares de recompensa em ratos com acesso diário prolongado a alimentos palatáveis, cocaína ou heroína
Para medir os limites de recompensa, um eletrodo estimulante é implantado cirurgicamente no hipotálamo lateral de ratos, uma região na qual a estimulação elétrica é poderosamente gratificante e pode desencadear ataques intensos de comportamento alimentar. Após a recuperação, os animais podem auto-estimular esta região girando a roda. Após o estabelecimento de um comportamento estável de autoestimulação, é determinada a intensidade mínima de estimulação que mantém o comportamento de autoestimulação (isto é, o limiar de recompensa). Este limite de recompensa fornece uma medida operacional da atividade do sistema de recompensa. Os limites de recompensa permanecem estáveis e inalterados nos ratos de controle que têm acesso à ração de laboratório padrão e que permanecem sem uso de drogas. No entanto, os limiares elevam-se gradualmente em ratos com acesso diário prolongado a uma dieta palatável densa em energia, consistindo de alimentos saborosos (por exemplo, cheesecake, bacon, chocolate, etc.). Da mesma forma, os limiares de recompensa são progressivamente elevados em ratos que ampliaram o acesso diário a infusões intravenosas de cocaína ou heroína. Os limiares de recompensas elevados são interpretados para refletir a diminuição da sensibilidade do sistema de recompensa do cérebro. Esses efeitos sugerem que o consumo excessivo de alimentos palatáveis e o ganho de peso associado podem induzir déficits profundos na recompensa do cérebro, semelhantes aos induzidos pelo consumo excessivo de drogas que causam dependência.
Figura 4. Plasticidade da estria na obesidade O ganho de peso está associado à diminuição da ativação estriatal em resposta a alimentos palatáveis, medidos por ressonância magnética funcional, e a níveis mais baixos de disponibilidade do receptor de D2 dopaminérgico (D2R) em humanos (ver texto para detalhes).
Deficient Dopamine D2 Receptor Sinalizando na Obesidade
Vários relatórios recentes revelaram possíveis mecanismos pelos quais os déficits de recompensa podem emergir em resposta ao consumo excessivo de alimentos palatáveis durante o desenvolvimento da obesidade. Como observado acima, as mulheres que ganharam peso durante um período de meses 6 tiveram um declínio acentuado na atividade estriatal em resposta a alimentos palatáveis durante este período de tempo em comparação com mulheres que não ganharam peso (Stice et al., 2010a; Figura 4). Indivíduos em jejum autorizados a comer sua refeição favorita à saciedade apresentaram níveis menores de ligação do raclopride antagonista do receptor D2 da dopamina (D2R) no estriado (Small et al., 2003), sugerindo que a sinalização D2R diminui em resposta ao consumo alimentar apetecível. De fato, indivíduos obesos têm níveis mais baixos de disponibilidade de D2R no estriado em comparação com controles magros (Barnard e outros, 2009, Stice e outros, 2008a e Wang e outros, 2001), enquanto que a perda de peso em pacientes obesos está associado com o aumento da densidade D4R estriatal (Wang et al., 2). Considerando que a transmissão da dopamina estriatal desempenha um papel fundamental na regulação da alimentação hedônica, as diminuições adaptativas na sinalização D2R poderiam contribuir para a redução da responsividade do corpo estriado a alimentos apetitosos em indivíduos obesos. Para testar essa possibilidade, Small e colaboradores examinaram a atividade em circuitos de recompensa do cérebro em resposta a um milkshake saboroso em indivíduos de controle e portadores do alelo TaqIA A1 (Felsted et al., 2010). O polimorfismo de comprimento de fragmento de restrição TaqIA está a jusante do gene D2R (Neville et al., 2004), e indivíduos portadores do alelo A1 do polimorfismo têm entre 30% –40% menos D2Rs do estriado comparados com aqueles que não carregam o alelo ([Jönsson et al., 1999], [Ritchie e Noble, 2003] e [Stice et al., 2010b]). Além disso, os portadores do alelo A1 também reduziram o metabolismo da glicose nas áreas do cérebro estriado e cortical envolvidas nas respostas hedônicas aos alimentos (Jönsson et al., 1999). Indivíduos portadores do alelo TaqIA A1 estão sobre-representados em populações obesas ([Barnard et al., 2009], [Stice e outros, 2008a] e [Wang et al., 2001]). Além disso, o alelo A1 também aumenta a vulnerabilidade ao álcool, ao opióide e ao vício em estimulantes psicomotores ([Lawford e outros, 2000], [Noble e outros, 1993] e [Noble e outros, 2000]). Descobriu-se que as áreas mesencéfalo provavelmente incluindo o VTA e SN, que fornecem entrada dopaminérgica para o estriado, foram ativadas em resposta a um milkshake palatável em indivíduos controle (Felsted et al., 2010). Por outro lado, a atividade nesses locais do cérebro foi realmente diminuída em resposta à recompensa alimentar nos portadores do alelo A1 (Felsted et al., 2010). Respostas inversas semelhantes na ativação cerebral entre portadores de alelos A1 e não portadores também foram detectadas em locais cerebrais talâmicos e corticais (Felsted et al., 2010). Estes dados são altamente consistentes com um papel fundamental para D2Rs na regulação da responsividade mesostriatal a alimentos palatáveis. Stice e seus colegas (2008a) encontraram uma correlação inversa entre o IMC e a ativação do estriado (caudado e putâmen) em resposta ao milkshake de chocolate saboroso em pacientes humanos. Além disso, essa relação inversa foi mais aparente em indivíduos portadores do alelo TaqIA A1 (Stice et al., 2008a). Ganho de peso futuro nesses indivíduos, medido 1 ano após imagens cerebrais iniciais, mostrou que a magnitude da ativação estriatal em resposta a alimentos palatáveis foi negativamente correlacionada com ganho de peso em indivíduos com o alelo A1 e positivamente correlacionados nos alelos não A1 Stice et al., 2008a). Em um estudo de acompanhamento, foi relatado que a magnitude da ativação do estriatal em resposta à ingestão de alimentos palatáveis, em oposição ao seu consumo real, foi inversamente correlacionada com o ganho de peso ao longo do ano seguinte em indivíduos com o alelo A1, mas positivamente correlacionados em alelos não A1 (Stice et al., 2010b). Esses achados sugerem que os D2Rs regulam a responsividade estriatal aos alimentos palatáveis e que a diminuição da sinalização D2R induzida pelo ganho de peso ou por fatores genéticos pode aumentar a vulnerabilidade à obesidade.
Sinalização D2R deficiente contribui para os défices de recompensa na obesidade
Semelhante aos níveis de D2R estriado negativo em indivíduos humanos obesos, os níveis de D2R também são reduzidos em camundongos e ratos alimentados com uma dieta saborosa (por exemplo, [Colantuoni et al., 2001], [Geiger e outros, 2009] e [Johnson e Kenny] , 2010]) e em ratos geneticamente predispostos a obesidade (ratos Zucker) (Thanos et al., 2008). Nosso laboratório investigou diretamente o papel da interrupção da transmissão da dopamina no estriado em geral, e diminui a sinalização da D2R em particular, nos déficits de recompensa semelhantes ao vício que emergem em ratos durante o desenvolvimento da obesidade (ver Figura 5). Especificamente, testamos os efeitos de diminuir a expressão de D2Rs do estriado em ratos usando interferência de RNA mediada por vírus, em seguida, avaliando os limiares de BSR quando os ratos tiveram acesso somente a ração ou ração combinados com acesso diário 18-23 hr a um palatável dieta (ou seja, uma dieta cafeteria) (Johnson e Kenny, 2010). Descobrimos que a resposta para recompensar a estimulação do LH começou a diminuir quase imediatamente após a exposição à dieta da cafeteria nos ratos knockdown D2R (Johnson e Kenny, 2010; Figura 5). As diminuições nos níveis de D2R do estriado, portanto, aceleram rapidamente o surgimento de hipofuncionalidade de recompensa em ratos com acesso prolongado a alimentos altamente palatáveis, um processo que normalmente leva várias semanas para emergir em ratos de controle com acesso prolongado a dieta palatável. No entanto, o knockdown de D2R estriado em ratos com acesso a ração só não alterou a resposta para recompensa da estimulação LH, sugerindo que a diminuição da sinalização D2R estriatal interage com outras respostas adaptativas induzidas por dieta em circuitos de recompensa do cérebro para desencadear hiposensibilidade de recompensa. Além dos níveis reduzidos de D2R, outros aspectos da transmissão dopaminérgica do estriado também são alterados no cérebro de ratos obesos. Por exemplo, ratos Sprague-Dawley criaram seletividade para ganhar peso rapidamente em uma dieta de alta energia (ratos propensos à obesidade) têm baixos níveis basais e evocados de dopamina no NAc do que ratos que são resistentes ao ganho de peso (ratos resistentes à obesidade) (Geiger et al. al., 2008; ver também Rada et al., 2010). Os ratos obesos também apresentam níveis reduzidos de biossintéticos de dopamina e maquinário de armazenamento, sugerindo que uma falha na produção e liberação de dopamina contribui para déficits na transmissão da dopamina estriada em ratos obesos (Geiger et al., 2008). Ratos que desenvolveram obesidade através do consumo excessivo de uma dieta de alta energia agradável também apresentaram níveis basais e evocados de dopamina menores no NAc em comparação com ratos que tiveram acesso apenas ao padrão de alimentação (Davis et al., 2008) e Geiger et al. 2009]). É importante ressaltar que uma refeição de ração padrão foi suficiente para aumentar os níveis de dopamina no NAc dos ratos controle, enquanto apenas os alimentos altamente palatáveis foram suficientes para desencadear a liberação de dopamina nos ratos obesos que tinham uma história de acesso prolongado ao alimento palatável (Geiger et al., 2009). Esses achados demonstram que o desenvolvimento da obesidade em ratos está associado à disfunção na transmissão de dopamina mesostriatal, mais proeminente nos D2Rs do estriado, e que a sinalização D2R deficiente contribui para o surgimento de déficits de recompensa durante o desenvolvimento da obesidade em ratos. Isso é consistente com o fato de que a regulação negativa de D2Rs no estriado é uma notável resposta neuroadaptativa ao ganho de peso em humanos ([Barnard et al., 2009], [Stice et al., 2008a] e [Wang et al., 2001]) e que a sinalização D2R do estriado deficiente pode atenuar as respostas estriatais ao alimento hedônico em seres humanos, predispondo assim o indivíduo ao ganho de peso futuro ([Stice et al., 2008a] e [Wang et al., 2001]).
Figura 5. Receptores D2 de Dopamina, Disfunção de Recompensa e Compulsividade na Obesidade - O knockdown de receptores D2 de dopamina (D2R) no estriado de ratos acelera o surgimento de disfunção de recompensa e alimentação compulsiva em ratos com acesso estendido a comida saborosa.
Deficiência de sinalização D2R pode desencadear compulsão alimentar na obesidade
A obesidade é caracterizada por excessos que persistem apesar do desejo expresso de limitar o consumo e o conhecimento das consequências negativas profundas da saúde e sociais do consumo excessivo continuado ([Booth et al., 2008], [Delin et al., 1997] e [Puhl et al., 2008]). Isso é exemplificado pelo fato de que muitos pacientes obesos passarão por uma cirurgia bariátrica potencialmente perigosa (controle bypass gástrico) para controlar seu peso (Yurcisin et al., 2009), mas muitas vezes recaem para comer demais, embora a cirurgia diminua as avaliações subjetivas da fome e reduza capacidade de consumir grandes quantidades de alimentos ([Kalarchian et al., 2002] e [Saunders, 2001]). A dependência química é similarmente definida como uma perda de controle inibitório sobre o consumo de drogas e a persistência no hábito, apesar da consciência das consequências potencialmente devastadoras para a saúde, sociais ou financeiras (DSM-IV; American Psychiatric Association, 1994). Como tal, a obesidade e o vício em drogas compartilham as marcas de distúrbios compulsivos, na medida em que há uma falha conspícua em utilizar informações sobre futuras consequências deletérias ao consumo moderado e à persistência no consumo, apesar da disponibilidade de comportamentos alternativos menos prejudiciais.
A ingestão compulsiva de drogas tem sido operacionalmente definida em roedores como o consumo que é resistente à supressão por punição ou estímulos ambientais prevendo a punição ([Pelloux et al., 2007] e [Vanderschuren e Everitt, 2004]). Períodos de acesso prolongado à cocaína e outras drogas de abuso podem impulsionar o surgimento de comportamentos compulsivos de consumo de drogas em ratos ([Ahmed e Koob, 1998], [Deroche-Gamonet e outros, 2004] e [Vanderschuren e Everitt, 2004] ). De fato, ratos com histórico de consumo extenso de cocaína exibem ingestão que é resistente à ruptura por um estímulo condicionado (CS) aversivo que prevê um desfecho negativo (isto é, uma luz indicadora que prevê a entrega de choque aéreo) (Belin et al., 2008) e [Vanderschuren e Everitt, 2004]). Por outro lado, o mesmo CS aversivo pode diminuir profundamente as respostas de busca de drogas em ratos com acesso relativamente limitado à droga. Considerando as semelhanças entre o uso compulsivo de drogas no vício e excessos na obesidade, investigamos recentemente se ratos obesos consumiriam alimentos saborosos de maneira compulsiva e se os D2Rs do estriado desempenham um papel nesse processo (Johnson e Kenny, 2010). Descobrimos que ratos obesos com uma história de acesso prolongado a alimentos palatáveis continuaram a comer alimentos saborosos, mesmo na presença de um CS nocivo (um sinal de luz) que previa a entrega de choque nas patas (Johnson e Kenny, 2010). Em contraste, o mesmo CS aversivo interrompeu o consumo de comida palatável em ratos magros com exposição muito limitada a comida palatável densa de energia. Consumo de comida palatável pode, portanto, tornar-se compulsivo em ratos obesos da mesma maneira que o consumo de cocaína pode se tornar compulsivo. Consistente com essa interpretação dos dados, os ratos que anteriormente tinham acesso a uma dieta rica em gordura e palatável passaram mais tempo em um ambiente aversivo (iluminado) para obter a comida saborosa do que os ratos que não tinham experiência prévia com a dieta (Teegarden and Bale , 2007). Por causa do medo de predação, as arenas abertas iluminadas são altamente aversivas aos ratos (Suarez e Gallup, 1981). Os camundongos, portanto, tornam-se resistentes às conseqüências potencialmente negativas de seu comportamento de forrageamento e arriscam a predação para obter alimentos saborosos, mesmo quando alimentos menos saborosos estão disponíveis em um risco bem menor.
Curiosamente, o alelo A1 do polimorfismo TaqIA que resulta na diminuição da densidade D2R do estriado (Noble, 2000) e ativação embotada do estriado em resposta a alimentos palatáveis (Stice et al., 2008a) também está associado a déficits na aprendizagem para evitar ações que consequências negativas (Klein et al., 2007). É precisamente esse tipo de falha em utilizar informações relacionadas a consequências negativas futuras de comer em excesso que podem contribuir para o desenvolvimento da compulsão alimentar em indivíduos obesos. Descobrimos que o surgimento de compulsão-como comer em ratos com acesso a comida saborosa foi dramaticamente acelerado após knockdown D2R striatal (Johnson e Kenny, 2010). De fato, ratos com knockdown de D2R estriado que anteriormente tinham apenas 14 dias de acesso estendido a alimentos palatáveis densos em energia exibiam consumo de comida apetecível que era resistente a rompimento por um CS aversivo (Johnson e Kenny, 2010; Figura 5). No entanto, este período do dia 14 de exposição limitada ao alimento saboroso não foi suficiente para induzir uma alimentação compulsiva em ratos de controlo (Johnson e Kenny, 2010). Essas descobertas sugerem que a ingestão compulsiva de alimentos apetitosos, semelhante à dependência, pode surgir em ratos obesos. Além disso, a sinalização D2R do estriado deficiente, que acelera o surgimento da hipossensibilidade à recompensa em resposta ao consumo excessivo de alimentos palatáveis, também acelera o surgimento de uma alimentação compulsiva (Figura 5).
Interações entre os D2Rs e os Reguladores Hormonais do Balanço Energético na Obesidade
A leptina exógena administrada na VTA inibe a transmissão da dopamina mesoacumba e o comportamento de alimentação ([Hommel et al., 2006] e [Krügel et al., 2003]). Além de seu efeito inibitório agudo sobre os sistemas de dopamina do mesencéfalo, há evidências acumuladas de que a sinalização tônica da leptina também pode ser necessária para manter níveis adequados de sinalização de dopamina mesostriatal. Flier e colegas descobriram que os camundongos ob / ob tinham níveis mais baixos de tirosina hidroxilase nos neurônios dopaminérgicos mesencefálicos, uma enzima chave na biossíntese da dopamina (Fulton et al., 2006). Além disso, camundongos ob / ob reduziram a liberação de dopamina evocada no NAc (Fulton et al., 2006) e diminuíram as reservas vesiculares somatodendríticas da dopamina em VTA e SN (Roseberry et al., 2007). Estas deficiências na produção de dopamina e maquinário de transdução de sinal em camundongos ob / ob foram corrigidas pelo tratamento com leptina ([Fulton et al., 2006] e [Pfaffly et al., 2010]). De facto, a leptina infundida apenas na LH foi suficiente para corrigir a transmissão disfuncional da dopamina em ratinhos ob / ob (Leinninger et al., 2009), sugerindo que as células que expressam o receptor da leptina na LH actuam para manter níveis adequados de sinalização da dopamina. Além da diminuição da produção e liberação de dopamina, os camundongos ob / ob também tenderam a ter níveis mais baixos de expressão de D2R no estriado (Pfaffly et al., 2010). Além disso, o tratamento exógeno com leptina sob um regime que resulta no desenvolvimento de insensibilidade à sinalização da leptina (isto é, resistência à leptina) reduziu acentuadamente os níveis de D2R do estriado em camundongos do tipo selvagem (Pfaffly et al., 2010). Ratos obesos desenvolvem resistência à leptina na VTA ([Matheny et al., 2011] e [Scarpace et al., 2010]) e também têm níveis mais baixos de TH em VTA, diminuição da liberação de dopamina no corpo estriado e níveis reduzidos de D2R no estriado (Geiger et al., 2008). Tomados em conjunto, estes dados demonstram que a leptina tem ações complexas nos sistemas de dopamina do mesencéfalo. Por um lado, a ativação aguda dos receptores de leptina na VTA exerce um efeito inibitório na transmissão da dopamina mesoacumba e pode inibir o comportamento alimentar (Hommel et al., 2006) e [Krügel et al., 2003]. Por outro lado, a sinalização da leptina no mesencéfalo é necessária para manter a produção adequada de dopamina e transmissão de sinal, e os déficits genéticos na sinalização da leptina ou o desenvolvimento de resistência à leptina na obesidade perturbam profundamente os sistemas de dopamina mesoaccumbens. Como tal, é uma possibilidade interessante que o desenvolvimento de resistência à leptina em neurônios dopaminérgicos mesencefálicos durante o desenvolvimento da obesidade possa desempenhar um papel central na ruptura da sinalização D2R do estriado que parece impulsionar o surgimento da disfunção de recompensa tipo vício e excessos compulsivos. (Figura 5) em ratos obesos.
Além dos efeitos complexos da sinalização da leptina na transmissão dopaminérgica mesostriatal, há evidências acumuladas de que os D2Rs podem, por sua vez, regular a sinalização da leptina. A bromocriptina agonista do D2R reduz os níveis circulantes de leptina ([Doknic et al., 2002], [Kok et al., 2006] e [Mastronardi et al., 2001]), sugerindo que os D2Rs exercem uma influência inibitória nos níveis de leptina. Além disso, camundongos com mutação nula no gene D2R aumentaram a sinalização da leptina no hipotálamo e são mais sensíveis aos efeitos anoréticos da leptina (Kim et al., 2010). É bem conhecido que os níveis de leptina aumentam durante o desenvolvimento da obesidade (hiperleptinemia), embora haja uma diminuição concomitante na sensibilidade à sinalização da leptina (isto é, resistência à leptina) (Hamilton et al., 1995). Assim, é interessante a possibilidade de que diminuições na sinalização do D2R do estriado durante o desenvolvimento da obesidade possam representar uma resposta compensatória ao consumo excessivo de alimentos palatáveis e ganho de peso que aumenta os níveis circulantes de leptina e aumenta sua eficiência de sinalização para superar o desenvolvimento de resistência à leptina. Tal ação pode potencializar os efeitos inibitórios da leptina sobre sistemas estriatais que regulam a responsividade a alimentos palatáveis ([Farooqi et al., 2007], [Fulton et al., 2006] e [Hommel et al., 2006]), agindo assim para atenuar as respostas hedônicas aos alimentos palatáveis. Colocando este achado em conjunto com o papel regulador da leptina nos D2Rs descritos acima, parece que a sinalização de leptina e D2R pode ser acoplada de maneira recíproca para regular aspectos homeostáticos e hedônicos do comportamento alimentar.
Sistemas de estresse cerebral desregulados na obesidade
A sinalização da leptina no mesencéfalo atua na regulação da transmissão da dopamina mesoacumba e na responsividade ao alimento hedônico. No entanto, neurônios na VTA que expressam receptores de leptina se projetam esparsamente para o NAc e, em vez disso, demonstram projeções mais proeminentes para o núcleo central da amígdala (CeA) (Leshan et al., 2010). No contexto do comportamento alimentar, o CeA é conhecido por regular os efeitos inibitórios de estímulos ambientais nocivos no consumo de alimentos (Petrovich et al., 2009). Especificamente, lesões do CeA, mas não da amígdala basolateral (BLA), abolem os efeitos inibitórios de um estímulo condicionado emparelhado com choque na alimentação, sugerindo que o CeA é crítico para o controle inibitório sobre o comportamento alimentar em resposta a sinais ambientais que predizem resultados negativos ( Petrovich et al., 2009). Ratos obesos, ou ratos não obesos com knockdown D2R no estriado e acesso a alimentos saborosos, continuam a consumir alimentos palatáveis de maneira compulsiva na presença de uma SC aversiva. Estes efeitos são surpreendentemente semelhantes à ruptura na reatividade a um CS aversivo em ratos lesionados com CeA (Petrovich et al., 2009). Assim, será importante determinar se as alterações na atividade CeA, talvez como conseqüência de downregulation D2R estriatal ou desenvolvimento de resistência à leptina no mesencéfalo, contribuem para o surgimento de compulsão alimentar em ratos obesos.
Além de regular os efeitos de estímulos ambientais nocivos sobre o comportamento alimentar, o CeA também pode desempenhar um papel fundamental na alimentação hedônica relacionada ao estresse. Em humanos, o estresse motiva poderosamente a seleção e o consumo de alimentos palatáveis com alta densidade energética, independente da necessidade calórica ([Gluck et al., 2004], [Kandiah et al., 2006] e [O'Connor et al., 2008]) , e a obesidade está associada à secreção elevada de glicocorticoides relacionada ao estresse ([Björntorp e Rosmond, 2000] e [la Fleur, 2006]). Estressores ambientais e sociais também induzem hiperfagia de alimentos palatáveis com alta densidade energética em roedores e macacos, com o consumo de alimentos palatáveis potencialmente atenuando os efeitos adversos do estresse ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et al. al., 2004] e [Wilson et al., 2008]). Além disso, a droga que evoca estresse ioimbina pode restabelecer respostas de busca de comida palatável previamente extinta (pressão de alavanca) em ratos, um efeito atenuado pelo antagonista do receptor do fator de liberação de corticotropina-1 (CRF-1) antalarmina (Ghitza et al., 2006 ) É importante ressaltar que os efeitos precisos do estresse no consumo de alimentos em humanos e animais de laboratório dependem da natureza e magnitude do estressor, do tipo de alimento disponível para consumo (palatável versus insosso), do peso corporal e do sexo (Dallman , 2010).
Camundongos com acesso prolongado a uma dieta rica em gordura e palatável tiveram diminuição da expressão do hormônio do estresse CRF no CeA (Teegarden and Bale, 2007). Por outro lado, os ratos submetidos à “retirada” da dieta palatável aumentaram a expressão do CRF no CeA (Teegarden and Bale, 2007). Este último efeito é muito semelhante ao aumento da expressão do CRF no CeA detectado em ratos submetidos à retirada de todas as principais drogas de abuso (Koob, 2010). Como o uso adicional de drogas pode normalizar essa resposta neurobiológica aversiva à retirada de drogas, tem sido levantado a hipótese de que a transmissão de FLC hiperativa em CeA e outras estruturas límbicas pode facilitar o desenvolvimento do uso compulsivo de drogas (Koob e Zorrilla, 2010). Em consonância com essa visão, os camundongos submetidos à retirada do alimento palatável e denso em energia, que tinham níveis elevados de CRF no CeA, gastaram significativamente mais tempo em um ambiente aversivo para obter comida saborosa do que os ratos sem experiência prévia com o alimento. embora menos palatável estava disponível em um ambiente não-eversivo (escuro iluminado) (Teegarden e Bale, 2007). Os camundongos, portanto, tornam-se resistentes às conseqüências potencialmente negativas de seu comportamento de forrageamento e arriscam a predação para obter alimentos saborosos, mesmo quando alimentos menos palatáveis estão disponíveis em um perigo bem menor, em parte para atenuar a transmissão de CRF no CeA (Teegarden and Bale, 2007). Várias outras evidências apoiam um papel para a transmissão da ACR na alimentação compulsiva. Em particular, um estudo recente avaliou os efeitos do antagonista do receptor CRF-1 R121919 no consumo de alimentos em ratos submetidos à variação cíclica em sua dieta em que eles tiveram acesso a ração padrão 5 dias por semana e acesso a uma dieta de açúcar palatável 2 dias por semana (Cottone et al., 2009). Após 7 semanas desta variação cíclica na dieta, R121919 atenuou o consumo excessivo da dieta altamente palatável e aumento do consumo de comida bland (Cottone et al., 2009). Além disso, os níveis de expressão de CRF no CeA foram aumentados nos ratos ciclados durante a retirada da dieta palatável, mas retornaram aos níveis basais após reexposição à dieta palatável (Cottone et al., 2009). Finalmente, a regulação da CRF da transmissão GABAérgica no CeA foi aumentada nos ratos ciclados submetidos à retirada da dieta palatável em comparação com os ratos controle que anteriormente tinham acesso apenas à comida, refletido no fato de que R121919 interrompeu o potencial pós-sináptico inibitório GABAérgico em CeA corta os ratos ciclados em uma concentração que não alterou a transmissão em fatias dos ratos controle (Cottone et al., 2009). Curiosamente, um efeito semelhante de CRF na transmissão GABAérgica em CeA também foi observado em ratos submetidos à retirada da exposição crônica ao etanol (Roberto et al., 2010). Finalmente, o CeA, o leito nuclear da estria terminalis (BNST) e a concha de NAc constituem uma estrutura contígua maior denominada “amígdala estendida”. A infusão de CRF na concha de NAc em locais que estimulam a alimentação hedônica aumenta a saliência motivacional de um ambiente sugestão que anteriormente tinha sido emparelhado com a disponibilidade de alimentos saborosos (Peciña et al., 2006a). O estresse pode, portanto, aumentar a saliência de estímulos ambientais pareados por alimentos, modulando a atividade dos neurônios da casca do NAc. Em conjunto, esses achados sugerem que o consumo excessivo de alimentos saborosos ou drogas de abuso pode induzir respostas neuroadaptativas similares nas vias de estresse extra-hipotalâmicas no cérebro, o que pode contribuir para comportamentos consumatórios compulsivos.
Conclusões
Muito progresso foi feito recentemente na identificação de sistemas cerebrais envolvidos nos efeitos hedônicos de alimentos saborosos e as adaptações que ocorrem nesses circuitos em resposta ao consumo excessivo de alimentos saborosos e ganho de peso. É surpreendente que sistemas cerebrais semelhantes e respostas adaptativas comuns sejam acionados em resposta ao consumo de alimentos saborosos e drogas que causam dependência. Em particular, o consumo excessivo de alimentos saborosos ou drogas de abuso induz déficits semelhantes na capacidade de resposta dos sistemas de recompensa do cérebro. Alimentos saborosos e drogas aditivas induzem déficits na transmissão de dopamina estriatal e na expressão de D2Rs estriatal. Alimentos saborosos e drogas que causam dependência também desencadeiam o surgimento de um comportamento de consumo compulsivo em roedores e envolvem respostas de estresse extra-hipotalâmico. Finalmente, vulnerabilidades genéticas comuns nos sistemas de recompensa do cérebro podem predispor os indivíduos a comer demais e a obesidade, e também ao uso de drogas e vício. Na verdade, com base nessas e em outras semelhanças entre obesidade e dependência de drogas, argumentou-se que a obesidade deveria ser incluída como uma categoria diagnóstica no futuro DSM-V ([Devlin, 2007] e [Volkow e O'Brien, 2007] ) Com isso em mente, as áreas críticas para pesquisas futuras envolverão uma investigação mais aprofundada das possíveis sobreposições neurobiológicas entre a alimentação compulsiva e o uso de drogas. Por exemplo, será importante testar se a obesidade está relacionada ao desenvolvimento de comportamento consumador do hábito resultante da plasticidade no corpo estriado dorsal da mesma forma que o vício em drogas pode estar relacionado à remodelação estriatal e ao surgimento de busca de drogas semelhante ao hábito comportamentos ([Everitt e Robbins, 2005], [Hollander et al., 2010] e [Kasanetz et al., 2010]). Além disso, as regiões corticais do cérebro envolvidas no controle executivo e na tomada de decisão (ou seja, córtex pré-frontal) e no processamento interoceptivo (córtex insular) têm sido fortemente implicadas na dependência de drogas ([Everitt et al., 2008], [Fineberg et al., 2010 ], [Koob e Volkow, 2010] e [Naqvi e Bechara, 2009]), mas pouco se sabe sobre seu papel preciso na alimentação compulsiva e na obesidade, por exemplo, ([Nair et al., 2011] e [Volkow et al. , 2009]). Tomados em conjunto, os dados revisados acima apoiam a noção de que a obesidade e o vício em drogas podem surgir de respostas neuroadaptativas semelhantes em circuitos de recompensa do cérebro e sugerem que os mecanismos conhecidos de vício podem fornecer uma estrutura heurística para compreender a obesidade.
Agradecimentos
O autor é apoiado por doações do Instituto Nacional sobre Drug Abuse (NIDA). O autor é grato a Paul Johnson e Christie Fowler por valiosas percepções e comentários sobre o manuscrito. Este é o número do manuscrito 21042 do The Scripps Research Institute.
Referências
1.
o Abizaid e outros, 2006a
o A. Abizaid, Q. Gao, TL Horvath
o Pensamentos para alimentação: Mecanismos cerebrais e balanço energético periférico
o Neurônio, 51 (2006), pp. 691 – 702
o
2.
Abizaid et al., 2006b
A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschop et ai.
O grelelino modula a atividade e a organização da entrada sináptica dos neurônios dopaminérgicos mesencefálicos, promovendo o apetite
o J. Clin. Invest., 116 (2006), pp. 3229 – 3239
o
3.
Ahmed e Koob, 1998
o SH Ahmed, GF Koob
o Transição de moderada para excessiva ingestão de drogas: Alteração no set point hedônico
o Ciência, 282 (1998), pp. 298 – 300
o
4.
Ahmed e Koob, 2005
o SH Ahmed, GF Koob
o Transição para dependência de drogas: Um modelo de reforço negativo baseado em uma diminuição alostática na função de recompensa
o Psicofarmacologia (Berl.), 180 (2005), pp. 473-490
o
5.
o Ahmed et al., 2002
o SH Ahmed, Kenny PJ, GF Koob, A. Markou
Evidência neurobiológica da alostase hedônica associada ao uso crescente de cocaína
o Nat. Neurosci., 5 (2002), pp. 625 – 626
o
6.
o Allison et al., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItallie
o Mortes anuais atribuíveis à obesidade nos Estados Unidos
o JAMA, 282 (1999), pp. 1530-1538
o
7.
o Associação Psiquiátrica Americana, 1994
o Associação Psiquiátrica Americana
o Manual Diagnóstico e Estatístico de Transtornos Mentais
(Quarta Edição) American Psychiatric Association, Washington, DC (1994)
o
8.
o Angeles-Castellanos e outros, 2007
o M. Angeles-Castellanos, J. Mendoza, C. Escobar
o Ritmos diários de mudança de fase dos ritmos de alimentação restrita de c-Fos e imunorreatividade da proteína Per1 em regiões corticolímbicas de ratos
o Neurociência, 144 (2007), pp. 344 – 355
o
9.
o Baicy et al., 2007
o K. Baicy, ED Londres, J. Monterosso, ML Wong, T. Delibasi, A. Sharma, J. Licinio
A reposição de leptina altera a resposta do cérebro a estímulos alimentares em adultos geneticamente deficientes em leptina
o Proc. Natl. Acad. Sci. EUA, 104 (2007), pp. 18276 – 18279
o
10.
o Baldo et al., 2004
o BA Baldo, L. Gual-Bonilla, K. Sijapati, RA Daniel, CF Landry, AE Kelley
o Ativação de uma subpopulação de neurônios hipotalâmicos contendo orexina / hipocretina pela inibição mediada pelo receptor GABAA da concha do núcleo accumbens, mas não pela exposição a um novo ambiente
o Eur. J. Neurosci., 19 (2004), pp. 376-386
o
11.
o Balleine e Dickinson, 2000
o BW Balleine, A. Dickinson
O efeito das lesões do córtex insular sobre o condicionamento instrumental: evidências de um papel na memória de incentivo
o J. Neurosci., 20 (2000), pp. 8954-8964
o
12.
o Barnard e outros, 2009
o ND Barnard, EP Nobre, T. Ritchie, J. Cohen, DJ Jenkins, G. Turner-McGrievy, L. Gloede, AA Verde, H. Ferdowsian
o polimorfismo do receptor de dopamina D2 Taq1A, peso corporal e ingestão dietética no diabetes tipo 2
o Nutrição, 25 (2009), pp. 58 – 65
o
13.
Basso e Kelley, 1999
o AM Basso, AE Kelley
o Alimentação induzida pela estimulação do receptor GABA (A) dentro da casca do nucleus accumbens: Mapeamento e caracterização regional do macronutriente e preferência do gosto
o Behav. Neurosci., 113 (1999), pp. 324 – 336
o
14.
o Batterham et al., 2007
o RL Batterham, ffytche do DH, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
PYY modulação de áreas cerebrais corticais e hipotalâmicas prediz comportamento alimentar em humanos
o Natureza, 450 (2007), pp. 106 – 109
o
15.
o Baxter e Murray, 2002
o MG Baxter, EA Murray
o amígdala e recompensa
o Nat. Rev. Neurosci., 3 (2002), pp. 563-573
o
16.
o Bean et al., 2008
o MK Bean, K. Stewart, ME Olbrisch
Obesidade na América: Implicações para psicólogos clínicos e de saúde
o J. Clin. Psychol. Med. Configurações, 15 (2008), pp. 214 – 224
o
17.
o Beaver et al., 2006
JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o Diferenças individuais na unidade de recompensa prevêem respostas neurais a imagens de alimentos
o J. Neurosci., 26 (2006), pp. 5160-5166
o
18.
o Belin et al., 2008
D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o Alta impulsividade prediz a mudança para o consumo compulsivo de cocaína
o Ciência, 320 (2008), pp. 1352 – 1355
o
19.
o Berridge, 1996
o KC Berridge
o recompensa alimentar: substratos cerebrais de querer e gostar
o Neurosci. Biobehav. Rev., 20 (1996), pp. 1 – 25
o
20.
o Berridge, 2009
o KC Berridge
o 'Gostar' e 'querer' recompensas alimentares: substratos cerebrais e papéis nos transtornos alimentares
o Physiol. Behav., 97 (2009), pp. 537 – 550
o
21.
o Björntorp e Rosmond, 2000
o P. Björntorp, R. Rosmond
o Obesidade e cortisol
o Nutrição, 16 (2000), pp. 924 – 936
o
22.
Blundell e Herberg, 1968
o JE Blundell, LJ Herberg
o Efeitos relativos do déficit nutricional e do período de privação sobre a taxa de auto-estimulação elétrica do hipotálamo lateral
o Natureza, 219 (1968), pp. 627 – 628
o
23.
o Booth et al., 2008
o Cabine ML, RL Wilkenfeld, DL Pagnini, Cabine SL, LA King
o Percepções de adolescentes sobre sobrepeso e obesidade: o peso do estudo de opinião
o J. Paediatr. Saúde da criança, 44 (2008), pp. 248 – 252
o
24.
o Bragulat e outros, 2010
V. Bragulat, M. Dzemidzic, C. Bruno, CA Cox, T. Talavage, RV Considine, DA Kareken
o Sondas de odores relacionados ao alimento dos circuitos de recompensa do cérebro durante a fome: um estudo piloto de fMRI
Obesidade, Silver Spring, MD (2010)
o
25.
o Cabanac e Johnson, 1983
o M. Cabanac, KG Johnson
o Análise de um conflito entre palatabilidade e exposição ao frio em ratos
o Physiol. Behav., 31 (1983), pp. 249 – 253
o
26.
o Campfield et al., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Queimadura
Proteína OB recombinante de camundongo: evidência de um sinal periférico ligando adiposidade e redes neurais centrais
o Ciência, 269 (1995), pp. 546 – 549
o
27.
o canhão e palmitador, 2003
o CM Cannon, RD Palmiter
o Recompensa sem dopamina
o J. Neurosci., 23 (2003), pp. 10827-10831
o
28.
o Carr e Simon, 1984
o KD Carr, EJ Simon
o Potenciação da recompensa pela fome é mediada por opiáceos
o Cérebro Res., 297 (1984), pp. 369-373
o
29.
o Centros de Controle e Prevenção de Doenças, 2009
o Centros de Controle e Prevenção de Doenças (2009). Tendências de Obesidade nos EUA (Atlanta: Centros de Controle e Prevenção de Doenças).
o
30.
o Colantuoni et al., 2001
C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, G. Schwartz, TH Moran, BG Hoebel.
O consumo excessivo de açúcar altera a ligação aos receptores dopaminérgicos e mu-opióides no cérebro
o Neuroreport, 12 (2001), pp. 3549 – 3552
o
31.
o Cornelius et al., 2010
JR Cornelius, M. Tippmann-Peikert, NL Slocumb, CF Frerichs, MH Silber
o Transtornos do controle do impulso com o uso de agentes dopaminérgicos na síndrome das pernas inquietas: um estudo caso-controle
o Sleep, 33 (2010), pp. 81 – 87
o
32.
o Cornier e outros, 2009
o MA Cornier, AK Salzberg, DC Endly, DH Bessens, DC Rojas, JR Tregellas
o Os efeitos da superalimentação na resposta neuronal a estímulos visuais de alimentos em indivíduos magros e obesos reduzidos
o PLoS ONE, 4 (2009), p. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone e outros, 2009
P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, M. Fekete, L. Steardo, KC Rice, DE Grigoriadis et al.
o recrutamento do sistema CRF medeia o lado negro da compulsão alimentar
o Proc. Natl. Acad. Sci. EUA, 106 (2009), pp. 20016 – 20020
o
34.
o Dagher, 2009
o A. Dagher
o neurobiologia do apetite: fome como vício
o Int. J. Obes. (Lond), 33 (Supl 2) (2009), pp. S30-S33
o
35.
o Dagher e Robbins, 2009
o A. Dagher, TW Robbins
o Personalidade, vício, dopamina: percepções da doença de Parkinson
o Neurônio, 61 (2009), pp. 502 – 510
o
36.
o Dallman, 2010
o MF Dallman
o Obesidade induzida pelo estresse e o sistema nervoso emocional
o Tendências Endocrinol. Metab., 21 (2010), pp. 159 – 165
o
37.
o Dallman et al., 2003
o MF Dallman, N. Pecoraro, SF Akana, SE La Fleur, F. Gomez, H. Houshyar, ME Bell, S. Bhatnagar, KD Laugero, S. Manalo
o estresse crônico e obesidade: uma nova visão de "comfort food"
o Proc. Natl. Acad. Sci. EUA, 100 (2003), pp. 11696 – 11701
o
38.
o Dallman et al., 2006
MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
Glucocorticóides, estresse crônico e obesidade
o Prog. Cérebro Res., 153 (2006), pp. 75 – 105
o
39.
o Davis et al., 2004
C. Davis, S. Strachan, M. Berkson
o Sensibilidade à recompensa: Implicações para excessos e excesso de peso
o Apetite, 42 (2004), pp. 131 – 138
o
40.
o Davis et al., 2008
JF Davis, Tracy AL, JD Schurdak, MH Tschöp, JW Lipton, Clegg DJ, SC Benoit
o A exposição a níveis elevados de gordura na dieta atenua a recompensa do psicoestimulante e o turnover da dopamina mesolímbica no rato
o Behav. Neurosci., 122 (2008), pp. 1257 – 1263
o
41.
o de Araújo e outros, 2010
o IE de Araújo, X. Ren, JG Ferreira
o Sensibilidade metabólica em sistemas de dopamina no cérebro
o Resultados Probl. Diferença Celular, 52 (2010), pp. 69 – 86
o
42.
o Delin et al., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
Comportamento alimentar e a experiência da fome após cirurgia de bypass gástrico para obesidade mórbida
Obes. Surg., 7 (1997), pp. 405 – 413
o
43.
o Deroche-Gamonet e outros, 2004
V. Deroche-Gamonet, D. Belin, PV Piazza
o Evidências de comportamento semelhante ao vício no rato
o Ciência, 305 (2004), pp. 1014 – 1017
o
44.
o Devlin, 2007
o MJ Devlin
o Existe um lugar para a obesidade no DSM-V?
o Int. J. Coma. Disord., 40 (Supl) (2007), pp. S83-S88
o
45.
o Doknic e outros, 2002
o M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
o Tom dopaminérgico e obesidade: uma visão dos prolactinomas tratados com bromocriptina
o Eur. J. Endocrinol., 147 (2002), pp. 77-84
o
46.
Everitt e Robbins, 2005
o BJ Everitt, TW Robbins
o Sistemas neurais de reforço para a dependência de drogas: das ações aos hábitos à compulsão
o Nat. Neurosci., 8 (2005), pp. 1481 – 1489
o
47.
o Everitt et al., 2008
o BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o revisão. Mecanismos neurais subjacentes à vulnerabilidade para desenvolver hábitos compulsivos de busca de drogas e dependência
o Philos. Trans. R. Soc. Lond. Biol. Sci., 363 (2008), pp. 3125 – 3135
o
48.
o Farooqi et al., 2007
o IS Farooqi, E. Bullmore, J. Keogh, J. Gillard, S. O'Rahilly, PC Fletcher
Leptina regula regiões estriadas e comportamento alimentar humano
o Science, 317 (2007), p. 1355
o
49.
o Felsted e outros, 2010
JA Felsted, X. Ren, F. Chouinard-Decorte, DM Pequeno
o Genetically determinadas diferenças na resposta do cérebro a uma recompensa alimentar primária
o J. Neurosci., 30 (2010), pp. 2428-2432
o
50.
o Figlewicz e outros, 2001
DP Figlewicz, MS Higgins, SB Ng-Evans, PJ Havel
Leptina reverte a preferência de lugar condicionado à sacarose em ratos com restrição alimentar
o Physiol. Behav., 73 (2001), pp. 229 – 234
o
51.
o Figlewicz e outros, 2003
DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o Expressão de receptores para insulina e leptina na área tegmentar ventral / substância negra (VTA / SN) do rato
o Cérebro Res., 964 (2003), pp. 107-115
o
52.
o Fineberg et al., 2010
o NA Fineberg, MN Potenza, SR Chamberlain, HA Berlim, L. Menzies, A. Bechara, BJ Sahackian, TW Robbins, ET Bullmore, E. Hollander.
o Sondar comportamentos compulsivos e impulsivos, de modelos animais a endofenótipos: uma revisão narrativa
o Neuropsychopharmacology, 35 (2010), pp. 591-604
o
53.
o Finkelstein e outros, 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
o Causas econômicas e conseqüências da obesidade
o Annu. Rev. Public Health, 26 (2005), pp. 239 – 257
o
54.
o Flegal et al., 2010
o KM Flegal, Carroll MD, CL Ogden, LR Curtin
o Prevalência e tendências na obesidade entre adultos americanos, 1999-2008
o JAMA, 303 (2010), pp. 235-241
o
55.
o Foo e Mason, 2005
o H. Foo, P. Mason
o Supressão sensorial durante a alimentação
o Proc. Natl. Acad. Sci. EUA, 102 (2005), pp. 16865 – 16869
o
56.
o Franken e Muris, 2005
o IH Franken, P. Muris
o Diferenças individuais na sensibilidade à recompensa estão relacionadas ao desejo por comida e ao peso corporal relativo em mulheres saudáveis
o Apetite, 45 (2005), pp. 198 – 201
o
57.
o Friedman et al., 2011
o A. Friedman, E. Lax, Y. Dikshtein, L. Abraham, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
o A estimulação elétrica da habenula lateral produz um efeito inibitório na auto-administração da sacarose
o Neurofarmacologia, 60 (2011), pp. 381 – 387
o
58.
o Fulton e outros, 2000
o S. Fulton, B. Woodside, P. Shizgal
o Modulação do circuito de recompensa cerebral pela leptina
o Ciência, 287 (2000), pp. 125 – 128
o
59.
o Fulton e outros, 2006
o S. Fulton, P. Pissios, Manchon RP, L. Stiles, L. Frank, EN Pothos, Maratos E.-Flier, JS Flier
o Regulação da leptina da via da dopamina mesoaccumbens
o Neurônio, 51 (2006), pp. 811 – 822
o
60.
o Gao e Horvath, 2007
o Q. Gao, TL Horvath
o Neurobiologia da alimentação e gasto energético
o Annu. Rev. Neurosci., 30 (2007), pp. 367-398
o
61.
o Gautier e outros, 2000
JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
o Respostas cerebrais diferenciais à saciedade em homens obesos e magros
o Diabetes, 49 (2000), pp. 838-846
o
62.
Geiger e outros, 2008
BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, EG Kokkotou, EN Pothos
o Evidência de exocitose dopaminérgica mesolímbica defeituosa em ratos obesos
o FASEB J., 22 (2008), pp. 2740-2746
o
63.
Geiger e outros, 2009
o BM Geiger, M. Haburcak, NM Avena, Moyer MC, BG Hoebel, Pothos EN
o Déficits da neurotransmissão de dopamina mesolímbica na obesidade da dieta de ratos
o Neurociência, 159 (2009), pp. 1193 – 1199
o
64.
o Ghitza et al., 2006
o UE Ghitza, SM Cinza, DH Epstein, KC Rice, Y. Shaham
o Neuropsicofarmacologia
o A droga ansiogênica ioimbina restaura a busca por alimentos palatáveis em um modelo de recaída de ratos: um papel dos receptores de CRF (1), 33 (2006), pp. 2188-2196
o
65.
Gluck et al., 2004
o ME Gluck, A. Geliebter, J. Hung, E. Yahav
o Cortisol, fome e desejo de compulsão alimentar após um teste de estresse frio em mulheres obesas com transtorno da compulsão alimentar periódica
o Psicossom. Med., 66 (2004), pp. 876 – 881
o
66.
o Goldstone et al., 2009
- AP Goldstone, CG Prechtl de Hernandez, JD Beaver, K. Muhammed, C. Croese, G. Bell, G. Durighel, E. Hughes, AD, Waldman, G. Frost, JD Bell.
o Preconceitos de jejum sistemas de recompensa do cérebro para alimentos de alto teor calórico
o Eur. J. Neurosci., 30 (2009), pp. 1625-1635
o
67.
o Halaas e outros, 1995
JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, Burley SK, JM Friedman
o Efeitos redutores de peso da proteína plasmática codificada pelo gene obeso
o Ciência, 269 (1995), pp. 543 – 546
o
68.
o Hamilton et al., 1995
o BS Hamilton, D. Paglia, AY Kwan, M. Deitel
o Aumento da expressão de mRNAs obesos em células de gordura omental de humanos com obesidade maciça
o Nat. Med., 1 (1995), pp. 953 – 956
o
69.
o Hernandez e Hoebel, 1988
o L. Hernandez, BG Hoebel
o A recompensa alimentar e a cocaína aumentam a dopamina extracelular no nucleus accumbens, conforme medido por microdiálise
o Vida Sci., 42 (1988), pp. 1705 – 1712
o
70.
o Hill et al., 2003
o JO Hill, HR Wyatt, Reed GW, JC Peters
o Obesidade e o meio ambiente: para onde vamos a partir daqui?
o Ciência, 299 (2003), pp. 853 – 855
o
71.
o Hoebel, 1969
o BG Hoebel
o Alimentação e auto-estimulação
o Ann. NY Acad. Sci., 157 (1969), pp. 758 – 778
o
72.
o Hoebel e Balagura, 1967
o BG Hoebel, S. Balagura
o Auto-estimulação do hipotálamo lateral modificado pela insulina e glucagon
o Physiol. Behav., 2 (1967), pp. 337 – 340
o
73.
Hoebel e Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Controle hipotalâmico da alimentação e autoestimulação
o Ciência, 135 (1962), pp. 375 – 377
o
74.
o Hoebel e Thompson, 1969
o BG Hoebel, RD Thompson
o Aversão à estimulação hipotalâmica lateral causada por alimentação intragástrica ou obesidade
o J. Comp. Physiol. Psychol., 68 (1969), pp. 536-543
o
75.
Hofmann et al., 2010
W. Hofmann, GM van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o prazer se desenrola: respostas hedônicas a comida tentadora
o Psychol. Sci., 21 (2010), pp. 1863 – 1870
o
76.
o Holanda e Gallagher, 2004
o PC Holland, M. Gallagher
Interações Amígdala-frontais e expectativa de recompensa
o Curr. Opin. Neurobiol., 14 (2004), pp. 148 – 155
o
77.
Hollander e outros, 2010
JA Hollander, OI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahlestedt, MD Conkright, Kenny PJ
o microRNA do Striatal controla a ingestão de cocaína através da sinalização CREB
o Natureza, 466 (2010), pp. 197 – 202
o
78.
o Hommel et al., 2006
JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
A sinalização do receptor de leptina em neurônios dopaminérgicos mesencefálicos regula a alimentação
o Neurônio, 51 (2006), pp. 801 – 810
o
79.
o Imaizumi et al., 2001
o M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o Preferência por alimentos ricos em gordura em ratos: batatas fritas em comparação com batatas cozidas
o Apetite, 36 (2001), pp. 237 – 238
o
80.
o Jerlhag e outros, 2006
o E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
A grelina estimula a atividade locomotora e o excesso de dopamina por meio de sistemas colinérgicos centrais em camundongos: Implicações para seu envolvimento na recompensa cerebral
o viciado. Biol., 11 (2006), pp. 45 – 54
o
81.
o Jerlhag e outros, 2007
o E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
o A administração de grelina nas áreas tegmentares estimula a atividade locomotora e aumenta a concentração extracelular de dopamina no nucleus accumbens
o viciado. Biol., 12 (2007), pp. 6 – 16
o
82.
o Jhou e outros, 2009
o TC Jhou, Campos HL, MG Baxter, CB Saper, Holanda PC
O núcleo tegmentar rostromedial (RMTg), um aferente GABAérgico aos neurônios dopaminérgicos do mesencéfalo, codifica os estímulos aversivos e inibe as respostas motoras.
o Neurônio, 61 (2009), pp. 786 – 800
o
83.
o Johnson e Kenny, 2010
o PM Johnson, PJ Kenny
Receptores dopaminérgicos D2 em disfunção de recompensa e compulsão alimentar em ratos obesos
o Nat. Neurosci., 13 (2010), pp. 635 – 641
o
84.
o Johnson et al., 1996
o PI Johnson, o MA Parente, o JR Stellar
o As lesões induzidas por NMDA do nucleus accumbens ou do pallidum ventral aumentam a eficácia recompensadora dos alimentos aos ratos privados
o Cérebro Res., 722 (1996), pp. 109-117
o
85.
o Jönsson et al., 1999
o EG Jönsson, MM Nöthen, F. Grünhage, L. Farde, Y. Nakashima, P. Propping, GC Sedvall
o Polimorfismos no gene do receptor dopaminérgico D2 e suas relações com a densidade de receptores de dopamina do estriado de voluntários saudáveis
o Mol. Psiquiatria, 4 (1999), pp. 290 – 296
o
86.
o Kalarchian et al., 2002
o MA Kalarchian, MD Marcus, Wilson GT, EW Labouvie, RE Brolin, LB LaMarca
o compulsão alimentar entre os pacientes de bypass gástrico no seguimento de longo prazo
Obes. Surg., 12 (2002), pp. 270 – 275
o
87.
o Kandiah et al., 2006
o J. Kandiah, M. Yake, J. Jones, M. Meyer
o estresse influencia o apetite e conforta as preferências alimentares em mulheres universitárias
o Nutr. Res., 26 (2006), pp. 118 – 123
o
88.
o Karhunen et al., 1997
LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o fluxo sanguíneo cerebral regional durante a exposição a alimentos em mulheres obesas e com peso normal
o Cérebro, 120 (1997), pp. 1675 – 1684
o
89.
o Kasanetz et al., 2010
F. Kasanetz, V. Deroche-Gamonet, N. Berson, E. Balado, M. Lafourcade, O. Manzoni, PV Piazza
o A transição para o vício está associada a um comprometimento persistente da plasticidade sináptica
o Ciência, 328 (2010), pp. 1709 – 1712
o
90.
o Kelley e outros, 1996
o AE Kelley, EP abençoe, CJ Swanson
o Investigação dos efeitos de antagonistas de opiáceos infundidos no núcleo accumbens na alimentação e ingestão de sacarose em ratos
o J. Pharmacol. Exp. Ther, 278 (1996), pp. 1499 – 1507
o
91.
o Kelley e outros, 2005
o AE Kelley, BA Baldo, WE Pratt, MJ Will
Circuitos corticoestriatal-hipotalâmicos e motivação alimentar: integração de energia, ação e recompensa.
o Physiol. Behav., 86 (2005), pp. 773 – 795
o
92.
o Kenny e outros, 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o Retirada condicionada impulsiona o consumo de heroína e diminui a sensibilidade à recompensa
o J. Neurosci., 26 (2006), pp. 5894-5900
o
93.
o Kim et al., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sol, JH Baik
o Sinalização aprimorada da leptina hipotalâmica em camundongos sem receptores dopaminérgicos D2
o J. Biol. Chem., 285 (2010), pp. 8905 – 8917
o
94.
o Klein et al., 2007
o T. Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o diferenças geneticamente determinadas na aprendizagem de erros
o Ciência, 318 (2007), pp. 1642 – 1645
o
95.
o Kojima et al., 1999
o M. Kojima, H. Hosoda, Y. Data, M. Nakazato, H. Matsuo, K. Kangawa
A grelina é um peptídeo acilado liberador de hormônio de crescimento do estômago
o Natureza, 402 (1999), pp. 656 – 660
o
96.
o Kok et al., 2006
o P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o A ativação de receptores dopaminérgicos D2 diminui a concentração de leptina circadiana em mulheres obesas
o J. Clin. Endocrinol. Metab., 91 (2006), pp. 3236 – 3240
o
97.
o Koob, 2010
o GF Koob
o papel do CRF e dos peptídeos relacionados ao CRF no lado obscuro do vício
o Cérebro Res., 1314 (2010), pp. 3-14
o
98.
o Koob e Le Moal, 2008
o GF Koob, M. Le Moal
o vício e o sistema anti-horário do cérebro
o Annu. Rev. Psychol., 59 (2008), pp. 29-53
o
99.
o Koob e Volkow, 2010
o GF Koob, ND Volkow
o Neurocircuito da dependência
o Neuropsychopharmacology, 35 (2010), pp. 217-238
o
100.
o Koob e Zorrilla, 2010
o GF Koob, EP Zorrilla
Mecanismos neurobiológicos da dependência: foco no fator liberador de corticotropina
o Curr. Opin. Investig. Drogas, 11 (2010), pp. 63 – 71
o
101.
o Kringelbach et al., 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o A ativação do córtex orbitofrontal humano a um estímulo alimentar líquido está correlacionada com o seu prazer subjetivo
o Cereb. Córtex, 13 (2003), pp. 1064 – 1071
o
102.
o Krügel et al., 2003
U. Krügel, T. Schraft, H. Kittner, W. Kiess, P. Illes
A liberação de dopamina evocada basalmente e por alimentação no núcleo do rato accumbens está deprimida pela leptina
o Eur. J. Pharmacol., 482 (2003), pp. 185-187
o
103.
o la Fleur, 2006
o SE la Fleur
o Efeitos dos glicocorticoides no comportamento alimentar de ratos
o Physiol. Behav., 89 (2006), pp. 110 – 114
o
104.
o LaBar e outros, 2001
o KS LaBar, o DR Gitelman, o TB Parrish, o YH Kim, o AC Nobre, o MM Mesulam
o Fome modula seletivamente a ativação corticolímbica aos estímulos alimentares em humanos
o Behav. Neurosci., 115 (2001), pp. 493 – 500
o
105.
o Latagliata e outros, 2010
o CE Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o A busca de alimentos, apesar das conseqüências prejudiciais, está sob controle noradrenérgico cortical pré-frontal
o BMC Neurosci., 11 (2010), p. 15
o
106.
o Lawford et al., 2000
o BR Lawford, RM Jovem, EP Noble, J. Sargent, J. Rowell, S. Shadforth, X. Zhang, T. Ritchie
o Alelo do receptor D (2) de dopamina A (1) e dependência de opióides: associação com o uso de heroína e resposta ao tratamento com metadona
o J. Med. Genet., 96 (2000), pp. 592 – 598
o
107.
o Leinninger et al., 2009
o GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong et al.
A leptina atua via neurônios hipotalâmicos laterais expressando o receptor de leptina para modular o sistema de dopamina mesolímbica e suprimir a alimentação.
o Metab. celular, 10 (2009), pp. 89 – 98
o
108.
o Lenoir e outros, 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
Oçura intensa supera a recompensa de cocaína
o PLoS ONE, 2 (2007), p. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Leshan et al., 2010
o RL Leshan, DM Opland, Louis GW, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
• Os neurônios receptores de leptina da área tegmentar ventral especificamente projetam e regulam os neurônios transcritos regulados por cocaína e anfetamina da amígdala central estendida
o J. Neurosci., 30 (2010), pp. 5713-5723
o
110.
o Louis et al., 2010
o GW Louis, GM Leinninger, CJ Rhodes, MG Myers Jr.
o Inervação e modulação direta dos neurônios da orexina pelos neurônios do LepRb hipotalâmico lateral
o J. Neurosci., 30 (2010), pp. 11278-11287
o
111.
o Luppino e outros, 2010
o FS Luppino, LM de Sagacidade, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
o sobrepeso, obesidade e depressão: uma revisão sistemática e meta-análise de estudos longitudinais
o Arch. Gen. Psiquiatria, 67 (2010), pp. 220 – 229
o
112.
o Lutter e Nestler, 2009
o M. Lutter, EJ Nestler
o Sinais homeostáticos e hedônicos interagem na regulação da ingestão de alimentos
o J. Nutr., 139 (2009), pp. 629-632
o
113.
o Macht e Mueller, 2007
o M. Macht, J. Mueller
o Efeitos imediatos do chocolate em estados de humor induzidos experimentalmente
o Apetite, 49 (2007), pp. 667 – 674
o
114.
o Maldonado-Irizarry e Kelley, 1995
o CS Maldonado-Irizarry, AE Kelley
Lesões excitotóxicas do núcleo e sub-regiões do núcleo accumbens afetam diferencialmente a regulação do peso corporal e a atividade motora em ratos
o Brain Res. Bull., 38 (1995), pp. 551 – 559
o
115.
o Maldonado-Irizarry e outros, 1995
o CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o Receptores de glutamato no comportamento de alimentação do controle da casca do nucleus accumbens através do hipotálamo lateral
o J. Neurosci., 15 (1995), pp. 6779-6788
o
116.
o Malik et al., 2008
o S. Malik, F. McGlone, D. Bedrossian, A. Dagher
O grelina modula a atividade cerebral em áreas que controlam o comportamento apetitivo
o Metab. celular, 7 (2008), pp. 400 – 409
o
117.
o Man et al., 2009
o MS Man, HF Clarke, AC Roberts
o O papel do córtex orbitofrontal e estriado medial na regulação de respostas prepotentes a recompensas alimentares
o Cereb. Córtex, 19 (2009), pp. 899 – 906
o
118.
o Margules and Olds, 1962
o DL Margules, J. Olds
o "alimentação" e sistemas "recompensadores" idênticos no hipotálamo lateral de ratos
o Ciência, 135 (1962), pp. 374 – 375
o
119.
o Markou e Frank, 1987
o A. Markou, RA Frank
o Efeito do posicionamento de operante e eletrodo nas funções de resposta de duração do trem de autoestimulação
o Physiol. Behav., 41 (1987), pp. 303 – 308
o
120.
o Markou e Koob, 1991
o A. Markou, GF Koob
o Postedocaína anedonia. Um modelo animal de retirada de cocaína
o Neuropsychopharmacology, 4 (1991), pp. 17-26
o
121.
o Mastronardi e outros, 2001
o CA Mastronardi, WH Yu, Srivastava VK, WL Dees, SM McCann
A liberação de leptina induzida por lipopolissacarídeo é controlada neuralmente
o Proc. Natl. Acad. Sci. EUA, 98 (2001), pp. 14720 – 14725
o
122.
o Matheny e outros, 2011
o M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
A resistência à leptina induzida por dieta específica de região e induzida por leptina inclui a área tegmentar ventral em ratos
o Neurofarmacologia (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 na imprensa. Publicado on-line em novembro 5, 2010
o
123.
o Matsumoto e Hikosaka, 2007
o M. Matsumoto, O. Hikosaka
o Habenula lateral como fonte de sinais negativos de recompensa em neurônios dopaminérgicos
o Natureza, 447 (2007), pp. 1111 – 1115
o
124.
o Morton et al., 2006
GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
o Controle do sistema nervoso central da ingestão de alimentos e peso corporal
o Natureza, 443 (2006), pp. 289 – 295
o
125.
o Monte e Hoebel, 1967
o G. Mount, BG Hoebel
o auto-estimulação hipotalâmica lateral: limiar auto-determinado aumentado pela ingestão de alimentos
o Psychon. Sci., 9 (1967), pp. 265 – 266
o
126.
o Nair et al., 2011
o SG Nair, BM Navarre, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o Papel do córtex pré-frontal dorsal dopaminérgico dopaminérgico receptores da família D1 em recaída à procura de alimentos com alto teor de gordura induzida pela droga ansiogênica ioimbina
o Neuropsychopharmacology, 36 (2011), pp. 497-510
o
127.
o Nakazato e outros, 2001
o M. Nakazato, N. Murakami, Y. Data, M. Kojima, H. Matsuo, K. Kangawa, S. Matsukura
o Um papel para a grelina na regulação central da alimentação
o Natureza, 409 (2001), pp. 194 – 198
o
128.
o Naqvi e Bechara, 2009
o NH Naqvi, A. Bechara
o ilha oculta do vício: a ínsula
o Tendências Neurosci., 32 (2009), pp. 56-67
o
129.
o Neville et al., 2004
o MJ Neville, CE Johnstone, RT Walton
o Identificação e caracterização de ANKK1: Um novo gene da cinase intimamente ligado ao DRD2 na banda cromossômica 11q23.1
o Hum. Mutat., 23 (2004), pp. 540 – 545
o
130.
o Nirenberg e Waters, 2006
o MJ Nirenberg, C. Waters
o Comer compulsivo e ganho de peso relacionado ao uso de agonistas dopaminérgicos
o Mov. Disord., 21 (2006), pp. 524 – 529
o
131.
o nobre, 2000
o EP Noble
o Adicção e seu processo de recompensa através de polimorfismos do gene do receptor de dopamina D2: Uma revisão
o Eur. Psiquiatria, 15 (2000), pp. 79 – 89
o
132.
o Noble e outros, 1993
o EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin et al.
o Associação alélica do gene do receptor de dopamina D2 com dependência de cocaína
o Drug Alcohol Depend., 33 (1993), pp. 271-285
o
133.
o Noble e outros, 2000
o EP Nobre, X. Zhang, TL Ritchie, RS Sparkes
o Haplótipos no lócus DRD2 e alcoolismo grave
o J. Med. Genet., 96 (2000), pp. 622 – 631
o
134.
o O'Connor et al., 2008
o DB O'Connor, F. Jones, M. Conner, B. McMillan, E. Ferguson
o Efeitos das dificuldades diárias e estilo de comer no comportamento alimentar
Psicologia da Saúde, 27 (1, Suppl) (2008), pp. S20-S31
o
135.
o O'Doherty et al., 2002
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Respostas neurais durante a antecipação de uma recompensa primária de sabor
o Neurônio, 33 (2002), pp. 815 – 826
o
136.
o O'Rahilly, 2009
o S. O'Rahilly
A genética humana ilumina os caminhos para a doença metabólica
o Natureza, 462 (2009), pp. 307 – 314
o
137.
o Oswald et al., 2010
o KD Oswald, DL Murdaugh, rei do VL, MM Boggiano
o Motivação para alimentos saborosos, apesar das consequências em um modelo animal de compulsão alimentar
o Int. J. Coma. Desordem. (2010) http://dx.doi.org/10.1002/eat.20808 na imprensa. Publicado online em fevereiro 22, 2010
o
138.
o Park e Carr, 1998
o TH Park, KD Carr
o Padrões neuroanatômicos da imunorreatividade fos-induzida induzida por um ambiente saboroso de refeição e pareado por refeição em ratos tratados com salina e naltrexona
o Cérebro Res., 805 (1998), pp. 169-180
o
139.
o Peciña e Berridge, 2005
o S. Peciña, KC Berridge
Ponto quente hedônico na casca do núcleo accumbens: onde os mi-opioides causam um aumento do impacto hedônico da doçura?
o J. Neurosci., 25 (2005), pp. 11777-11786
o
140.
o Peciña e outros, 2006a
o S. Peciña, J. Schulkin, KC Berridge
O fator de liberação de corticotropina do Nucleus accumbens aumenta a motivação para a recompensa da sacarose: efeitos de incentivo positivo paradoxal no estresse?
o BMC Biol., 4 (2006), p. 8
o
141.
o Peciña e outros, 2006b
o S. Peciña, KS Smith, KC Berridge
Pontos quentes hedônicos no cérebro
o Neurocientista, 12 (2006), pp. 500-511
o
142.
o Pecoraro et al., 2004
N. Pecoraro, F. Reyes, F. Gomez, A. Bhargava, MF Dallman
O estresse crônico promove a alimentação palatável, que reduz os sinais de estresse: os efeitos de feedforward e feedback do estresse crônico
o Endocrinologia, 145 (2004), pp. 3754 – 3762
o
143.
Pelchat et al., 2004
o ML Pelchat, A. Johnson, R. Chan, J. Valdez, JD Ragland
o Imagens do desejo: ativação do desejo por comida durante fMRI
o Neuroimagem, 23 (2004), pp. 1486 – 1493
o
144.
o Pelleymounter e outros, 1995
o MA Pelleymounter, MJ Cullen, MB Baker, R. Hecht, D. Winters, T. Boone, F. Collins
o Efeitos do produto gênico obeso na regulação do peso corporal em camundongos ob / ob
o Ciência, 269 (1995), pp. 540 – 543
o
145.
o Pelloux et al., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Busca compulsiva de drogas por ratos sob punição: Efeitos da história de consumo de drogas
o Psicofarmacologia (Berl.), 194 (2007), pp. 127-137
o
146.
o Perello e outros, 2010
o M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Woloszyn, M. Yanagisawa, M. Lutter, JM Zigman
o Grelina aumenta o valor de recompensa da dieta rica em gordura de uma forma dependente da orexina
o Biol. Psiquiatria, 67 (2010), pp. 880 – 886
o
147.
o Petrovich et al., 2009
o GD Petrovich, CA Ross, P. Mody, PC Holanda, M. Gallagher
Central, mas não basolateral, a amígdala é fundamental para o controle da alimentação por meio de pistas eruditas e aprendidas
o J. Neurosci., 29 (2009), pp. 15205-15212
o
148.
o Pfaffly et al., 2010
o J. Pfaffly, M. Michaelides, GJ Wang, Pessin JE, ND Volkow, PK Thanos
o A leptina aumenta a ligação do receptor D2 da dopamina do estriado em camundongos obesos (ob / ob) deficientes em leptina
o Sinapse, 64 (2010), pp. 503 – 510
o
149.
o Puhl et al., 2008
o RM Puhl, CA Musgo-Racusin, MB Schwartz, KD Brownell
o Estigmatização do peso e redução do viés: Perspectivas de adultos com sobrepeso e obesidade
o Saúde Educ. Res., 23 (2008), pp. 347 – 358
o
150.
o Rada et al., 2010
P. Rada, eu Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
Redução da dopamina acumbens em ratos Sprague-Dawley propensos a comer demais uma dieta rica em gordura
o Physiol. Behav., 101 (2010), pp. 394 – 400
o
151.
o Ritchie and Noble, 2003
o T. Ritchie, EP Noble
o Associação de sete polimorfismos do gene do receptor de dopamina D2 com características de ligação ao receptor do cérebro
o Neurochem. Res., 28 (2003), pp. 73 – 82
o
152.
o Roberto et al., 2010
o M. Roberto, M. Cruz, N. W. Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
A liberação de ácido gama-aminobutírico induzida pelo fator liberador de corticotropina desempenha um papel fundamental na dependência de álcool
o Biol. Psiquiatria, 67 (2010), pp. 831 – 839
o
153.
o Roitman et al., 2004
o MF Roitman, GD Stuber, Phillips PE, RM Wightman, RM Carelli
o A dopamina opera como um modulador de subsegundos da busca por alimentos
o J. Neurosci., 24 (2004), pp. 1265-1271
o
154.
o Roitman et al., 2008
o MF Roitman, Wheeler RA, RM Wightman, RM Carelli
Respostas químicas em tempo real no núcleo accumbens diferenciam estímulos recompensadores e aversivos
o Nat. Neurosci., 11 (2008), pp. 1376 – 1377
o
155.
o Rolos, 2008
o ET Rolls
o Funções do córtex cingulado orbitofrontal e pré-lingual no paladar, olfato, apetite e emoção
o Acta Physiol. Pendurado, 95 (2008), pp. 131 – 164
o
156.
o Rolos, 2010
o ET Rolls
o Sabor, textura olfativa e alimentar recompensam o processamento no cérebro e na obesidade
o Int. J. Obes. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 na imprensa. Publicado online agosto 3, 2010
o
157.
o Rolls et al., 1983
ET Rolls, BJ Rolls, EA Rowe
o saciedade específica do sentido e específica da motivação para a vista e o gosto da comida e da água no homem
o Physiol. Behav., 30 (1983), pp. 185 – 192
o
158.
o Roseberry e outros, 2007
o AG Roseberry, pintor de T., GP Mark, JT Williams
Diminuição dos estoques de dopamina vesicular e somatodendrítica em camundongos deficientes em leptina
o J. Neurosci., 27 (2007), pp. 7021-7027
o
159.
o Rothemund e outros, 2007
Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Ativação diferencial do corpo estriado dorsal por estímulos visuais altamente calóricos em indivíduos obesos
o Neuroimagem, 37 (2007), pp. 410 – 421
o
160.
o Salas et al., 2010
o R. Salas, P. Baldwin, M. de Biasi, PR Montague
o BOLD responde a erros negativos de predição de recompensa em habenula humana
o Frente. Cantarolar. Neurosci., 4 (2010), p. 36
o
161.
o Saper et al., 2002
o CB Saper, TC Chou, JK Elmquist
o A necessidade de se alimentar: controle homeostático e hedônico da alimentação
o Neurônio, 36 (2002), pp. 199 – 211
o
162.
o Saunders, 2001
o R. Saunders
o Compulsivo comer e cirurgia de bypass gástrico: O que a fome tem a ver com isso?
Obes. Surg., 11 (2001), pp. 757 – 761
o
163.
o Scarpace e outros, 2010
o PJ Scarpace, M. Matheny, Y. Zhang
o funcionamento da roda elimina a preferência de alta gordura e aumenta a sinalização da leptina na área ventral tegmental
o Physiol. Behav., 100 (2010), pp. 173 – 179
o
164.
o Schiltz et al., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Sinais associados a alimentos alteram a conectividade funcional do prosencéfalo, avaliada com expressão imediata de gene e proenquimatina precoces
o BMC Biol., 5 (2007), p. 16
o
165.
o Schur et al., 2009
o EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
A ativação na regulação da energia cerebral e centros de recompensa por dicas de alimentos varia com a escolha do estímulo visual
o Int. J. Obes. (Lond.), 33 (2009), pp. 653-661
o
166.
o Sclafani et al., 1998
o A. Sclafani, RJ Bodnar, AR Delamater
o Farmacologia das preferências alimentares condicionadas
o Apetite, 31 (1998), p. 406
o
167.
o Sescousse e outros, 2010
G. Sescousse, J. Redouté, JC Dreher
o A arquitetura do código de valor de recompensa no córtex orbitofrontal humano
o J. Neurosci., 30 (2010), pp. 13095-13104
o
168.
o Shomaker et al., 2010
o LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, Columbo KM, LE Wolkoff, Brady SM, Crocker MK, AH Ali et al.
o Comer na ausência de fome em adolescentes: ingestão após uma refeição de grande variedade comparada com aquela após uma refeição padronizada
o J. Clin. Nutr., 92 (2010), pp. 697 – 703
o
169.
o Simmons e outros, 2005
o WK Simmons, A. Martin, LW Barsalou
o Imagens de alimentos apetitosos ativam córtices gustativos para sabor e recompensa
o Cereb. Córtex, 15 (2005), pp. 1602 – 1608
o
170.
o pequeno, 2010
o DM pequeno
o Gosto de representação na ínsula humana
o Brain Struct. Func., 214 (2010), pp. 551 – 561
o
171.
o Small et al., 2003
o DM Pequeno, M. Jones-Gotman, A. Dagher
o A liberação de dopamina induzida pela alimentação no corpo estriado dorsal se correlaciona com as taxas de agradabilidade à refeição em voluntários humanos saudáveis
o Neuroimagem, 19 (2003), pp. 1709 – 1715
o
172.
o Smith e Berridge, 2007
o KS Smith, KC Berridge
o Circuito límbico opioide para recompensa: interação entre hotsônicos hotsônicos de nucleus accumbens e ventral pálido
o J. Neurosci., 27 (2007), pp. 1594-1605
o
173.
o Söderpalm e Berridge, 2000
o AH Söderpalm, KC Berridge
o Ingestão alimentar após diazepam, morfina ou muscimol: Microinjeções No núcleo accumbens shell
o Pharmacol. Biochem. Behav., 66 (2000), pp. 429 – 434
o
174.
o Stice et al., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Pequeno
o Relação entre obesidade e resposta embotada do estriado à comida é moderada pelo alelo TaqIA A1
o Ciência, 322 (2008), pp. 449 – 452
o
175.
o Stice et al., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Pequeno
o Relação de recompensa da ingestão de alimentos e ingestão antecipada de alimentos à obesidade: um estudo de ressonância magnética funcional
o J. Abnorm. Psychol., 117 (2008), pp. 924-935
o
176.
o Stice et al., 2010a
o E. Stice, S. Yokum, K. Blum, C. Bohon
o O ganho de peso está associado à redução da resposta do estriado a alimentos palatáveis
o J. Neurosci., 30 (2010), pp. 13105-13109
o
177.
o Stice et al., 2010b
o E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o A responsividade dos circuitos de recompensa aos alimentos prevê futuros aumentos na massa corporal: efeitos moderadores de DRD2 e DRD4
o Neuroimagem, 50 (2010), pp. 1618 – 1625
o
178.
o Stoeckel, 2010
o Stoeckel, LE (2010). O Princípio da Obesidade de Cachinhos Dourados. Americano científico. Junho 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Stratford e Kelley, 1997
o TR Stratford, AE Kelley
o GABA na casca do nucleus accumbens participa na regulação central do comportamento alimentar
o J. Neurosci., 17 (1997), pp. 4434-4440
o
180.
o Stratford e Kelley, 1999
o TR Stratford, AE Kelley
o Evidência de uma relação funcional entre a casca do nucleus accumbens e o hipotálamo lateral, auxiliando no controle do comportamento alimentar
o J. Neurosci., 19 (1999), pp. 11040-11048
o
181.
o Suarez e Gallup, 1981
o SD Suarez, GGJ Gallup
o Uma análise etológica do comportamento de campo aberto em ratos e camundongos
o Aprenda. Motiv, 12 (1981), pp. 342 – 363
o
182.
o Sunday et al., 1983
SR domingo, Sanders, G. Collier
o Palatabilidade e padrões de refeição
o Physiol. Behav., 30 (1983), pp. 915 – 918
o
183.
o Swinburn et al., 2009
B. Swinburn, G. Sacks, E. Ravussin
o Aumento do suprimento de energia alimentar é mais que suficiente para explicar a epidemia de obesidade nos EUA
o J. Clin. Nutr., 90 (2009), pp. 1453 – 1456
o
184.
o Taha e campos, 2005
o SA Taha, HL Fields
o Codificação de palatabilidade e comportamentos apetitivos por populações neuronais distintas no nucleus accumbens
o J. Neurosci., 25 (2005), pp. 1193-1202
o
185.
o Taha et al., 2009
o SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Campos
o Convergente, não serial, os circuitos estriado e paliativo regulam a ingestão de alimentos induzidos por opióides
o Neurociência, 161 (2009), pp. 718 – 733
o
186.
o Teegarden e Bale, 2007
o SL Teegarden, Bale TL
o Diminuição da preferência alimentar produz aumento da emotividade e risco de recaída alimentar
o Biol. Psiquiatria, 61 (2007), pp. 1021 – 1029
o
187.
o Teegarden e outros, 2009
o SL Teegarden, AN Scott, Bale TL
o A exposição precoce a uma dieta rica em gordura promove mudanças a longo prazo nas preferências alimentares e sinalização de recompensa central
o Neurociência, 162 (2009), pp. 924 – 932
o
188.
o Thanos et al., 2008
o PK Thanos, M. Michaelides, YK Piyis, Wang GJ, ND Volkow
o A restrição alimentar aumenta acentuadamente o receptor D2 de dopamina (D2R) em um modelo de obesidade em ratos, avaliado com imagem de muPET in vivo ([11C] racloprida) e autorradiografia in vitro ([3H] espiperona)
o Sinapse, 62 (2008), pp. 50 – 61
o
189.
Thompson e Swanson, 2010
RH Thompson, LW Swanson
Análise de conectividade estrutural orientada por hipóteses suporta rede sobre modelo hierárquico de arquitetura cerebral
o Proc. Natl. Acad. Sci. EUA, 107 (2010), pp. 15235 – 15239
o
190.
o Vanderschuren e Everitt, 2004
o LJ Vanderschuren, BJ Everitt
o A procura de drogas torna-se compulsiva após auto-administração prolongada de cocaína
o Ciência, 305 (2004), pp. 1017 – 1019
o
191.
o Vendruscolo e outros, 2010a
o LF Vendruscolo, AB Gueye, Darnaudéry M., SH Ahmed, M. Cador
O consumo excessivo de açúcar durante a adolescência altera seletivamente a função de motivação e recompensa em ratos adultos
o PLoS ONE, 5 (2010), p. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo e outros, 2010b
LF Vendruscolo, AB Gueye, Vendruscolo JC, Clemens KJ, P. Mormède, Darnaudéry M., M. Cador
o Redução do consumo de álcool em ratos adultos expostos à sacarose durante a adolescência
o Neurofarmacologia, 59 (2010), pp. 388 – 394
o
193.
o Volkow e O'Brien, 2007
o ND Volkow, CP O'Brien
o Questões para o DSM-V: A obesidade deve ser incluída como um distúrbio cerebral?
o J. Psiquiatria, 164 (2007), pp. 708-710
o
194.
Volkow e Wise, 2005
o ND Volkow, RA Sábio
o Como o vício em drogas pode nos ajudar a entender a obesidade?
o Nat. Neurosci., 8 (2005), pp. 555 – 560
o
195.
o Volkow et al., 2009
o ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan
o Associação inversa entre IMC e atividade metabólica pré-frontal em adultos saudáveis
o Obesidade (Silver Spring), 17 (2009), pp. 60-65
o
196.
o Vucetic e Reyes, 2010
o Z. Vucetic, TM Reyes
o Circuito dopaminérgico central controlando a ingestão e recompensa alimentar: implicações para a regulação da obesidade
o Wiley Interdiscip. Rev. Syst. Biol. Med., 2 (2010), pp. 577 – 593
o
197.
o Wang et al., 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o dopamina do cérebro e obesidade
o Lancet, 357 (2001), pp. 354-357
o
198.
o Wang et al., 2002
o GJ Wang, ND Volkow, JS Fowler
o O papel da dopamina na motivação para alimentos em humanos: implicações para a obesidade
o Expert Opin. Ther. Alvos, 6 (2002), pp. 601 – 609
o
199.
o Wang et al., 2004a
GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
o A exposição a estímulos alimentares apetitivos ativa ativamente o cérebro humano
o Neuroimagem, 21 (2004), pp. 1790 – 1797
o
200.
o Wang et al., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o Similaridade entre obesidade e dependência de drogas, avaliada por imagem neurofuncional: uma revisão conceitual
o J. Addict. Dis., 23 (2004), pp. 39 – 53
o
201.
o Wang et al., 2008
GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
o Distensão gástrica ativa circuitos de saciedade no cérebro humano
o Neuroimagem, 39 (2008), pp. 1824 – 1831
o
202.
o Wassum e outros, 2009
o KM Wassum, SB Ostlund, NT Maidment, BW Balleine
o Circuitos opiáceos distintos determinam a palatabilidade e a conveniência de eventos recompensadores
o Proc. Natl. Acad. Sci. EUA, 106 (2009), pp. 12512 – 12517
o
203.
o Wassum e outros, 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
A ativação do receptor μ-Opióide na amígdala basolateral medeia a aprendizagem de aumentos, mas não diminui no valor de incentivo de uma recompensa alimentar
o J. Neurosci., 31 (2011), pp. 1591-1599
o
204.
o Wilkinson e Peele, 1962
o HA Wilkinson, TL Peele
o Modificação da auto-estimulação intracraniana pela saciedade da fome
o J. Physiol., 203 (1962), pp. 537-540
o
205.
o Will et al., 2003
o MJ Will, EB Franzblau e AE Kelley
Os opioides mu de Nucleus accumbens regulam a ingestão de uma dieta rica em gordura através da ativação de uma rede cerebral distribuída
o J. Neurosci., 23 (2003), pp. 2882-2888
o
206.
o Wilson et al., 2008
o ME Wilson, J. Fisher, A. Fischer, V. Lee, RB Harris, TJ Bartness
Quantificar a ingestão de alimentos em macacos socialmente alojados: efeitos do status social no consumo calórico
o Physiol. Behav., 94 (2008), pp. 586 – 594
o Artigo | PDF (553 K) |
Visualizar registro no Scopus
| Citado por em Scopus (22)
207.
o Yurcisin e outros, 2009
o BM Yurcisin, MM Gaddor, EJ DeMaria
o Obesidade e cirurgia bariátrica
o Clin. Peito Med., 30 (2009), pp. 539-553, ix
o
208.
o Zhang et al., 1998
o M. Zhang, BA Gosnell, AE Kelley
A ingestão de alimentos com alto teor de gordura é seletivamente aumentada pela estimulação do receptor opióide mu dentro do núcleo accumbens
o J. Pharmacol. Exp. Ther, 285 (1998), pp. 908 – 914
o View Record in Scopus
| Citado por em Scopus (148)
209.
o Zheng et al., 2007
o H. Zheng, LM Patterson, HR Berthoud
A sinalização da orexina na área tegmentar ventral é necessária para o apetite hiperlipídico induzido pela estimulação opióide do nucleus accumbens
o J. Neurosci., 27 (2007), pp. 11075-11082
o View Record in Scopus
| Citado por em Scopus (64)
210.
o Zheng et al., 2009
o H. Zheng, NR Lenard, CA Shin, HR Berthoud
o Controle do apetite e regulação do balanço energético no mundo moderno: o cérebro dirigido pela recompensa se sobrepõe aos sinais de reposição
o Int. J. Obes. (Lond), 33 (Supl 2) (2009), pp. S8-S13
o View Record in Scopus
| Citado por em Scopus (34)