Relatórios Científicos volume 9, Número do artigo: 16918 (2019)
Sumário
O consumo excessivo de sacarose provoca um desejo semelhante ao vício que pode sustentar a epidemia de obesidade. Os opióides e a dopamina mediam os efeitos gratificantes das drogas de abuso e das recompensas naturais de estímulos como alimentos saborosos. Investigamos os efeitos da sacarose usando imagens PET com [11C] carfentanil (agonista dos receptores opioides μ) e [11C] racloprida (antagonista do receptor da dopamina D2 / 3) em sete minipigs de Göttingen anestesiados. Demos então aos mini-porcos acesso à solução de sacarose por uma hora em 12 dias consecutivos e realizamos a geração de imagens novamente 24 horas após o acesso final à sacarose. Em uma amostra menor de cinco minipigs, realizamos um [11C] sessão de PET com carfentanil após a primeira exposição à sacarose. Calculamos o potencial de ligação do voxel (BPND) usando o cerebelo como uma região de ligação não deslocável, analisou diferenças com o mapeamento estatístico não paramétrico e realizou uma análise regional. Após 12 dias de acesso à sacarose, a BPND dos dois traçadores declinaram significativamente no estriado, núcleo accumbens, tálamo, amígdala, córtex cingulado e córtex pré-frontal, consistente com a regulação negativa da densidade de receptores. Após uma única exposição à sacarose, descobrimos uma ligação reduzida de [11C] carfentanil no núcleo accumbens e córtex cingulado, consistente com a liberação de opióides. A menor disponibilidade de receptores opióides e dopamina pode explicar o potencial viciante associado à ingestão de sacarose.
Introdução
Cinco por cento da população mundial são clinicamente obesos1. Como marca registrada da síndrome metabólica, a obesidade está associada ao diabetes tipo 2, doenças cardiovasculares, problemas respiratórios e risco de depressão e possivelmente demência2. O aumento do consumo de alimentos densos em energia exagerou a distinção fisiológica entre a fome homeostática que segue a privação de alimentos e a fome hedônica, ou "desejo", que ocorre na ausência de privação3,4. Como a regulação homeostática sozinha não pode explicar o atual aumento da obesidade, é obrigatório testar o efeito nos mecanismos cerebrais de recompensa e prazer das propriedades viciantes de alimentos altamente palatáveis.
O consumo de sacarose está associado à obesidade e a sacarose é cada vez mais considerada uma substância viciante5. Algumas descobertas estão em desacordo com essa alegação devido a dificuldades em separar o consumo não palatável de respostas hedônicas e em determinar o ingrediente viciante em alimentos processados, bem como os diferentes mecanismos pelos quais os alimentos alteram os circuitos cerebrais por caminhos naturais.6. Contudo, em contextos específicos, a ingestão de sacarose induz recompensa e desejo, comparáveis em magnitude aos induzidos por drogas viciantes, que levam ao consumo excessivo e eventual obesidade6,7.
A fome está associada ao "desejo" que está intimamente relacionado aos efeitos da neurotransmissão dopaminérgica em várias circunstâncias de recompensa8, mas ainda não está claro como a ação da dopamina (DA) é modulada em resposta à alimentação compulsiva. O consumo de alimentos palatáveis está associado ao "gosto", mediado principalmente pelo sistema opioide endógeno, especialmente o receptor μ-opioide (μOR)9,10, que pode promover o consumo excessivo quando desregulado. No presente relatório, testamos a alegação de que a sacarose leva à liberação de opioides e dopamina que diminui a disponibilidade dos receptores μOR e DA D2 / 3. A disponibilidade é um índice do número de receptores desocupados disponíveis para ligação ao marcador e, em princípio, não distingue entre a ocupação do ligante e a densidade do receptor.11.
O início da alimentação compulsiva depende de múltiplos fatores, e estudos causais em humanos levantam questões éticas. Portanto, a maioria dos estudos concentra-se no comportamento alimentar de ratos12. Embora os ratos tenham um “dente doce”, seus mecanismos homeostáticos importantes para ganho de peso, metabolismo e tipo de acúmulo de gordura diferem significativamente dos humanos. O minipig de Göttingen é um grande animal onívoro, com um cérebro girencefálico bem desenvolvido, que pode ser visualizado em resolução suficiente. Suas regiões corticais subcorticais e pré-frontais bem definidas13 permitir uma tradução mais direta da função do cérebro humano. Aqui, usamos imagens de tomografia por emissão de pósitrons (PET) para testar in vivo Disponibilidade de μOR e DA D2 / 3 em um modelo de minipig de exposição subcrônica à sacarose. Em uma amostra menor, investigamos os efeitos imediatos na ocupação do μOR após a primeira exposição à sacarose. Finalmente, testamos a relação entre as alterações na disponibilidade de receptores dos dois rastreadores.
Resultados
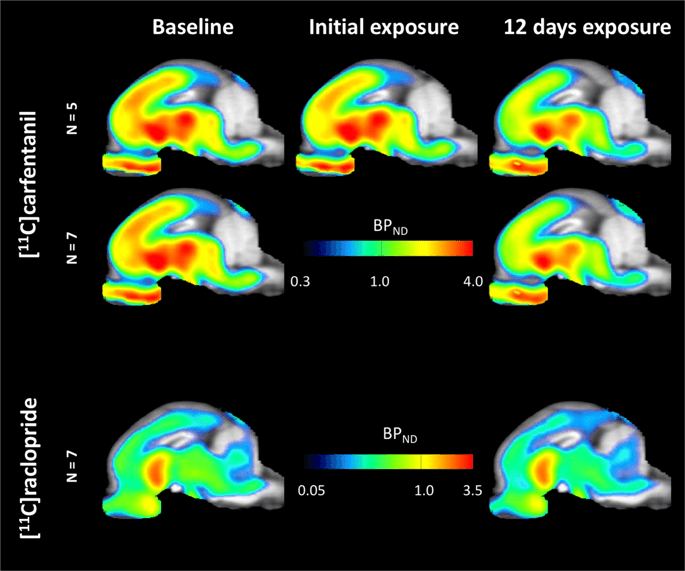
Mapas paramétricos médios de [11C] carfentanil e [11C] potencial de ligação à racloprida (BPND) são mostrados na Fig. 1. Analisar as alterações que ocorreram após a primeira exposição à sacarose em cinco minipigs em comparação à linha de base e um dia após as 12th acesso à sacarose em sete minipigs comparado à linha de base, usamos a teoria da permutação e a análise do cérebro inteiro não regionalmente restrita, o método preferido para amostras desse tamanho14.
Potencial médio de ligação não deslocável em termos de voxel (BPND) mapas sobrepostos a imagens de ressonância magnética na vista sagital. Os dados são apresentados para [11C] carfentanil BPND dos 5 mini-porcos fotografados na linha de base, após exposição inicial à sacarose e após 12 dias de exposição à sacarose (linha superior). [11C] carfentanil BPND de todos os 7 minipigs fotografados na linha de base e após 12 dias de acesso à sacarose são apresentados na linha do meio. [11C] racloprida BPND de todos os 7 minipigs fotografados na linha de base e após 12 dias de acesso à sacarose são mostrados na linha inferior. Observe que a escala de cores é exponencial para destacar o [11C] racloprida BPND em regiões extrastriatais.
Exposição inicial à sacarose
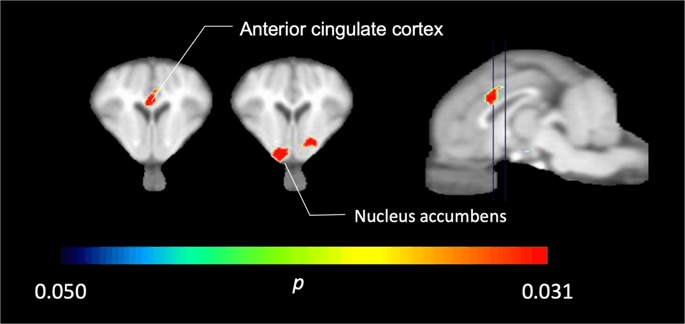
Nos cinco minipigs fotografados com [11C] carfentanil na linha de base e imediatamente após a primeira exposição à sacarose, encontramos uma redução significativa da ligação do marcador no córtex cingulado anterior e no núcleo accumbens em resposta à sacarose, mostrado em cores na Fig. 2, indicando p <0.05. Detectamos uma diminuição de até 14% na ligação do traçador em ambas as áreas em comparação com a linha de base.
Diminuições significativas em [11C] carfentanil BPND após a primeira exposição à água com sacarose em comparação com a linha de base (n = 5). Apenas voxels com significante (p <0.05) diminuições são mostradas como áreas coloridas projetadas em cortes de ressonância magnética ponderados em T1 no nível do córtex cingulado anterior (à esquerda) e do núcleo accumbens (no meio) de um atlas estereotáxico do cérebro de minipíg. Observe que o nível de significância máximo alcançável com 5 animais é 2-5 ≈ 0.031 (consulte a barra de cores). Os dados são apresentados em seções coronais do cérebro de porco nos níveis indicados na imagem sagital (direita).
12 dias de acesso à sacarose
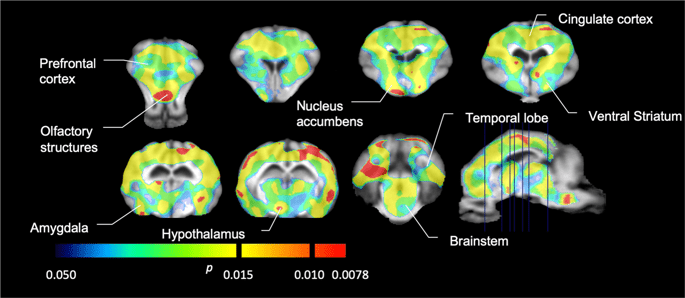
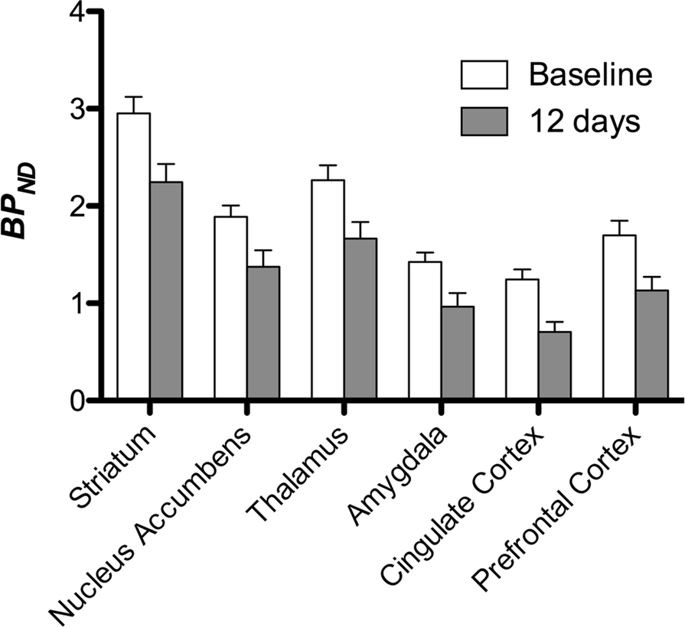
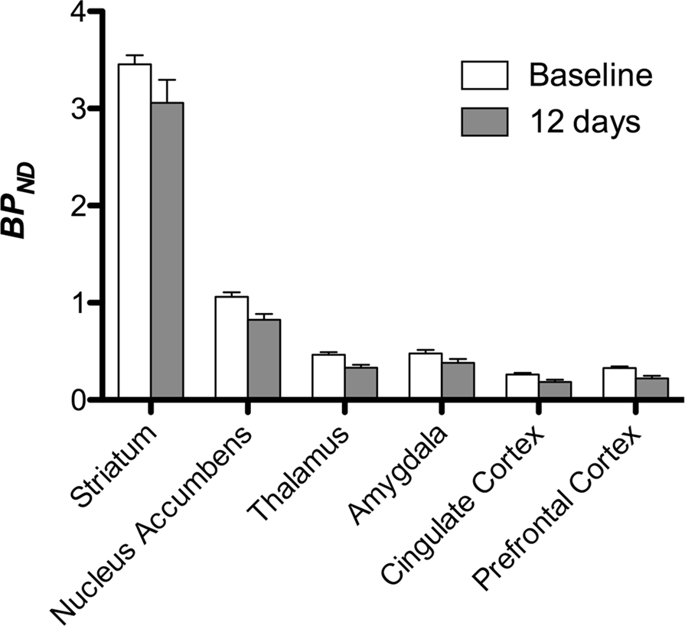
Em seguida, realizamos a análise de sete minipigs fotografados com [11C] carfentanil na linha de base e após 12 dias de acesso à sacarose e encontrou ligação do marcador significativamente reduzida em animais expostos à sacarose em comparação à linha de base. As regiões mais altamente afetadas são mostradas em vermelho na Fig. 3 (p <0.01) e incluem partes das estruturas olfatórias, nucleus accumbens / estriado ventral e córtex / lobo temporal, seguido por áreas mostradas em amarelo (p <0.015) que incluíram partes do córtex pré-frontal, córtex cingulado, amígdala e tronco cerebral . A fim de obter BPND e avaliamos a variação percentual, realizamos análises regionais e obtivemos valores médios em cada região na linha de base e após o consumo de sacarose (Fig. 4).
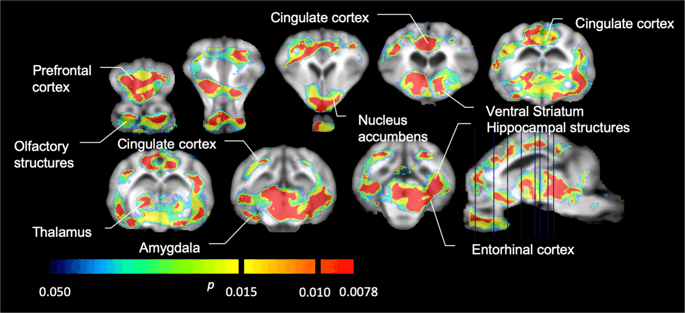
Diminuições significativas em [11C] potencial de ligação ao carfentanil (BPND) entre a linha de base e após 12 dias de exposição à água com sacarose (n = 7). Os voxels com significante (p <0.05) as diminuições são mostradas como áreas coloridas projetadas em cortes de ressonância magnética ponderados em T1 de um atlas cerebral de minipígios estereotáxicos. Os dados são apresentados em seções coronais do cérebro nos níveis indicados na imagem sagital (canto inferior direito). Observe que o nível de significância máximo alcançável com 7 animais é 2-7 ≈ 0.0078 (consulte a barra de cores).
Nós costumavamos [11C] racloprida como o rastreador de receptores DA D2 / 3 em regiões cerebrais estriatais e extrastriatais em minipigs na linha de base e após 12 dias de acesso à sacarose (Fig. 1) Encontramos diminuição da ligação do traçador em animais expostos à sacarose, em comparação com a linha de base com maiores efeitos (p <0.01) em áreas do córtex pré-frontal, nucleus accumbens / estriado ventral, córtex cingulado, amígdala, tálamo, mesencéfalo, regiões hipocampais e áreas olfatórias (FIG. 5) Os dados da análise regional são apresentados na Fig. 6.
Diminuições significativas em [11C] potencial de ligação à racloprida (BPND) entre a linha de base e após 12 dias de exposição à água com sacarose (n = 7). Os voxels com significante (p <0.05) as diminuições são mostradas como áreas coloridas projetadas em cortes de ressonância magnética ponderados em T1 de um atlas cerebral de minipígios estereotáxicos. Os dados são apresentados em seções coronais do cérebro de porco nos níveis indicados na imagem sagital (canto inferior direito). Observe que o nível de significância máximo alcançável com 7 animais é 2-7 ≈ 0.0078 (consulte a barra de cores).
Correlações entre [11C] raclopride e [11C] dados de carfentanil
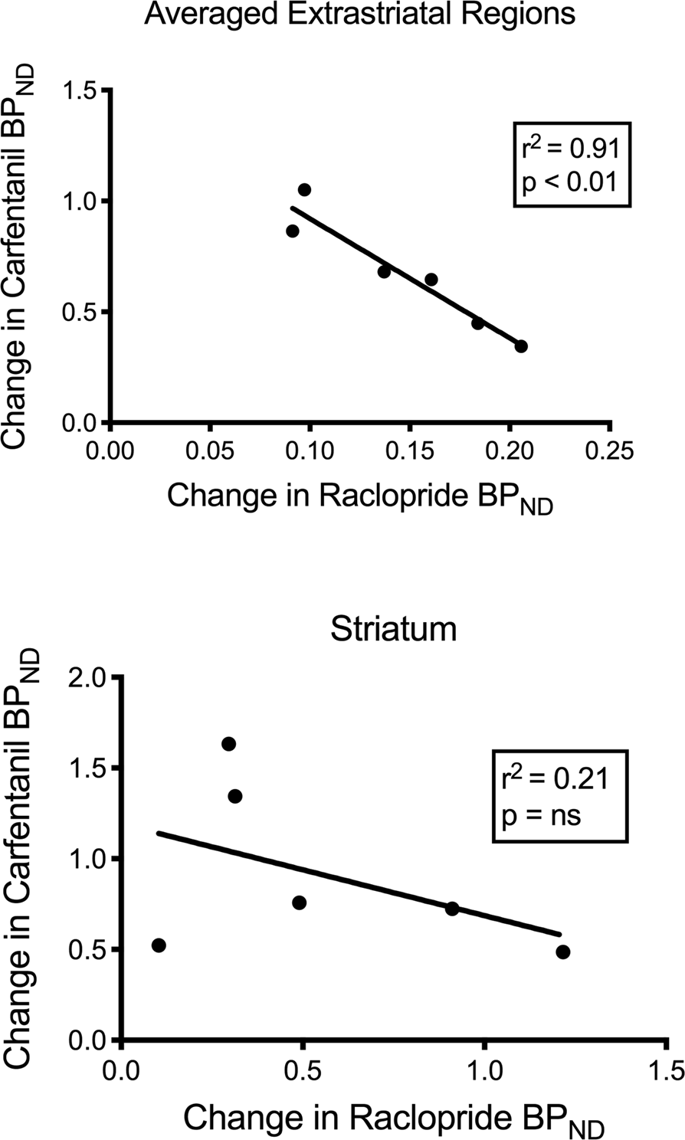
Testamos a correlação potencial entre [11C] raclopride e [11C] valores de carfentanil da PAND nas regiões estriatal e não estriatal em minipigs na linha de base e após 12 dias de ingestão de sacarose, sem associação observada. Em seguida, testamos se os declínios na ligação do marcador estavam correlacionados e comparamos as alterações da pressão arterialND para [11C] raclopride com as alterações da BPND para [11C] carfentanil apenas nos minipig que apresentaram menor PAND dos dois marcadores após a ingestão de sacarose (n = 6). Encontramos correlações negativas significativas na média extrastriatal (r2 = 0.91, p <0.01), mas não nas regiões estriatal (Fig. 7).
Correlações entre pré e pós-declínio de [11C] raclopride e [11C] potenciais de ligação ao carfentanil (BPND) em mini-porcos com diminuição da ligação do marcador após ingestão de sacarose (n = 6). São apresentados dados das regiões extrastriatais médias (em cima) e estriado (em baixo). O coeficiente de determinação (r2) e os valores de p são mostrados para cada gráfico.
Discussão
Determinamos os efeitos do acesso intermitente repetido à sacarose na neurotransmissão de opióides e DA no cérebro de mamíferos. Longitudinal in vivo A imagem PET dos receptores μOR e DA D2 / 3 revelou uma disponibilidade reduzida de receptores em todo o circuito de recompensa, incluindo o núcleo accumbens, o córtex pré-frontal e o córtex cingulado anterior. Os resultados demonstram claramente que a sacarose afeta os mecanismos de recompensa de maneira semelhante à das drogas de abuso.
Sabe-se que a ingestão de sacarose como substância palatável libera DA e induz dependência em roedores15, com a sacarose demonstrando ser ainda mais agradável que a cocaína em roedores em certos contextos. Assim, roedores trabalham mais intensamente para obter sacarose do que cocaína, mesmo na ausência de privação de alimentos5. No entanto, os efeitos da sacarose são regulados tanto pelo sistema homeostático quanto pelos circuitos de recompensa hedônicos16,17 que podem mediar a distinção entre aspectos nutricionais e hedônicos da ação da sacarose18. Optamos por um horário de uma hora por dia para promover a “compulsão”, pois estudos anteriores em ratos haviam revelado uma maior ingestão durante a primeira hora de acesso diário em um horário intermitente15,19. Os estudos comportamentais da ingestão de alimentos geralmente têm como alvo animais com restrição de alimentos, mas o design pode não refletir necessariamente os mesmos mecanismos neurais ativos na obesidade. Os porcos do presente estudo não tiveram restrição alimentar e foram alimentados com as quantidades usuais de sua dieta normal, além do acesso à sacarose.
Os receptores opióides (OR) são amplamente expressos no cérebro, especificamente em estruturas conhecidas por modular os processos de comer e recompensar20. Demonstrou-se que as RUPs são importantes nos efeitos recompensadores e recorrentes da cocaína21,22,23,24. Alterações na ligação também têm sido associadas às respostas homeostáticas à alimentação e ao prazer associado à comida saborosa25. Em particular, o “gosto” de alimentos está ligado ao sistema opióide endógeno, especialmente o μOR9,10 na concha do núcleo accumbens e no pálido ventral26. As infusões de um agonista μOR em partes distintas do núcleo accumbens e do pálido ventral melhoram fortemente os comportamentos de "gostar", incluindo saliências na língua e lambedura de patas, após o aumento da ingestão palatável de alimentos27,28,29. Outras evidências para a sinalização de opióides no processamento da regulação hedônica vêm de antagonistas da μOR que atenuam o consumo de comida palatável em ambos ad libitumanimais alimentados com alimentos e restritos a alimentos, mas com um efeito mais limitado na ingestão de pellets padrão não palatáveis30,31. Nos seres humanos, os antagonistas do μOR diminuem a ingestão de alimentos a curto prazo e reduzem o prazer de alimentos palatáveis32,33,34. A sinalização opióide na amígdala basolateral também contribui para a “falta” de alimentos através da modulação da busca de recompensas e do valor de incentivo dos alimentos35.
Com [11C] carfentanil, obtivemos imagens de ligação do marcador sensíveis tanto aos níveis de μOR quanto à liberação de opióides endógenos no cérebro36,37. Detectamos uma perda imediata da disponibilidade de μOR em áreas do núcleo accumbens e córtex cingulado anterior, regiões cerebrais específicas da via da recompensa, após o consumo inicial de sacarose por cinco mini-porcos, consistente com a liberação endógena de opióides. Estudos anteriores mostraram que comida saborosa pode levar a sentimentos de prazer38 estimulando a liberação de opióides. Após 12 dias de acesso à sacarose, observamos uma diminuição [11C] ligação do carfentanil, que tem várias explicações possíveis39 incluindo liberação endógena de opióides e ligação a μOR, internalização de μOR como resultado do aumento da ligação a opióides e aumento da ativação do receptor DA D2 / 3, levando à dessensibilização heteróloga de μOR40.
Em apoio às presentes conclusões, [11C] estudos de carfentanil em pacientes com bulimia41obesidade42,43,44e transtorno da compulsão alimentar45, mostram diminuição da disponibilidade do receptor. No entanto, essas são condições crônicas, enquanto os minipig receberam apenas sacarose por 12 dias. Em um estudo do comportamento alimentar agudo em homens saudáveis, a alimentação levou à liberação endógena e robusta de opioides cerebrais, tanto na presença quanto na ausência de hedonia, sugerindo que a liberação de opioides reflete respostas metabólicas, homeostáticas e hedônicas.25. Este estudo, junto com outro que fotografou pacientes após uma refeição líquida com sabor de chocolate44, é diretamente relevante para o estudo agudo de cinco mini-porcos após a primeira exposição à sacarose, mas é diferente do estudo subcrônico de exposição à sacarose por 12 dias, em que a disponibilidade reduzida de receptores reflete mais provavelmente o excesso de estimulação repetida e a regulação concomitante de μOR.
O córtex pré-frontal é importante na tomada de decisão e atribui valor aos itens e, portanto, a μOR no córtex pré-frontal pode ser responsável pela avaliação alterada da saliência alimentar, o que pode aumentar o potencial viciante da comida. Descobrimos uma ligação reduzida no córtex pré-frontal, consistente com estudos anteriores que mostram que a dieta rica em gordura reduz os níveis de mRNA μOR no córtex pré-frontal46 e que a infusão de um agonista μOR no córtex pré-frontal aumenta a ingestão de alimentos doces47. Mais uma vez, no entanto, surge a questão de saber se a dieta rica em gordura é uma condição mais crônica que provavelmente medeia a regulação negativa dos receptores, em comparação com o projeto de alimentação com sacarose a curto prazo, sugerindo a liberação sustentada de opióides endógenos que deslocam o traçador carfentanil ligado ao μOR , mesmo após 12 dias de sacarose.
A DA tem sido implicada em recompensas tanto por drogas quanto por comportamento. Verificou-se que o uso crônico de cocaína inibe a sinalização DA48. Os níveis de receptores DA D1 e D2 / 3 são alterados pela nicotina no cérebro de porco49e em primatas não humanos com histórico de abuso de cocaína50, consistente com a regulação negativa dos receptores D2 / 3 no cérebro de viciados em cocaína humana51,52. Quanto às drogas de abuso, a sacarose demonstrou regular positivamente os receptores DA D119 e aumentar a liberação do DA53, reforçando o papel da AD em “querer” em relação a alimentos saborosos. Estudos anteriores de PET demonstraram uma diminuição na disponibilidade estriada do receptor DA D2 / 3 na obesidade mórbida versus peso médio54,55, semelhante em magnitude à redução em pacientes dependentes de drogas56, e em animais com modelos de obesidade57. Em estudos com roedores, a derrubada do receptor D2 / 3 no estriado promove o desenvolvimento de busca compulsiva de alimentos em ratos com acesso a alimentos palatáveis57.
Nossas observações da disponibilidade reduzida de receptores D2 / 3 do porco podem indicar níveis aumentados de DA em resposta à saliência de incentivo associada à ingestão de sacarose, uma vez que a DA é liberada como parte do desejo de drogas de abuso e outras atividades agradáveis52,58,59,60. Como os porcos foram anestesiados durante a imagem e não receberam sacarose em 24 horas, a diminuição da pressão arterial D2 / 3ND provavelmente reflete uma redução no número de receptores em resposta ao aumento prolongado da liberação de DA em cada um dos 12 dias de acesso à sacarose. A redução pode aumentar os limiares de recompensa do cérebro, associados à regulação negativa dos receptores estriados da DA D2. Isso pode explicar o aumento da suscetibilidade a drogas de abuso observadas em estudos anteriores de ratos que consumiram demais sacarose que levaram a sensibilização cruzada à cocaína, hiperatividade após baixas doses de anfetamina, aumento da ingestão de álcool ao se abster de sacarose e tolerância aos efeitos analgésicos dos opiáceos.6.
Um estudo anterior da obesidade no minipig de Göttingen identificou diminuição do fluxo sanguíneo cerebral no núcleo accumbens, área tegmentar ventral (ATV) e córtex pré-frontal, com tomografia computadorizada de emissão de fóton único (SPECT) do cérebro61. Consistente com esses achados, observamos uma redução da ligação do DA D2 / 3 na região ventroforebrain contendo o núcleo accumbens e no córtex pré-frontal. Os níveis extracelulares de DA são aumentados em três vezes no núcleo accumbens após a ingestão de sacarose em ratos em movimento livre submetidos à microdiálise62. Em animais dependentes de sacarose, a ingestão repetida de sacarose pode levar à liberação de DA da concha do núcleo accumbens63. Os animais alimentados com dieta restrita e com acesso limitado à sacarose apresentaram menor ligação ao receptor DA D2 na concha do núcleo accumbens e no estriado dorsal64. Dietas restritas com alto teor de gordura e sacarose podem levar a uma regulação negativa sustentada do mRNA dos receptores D1 e D2 no núcleo accumbens65. Um estudo de microdiálise dos efeitos de alimentos palatáveis revelou aumento da liberação de DA no núcleo accumbens e no córtex pré-frontal quando o alimento ainda era considerado novo; uma vez que os ratos estavam acostumados com o novo alimento, o aumento da liberação era embotado no núcleo accumbens, mas não no córtex pré-frontal.66. A suscetibilidade diferencial à habituação e condicionamento da atividade em duas regiões pode explicar o aumento maior observado no córtex pré-frontal do que no núcleo accumbens de minipigs expostos à mesma substância palatável que perdeu a novidade após doze dias. No entanto, como não imaginamos minipigs com [11C] racloprida após a primeira administração de sacarose, esta explicação é especulativa.
O córtex pré-frontal modula a função executiva, a tomada de decisões e o autocontrole67. A neurotransmissão DA disfuncional no córtex pré-frontal prejudica a modulação do processamento da recompensa, sugerindo função executiva prejudicada e habilidades de tomada de decisão em indivíduos obesos68,69. Além disso, um estudo em PET humano correlacionou a diminuição do metabolismo do córtex frontal com a diminuição da ligação estriada D2 na obesidade70. Aqui, encontramos uma disponibilidade reduzida de receptores D2 / 3 no córtex pré-frontal, incluindo o córtex orbitofrontal de porcos expostos ao regime de sacarose.
Os neurônios dopaminérgicos do ATV enviam projeções para o hipocampo e a amígdala, onde eles apóiam comportamentos semelhantes aos hábitos71 e mediar a codificação e recuperação do condicionamento ao medicamento72,73 e sugestões de comida74,75. A imagem do cérebro humano mostrou ativação do hipocampo em resposta ao desejo e degustação de alimentos76. Consistente com nossas descobertas de uma disponibilidade reduzida de receptores hipocampais e amigdalianos D2 / 3 em resposta à sacarose, mapeamento do cérebro humano com [18F] fallypride mostrou liberação de DA induzida por cocaína na amígdala e no hipocampo77. Nos cérebros de roedores, a exposição à cocaína desencadeou a liberação de DA na amígdala78, e alterações nos níveis de amígdala DA influenciaram o comportamento de busca de cocaína induzida por pistas79.
Em um estudo de indivíduos obesos, a associação entre as disponibilidades de D2 / 3 e μOR, conhecida por existir em regiões estriatais de indivíduos magros, foi interrompida no estriado ventral80. Comparamos os valores da PAND dos dois rastreadores para testar se os dados reproduziram esse efeito. Ao contrário dos humanos magros, os cérebros atuais dos porcos não tinham correlação entre os valores da PAND dos dois marcadores, na linha de base ou após a exposição à sacarose. Em seguida, testamos se os animais com os maiores declínios da ligação ao raclopride do traçador também teriam as maiores diminuições da ligação ao carfentanil do traçador, mas, em vez disso, encontramos uma correlação negativa nas regiões extrastriatais médias, sugerindo que os animais com maior alteração no potencial de ligação do traçador. A racloprida do traçador apresentou a menor alteração no potencial de ligação do traçador carfentanil. A relação inversa entre as mudanças sugere que os efeitos da ingestão de sacarose nas disponibilidades dos respectivos receptores são regulados em direções opostas. Sabe-se que o consumo excessivo de alimentos saborosos, ou drogas, pode ser impulsionado pelo desejo ou pelo gosto, ou ambos60,81. É possível que a magnitude do desejo impulsionado pela dopamina negue a magnitude do gosto impulsionado pelos opióides, ou vice-versa. Evidências recentes apontam para papéis do GABAA receptores no ATV e terminais colinérgicos no estriado e possivelmente no córtex que atuam como alternadores entre os mecanismos de ação opióide dependentes e independentes da dopamina82,83 isso pode explicar a reciprocidade dos efeitos da dopamina e dos opióides nas regiões extrastriatais porcinas determinadas aqui.
Uma deficiência do PET, também em animais comparativamente grandes, é a resolução espacial limitada da tomografia que afeta os resultados de pequenas regiões cerebrais envolvidas em comportamentos associados a alimentos. No entanto, apesar dessas preocupações, [11C] a ligação racloprida foi previamente registrada nas regiões estriatal e extrastriatal84,85,86,87. O uso de [11C] raclopride para rotular o mesmo tipo de receptores não suscita preocupação com possíveis diferenças de afinidade que podem afetar o uso de rastreadores separados para os mesmos receptores em diferentes regiões. Estudos recentes incluíram registros de ligação extrastriatal de [11C] racloprida. Alakurtti et al. encontraram boa reprodutibilidade das medidas de ligação do raclopride estriatal no estriado, com reprodutibilidade apenas boa a moderada no córtex85. Em um estudo posterior, Svensson et al. discutimos várias questões que afetam o uso de [11C] racloprida como marcador de receptores extrastriatais D2 / 3 em um estudo com humanos saudáveis, incluindo baixa reprodutibilidade no córtex e declínio limitado da ligação extrastriatal no córtex frontal em resposta a um agente bloqueador D2 / 388. As comparações teste-reteste revelaram variabilidades de 4-7% no estriado e 13-59% nas regiões corticais, mas o tempo entre os exames foi em média de 20 dias, diferentemente dos 1-2 dias mais informativos da maioria dos estudos. Vários fatores na vida desses indivíduos podem ter tido tempo para influenciar os resultados. De fato, mostramos aqui que a simples adição de consumo de sacarose a uma rotina matinal por 12 dias pode ter influenciado as medidas vinculativas obtidas duas semanas depois. Outros fatores tão comuns como jogar videogame, fazer compras, entrar em novos relacionamentos românticos e atividade sexual, usar drogas ou mudar a dieta e o exercício podem influenciar os níveis extrastriatais de dopamina, com potencial para grande variação de conjuntos de dados. O estudo atual em minipigs introduziu uma configuração bem controlada, com a única variável sendo a ausência ou presença de sacarose na dieta. Neste contexto, os dados de sete animais apresentaram variabilidade suficientemente baixa em regiões extrastriatais relevantes para identificar uma redução estatisticamente significativa da ligação em resposta à sacarose.
Uma limitação do estudo atual é o uso de anestésicos necessários para garantir a imobilidade durante in vivo imagiologia de animais. Os efeitos de anestésicos específicos e suas interações com medicamentos ou outras intervenções podem confundir a ligação de radioligandos89,90. A cetamina é um medicamento anti-glutamatérgico com rápido efeito antidepressivo em doses sub-anestésicas91,92,93, que não reduzem o estriatal [11C] ligação à racloprida em humanos94. No entanto, verificou-se que a S-cetamina reduz a disponibilidade de ligação dos receptores da dopamina D2 / 3 no estriado de primatas não humanos conscientes95. O isoflurano é um anestésico comum no PET animal. Em estudos anteriores, encontramos acúmulo estriatal de [11C] SCH23390, um radioligando dos receptores da dopamina D1 por ser significativamente maior em minipigs anestesiados com isoflurano em vez de propofol, sugerindo suscetibilidade da neurotransmissão dopaminérgica a efeitos da anestesia96. No presente estudo, todos os mini-porcos foram fotografados em ambos os momentos sob pré-medicação com cetamina e anestesia com isoflurano, validando as comparações atuais.
Conclusão
O consumo excessivo de alimentos palatáveis pode causar e tornar-se resultado de dependência com consequências diretas para a saúde devido à obesidade. Testamos a alegação de que opióides e dopamina mediam recompensas, importantes para a sobrevivência e também para o abuso de drogas. Minipigs com acesso intermitente a uma solução de sacarose por 12 dias consecutivos demonstraram diminuição da disponibilidade de dopamina D2 / 3 e μ-opioide em regiões cerebrais estriatais e extrastriatais, implicando que alimentos ricos em sacarose influenciam os circuitos de recompensa cerebral de maneira semelhante à observada quando drogas viciantes são consumidos. A exposição inicial inicial à sacarose foi consistente com a liberação de opióides nas regiões cerebrais ativas como recompensa. As mudanças na disponibilidade de opióides e dopamina explicam o potencial viciante de sacarose consumida em excesso.
Materiais e Métodos
Ética animal
Este estudo foi aprovado e regulamentado pela Inspetoria Dinamarquesa de Experimentação Animal e todas as experiências foram realizadas de acordo com a diretiva 2010/63 / UE do Parlamento Europeu e do Conselho sobre a proteção de animais utilizados para fins científicos e as diretrizes da ARRIVE. Utilizamos sete minipigs Göttingen fêmeas de quatorze meses de idade (Ellegaard, Dalmose, Dinamarca). Os minipig foram alimentados com uma dieta de pellets (6 dL, 2 vezes ao dia, Special Diets Services, Aarhus, Dinamarca) com água da torneira disponível ad libitum. A temperatura ambiente era de 20 a 22 ° C, a umidade relativa de 50 a 55% e o ar era trocado oito vezes a cada hora.
Consumo intermitente de sacarose
Imaginamos sete minipigs com [11C] raclopride e [11C] carfentanil na linha de base e novamente um dia após 12 dias consecutivos de exposição à água com sacarose. A exposição à sacarose consistia em uma hora de acesso à água com sacarose (sacarose, Dansukker, Copenhague, Dinamarca) (500 gramas de sacarose em 2 litros de água), diariamente durante um período de 12 dias. A quantidade de ingestão de sacarose foi registrada e todos os mini-porcos consumiram 2 litros por dia. Também fotografamos cinco dos mesmos minipigs com [11C] carfentanil, 30 minutos após o primeiro acesso à sacarose, para estudar a liberação aguda de opioides.
Os miniporcos ganharam uma média de 13.6% do peso corporal de 25.4 kg (± 0.73 SEM) na linha de base para 28.9 kg (± 0.69 SEM) após a exposição à sacarose de 12 dias, que foi significativamente maior (teste t unicaudal, p < 0.001) do que os aumentos observados em uma amostra de miniporcos controle obtidos em estudos anteriores, onde os pesos aumentaram em média apenas 4.9%, durante o mesmo período de desenvolvimento.
Imagem PET do cérebro
Jejuamos porcos durante a noite com acesso livre à água antes da imagem. Nós pré-medicamos e anestesiamos os minipigs como descrito anteriormente97 e os colocou em decúbito dorsal em um dispositivo PET / CT (Siemens Biograph 64 Truepoint PET). Realizamos uma tomografia computadorizada de dose baixa antes de cada aquisição de PET para definição anatômica e correção de atenuação dos dados de emissão de PET. Administramos por via intravenosa [11C] racloprida na linha de base (360 ± 18 MBq, atividade específica 77 ± 76 GBq / μmol, massa injetada 0.12 ± 0.08 μg / kg) e após 12 dias de sacarose (374 ± 54 MBq, atividade específica 127 ± 85 GBq / μmol, massa injetada 0.06 ± 0.05 μg / kg) e [11C] carfentanil na linha de base (377 ± 43 MBq, atividade específica 311 ± 195 GBq / μmol, massa injetada 0.03 ± 0.02 μg / kg) e após 12 dias de sacarose (337 ± 71 MBq, atividade específica 177 ± 157 GBq / μmol, massa injetada de 0.06 ± 0.08 μg / kg) via veia da orelha, em 10 mL de solução salina, durante o primeiro minuto de uma varredura de 90 minutos. Reconstruímos dados PET usando TrueX 3D OSEM (3 iterações, 21 subconjuntos), uma matriz 256 × 256 × 109 e um filtro Gauss de 2 mm, usando uma estrutura de tempo de 5 × 60, 3 × 300, 4 × 600 , 2 × 900 segundos (total de 14 quadros, 90 minutos). Na linha de base e após 12 dias de sacarose, os minipigs foram fotografados com os dois marcadores injetados com pelo menos 100 minutos de intervalo, devido à meia-vida de [11C] traçadores de PET. Após a conclusão da sessão final de PET, nós sacrificamos os mini-porcos sob anestesia profunda com uma overdose intravenosa de pentobarbital (100 mg / kg).
Análises quantitativas e estatísticas
Realizamos etapas de pré-processamento usando o PMOD 3.7 (PMOD Technologies Ltd, Zurique, Suíça). Para definir os parâmetros de transformação estereotáxica a partir de imagens PET com média de tempo, foram utilizados modelos específicos de ligantes. Aplicamos as matrizes de transformação geradas e os campos de distorção nas séries temporais dinâmicas correspondentes do PET. Geramos imagens paramétricas de [11C] potencial de ligação à racloprida (BPND) por meio do método multilinear de tecidos de referência de Ichise e colegas de trabalho98. Criamos uma máscara personalizada do cerebelo que excluía o vermis para obter a radioatividade do tecido cerebelar ao longo do tempo em uma região com densidade insignificante de receptores DA D2 / 3. Geramos imagens paramétricas de [11C] carfentanil usando uma implementação do modelo de tecido de referência Logan99,100 com t * = 30 min. Estudos de [11C] ligação do carfentanil no cérebro humano usou o córtex occipital como região de referência36; no entanto, no porco, de acordo com as curvas de atividade do tempo, a ligação não deslocável era mais baixa no cerebelo do que no córtex occipital, consistente com os achados de um estudo de autoradiografia em ratos101. Portanto, selecionamos o cerebelo como região de referência no presente estudo.
Análise estatística
Submetemos os mapas a uma análise voxel com o mapeamento estatístico não paramétrico (SnPM v13.01, http://warwick.ac.uk/snpm) Caixa de ferramentas SPM que utiliza a teoria não paramétrica de permutação para fornecer uma estrutura para inferência estatística, uma abordagem que se mostra adequada para pequenas amostras devido ao controle rigoroso de falsos positivos14 e aplicado conforme descrito anteriormente102. Um especialista em neuroanatomia dos porcos (DO) comparou as imagens resultantes com um nível de significância de 5% com um atlas de Göttingen minipig de alta resolução103,104 definir e rotular regiões de DA D2 / 3 e μOR BP diminuídosND da linha de base à condição pós-sacarose. Em seguida, realizamos uma análise de região de interesse (ROI) para extrair BPND valores de regiões específicas consideradas interessantes com base na análise SnPM, incluindo estriado, núcleo accumbens, tálamo, amígdala, córtex cingulado e córtex pré-frontal. Nenhuma estatística adicional foi realizada na análise do ROI, pois essas regiões já foram consideradas significativas usando o SnPM.
Referências
- 1.
Smyth, S. & Heron, A. Diabetes and obesity: the twin epidemics. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Prevalence and trends in obesity between US Adultos, 1999–2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al. Dopamina por "querer" e opióides por "gostar": uma comparação de adultos obesos com e sem compulsão alimentar. Obesidade (Silver Spring) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obesidade e ambiente alimentar: densidade energética da dieta e custos da dieta. Revista americana de medicina preventiva 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH A doçura intensa supera a recompensa da cocaína. PLoS ONE 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In Neurociência no século XXI (ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Novos desenvolvimentos na neurobiologia da alimentação e dependência: atualização sobre o estado da ciência. Nutrição 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. Em Prazeres do Cérebro (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Dos hedônicos do paladar ao impulso motivacional: receptores opioides mu centrais e comportamento de comer compulsivamente. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Recompensa alimentar: substratos cerebrais de querer e de gostar. Neurociência e análises bio-comportamentais 20, 1 – 25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Mapping neurorreceptors at work: na definição e interpretação dos potenciais de ligação após 20 anos de progresso. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Modelos animais de consumo excessivo de açúcar e gordura: relação com o vício em alimentos e aumento do peso corporal. Métodos Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
JELSING, J. et al. O córtex pré-frontal no cérebro do minipig de Göttingen definido por critérios de projeção neural e citoarquitetura. Brain Res. Bol. 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Testes de permutação não paramétricos para neuroimagem funcional: um primer com exemplos. Hum Brain Mapp 15, 1 – 25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Evidence for sugar addiction: comportamentais e neuroquímicos efeitos da ingestão intermitente e excessiva de açúcar. Neurociência e análises bio-comportamentais 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al. Sistema de recompensa alimentar: perspectivas atuais e necessidades futuras de pesquisa. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Auto-administração de sacarose e ativação do CNS no rato. Sou J Physiol Regulam Integr Comp Physiol 300, R876-884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. Circuitos separados codificam os valores hedônicos e nutricionais do açúcar. Neurociência da natureza 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. A ingestão excessiva de açúcar altera a ligação à dopamina e aos receptores mu-opióides no cérebro. Neuroreport 12, 3549 – 3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiate receptor: autoradiographic localization in rat brain. Proc Natl Acad Sci EUA 73, 3729 – 3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Recompensa e hiperatividade da cocaína no rato: locais de modulação do receptor opioide mu. Neuroscience 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamine afeta a autoadministração de cocaína em ratos que respondem em um esquema de proporção progressiva de reforço. Farmacologia, bioquímica e comportamento 75, 301 – 307 (2003).
- 23.
Schroeder, JA et al. Papel dos receptores mu opióides na atividade, sensibilização e recompensa induzidas pela cocaína no rato. Psychopharmacology 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW A reintegração induzida por cocaína requer estimulação endógena de receptores opióides mu no pálido ventral. The Journal of Neuroscience: o jornal oficial da Society for Neuroscience 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. A alimentação libera opióides endógenos em humanos. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Circuito límbico opióide para recompensa: interação entre hotspots hedônicos do núcleo accumbens e pálido ventral. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Opioid site in nucleus accumbens shell medeia comer e hedonic 'gosto' por alimentos: mapa baseado em microinjeção Fos plumas. Brain Res. 863, 71 – 86 (2000).
- 28.
Zhang, M. & Kelley, AE A ingestão de soluções de sacarina, sal e etanol é aumentada pela infusão de um agonista opióide mu no núcleo accumbens. Psychopharmacology 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE A ingestão de alimentos ricos em gordura é seletivamente aumentada pela estimulação do receptor opióide mu dentro do núcleo accumbens. Revista de farmacologia e terapêutica experimental 285, 908 – 914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ A naloxona bloqueia aquela porção da alimentação impulsionada pelo sabor doce em ratos com restrição alimentar. Sou J Physiol 268, R248-252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioides e ingestão alimentar: vias neurais funcionais distribuídas? Neuropeptídeos 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Um antagonista opióide, naltrexona, reduz a preferência por sacarose em humanos. Sou J Physiol 251, R91-96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS O efeito da naltrexona na detecção do sabor e no limiar de reconhecimento. Apetite 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxone, um bloqueador de opiáceos, reduz o consumo de alimentos doces com alto teor de gordura em comedoras compulsivas obesas e magras. Am J Clin Nutr 61, 1206 – 1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Circuitos opióides distintos determinam a palatabilidade e o desejo de eventos gratificantes. Proc Natl Acad Sci EUA 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al. Libertação endógena de opióides no sistema de recompensa do cérebro humano induzido pela administração aguda de anfetamina. Biol Psychiatry 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, eu. et al. A anfetamina induziu a liberação endógena de opióides no cérebro humano detectada com [11C] carfentanil PET: replicação em uma coorte independente. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Peptídeos opióides e o controle do comportamento ingestivo humano. Neurociência e análises bio-comportamentais 26, 713 – 728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR O que aprender com in vivo imagiologia cerebral opioidérgica? Eur J Dor 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Interações dopamina-opioide no estriado de rato: um papel modulador para receptores de dopamina D1 na transdução de sinal mediada por receptor opioide delta Neurofarmacologia 39, 372 – 381 (2000).
- 41.
Bencherif, B. et al. A ligação regional ao receptor mu-opióide no córtex insular diminui na bulimia nervosa e se correlaciona inversamente com o comportamento em jejum. Journal of nuclear medicine: publicação oficial, Society of Nuclear Medicine 46, 1349 – 1351 (2005).
- 42.
Karlsson, HK et al. A obesidade está associada à diminuição da disponibilidade de receptores de dopamina D-mu-opióides, mas inalterados, no cérebro. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. A perda de peso após a cirurgia bariátrica normaliza os receptores opióides cerebrais na obesidade mórbida. Psiquiatria Mol 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Endogenous Opioid Mechanisms Are Implicated in Obesity and Weight Loss in Humans. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. Dopamina e neurotransmissão opióide em dependências comportamentais: um estudo PET comparativo em jogos patológicos e compulsão alimentar. Neuropsychopharmacology 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Crônica dieta rica em gordura impulsiona a regulação epigenética pós-natal do receptor opióide mu no cérebro. Neuropsicofarmacologia: publicação oficial do Colégio Americano de Neuropsicofarmacologia 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Indução de hiperfagia e ingestão de carboidratos por estimulação do receptor opióide mu em regiões circunscritas do córtex frontal. The Journal of Neuroscience: o jornal oficial da Society for Neuroscience 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. A cocaína crônica amortece a sinalização de dopamina durante a intoxicação por cocaína e desequilibra a sinalização do receptor D1 sobre D2. The Journal of Neuroscience: o jornal oficial da Society for Neuroscience 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al. Efeitos da nicotina aguda na hemodinâmica e na ligação do raclopride [11C] aos receptores da dopamina D2,3 no cérebro de porcos. NeuroImage 19, 1127 – 1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Efeito da auto-administração de cocaína nos receptores D2 da dopamina em macacos rhesus. Sinapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. Sugestões de cocaína e dopamina no estriado dorsal: mecanismo de desejo na dependência de cocaína. The Journal of Neuroscience: o jornal oficial da Society for Neuroscience 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. Aumento da ocupação de receptores de dopamina no estriado humano durante o desejo de cocaína induzido por sugestões. Neuropsychopharmacology 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. A estimulação oral com sacarose aumenta a accumbens dopamina no rato. Sou J Physiol Regulam Integr Comp Physiol 286, R31-37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Imaging dopamine's role in drug abuse and addiction. Neurofarmacologia 56(Supl. 1), 3-8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Dopamina cerebral e obesidade. Lanceta 357, 354 – 357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Similaridade entre obesidade e dependência de drogas avaliada por imagens neurofuncionais: uma revisão de conceito. Jornal de doenças viciantes 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Receptores de dopamina D2 em disfunção de recompensa semelhante ao vício e alimentação compulsiva em ratos obesos. Neurociência da natureza 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Neurociência afetiva do prazer: recompensa em humanos e animais. Psychopharmacology 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Pleasure systems in the brain. Neurônio 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Sinal de recompensa preditivo de neurônios dopaminérgicos. J Neurophysiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Alterações na atividade cerebral após uma obesidade induzida por dieta. Obesidade 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens mecanismos de dopamina na ingestão de sacarose. Brain Res. 904, 76 – 84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG A compulsão diária de açúcar libera repetidamente dopamina na concha do accumbens. Neuroscience 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. O acesso repetido à sacarose influencia a densidade do receptor D2 da dopamina no corpo estriado. Neuroreport 13, 1575 – 1578 (2002).
- 65.
Alsio, J. et al. A expressão gênica do receptor da dopamina D1 diminui no núcleo associado à exposição prolongada a alimentos palatáveis e difere dependendo do fenótipo de obesidade induzida pela dieta em ratos. Neuroscience 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Influência diferencial dos mecanismos de aprendizagem associativa e não associativa na capacidade de resposta da transmissão de dopamina pré-frontal e acumbal a estímulos alimentares em ratos alimentados ad libitum. J Neurosci 17, 851 – 861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Circuitos neuronais desequilibrados em adição. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexia, bulimia e obesidade: déficits de tomada de decisão compartilhada no Iowa Gambling Task (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Decision-making deficits and overeating: a risk model for obesity. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Os baixos receptores D2 estriados da dopamina estão associados ao metabolismo pré-frontal em obesos: possíveis fatores contribuintes. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW O núcleo central da amígdala interage com o estriado dorso-lateral para regular a aquisição de hábitos. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, S. et al. Ativação de circuitos de memória durante o desejo de cocaína induzido por sugestões. Proc Natl Acad Sci EUA 93, 12040 – 12045 (1996).
- 73.
Childress, AR et al. Ativação límbica durante o desejo induzido por cocaína. Am J Psychiatry 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC O que e quando “querer”? Com base na amígdala, focaliza a importância do incentivo no açúcar e no sexo. Psychopharmacology 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiology of addiction: a neurocircuitry analysis. Lancet Psychiatry 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Ativação cortical em resposta a estímulos de sabor puro durante os estados fisiológicos de fome e saciedade. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
FOTROS, A. et al. Liberação de dopamina induzida por cocaína na amígdala e no hipocampo: um estudo de fallypride de alta resolução com PET [(1) (8) F] em participantes dependentes de cocaína. Neuropsychopharmacology 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. Controle do comportamento de busca de cocaína por estímulos associados a drogas em ratos: efeitos sobre a recuperação dos níveis de dopamina extracelular e de resposta ao operador extintos na amígdala e no núcleo accumbens. Proc Natl Acad Sci EUA 97, 4321 – 4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE O antagonismo do receptor de dopamina D1 ou D2 dentro da amígdala basolateral altera diferencialmente a aquisição de associações cocaína-estímulo necessárias para o restabelecimento da busca por cocaína induzida por sugestão. Neuroscience 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Interação aberrante mesolímbica dopamina-opiáceos na obesidade. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Sinais comportamentais de dopamina. Tendências Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. The neurobiology of opiácea motivação. Primavera fria Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Nicotínico e regulação do receptor opióide da transmissão mediada pelo receptor D2 da dopamina estriatal. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. Declínio relacionado à idade da disponibilidade do receptor de dopamina D2 / 3 medido com racloprida [C-11] em regiões cerebrais humanas não estriatais: comparação de quatro métodos. NeuroImage 41, T133-T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al. Confiabilidade teste-reteste a longo prazo da ligação dos receptores D2 / 3 estriada e extrastriatal da dopamina: estudo com racloprida [(11) C] e PET de alta resolução. J Meteb Meteb Flow 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Liberação de dopamina endógena após desafios farmacológicos na doença de Parkinson. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
SAWAMOTO, N. et al. Déficits cognitivos e liberação estriato-frontal de dopamina na doença de Parkinson. Cérebro 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Validade e confiabilidade da quantificação extrastriatal de ligação ao raclopride [(11) C] no cérebro humano vivo. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al. A anestesia com isoflurano aumenta os efeitos inibitórios da cocaína e GBR12909 no transportador de dopamina: estudos de PET em combinação com microdiálise no cérebro de macacos. Brain Res. 849, 85 – 96 (1999).
- 90.
Hassoun, W. et al. Estudo PET da ligação do raclopride [11C] no estriado do gato acordado: efeitos dos anestésicos e papel do fluxo sanguíneo cerebral. Revista européia de medicina nuclear e imagiologia molecular 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. O papel da cetamina na depressão resistente ao tratamento: uma revisão sistemática. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. Efeitos antidepressivos da cetamina em pacientes deprimidos. Biol Psychiatry 47, 351 – 354 (2000).
- 93.
Browne, CA & Lucki, I. Efeitos antidepressivos da cetamina: mecanismos subjacentes a novos antidepressivos de ação rápida. Frente Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al. A cetamina não diminui a ligação do receptor dopamina estriatal D2 no homem. Psychopharmacology 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. Redução da ligação do receptor D2 / 3 da dopamina no corpo estriado após uma única administração de esquetamina, mas não R-cetamina: a PET estudo em macacos conscientes. Eur Arch Psychiatry Clin Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al. Efeitos da anestesia e das espécies na captação ou ligação de radioligandos in vivo no minipig de Göttingen. BioMed research international 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. Imagem longitudinal monoaminérgica de PET da inibição crônica do proteassoma em minipigs. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Strategies to better neurorreceptor parameter estimation by linear regression analysis. J Meteb Meteb Flow 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, j. et al. Razões de volume de distribuição sem amostragem de sangue a partir da análise gráfica de dados PET. J Meteb Meteb Flow 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Quantification of brain mu-opioid receptors with [11C] carfentanil: reference-tissue methods. Nucl Med Biol 30, 177 – 186 (2003).
- 101.
Panksepp, J. & Bishop, P. An autoradiographic map of (3H) diprenorphine binding in rat brain: effects of social interact. Brain Res. Bol. 7, 405 – 410 (1981).
- 102.
Landau, AM et al. A estimulação eletroconvulsiva afeta diferencialmente a ligação do [(11) C] MDL100,907 aos receptores 5HT2A corticais e subcorticais no cérebro dos porcos. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. The telencephalon of the Gottingen minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Online histological atlas of the Gottingen minipig brain. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Agradecimentos
Um “Auxílio ao Desenvolvimento de Projetos de Ideias da UA” da Universidade de Aarhus para a AML financiou o estudo. Somos gratos pelo apoio técnico da equipe do Centro PET do Hospital da Universidade de Aarhus e da Fazenda da Universidade de Aarhus pela ajuda no tratamento dos animais. Agradecemos ao professor Morten Kringelbach, ao professor Jørgen Scheel-Kruger e ao professor associado Arne Møller pela ajuda no início desses estudos.
Declarações de ética
Interesses concorrentes
Os autores declaram não haver interesses conflitantes.
Informações adicionais
Nota do editor A Springer Nature permanece neutra em relação a reivindicações jurisdicionais em mapas publicados e afiliações institucionais.
Direitos e permissões
Abra o Access Este artigo está licenciado sob uma Licença Internacional Creative Commons Attribution 4.0, que permite o uso, compartilhamento, adaptação, distribuição e reprodução em qualquer meio ou formato, desde que você dê o crédito apropriado ao (s) autor (es) original (is) e à fonte, forneça um link para a licença Creative Commons e indique se foram feitas alterações. As imagens ou outro material de terceiros neste artigo estão incluídos na licença Creative Commons do artigo, a menos que indicado de outra forma em uma linha de crédito para o material. Se o material não estiver incluído na licença Creative Commons do artigo e o uso pretendido não for permitido por regulamentação estatutária ou exceder o uso permitido, você precisará obter permissão diretamente do detentor dos direitos autorais. Para visualizar uma cópia desta licença, visite http://creativecommons.org/licenses/by/4.0/.