- 1Laboratório de Psicofarmacologia Cognitiva, Departamento de Neurociências, Centro de Dependência e Saúde Mental, Toronto, ON, Canadá
- 2Programa de Neurociência Translacional do Departamento de Psiquiatria da Faculdade de Medicina da Universidade da Pensilvânia, Filadélfia, PA, EUA
- 3Seção de Biopsicologia, Departamento de Neurociência, Centro de Dependência e Saúde Mental, Toronto, ON, Canadá
A dependência é considerada uma doença cerebral causada pela exposição crônica a drogas. A sensibilização dos sistemas de dopamina cerebral (DA) parcialmente medeia esse efeito. O jogo patológico (PG) é considerado um vício comportamental. Portanto, PG pode ser causado por exposição crônica ao jogo. Identificar uma sensibilização induzida por jogos de azar de sistemas de DA apoiaria essa possibilidade. Recompensas de jogo evocam o lançamento do DA. Um episódio de jogo de caça-níqueis desloca a resposta de DA de entrega de recompensa até o início de pistas (spinning reels) para recompensa, de acordo com os princípios de aprendizagem de diferença temporal. Assim, estímulos condicionados (CS) desempenham um papel fundamental nas respostas do DA ao jogo. Em primatas, a resposta do DA a um CS é mais forte quando a probabilidade de recompensa é 50%. Sob este cronograma, o CS provoca uma expectativa de recompensa, mas não fornece informações sobre se ele ocorrerá em um determinado teste. Durante o jogo, um cronograma 50% deve provocar o lançamento de DA máximo. Isso está de acordo com a frequência de recompensas (46%) em um caça-níqueis comercial. A liberação de DA pode contribuir para a sensibilização, especialmente para anfetaminas. A exposição crônica a um CS que prevê recompensa 50% do tempo poderia imitar esse efeito. Nós testamos essa hipótese em três estudos com ratos. Os animais receberam exposições 15 × 45-min a um CS que previa recompensa com uma probabilidade de 0, 25, 50, 75 ou 100%. O CS era uma luz; a recompensa foi uma solução 10% de sacarose. Após o treino, os ratos receberam um regime de sensibilização de cinco doses separadas (1 mg / kg) de d-anfetamina. Por fim, receberam um teste 0.5 ou 1 mg / kg de anfetamina antes de um teste de atividade locomotora 90-min. Nos três estudos, o grupo 50% apresentou maior atividade que os outros grupos em resposta a ambas as doses de desafio. Os tamanhos dos efeitos foram modestos mas consistentes, como refletido por uma associação significativa de grupos × rank (ϕ = 0.986, p = 0.025). A exposição crônica a um programa de estímulos preditivos de recompensa semelhante a jogos de azar pode promover a sensibilização à anfetamina, muito semelhante à exposição à própria anfetamina.
Introdução
A dependência tem sido caracterizada como uma doença cerebral causada pela exposição crônica a drogas de abuso (Leshner, 1997). Pensa-se que a neuroplasticidade medeia os efeitos de tal exposição (Nestler, 2001). A sensibilização dos sistemas de dopamina do cérebro (DA) é uma forma de neuroplasticidade implicada na hiper-reatividade a estímulos condicionados (CS) para drogas, e busca compulsiva de drogas (Robinson e Berridge, 2001). A sensibilização foi definida operacionalmente pelo aumento da liberação de DA em resposta a um CS para recompensa e pelo aumento da resposta locomotora ao desafio de DA farmacológico (Robinson e Berridge, 1993; Pierce e Kalivas, 1997; Vanderschuren e Kalivas, 2000). Embora a sensibilização seja apenas uma das muitas mudanças cerebrais ligadas ao vício (cf. Robbins e Everitt, 1999; Koob e Le Moal, 2008), mudanças na liberação de dopamina pré-sináptica têm sido sugeridas como representando neuroadaptações comuns envolvidas na busca de drogas baseada em dependência (por exemplo, recaída), naqueles fármacos que induzem a sensibilização locomotora a opiáceos (por exemplo, morfina) ou estimulantes (por exemplo, anfetamina) , também causa a reintegração de respostas operantes extintas para a auto-administração de heroína ou cocaína - um modelo animal de recaída (Vanderschuren et al., 1999). A evidência de que a sensibilização de incentivo (aumento do valor da recompensa do medicamento) é mais pronunciada após a exposição inicial a drogas que causam dependência sugere ainda que a sensibilização pode estar envolvida também nos estágios iniciais da dependência (Vanderschuren e Pierce, 2010).
O jogo patológico (GP) tem sido descrito como um vício comportamental e recentemente reclassificado para a mesma categoria que os transtornos dependentes de substâncias na 5 edição do Manual Diagnóstico e Estatístico de Transtornos Mentais (Frascella et al., 2010; APA, 2013). Isto implica que o PG pode ser causado por exposição crônica a atividade semelhante ao jogo, que mecanismos comuns podem mediar os efeitos do jogo e da exposição ao medicamento (Zack e Poulos, 2009; Leeman e Potenza, 2012); e que a sensibilização das vias cerebrais da DA pode ser um elemento importante desse processo.
Evidências clínicas indiretamente apoiam essa possibilidade: Usando tomografia por emissão de pósitrons (PET) Boileau e colegas descobriram que indivíduos do sexo masculino com PG exibem liberação de corpo estriado significativamente maior em resposta à anfetamina (0.4 mg / kg) do que controles masculinos saudáveis (Boileau et al., 2013). As diferenças gerais entre os grupos foram significativas no estriado associativo e somatossensorial. No estriado límbico, que inclui o núcleo accumbens, os grupos não diferiram. No entanto, em indivíduos PG, a liberação de DA no estriado límbico correlacionou-se diretamente com a gravidade dos sintomas da PG. Esses achados são consistentes com a sensibilização das vias cerebrais do DA no PG, mas também sugerem algumas diferenças importantes com indivíduos dependentes de substâncias humanas e com o modelo animal clássico de sensibilização por anfetamina. Ao contrário dos indivíduos PG e animais expostos a baixas doses de anfetaminas (cf. Robinson e outros, 1982), os seres humanos com dependência de substância exibem consistentemente diminuição da liberação de DA para um desafio estimulante (Volkow et al., 1997; Martinez e outros, 2007), e evidências de animais sugerem que isso pode refletir déficits na função da DA durante os estágios iniciais de abstinência após padrões compulsivos de abuso de substâncias (Mateo et al., 2005). Em estudos onde a sensibilização estimulante é demonstrada em animais, a liberação de DA aumentada é geralmente observada no corpo estriado límbico e não no estriado dorsal (associativo, somatossensorial) (Vezina, 2004). No entanto, a procura de droga induzida por estímulos (isto é, condicionada) em animais repetidamente expostos a cocaína tem sido associada à liberação de DA aumentada no estriado dorsal, um resultado que indica uma forma mais habitual de comportamento motivado (Ito et al., 2002). Assim, a elevação global da liberação de AD em regiões dorsais em indivíduos PG pode estar relacionada à busca de recompensa baseada em hábitos (inflexível, rotinizada) envolvendo “uma progressão de domínios ventrais para mais dorsais do corpo estriado” (Everitt e Robbins, 2005p. 1481), enquanto que a liberação de DA dependente da gravidade no corpo estriado límbico nesses sujeitos pode corresponder mais de perto à sensibilização de incentivo como tipicamente modelada em animais. Os achados do PET não podem revelar se a hiper-reatividade do DA era uma característica preexistente desses indivíduos PG, uma consequência da exposição ao jogo, ou um resultado de algum outro processo inteiramente. Para abordar esta questão, é necessário demonstrar a indução da sensibilização pela exposição ao jogo crônico em indivíduos que são normais antes da exposição. Isso levanta questões sobre quais características do jogo são mais propensas a induzir a sensibilização.
Skinner observou que o esquema variável de reforço era fundamental para o fascínio do jogo (ou pelo menos sua persistência) (Skinner, 1953). O comportamento de apostas num jogo de slot machine está em conformidade com os princípios básicos do condicionamento instrumental, como reflectido por uma correlação prospectiva entre o pagamento monetário e o tamanho da aposta em rodadas consecutivas (Tremblay et al., 2011). Assim, a resposta operante de razão variável parece fornecer um modelo externamente válido de jogo de slot machine.
Pesquisas recentes com animais fornecem forte apoio inicial para um efeito causal da exposição ao jogo sobre a sensibilização. Singer e colegas examinaram os efeitos das sessões diárias de reforço de sacarina fixo (FR55) ou variável (VR1) em um paradigma operante de pressão de alavanca na resposta locomotora subseqüente a uma dose baixa (20 mg / kg) de anfetamina em homens saudáveis ( Sprague Dawley) ratos (Singer et al., 2012). Eles hipotetizaram que, se o jogo levar à sensibilização, os ratos expostos ao esquema variável, que imita o jogo, deveriam exibir uma resposta maior à anfetamina do que os ratos expostos ao esquema fixo. Como previsto, o grupo VR20 exibiu 50% maior resposta locomotora à anfetamina do que o grupo FR20. Em contraste, os grupos apresentaram locomoção equivalente após uma injeção de solução salina. Esses achados confirmam que a exposição crônica ao reforço variável é suficiente para induzir hiper-reatividade a um desafio de DA em animais saudáveis, randomizados para os respectivos esquemas.
Várias questões surgem desse resultado: em primeiro lugar, em que medida a contingência percebida - ou a falta dela - entre a resposta operante e seu resultado medeiam esses efeitos? Em termos de aprendizagem, esse efeito envolve uma “expectativa de resultado-resposta” ou um efeito semelhante pode ser visto na ausência de uma resposta operante, isto é, “uma expectativa de resultado-estímulo” em um paradigma pavloviano (cf. Bolles, 1972)? Em segundo lugar, o grau de contingência entre o evento antecedente (resposta ou estímulo) e seu resultado influencia o grau de sensibilização?
A segunda questão diz respeito ao papel da incerteza na sensibilização. Por exemplo, jogos cujo resultado é verdadeiramente aleatório - completamente imprevisível - têm maior potencial para induzir sensibilização do que jogos em que as chances de vencer são claramente definidas, mas não aleatórias, mesmo que a taxa absoluta de recompensa seja baixa? A presente pesquisa abordou essas questões.
O desenho experimental foi informado por um estudo seminal sobre expectativa de recompensa e resposta de neurônios DA em macacos (Fiorillo et al., 2003). Os animais desse estudo receberam uma recompensa de sumo (US) com os calendários de relação variável 0, 25, 50, 75 ou 100%. Os horários foram designados pelo 1 do 4 CS diferente (ícones). O cronograma 0% entregou recompensas com a mesma frequência que o cronograma 100%, mas omitiu o CS. A taxa de disparo dos neurônios DA durante o intervalo entre o início da SC e a entrega ou omissão dos EUA foi a principal medida dependente. O estudo constatou que a resposta da DA aumentou em função da incerteza da entrega da recompensa. Assim, sob o cronograma 100% o CS evocou pouca atividade, sob os horários 25 e 75%, o CS evocou níveis moderados e similares de atividade, e sob o cronograma 50% a atividade máxima evocada do CS. Em cada caso, a taxa de disparos escalou ao longo do intervalo CS-US, isto é, à medida que a expectativa se aproximava da fruição.
Esses achados indicam que a atividade de AD não apenas varia com o fato de a recompensa ser ou não certa (Fixed Ratio) ou incerta (Variable Ratio), mas também varia em proporção inversa à quantidade de informação sobre entrega de recompensa transmitida pelo CS. Na condição 100%, o CS evoca a expectativa de recompensa e também prevê perfeitamente a sua entrega. Nas condições 25 e 75%, o CS evoca a expectativa e prevê a entrega de recompensas em três de quatro vezes. Na condição 50%, o CS evoca a expectativa, mas não fornece informações sobre entrega de prêmios além do acaso. Com base em seus achados, Fiorillo et al. concluiu: “Esse aumento induzido pela incerteza na dopamina poderia contribuir para as propriedades recompensadoras do jogo” (p. 1901).
Os efeitos da recompensa variável de 50% em uma única sessão não devem mudar no decorrer de várias sessões, porque a probabilidade de recompensa permanece totalmente imprevisível em cada tentativa. Assim, ao considerar as condições que maximizariam a ativação crônica dos neurônios DA ao longo de episódios repetidos de jogo, o esquema de 50% deve gerar o efeito mais duradouro e também o mais robusto. Isso é digno de nota, dado que a taxa de recompensa de longo prazo (recompensa> 0) observada ao longo de milhares de giros em uma máquina caça-níqueis comercial foi de 45.8% (Tremblay et al., 2011). Assim, a recompensa variável 50% parece refletir com precisão o cronograma de pagamento administrado pelos dispositivos de jogos de azar reais.
O presente estudo usou os mesmos esquemas de condicionamento de Fiorillo et al. em uma exposição crônica, desenho entre grupos com ratos. Os animais foram submetidos a ~ 3 semanas de sessões de condicionamento diárias, onde um CS (luz) foi pareado com um US (pequena quantidade de sacarose). Após a fase de treinamento, os animais descansaram antes da avaliação da sensibilização indexada pela resposta locomotora à anfetamina. Com base na literatura, foi previsto que ratos expostos a diferentes esquemas de recompensa não difeririam em seu comportamento locomotor livre de drogas, mas exibiriam níveis significativamente diferentes de locomoção após a anfetamina, com o grupo de 50% exibindo uma maior resposta locomotora à droga em relação a os outros grupos durante o curso das doses, um padrão que seria esperado se os 50% dos animais tivessem sido previamente expostos a doses adicionais da própria anfetamina (isto é, sensibilização cruzada).
Experiment 1
Materiais e Métodos
Assuntos
Quatro grupos (n = 8 / grupo) de ratos Sprague-Dawley machos adultos (300-350 g) (Charles River, St. Constant, Quebeque, Canadá) foram alojados individualmente em caixas de policarbonato (20 × 43 × 22 cm) sob um 12 reverso: 12 ciclo claro-escuro. Eles receberam ad libitum acesso a comida e água, e manipulação diária por um experimentador para 2 semanas antes do estudo. Cada grupo foi condicionado em um dos quatro programas de recompensa variável: 0, 25, 50 ou 100%. O grupo 75% foi omitido neste estudo inicial, como Fiorillo et al. (2003) encontraram liberação equivalente pós-CS DA sob 25 e 75% de recompensas, de modo que ambas as condições levaram a uma maior liberação de DA do que a condição 100% CS-US, mas menor que a condição 50%.
Aparelho
O acesso às apresentações de sacarose e ao CS foi fornecido individualmente em caixas de condicionamento operante (33 × 31 × 29 cm). Cada caixa foi equipada com um magazine reforçador, localizado na parede frontal. Uma luz no topo da revista serviu como o CS. Um líquido motorizado controlado por solenóide poderia ser elevado ao chão do depósito. Os eventos na caixa foram controlados pelo equipamento e software Med Associates, usando um programa interno escrito no MED-PC. O teste locomotor foi realizado individualmente em gaiolas de acrílico (27 × 48 × 20 cm). Cada gaiola foi equipada com um sistema de monitoramento composto por seis células foto-feixe para detectar o movimento horizontal.
Procedimento
Training. O estudo foi conduzido em conformidade com as diretrizes éticas estabelecidas pelo Canadian Council on Animal Care. Os ratos foram restringidos ao alimento a 90% do seu peso corporal durante a duração do estudo e alojados individualmente. Cada rato recebeu 15 dias de treino de recompensa de sacarose (10% de solução de água a 0.06 ml por recompensa): 5 dias consecutivos × 3 semanas, com fins de semana desligados. Os animais foram mantidos com comida normal antes e depois da fase de treino; a exposição à sacarose foi restrita às sessões de treinamento quinze 40-min. Cada sessão diária consistia em apresentações de estímulo 15 (uma luz; CS), cada uma separada por um intervalo inter-tentativas de 120 s. A luz estava localizada no painel superior da revista e permaneceu ligada para 25 s, com sacarose disponibilizada durante os últimos 5 s. No caso do grupo 0, o dipper de sacarose foi elevado a cada 140 s (para 5 s), mas a luz do estímulo não foi iluminada. Isso equivale ao intervalo entre as apresentações do dipper no grupo 0 e os outros grupos (120 + 25 s). Cada sessão de tratamento durou ~ 40 min. Em média, o grupo 25 recebeu sacarose uma vez para cada quatro apresentações de CS; o grupo 50 recebeu sacarose uma vez para cada duas apresentações de CS e o grupo 100 recebeu sacarose após cada apresentação de CS.
ensaio. Duas semanas após a última sessão de acesso à sacarose (ou “condicionamento”), a resposta locomotora à d-anfetamina (AMPH; ip) foi avaliada. Os ratos receberam três sessões 2-h para se habituarem às caixas locomotoras, seguidas de seis sessões de teste AMPH. Os dias do teste AMPH ocorreram em intervalos de 1 por semana. Nos dias de teste, os ratos receberam 30 min para se habituarem a caixas e receberam uma dose única de 0.5 mg / kg de AMPH seguida, em sessões semanais separadas, de cinco doses de 1.0 mg / kg (uma dose por dia) nos dias de teste 1 até 5 . A locomoção pós-AMPH foi avaliada para 90 min em cada sessão.
Abordagem analítica de dados
As análises estatísticas foram conduzidas com SPSS (v. 16 e v. 21; SPSS Inc., Chicago IL). A resposta comportamental imediata ao CS foi avaliada em termos de perfurações do nariz na abertura onde a sacarose foi dispensada. O número médio de "nose pokes" durante este intervalo (5 s por ensaio) foi então comparado com o número médio de "nose pokes" durante a mesma duração (5 s) em média ao longo do tempo quando o CS estava ausente. Grupo × Sessão ANOVAs de nose-pokes com CS presentes e ausentes rastrearam a aquisição de resposta discriminativa à sugestão e respostas indiscriminadas do punch do nariz sob os diferentes esquemas ao longo das sessões de treinamento de sacarose 15.
Os efeitos do tratamento nas respostas locomotoras foram avaliados com ANOVAs Grupo × Sessão para a fase de habituação sem drogas (três sessões), desafio 0.5 de pré-sensibilização mg / kg AMPH (uma sessão) e durante as cinco sessões 1 mg / kg AMPH regime de sensibilização, quando se esperava que os grupos diferissem em resposta a doses repetidas de AMPH. Grupo × Sessão ANOVAs também avaliaram as respostas locomotoras sem fármacos durante a fase de habituação 30-min pré-injeção de cada sessão de teste AMPH. Comparações planejadas avaliaram a diferença no desempenho médio para o grupo 50 vs. grupo 0 (sem controle de expectativa) e grupo 100 (sem controle de incerteza), por meio de t-testes (Howell, 1992), usando os termos de erro MS e erro df para o efeito relevante (isto é, interação grupo ou grupo × sessão) da ANOVA (Winer, 1971). Análises de tendências polinomiais testaram o perfil das mudanças ao longo das sessões.
Para determinar se as respostas de abordagem na presença e ausência do SC durante as sessões de treinamento de sacarose 15 contribuíram para a variação na resposta locomotora à AMPH, ou diferenças de grupo mediadas na resposta AMPH, análises de acompanhamento de covariância (ANCOVAs) foram realizadas no AMPH dados locomotores, incluindo o total de golpes no nariz (soma para as sessões 15) quando o CS estava ausente como covariável. Um efeito significativo da covariável indicaria que as respostas de abordagem isenta de drogas moderavam (influenciavam a força) os efeitos de grupo ou sessão. Um declínio na significância dos efeitos de grupo ou sessão na presença de uma covariável significativa indicaria que as respostas de abordagem mediadas (contabilizadas) os efeitos de grupo ou sessão. Um declínio na significância dos efeitos de grupo ou sessão na ausência de um efeito covariável significativo simplesmente refletiria uma perda de poder estatístico devido à realocação de df do termo de erro para a covariável, e não teria relação com a interpretação do termo de erro. efeitos de grupo ou sessão.
Resultados
Nariz cutuca durante sessões de condicionamento de sacarose
CS presente. Figura 1A mostra os golpes no nariz médios para os grupos 25, 50 e 100 enquanto o CS estava presente nas sessões de condicionamento de sacarose 15 (os golpes no nariz não foram codificados para o grupo 0, que não recebeu EC). Uma ANOVA de 3 Group × 15 Session produziu efeitos principais significativos do Group, F(2, 21) = 5.63, p = 0.011 e Session, F(14, 294) = 14.00, p <0.001, junto com uma interação significativa Grupo × Sessão, F(28, 294) = 2.93, p <0.001. Figura 1A indica que o efeito principal da Sessão refletiu um aumento nos toques nas sessões em todos os três grupos, e o efeito principal do Grupo refletiu pontuações gerais geralmente mais altas no grupo 100 vs. grupo 25 com pontuações intermediárias no grupo 50. Uma interação significativa de Grupo × Sessão para a tendência cúbica, F(2, 21) = 4.42, p = 0.030, indicou uma subida, descida e nivelamento rápidos nos golpes no nariz durante as sessões no grupo 100, contra um aumento linear sobre as sessões no grupo 50, e um aumento linear mais raso sobre as sessões no grupo 25.
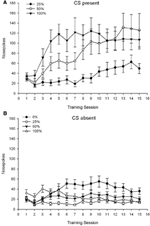
Figura 1. Respostas de abordagem da média (SE) (cutucões no nariz) em sessões de treinamento de sacarose 15 em grupos de ratos Sprague Dawley (n = 8 / group) expostos a recompensa de sacarose (solução de 10%) entregue sob programações variáveis de 0, 25, 50 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados. (UMA) Pontuações quando o CS estava presente (testes 5 s × 15). (B) Pontuações quando CS estava ausente (média para 5 × 15 s enquanto a luz estava desligada).
CS ausente. Figura 1B mostra as perfurações médias do nariz para todos os quatro grupos por uma duração equivalente (testes 5 s × 15) em média ao longo do tempo em que o CS estava ausente. Uma ANOVA de 4 Group × 15 Session produziu efeitos principais significativos do Group, F(3, 28) = 7.06, p = 0.001 e sessão F(14, 392) = 2.84, p <0.001, junto com uma interação significativa Grupo × Sessão, F(42, 392) = 3.93, p <0.001. Uma interação significativa Grupo × Sessão para a tendência quadrática, F(3, 28) = 3.91, p = 0.019, sem interação com a tendência cúbica, F(3, 28) <0.93, p > 0.44, refletiu um perfil em “U invertido” de cutucadas no nariz durante as sessões do grupo 0, em comparação com um perfil geralmente estável nas sessões dos outros grupos.
Habituação às câmaras locomotoras
Uma sessão 4 3 Group ANOVA produziu um efeito principal de Session, F(2, 56) = 5.67, p = 0.006 e nenhum outro efeito significativo, F(3, 28) <1.60, p > 0.21. A média (SE) de quebras do feixe por 2 h nas caixas locomotoras foi de 1681 (123) na sessão 1, 1525 (140) na sessão 2 e 1269 (96) na sessão 3. As comparações planejadas não encontraram diferenças significativas entre o grupo 50 e o grupo 0 ou grupo 100 na primeira ou última sessão de habituação, t(84) <1.69, p > 0.05. Assim, na ausência de AMPH, a exposição repetida às caixas de teste foi associada a um declínio consistente na atividade locomotora espontânea nos quatro grupos (ou seja, efeito de sessão), e nenhuma resposta diferencial em função do cronograma de treinamento de sacarose (sem interação) .
Sessões de teste
Efeitos da pré-sensibilização 0.5 mg / kg AMPH challenge.
Locomoção pré-injeção. A ANOVA unidirecional do Grupo 4 de resposta locomotora durante a fase de habituação 30-min pré-injeção não produziu efeitos significativos, F(3, 28) <1.05, p > 0.38. As comparações planejadas não encontraram nenhuma diferença significativa entre o grupo 50 e o grupo 0 ou grupo 100, t(32) <0.87, p > 0.40. Portanto, as diferenças da linha de base na locomoção pré-injeção não foram responsáveis pelas diferenças do grupo na resposta locomotora ao AMPH. As quebras de feixe médias (SE) para a amostra foram 559 (77).
Locomoção pós-injeção vs. sessão final de habituação sem drogas. Uma ANOVA de 4 grupos x 2 sessão comparou as respostas locomotoras dos grupos na sessão de habituação final e imediatamente após o desafio de pré-sensibilização 0.5 mg / kg de AMPH. As pontuações para a sessão de habituação (120 min) foram escaladas para corresponder à duração da sessão de teste AMPH (90 min) (pontuação de habituação bruta × 90/120). A análise rendeu um efeito principal significativo da Sessão, F(1, 28) = 34.16, p <0.001, e nenhum outro efeito significativo, F(3, 28) <2.26, p > 0.10. O efeito Session refletiu um aumento nas quebras de feixe médias (SE) em resposta à dose, de 952 (72) para 1859 (151). As comparações planejadas não encontraram diferenças significativas entre o grupo 50 e o grupo 0 ou grupo 100 em resposta à dose, t(56) <1.72, p > 0.10. No entanto, a ordem de classificação das pontuações de quebra de feixe (M; SE) alinhada com a hipótese: grupo 50 (2205; 264)> grupo 0 (2025; 203)> grupo 100 (1909; 407)> grupo 25 (1296; 299) .
Efeitos do 1 mg / kg AMPH.
Locomoção pré-injeção. Uma sessão 4 × 5 ANOVA de resposta locomotora durante a fase de habituação 30-min pré-injeção nas sessões de teste de 1 mg / kg AMPH produziu um efeito principal de Session, F(4, 112) = 43.64, p <0.0001, e nenhum outro efeito significativo, F(3, 28) <0.97, p > 0.42. As comparações planejadas não encontraram nenhuma diferença significativa entre o grupo 50 e o grupo 0 ou grupo 100 na primeira ou última sessão de teste, t(140) <0.84, p > 0.30. Portanto, as diferenças da linha de base na locomoção não foram responsáveis pelas diferenças do grupo na resposta locomotora ao AMPH. As pontuações médias (SE) de quebra de feixe para a fase de habituação pré-dose nas sessões 1–5 foram: 454 (30), 809 (53), 760 (36), 505 (35), 756 (39).
Locomoção pós-injeção. Figura 2 mostra os efeitos de cinco injeções de 1 mg / kg AMPH (uma por semana) nos escores de atividade locomotora nos quatro grupos. Uma sessão 4 5 Group ANOVA produziu um efeito principal de Session, F(4, 112) = 8.21, p <0.001, um efeito principal marginal do Grupo, F(2, 45) = 3.28, p = 0.085 e sem interação significativa, F(12, 122) <0.77, p > 0.68.
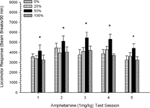
Figura 2. Resposta locomotora média (SE) (número de interrupções de feixe num sistema electrónico por 90 min) para 1 mg / kg de d-anfetamina (ip) em sessões semanais de 5 em grupos de ratos Sprague Dawley (n = 8 / group) previamente expostos a sessões de condicionamento diário 15 com recompensa de sacarose (solução 10%) entregue sob programações variáveis 0, 25, 50 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados. *p <0.05 para a diferença média entre o grupo 50 e o grupo 0, bem como o grupo 100, com base em comparações planejadas.
Comparações planejadas revelaram que as pontuações do grupo 50 diferiram significativamente do grupo 0, t(14) = 2.19, p = 0.037 e grupo 100, t(14) = 2.36, p = 0.025 [e diferiu marginalmente do grupo 25, t(14) = 2.03, p = 0.051]. Assim, no grupo 50, a resposta locomotora a 1 mg / kg de AMPH excedeu de forma fiável a dos outros três grupos ao longo de todas as cinco sessões de teste. A análise de tendência polinomial detectou uma tendência quadrática significativa nas sessões, F(1, 28) = 32.47, p <0.0001, e nenhuma outra tendência significativa, F(1, 28) <1.78, p > 0.19. Figura 2 mostra que esse resultado refletiu um padrão "invertido U" entre as sessões.
Controle de variação na resposta do nariz durante o treinamento de sacarose
A ANOVA de acompanhamento das respostas locomotoras ao 1 mg / kg AMPH, com os "nose pokes" (CS presentes) como covariate, nos três grupos que receberam o CS, produziu um efeito principal marginal do Grupo, F(2, 20) = 3.07, p = 0.069, e nenhum efeito relacionado à covariável, F(4, 80) <0.05, p > 0.85. Assim, a abordagem com indicação de resposta durante o treinamento não explicou a variação significativa na resposta locomotora a 1 mg / kg de AMPH nos grupos 25, 50 ou 100.
A ANOVA de seguimento das respostas locomotoras ao 1 mg / kg AMPH, com os "nose pokes" (SC ausentes) como covariável, produziu um efeito significativo da co-variável, F(1, 27) = 6.17, p = 0.020, um efeito principal significativo do Grupo, F(3, 27) = 4.13, p = 0.016, uma sessão marginal × interação Covariate, p = 0.080 e nenhum outro efeito significativo, F(4, 108) <1.48, p > 0.21. Assim, a resposta não indicada (indiscriminada) durante o treinamento explicou a variação significativa na resposta locomotora a 1 mg / kg de AMPH. No entanto, essa variação não se sobrepôs à variância relacionada ao grupo, porque a inclusão da covariável na análise aumentou em vez de diminuir a significância do efeito do grupo.
Discussão
Os dados do poke do nariz, enquanto o CS estava presente, mostram que os grupos adquiriram a associação entre o CS e a entrega de sacarose, como refletido por um aumento nas respostas ao longo das sessões de treinamento. O perfil de responder sobre as sessões enquanto o CS estava presente sugeriu que as programações 100 e 50% CS-US foram igualmente eficazes na abordagem de elicitação, enquanto o programa 25% provocou um aumento mais modesto na abordagem induzida por pistas. Os dados do nariz perfuraram enquanto o CS estava ausente sugerem que grupos que receberam qualquer um dos três esquemas de treinamento de sacarose-CS (grupo 25, 50, 100) rapidamente aprenderam a reduzir seus perfurocortantes na ausência do CS, enquanto animais no grupo 0 , que não recebeu CS, apenas aprendeu a diminuir seu comportamento de abordagem em um grau limitado após um treinamento extensivo.
Os dados de habituação mostram que os grupos não diferiram antes da AMPH e que a exposição repetida às caixas de teste foi associada à diminuição da resposta locomotora livre de drogas. Portanto, as diferenças entre os grupos e o aumento da resposta sobre doses repetidas de AMPH não podem ser atribuídas a diferenças pré-existentes no comportamento locomotor.
Os resultados do desafio de pré-sensibilização com 0.5 mg / kg de AMPH confirmaram que o fármaco aumentava a atividade locomotora em relação ao dia de habituação livre de fármaco final. Em consonância com a hipótese, o grupo 50 obteve classificação maior que os grupos 0 ou 100 (assim como o grupo 25) em termos de resposta média à dose, embora as diferenças médias entre os grupos não tenham sido significativas.
Para as sessões de sensibilização, as comparações planejadas entre os grupos mostraram que a exposição anterior à recompensa de sacarose condicionada de 50% levou a um aumento significativo na resposta locomotora a uma dose de 1.0 mg / kg de anfetamina em relação aos outros três esquemas. Este efeito foi evidente desde a primeira dose e não se alterou apreciavelmente com doses repetidas. A análise de tendência indicou uma resposta bifásica (para a amostra completa) a doses repetidas de AMPH, aumentando até a terceira dose e diminuindo depois disso. Os resultados da ANCOVA de acompanhamento com cutucadas no nariz (CS ausente) como covariável confirmaram que as diferenças nas respostas locomotoras dos quatro grupos a 1 mg / kg de AMPH não foram mediadas por uma abordagem não informada respondendo durante as sessões de treinamento de sacarose.
O efeito de grupo durante as sessões de sensibilização é consistente com nossa hipótese. O efeito da sessão bifásica não é consistente com o esperado aumento contínuo nas respostas locomotoras com doses repetidas de AMPH. Isso pode estar relacionado ao intervalo de dosagem. Para resolver esta questão, deve ser utilizado um procedimento (doses diárias alternativas) para induzir uma escalada consistente da resposta locomotora às doses 1.0 de mg / kg de AMPH (isto é, sensibilização comportamental). O impacto de um regime de sensibilização de AMPH na resposta subsequente a um segundo desafio 0.5 mg / kg apoiaria ainda mais a generalidade deste efeito. A inclusão de um desafio salino antes da AMPH determinaria o papel da expectativa ou efeitos relacionados à injeção (por exemplo, estresse) na resposta locomotora à AMPH. A inclusão de um grupo de sacarose 75% condicionado ajudaria a esclarecer o papel da incerteza de recompensa versus a infreqüência de recompensa no padrão de respostas para os grupos 50 e 25. Além disso, para permitir a avaliação (por ANCOVA) da contribuição de respostas de abordagem cued livre à locomoção sob AMPH (usando golpes no nariz com CS presente como covariada), os golpes no nariz também foram codificados para o grupo 0 durante o intervalo em que o CS estava presente nos outros quatro grupos (isto é, de modo que os golpes de nariz de todos os cinco grupos - incluindo o grupo 0 que não recebeu CS - pudessem ser incluídos na análise de covariância com CS presente como covariável). Esses refinamentos foram incorporados no experimento 2.
Experiment 2
Materiais e Métodos
A metodologia da experiência 2 foi semelhante à da experiência 1, mas revista para aproximar melhor um regime encontrado para induzir de forma fiável a sensibilização da AMPH (Fletcher et al., 2005). As alterações foram as seguintes: (a) O grupo 75% CS-sacarose (n = 8) foi incluído; (b) Durante o treino de sacarose, os ratos (excepto para o grupo 0) receberam apresentações 20 CS (luz) (em oposição a 15 na experiência 1); (c) As apresentações de SC foram separadas por um intervalo médio entre sessões de 90 s; intervalo: 30 – 180 s (vs. 120 s na experiência 1), que compensou o aumento nas tentativas de treino para igualar a duração de cada sessão de treino à da experiência 1; (d) a duração de cada uma das três sessões de habituação foi diminuída de 120 para 90 min para corresponder à duração das sessões de teste; (e) Foi adicionado um desafio salino (ip, 1 ml / kg) (90 min) (dia de treino pós-sacarose 8), para avaliar os efeitos locomotores da injecção per se (por exemplo, expectativa, estresse); (f) As sessões de sensibilização 1 mg / kg foram realizadas em dias alternados (dias pós-treino 12-21) e não em intervalos semanais como na experiência 1; (g) Juntamente com a pré-sensibilização 0.5 mg / kg AMPH desafio (9 pós-treino), foi adicionado um segundo desafio 0.5 mg / kg AMPH pós-sensibilização (dia de treino pós-sacarose 28), para testar a generalidade do efeito de sensibilização entre doses; (h) golpes no nariz enquanto CS estava presente foram codificados para todos os grupos (incluindo o grupo 0); (i) cutucadas nasais enquanto CS estava ausente foram gravadas especificamente do intervalo 5-s imediatamente antes do início do CS para indexar resposta de abordagem prematura.
Resultados
Nariz cutuca durante sessões de condicionamento de sacarose
Um grupo 5 × 15 Session × 2 Fase (CS presente, CS ausente) ANOVA de nose pokes produziu efeitos principais significativos do Group, F(4, 19) = 2.89, p = 0.050, Session F(14, 266) = 2.28, p = 0.006 e fase, F(1, 19) = 14.72, p = 0.001, bem como uma interação significativa de três vias, F(56, 266) = 1.38, p = 0.050. Painéis (A, B) da figura 3 traçar os escores médios de cutucadas no nariz dos grupos para as fases SC presente e SC ausente, respectivamente. A comparação dos dois painéis revela que o efeito principal da Fase refletiu mais respostas gerais de cutucada no nariz quando o CS estava presente vs. ausente. Portanto, as respostas com indicação ocorreram com muito mais frequência do que as respostas prematuras sem indicação. Os principais efeitos do Grupo e da Sessão não foram interpretados prontamente devido à interação de ordem superior. Este último resultado refletiu uma convergência de pontuações para os cinco grupos em um nível baixo relativamente estável nas sessões quando o CS estava ausente (Figura 3B), juntamente com uma divergência de escores em níveis altos (grupo 75, grupo 100), intermediário (grupo 50), e baixo (grupo 0, grupo 25) de soco nasal, respondendo durante as sessões quando o CS estava presente (Figura 3A). Das tendências polinomiais de ordem inferior (linear, quadrática, cúbica) apenas a interação de três vias para a tendência linear aproximou significância, F(4, 19) = 2.32, p = 0.094, refletindo o aumento geralmente monotônico dos sulcos nas sessões no grupo 75 e estabilização relativamente mais rápida nos níveis alto, intermediário e baixo de resposta nos outros grupos quando o CS estava presente.
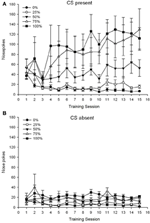
Figura 3. Respostas de abordagem da média (SE) (cutucões no nariz) em sessões de treinamento de sacarose 15 em grupos de ratos Sprague Dawley (n = 8 / group) expostos à recompensa de sacarose (solução de 10%) fornecida sob programações variáveis de 0, 25, 50, 75 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados. (UMA) Pontuações quando o CS estava presente (testes 5 s × 20). (B) Pontuações quando CS estava ausente (média para 5 × 20 s enquanto a luz estava desligada).
Habituação às caixas locomotoras
Uma sessão 5 × 3 ANOVA de respostas locomotoras livres de drogas produziu um efeito principal significativo de Session, F(2, 70) = 60.01, p <0.0001, e nenhum outro efeito significativo, F(4, 35) <0.70, p > 0.60. As comparações planejadas do grupo 50 com o grupo 0 e com o grupo 100 na primeira e na última sessão de habituação não produziram efeitos significativos, tde <0.84, p > 0.40. Portanto, a resposta locomotora média livre de drogas nos grupos principais não diferiu antes do teste. O número médio (SE) de quebras de feixe por 90 min foi 2162 (118) na sessão 1, 1470 (116) na sessão 2 e 1250 (98) na sessão 3.
Sessões de teste
Planos de sal. Uma sessão 5 × 2 ANOVA comparou a resposta locomotora na sessão final de habituação e na sessão de desafio com soro fisiológico. A ANOVA produziu um efeito principal de Session, F(1, 35) = 62.46, p <0.0001, e nenhum outro efeito significativo, F(4, 35) <0.65, p > 0.64. Figura 4 traça o grupo significa e mostra que o efeito Sessão refletiu uma diminuição global na resposta locomotora da sessão de habituação final livre de drogas para a sessão salina, que não variou por grupo. Assim, o declínio da resposta locomotora observado nas três sessões de habituação continuou na quarta exposição livre de drogas às caixas de teste.
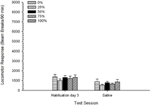
Figura 4. Resposta locomotora média (SE) (número de interrupções de feixe numa matriz electrónica por 90 min) nas últimas sessões de habituação sem drogas 3 e numa sessão subsequente após injecção de solução salina (ip, 1 ml / kg) em grupos de Sprague Dawley ratos (n = 8 / grupo) anteriormente expostos a sessões de condicionamento diário 15 com recompensa de sacarose (solução 10%) entregue sob programações variáveis 0, 25, 50, 75 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados.
Efeitos do 0.5 mg / kg AMPH.
Locomoção pré-injeção. Uma sessão 5 × 2 ANOVA de locomoção pré-injecção (30-min) nos dias pré e pós-sensibilização 0.5 mg / kg AMPH produziu um efeito principal significativo de Session, F(1, 35) = 13.39, p = 0.001 e nenhum outro efeito significativo, F(4, 35) <1.79, p > 0.15. As comparações planejadas não encontraram diferenças significativas entre o grupo 50 e o grupo 0 ou grupo 100 na primeira sessão, t(70) <1.00, p > 0.30. No entanto, na segunda sessão (pós-sensibilização), o grupo 50 (1203; 121) exibiu significativamente mais quebras do feixe pré-injeção (M; SE) do que o grupo 100 (756; 103), t(70) = 5.11, p <0.001, mas não diferiu do grupo 0 (1126; 211), t(7) <0.88, p > 0.40. Portanto, as diferenças basais na locomoção não levaram em conta as diferenças do grupo na resposta locomotora à primeira dose de 0.5 mg / kg de AMPH, mas podem ter contribuído para as diferenças entre o grupo 50 e o grupo 100 na resposta locomotora à segunda dose de 0.5 mg / kg de AMPH . As quebras médias (SE) do feixe para a fase de pré-injeção na primeira e na segunda sessões de teste de 0.5 mg / kg AMPH foram 757 (41) e 974 (59).
Locomoção pós-injeção. Uma sessão 5 × 2 ANOVA da resposta locomotora a 0.5 mg / kg AMPH antes e depois do regime de sensibilização à dose de 5 produziu um efeito principal de Session, F(1, 35) = 76.05, p <0.0001, e nenhum outro efeito significativo, F(4, 35) <1.10, p > 0.37. Figura 5 mostra as pontuações médias para cada grupo e sessão.
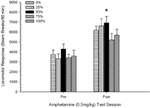
Figura 5. Resposta locomotora média (SE) (número de interrupções de feixe num sistema electrónico por 90 min) a 0.5 mg / kg de d-anfetamina em sessões separadas antes e após um regime de sensibilização por sessão com 5 de d-anfetamina (1.0 mg / kg; ip por sessão) em grupos de ratos Sprague Dawley (n = 8 / grupo) anteriormente expostos a sessões de condicionamento diário 15 com recompensa de sacarose (solução 10%) entregue sob programações variáveis 0, 25, 50, 75 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados. *p <0.05 para a diferença média entre o grupo 50 e o grupo 0, bem como o grupo 100, com base em comparações planejadas.
A figura mostra que o efeito Sessão envolveu um aumento significativo nas quebras do feixe da média geral (SE) por 90 min de 0.5 mg / kg dose 1, 3674 (216) para 0.5 mg / kg dose 2, 6123 (275). A falta de interação ou efeito de grupo sugeriu que a sensibilização à AMPH não variou de forma confiável entre os grupos. Apesar da falta de efeitos significativos relacionados com o grupo na ANOVA, a inspecção da figura revela que o grupo 50 apresentou a maior resposta à primeira e segunda doses de 0.5 mg / kg. Comparações planeadas de resposta à primeira dose de 0.5 mg / kg não revelaram diferenças significativas entre o grupo 50 e o grupo 0 ou o grupo 100, t's(35) <0.48, p > 0.50. No entanto, em resposta à segunda (pós-sensibilização) dose de 0.5 mg / kg, o grupo 50 exibiu locomoção significativamente maior do que o grupo 0, t(35) = 2.00, p <0.05, assim como o grupo 100, t(35) = 3.29, p <0.01.
À luz da diferença significativa do grupo na locomoção pré-injecção na segunda sessão 0.5 mg / kg AMPH relatada acima, foi conduzida uma ANOVA de 5 Grupo 2 Sessão de resposta locomotora a 0.5 mg / kg AMPH, controlando para pré- locomoção por injeção na segunda sessão. Esta análise produziu um efeito significativo da covariável, F(1, 34) = 8.65, p = 0.006, um efeito principal da Sessão F(1, 34) = 10.83, p = 0.002 e nenhum outro efeito significativo, F(4, 34) <0.85, p > 0.50. É importante notar que as comparações planejadas com base no erro MS e erro df da ANCOVA confirmaram que a resposta locomotora média à segunda dose de 0.5 mg / kg de AMPH permaneceu significativamente maior no grupo 50 do que no grupo 100, t(34) = 3.09, p <0.01 e grupo 0, t(34) = 1.88, p <0.05 (unicaudal), quando a variação pré-injeção da sessão 2 foi controlada. Assim, o grupo 50 apresentou resposta locomotora pós-sensibilização significativamente maior a 0.5 mg / kg de AMPH do que o grupo 100 ou o grupo 0, e essas diferenças de grupo não foram mediadas pela locomoção pré-injeção nos dias de teste.
Efeitos do 1.0 mg / kg AMPH.
Locomoção pré-injeção. Uma análise ANOVA de 5 Group × 5 Session das pontuações 30-min pré-injecção para as sessões de sensibilização 1 mg / kg AMPH produziu um efeito principal de Session, F(4, 140) = 16.70, p <0.0001, e nenhum outro efeito significativo, F(4, 35) <0.94, p > 0.45. As comparações planejadas não encontraram nenhuma diferença significativa na locomoção pré-injeção entre o grupo 50 e o grupo 0 ou grupo 100 na primeira sessão, t(175) <1.66, p > 0.10. No entanto, na sessão final, o grupo 50 (1167; 140) exibiu significativamente mais quebras de feixe (M; SE) do que o grupo 100 (1000; 99), t(175) = 2.35, p <0.05, mas não diferiu do grupo 0 (1085, 120), t(175) <1.16, p > 0.20. Portanto, as diferenças na locomoção pré-injeção contribuíram para as diferenças entre os grupos 50 e 100 na resposta locomotora à dose final de 1 mg / kg de AMPH. A média (SE) das quebras do feixe geral para a amostra durante a fase de pré-injeção para as Sessões 1 a 5 foram: 810 (46), 784 (52), 760 (53), 726 (46), 1009 (51).
Locomoção pós-injeção. Uma sessão 5 × 5 ANOVA de respostas a 1 mg / kg AMPH produziu um efeito principal significativo de Session, F(4, 140) = 6.72, p <0.001, uma interação marginal Grupo × Sessão, F(16, 140) = 1.57, p = 0.085 e nenhum efeito principal do Group, F(4, 35) <0.44, p > 0.77. As análises de tendência polinomial revelaram uma tendência linear significativa, F(1, 35) = 9.19, p = 0.005 e tendência cúbica, F(1, 35) = 21.63, p <0.001, nas sessões 1 a 5. Figura 6 mostra os escores locomotores médios para cada grupo e sessão.

Figura 6. Resposta locomotora média (SE) (número de interrupções de feixe num sistema electrónico por 90 min) para 1 mg / kg de d-anfetamina (ip) em sessões semanais de 5 em grupos de ratos Sprague Dawley (n = 8 / grupo) anteriormente expostos a sessões de condicionamento diário 15 com recompensa de sacarose (solução 10%) entregue sob programações variáveis 0, 25, 50, 75 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados.
A figura mostra que o efeito Sessão refletiu um aumento significativo nas quebras de feixe de média geral (SE) para toda a amostra da sessão 1, 4624 (213) para a sessão 5, 5736 (272), confirmando o surgimento da sensibilização ao AMPH. A tendência cúbica denotava o máximo relativo nas sessões 1, 3 e 5, com quedas nas sessões 2 e 4, particularmente para os grupos 0 e 50. A figura também revela que, apesar da falta de interação significativa, o grupo 25 exibiu uma resposta locomotora progressivamente maior durante as sessões e diferiu consideravelmente dos outros grupos nas sessões 4 e 5 (9 e 22% maior respectivamente, do que o próximo grupo mais alto). Comparações planejadas descobriram que o grupo 50 não diferiu significativamente dos grupos 0 ou 100, t(175) <0.89, p > 0.40 na primeira ou na última sessão de teste de AMPH 1 mg / kg.
Controle de variação na resposta do nariz durante o treinamento de sacarose
Dois grupos 5 × 2 Session As ANCOVAs da resposta locomotora a 0.5 mg / kg AMPH antes e depois do regime de sensibilização, incluindo puck total no nariz durante o treinamento de sacarose com CS presente e com CS ausente como covariáveis separadas, não encontraram efeitos significantes para nenhuma das covariáveis, F(1, 18) <1.03, p > 0.31. Portanto, a abordagem de resposta durante o treinamento não mediou as diferenças do grupo em resposta a 0.5 mg / kg de AMPH.
Dois grupos 5 5 Session ANCOVAs de resposta locomotora a 1 mg / kg durante as sessões de sensibilização com perfurações totais do nariz (CS presente, CS ausente) como covariáveis separadas não produziram efeitos significativos da covariável enquanto o CS estava presente, F(4, 104) <1.04, p > 0.38, e um efeito principal marginal da covariável enquanto o CS estava ausente, F(1, 18) = 3.32, p = 0.085.
Discussão
Os resultados deste estudo não apoiaram consistentemente a hipótese de que o grupo 50 demonstraria maior resposta locomotora ao longo das sessões em comparação com os outros grupos. Os dados 1 mg / kg AMPH confirmaram o surgimento de sensibilização com o regime de dosagem em dias alternados. O padrão entre grupos indicou uma tendência para maior sensibilização durante as últimas sessões no grupo 25, sem tal evidência para o grupo 50. Em contrapartida, os resultados da dose 0.5 mg / kg indicaram uma tendência para uma maior sensibilização no grupo 50, confirmando simultaneamente um aumento global significativo da resposta locomotora entre os grupos e a segunda dose 0.5 mg / kg AMPH. O efeito nulo da injeção de solução salina confirmou que a expectativa ou o estresse relacionado à injeção não contribuiu para os efeitos da AMPH.
Os dados do toque do nariz novamente revelaram um aumento geral na abordagem respondendo ao longo das sessões de treinamento quando o CS estava presente, sem aumento correspondente quando o CS estava ausente. Portanto, os animais pareciam adquirir a associação entre o CS e a perspectiva de recompensa de sacarose. Agrupar as diferenças na frequência dos golpes nasais quando o CS estava presente se aproximou aproximadamente da freqüência de entrega de recompensa sob os respectivos cronogramas, com os grupos 75 e 100 exibindo o maior número de golpes no nariz, grupo 50 exibindo números intermediários de golpes no nariz e grupos 0 e 25 exibindo o menor número de cutucadas. Estes resultados sugerem que o CS chegou a controlar abordagem respondendo de uma maneira consistente com a probabilidade global de recompensa. Embora especulativo, uma explicação possível para as taxas mais baixas de pique do nariz com CS presentes no grupo 50 no experimento 2 vs. 1 pode ser o encurtamento do intervalo entre estudos, já que intervalos mais longos entre os experimentos (experimento 1) parecem encorajar tendências e isso está associado ao aumento da rotatividade de DA nos córtices cingulado anterior, pré-límbico e infralímbico (Dalley et al., 2002). Portanto, a redução de 30% no intervalo entre os experimentos 2 (e 3) pode ter alterado os níveis de DA cortical e promovido uma abordagem mais seletiva (ou seja, guiada pela freqüência relativa de recompensa) versus impulsiva (não guiada pela freqüência de recompensa) a responder no grupo 50 durante os ensaios de treino na experiência 2 em comparação com a experiência 1.
A falta de efeitos relacionados à covariância para os "nose pokes" na condição de CS presente nas ANCOVAs indica que a abordagem de resposta durante o treinamento de sacarose não mediou os efeitos dos diferentes esquemas de sacarose-CS nas respostas à AMPH. O efeito marginalmente significativo da covariável para a condição de SC ausente na ANCOVA de respostas locomotoras a 1 mg / kg AMPH sugere que a tendência à resposta prematura livre de droga explicou alguma da variabilidade nos efeitos locomotores da AMPH durante as sessões de sensibilização.
Juntas, as evidências sugerem que os efeitos da história de condicionamento podem ser mais discerníveis com 0.5 AMPH do que com 1 mg / kg AMPH, e que um protocolo que gera sensibilização na ausência de qualquer outra manipulação pode obscurecer ou tornar redundantes os efeitos de uma suposta manipulação comportamental promotora de sensibilização (isto é, recompensa variável crônica).
A sensibilização comportamental à AMPH é um efeito robusto no laboratório. No entanto, fora do laboratório, apenas uma minoria de indivíduos que jogam cronicamente escalam para níveis patológicos. Embora o risco de sensibilização esteja relacionado ao risco de dependência (ou busca de drogas), especialmente para psicoestimulantes (Vezina, 2004; Flagel e outros, 2008), muitos fatores além do risco de sensibilização podem predispor ao vício (por exemplo, Verdejo-Garcia et al., 2008; Conversano et al., 2012; Volkow et al., 2012). No entanto, os fatores de traço que conferem vulnerabilidade à sensibilização podem interagir com o histórico de condicionamento para acentuar os efeitos da recompensa imprevisível (isto é, programação 50% CS-US) na reatividade do sistema DA. Para investigar essa possibilidade, a experiência 3 empregou o mesmo procedimento da experiência 2, mas usou a linhagem Lewis em vez de ratos da linhagem Sprague Dawley.
Ratos Sprague Dawley apresentam níveis intermediários de transportadores DA, com níveis mais baixos do que ratos da linhagem Wistar (Zamudio et al., 2005), mas níveis mais altos que os ratos Wistar-Kyoto (uma cepa “depressiva”) no núcleo accumbens, amígdala, área tegmentar ventral e substantia nigra (Jiao et al., 2003). Este perfil pode tornar os ratos Sprague Dawley apenas moderadamente sensíveis a manipulações ambientais ou farmacológicas da função DA. Em contraste, os ratos Lewis exibem baixos níveis de transportadores DA, bem como os receptores D2 e D3 DA no núcleo accumbens e no estriado dorsal, em comparação com outras estirpes (por exemplo, F344) (Flores et al., 1998) Essas diferenças morfológicas podem contribuir para a resposta diferencial dos ratos Lewis às manipulações DA. Os ratos Lewis também exibem uma gama de respostas acentuadas às manipulações experimentais de drogas em comparação com outras cepas (por exemplo, F344). Mais importante ainda, os ratos Lewis exibem maior sensibilização à metanfetamina, caracterizada por baixa resposta às doses iniciais, mas maior resposta às doses posteriores (Camp et al., 1994). Os ratos Lewis também exibem maior sensibilização locomotora a uma variedade de doses de cocaína (Kosten et al., 1994; Haile e outros, 2001). Com base nesse padrão de efeitos, supomos que os ratos Lewis nos permitiriam investigar se a suscetibilidade à sensibilização amplifica os efeitos do esquema de condicionamento na resposta subsequente à AMPH.
Experiment 3
Materiais e Métodos
A metodologia foi a mesma do experimento 2, além do uso de ratos Lewis (200-225 g na chegada, Charles River, Quebec, Canadá).
Resultados
Nariz cutuca durante sessões de condicionamento de sacarose
Um grupo 5 × 15 Session × 2 Fase (CS presente, CS ausente) ANOVA de nose pokes produziu efeitos principais significativos do Group, F(4, 34) = 6.12, p = 0.001, Session, F(14, 476) = 3.42, p <0.001 e Fase, F(1, 34) = 20.83, p <0.001, bem como uma interação significativa de três vias, F(56, 476) = 1.56, p = 0.008. Painéis (A, B) da figura 7 traçar os escores médios de cutucadas do nariz dos grupos para as fases SC presente e SC ausente, respectivamente. A comparação dos dois painéis revela que o efeito principal da Fase refletiu mais respostas gerais de cutucada no nariz quando o CS estava presente vs. ausente. Portanto, as respostas indicadas ocorreram com muito mais frequência do que as respostas prematuras. Os principais efeitos do Grupo e da Sessão não foram prontamente interpretados devido à interação de ordem superior. A interação de três vias refletiu uma convergência de pontuações para os cinco grupos em um nível baixo relativamente estável em todas as sessões quando o CS estava ausente [Painel (B)], juntamente com uma divergência de pontuações quando o CS estava presente em perfis relativamente discretos para cada grupo que estava em paralelo à sua ordem de classificação de frequência de recompensa: do maior (grupo 100) para o menor (grupo 25) [Painel (UMA)]. Apenas a tendência linear para a interação foi significativa, F(4, 34) = 4.03, p = 0.009, refletindo o aumento geralmente consistente nos golpes no nariz durante as sessões no grupo 100 quando o CS estava presente em comparação com o perfil relativamente inconsistente de aumento nos golpes no nariz ao longo das sessões nos outros grupos durante esta fase.

Figura 7. Respostas da abordagem da média (SE) (picadas no nariz) em sessões de treinamento de sacarose 15 em grupos de ratos Lewis (n = 8 / group) expostos à recompensa de sacarose (solução de 10%) fornecida sob programações variáveis de 0, 25, 50, 75 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados. (UMA) Pontuações quando o CS estava presente (testes 5 s × 20). (B) Pontuações quando CS estava ausente (média para 5 × 20 s enquanto a luz estava desligada).
Habituação às caixas locomotoras
Uma sessão 5 3 Group ANOVA produziu um efeito principal de Session, F(2, 70) = 23.07, p <0.0001, e nenhum outro efeito significativo, F(8, 70) <1.47, p > 0.18. Um padrão curvilíneo de pontuações locomotoras médias (SE) emergiu da sessão 1, 1076 (74), através da sessão 2, 644 (48), até a sessão 3, 762 (59). As comparações planejadas do grupo 50 com o grupo 0 e com o grupo 100 na primeira e na última sessão de habituação revelaram significativamente menos quebras de feixe no grupo 50 (M = 911; SE = 109) vs. grupo 0 (M = 1103; SE = 176) na sessão de habituação 1, t(105) = 2.02, p <0.05, mas nenhuma diferença entre o grupo 50 e o grupo 100 (M = 1066; SE = 150), t(105) <1.20, p > 0.20, nesta sessão. O Grupo 50 não diferiu significativamente do grupo 0 ou do grupo 100 na sessão de habituação final, t(105) <0.93, p > 0.30. Portanto, a resposta locomotora média livre de drogas nos grupos principais não diferiu consistentemente antes do teste.
Sessões de teste
Planos de sal. Uma sessão 5 × 2 ANOVA de respostas locomotoras na sessão final de habituação e na sessão de teste salino produziram um efeito principal significativo de Session, F(1, 35) = 50.12, p <0.0001, e nenhum outro efeito significativo, F(4, 35) <0.57, p > 0.68. Figura 8 mostra as pontuações médias do grupo para as duas sessões e indica que o efeito da sessão refletiu um declínio significativo da habituação ao teste salino. Assim, recebimento da injeção per se (por exemplo, expectativa, estresse) não melhorou a resposta locomotora.

Figura 8. Resposta locomotora média (SE) (número de interrupções de feixe numa matriz electrónica por 90 min) na última sessão de habituação sem drogas 3 e numa sessão subsequente após injecção de solução salina (ip, 1 ml / kg) em grupos de ratos Lewis (n = 8 / grupo) anteriormente expostos a sessões de condicionamento diário 15 com recompensa de sacarose (solução 10%) entregue sob programações variáveis 0, 25, 50, 75 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados.
Efeitos do 0.5 mg / kg AMPH.
Locomoção pré-injeção. Uma sessão 5 × 2 ANOVA de locomoção pré-injeção produziu um efeito principal significativo de Session, F(1, 35) = 15.04, p <0.001, e nenhum outro efeito significativo, F(4, 35) <1.19, p > 0.33. As comparações planejadas não encontraram nenhuma diferença significativa entre o grupo 50 e o grupo 0 ou o grupo 100 em qualquer sessão de teste, t(70) <0.99, p > 0.30. Portanto, as diferenças basais na locomoção pré-injeção não levaram em consideração as diferenças do grupo na resposta locomotora a 0.5 mg / kg de AMPH. As quebras médias (SE) do feixe para a fase de pré-injeção para a primeira e segunda (pós-sensibilização) sessões de 0.5 mg / kg foram 325 (25) e 473 (36).
Locomoção pós-injeção. Uma sessão 5 × 2 ANOVA de resposta locomotora a doses de 0.5 mg / kg administradas antes e depois de 1 mg / kg AMPH crónico produziu um efeito principal de Session, F(1, 34) = 87.44, p <0.0001, e nenhum outro efeito significativo, F(4, 34) <0.94, p > 0.45. Figura 9 Traça os escores locomotores médios para cada grupo e sessão e mostra que o efeito Sessão refletiu uma resposta geral aumentada para a segunda dose de 0.5 mg / kg, consistente com a sensibilização. A figura também mostra que os grupos tiveram um desempenho muito semelhante na sessão 1, mas o grupo 50 exibiu mais atividade locomotora do que os outros grupos na sessão 2. Comparações planeadas em resposta à primeira dose de 0.5 mg / kg não revelaram diferenças significativas entre o grupo 50 e o grupo 0 ou o grupo 100, t(35) <1.28, p > 0.20. No entanto, o grupo 50 exibiu resposta locomotora significativamente maior à segunda dose de 0.5 mg / kg do que o grupo 0, t(35) = 4.32, p <0.001, ou grupo 100, t(35) = 2.24, p <0.05.

Figura 9. Resposta locomotora média (SE) (número de interrupções de feixe num sistema electrónico por 90 min) a 0.5 mg / kg de d-anfetamina em sessões separadas antes e após um regime de sensibilização por sessão com 5 de d-anfetamina (1.0 mg / kg; ip por sessão) em grupos de ratos Lewis (n = 8 / grupo) anteriormente expostos a sessões de condicionamento diário 15 com recompensa de sacarose (solução 10%) entregue sob programações variáveis 0, 25, 50, 75 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados. *p <0.05 para a diferença média entre o grupo 50 e o grupo 0, bem como o grupo 100, com base em comparações planejadas.
Efeitos do 1 mg / kg AMPH.
Locomoção pré-injeção. Uma sessão 5 × 5 ANOVA de escores 30-min pré-injeção para as sessões de sensibilização produziu um efeito principal de Session, F(4, 140) = 4.10, p = 0.004 e nenhum outro efeito significativo, F(4, 35) = 1.25, p > 0.31. As comparações planejadas descobriram que as quebras do feixe durante a fase de pré-injeção (M; SE) foram significativamente menores no grupo 50 (395; 62) do que no grupo 100 (508; 62), t(175) = 2.58, p <0.01, mas não grupo 0, t(175) <1.83, p > 0.10, na sessão 1 de AMPH de 1 mg / kg. Na sessão final de AMPH de 1 mg / kg, as comparações planejadas também descobriram que a locomoção pré-injeção no grupo 50 (378; 60) foi significativamente menor do que no grupo 100 (650; 75 ), t(175) = 6.17, p <0.001, mas não no grupo 0, t(175) <1.84, p > 0.10. Como a direção dessas diferenças de grupo (grupo de controle = grupo 50) foi oposta ao padrão hipotético, as diferenças de grupo na locomoção pós-injeção que se alinham com a hipótese não podem ser atribuídas às diferenças de linha de base pré-injeção. As quebras de feixe médias (SE) gerais durante a fase de pré-injeção para as Sessões 1 a 5 foram: 442 (34), 452 (32), 542 (40), 411 (26), 504 (37).
Locomoção pós-injeção. Um grupo 5 × 5 Sessões ANOVA de respostas às doses de 1 mg / kg produziram um efeito principal significativo de Session, F(4, 140) = 6.15, p <0.001, e nenhum outro efeito significativo, F(4, 35) <0.57, p > 0.68. As análises de tendência polinomial revelaram uma tendência linear significativa, F(1, 35) = 9.34, p = 0.004 e tendência cúbica, F(1, 35) = 5.08, p = 0.031, o último resultado denotando o máximo relativo nas sessões 3 e 5. Figura 10 traça estes resultados e mostra que, apesar da falta de interacção significativa na ANOVA, o grupo 50 exibiu uma locomoção substancialmente maior do que os outros quatro grupos em resposta à dose final de 1 mg / kg. Assim, as comparações planejadas revelaram escores médios significativamente maiores na sessão 5 no grupo 50 do que em todos os outros grupos, t(35) > 3.68, p <0.001.
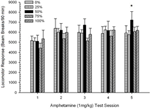
Figura 10. Resposta locomotora média (SE) (número de interrupções de feixe num sistema electrónico por 90 min) para 1 mg / kg de d-anfetamina (ip) nas sessões semanais de 5 em grupos de ratos Lewis (n = 8 / grupo) anteriormente expostos a sessões de condicionamento diário 15 com recompensa de sacarose (solução 10%) entregue sob programações variáveis 0, 25, 50, 75 ou 100%. O estímulo condicionado foi uma luz (120 s). O grupo 0 recebeu o mesmo número de recompensas que o grupo 100 na ausência de estímulos condicionados. *p <0.05 para a diferença média entre o grupo 50 e o grupo 0, bem como o grupo 100, com base em comparações planejadas.
Controle de variação na resposta do nariz durante o treinamento de sacarose
Dois grupos 5 × 2 Session As ANCOVAs da resposta locomotora a 0.5 mg / kg AMPH antes e depois do regime de sensibilização, incluindo puck total no nariz durante o treinamento de sacarose com CS presente e com CS ausente como covariáveis separadas, não encontraram efeitos significantes para nenhuma das covariáveis, F(1, 32) <0.44 p > 0.51. Duas ANCOVAs de 5 Grupo × 5 Sessão de resposta locomotora a 1 mg / kg de AMPH durante as sessões de sensibilização com cutucadas totais no nariz (CS presente, CS ausente) como covariáveis separadas não produziram efeitos significativos da covariável enquanto a CS estava presente ou ausente, F(1, 33) <0.14, p > 0.71. Portanto, a resposta da abordagem livre de drogas não levou em conta as diferenças do grupo nas respostas locomotoras a qualquer dose de AMPH.
Discussão
Sensibilização desenvolvida aos efeitos de anfetamina 1.0 mg / kg repetida. Os dados de habituação e solução salina confirmam que este efeito não foi devido a diferenças pré-existentes, expectativa ou respostas relacionadas ao estresse à injeção. As ANCOVAs com cutículas no nariz confirmam que esses efeitos não foram devidos ao comportamento de abordagem sem drogas. Os próprios dados da picada no nariz indicaram que os grupos adquiriram a associação entre o CS e a perspectiva de recompensa com sacarose. O nível de classificação dos grupos de resposta de cutucão no nariz no final do treinamento correspondeu à frequência geral de recompensa sob os diferentes esquemas do mais alto (grupo 100) ao mais baixo (grupo 0), como fez no experimento 2. A média geral relativamente mais baixa Os níveis de picada de nariz neste experimento em comparação com os experimentos 1 e 2 podem refletir uma abordagem mais seletiva em resposta a dicas para recompensa em ratos Lewis (Kosten et al., 2007).
Os dados da dose de 0.5 mg / kg mostraram que a resposta locomotora inicial ao AMPH em ratos Lewis 9) foi um pouco suprimido em comparação com ratos Sprague Dawley (experiência 2; 5), mas o aumento intragrupo em resposta à segunda dose em ratos Lewis foi considerável (quase o dobro da resposta à primeira dose de 0.5 mg / kg) após o regime AMPH em sessão 5 Mais notadamente, o grupo 50 apresentou uma maior resposta locomotora de todos os grupos excepto o grupo 25 para a segunda (isto é, pós-sensibilização) 0.5 mg / kg AMPH e uma maior resposta locomotora que todos os outros grupos, incluindo o grupo 25, para a dose final 1 mg / kg AMPH (sessão final de sensibilização) .
Análise sumária das classificações do grupo entre os experimentos
Para determinar a fiabilidade das diferenças de grupo na sensibilização, uma análise não paramétrica avaliou a contingência entre o grupo e a classificação da resposta locomotora média à segunda dose (AMPH pós-crónica 0.5 mg / kg e a dose final 1.0 mg / kg de AMPH das experiências 3. A análise produziu um efeito significativo, φ = 0.986, p = 0.025, refletindo o fato de que o grupo 50 ficou em primeiro lugar em todas menos uma das comparações. A classificação superior do grupo 50 em comparação com todos os outros grupos em resposta à segunda dose (0.5 mg / kg de AMPH pós-crónica) está representada na Figura 5 (experimento 2) e figura 9 (experiência 3). A classificação superior do grupo 50 em relação a outros grupos em resposta à dose final de 1.0 mg / kg é apresentada na Figura 2 (experimento 1) e figura 10 (experiência 3). A única excepção a este padrão foi a resposta à dose final de 1.0 mg / kg em ratos Sprague-Dawley na experiência 2.
Discussão geral
A presente série de experimentos testou a hipótese de que a exposição crônica a um cronograma de recompensa semelhante ao do jogo pode sensibilizar as vias de DA do cérebro, bem como a exposição crônica a drogas de abuso. A evidência de tal efeito sugeriria que a neuroplasticidade, do mesmo tipo que se acredita contribuir para a dependência de drogas, pode ser induzida pela exposição crônica a programas de recompensa imprevisíveis. Em consonância com a literatura sobre dependência de drogas, a resposta locomotora às doses de 0.5 e 1.0 mg / kg de reatividade do sistema DA indexado por AMPH, com maior locomoção em resposta a doses posteriores define operacionalmente a sensibilização (cf. Robinson e Berridge, 1993; Pierce e Kalivas, 1997; Vanderschuren e Kalivas, 2000).
No geral, os resultados estão de acordo com nossa hipótese. No entanto, eles também indicam considerável variabilidade nos efeitos experimentais devido a fatores processuais. Os efeitos do cronograma de condicionamento foram modestos, mas consistentes, com o grupo 50 demonstrando uma resposta maior do que os outros quatro grupos para ambas as doses após o regime de cinco doses. Embora em geral FOs valores para efeitos relacionados ao grupo nas análises de variância foram frequentemente não significativos, as diferenças dos grupos principais foram confirmadas com comparações planejadas em pares. A este respeito, deve-se notar que, “O pensamento atual, entretanto, é que a significância geral [para F na ANOVA] não é necessário. Em primeiro lugar, as hipóteses testadas pelo teste geral e um teste de comparação múltipla são bastante diferentes, com níveis de poder bastante diferentes. Por exemplo, o F Na verdade, distribui as diferenças entre os grupos através do número de graus de liberdade dos grupos. Isso tem o efeito de diluir o F na situação em que várias médias de grupo são iguais entre si, mas diferentes de alguma outra média ”(Howell, 1992p. 338). Esta é precisamente a situação que se aplicou nas experiências atuais, onde se esperava que o grupo 50 diferisse dos controles do grupo 0 e do grupo 100, mas nenhuma diferença entre esses grupos de controle foi prevista para o grupo 25 ou grupo 75.
Os dados do nariz cutâneo confirmaram que, em todos os experimentos, os animais adquiriram a associação entre o CE e a perspectiva de recompensa de sacarose. A correspondência entre a frequência do puxão do nariz para os diferentes grupos e a freqüência geral de recompensa sob seus respectivos cronogramas de treinamento sugere que a taxa média de recompensa pela sacarose guiou a resposta livre de drogas. No entanto, a falta de efeito mediador dos golpes no nariz nas respostas locomotoras relacionadas ao grupo para AMPH nas ANCOVAs indicou que processos separados fundamentam os dois comportamentos.
Em alguns casos, o efeito do cronograma de condicionamento foi evidente em resposta à primeira dose de AMPH; em outros casos, só surgiu após doses repetidas. As diferenças entre grupos na resposta locomotora à primeira dose de AMPH sugerem que a exposição a esquemas de recompensa similares ao jogo é suficiente por si só para induzir sensibilização. As diferenças de grupo na locomoção após múltiplas doses de AMPH indicam um efeito mais sutil que pode ser caracterizado como “suscetibilidade”, que só se manifesta quando combinado com exposição contínua ao agente sensibilizante primário (isto é, anfetamina).
As diferenças no padrão de resposta entre os experimentos sugerem que um intervalo maior entre o treinamento e o desafio inicial com AMPH pode maximizar a oportunidade de detectar o efeito inerente de sensibilização do tratamento condicionante. Isto por sua vez sugere que os efeitos da exposição à recompensa condicionada podem incubar com o tempo, um fenómeno também observado na sensibilização a estimulantes (Grimm et al., 2006). O padrão de resposta às duas doses de anfetamina sugere que a dose de 0.5 mg / kg pode ser mais eficaz em revelar os efeitos da história de condicionamento. Isso, por sua vez, sugere que os efeitos de condicionamento sob o atual protocolo de treinamento são um tanto sutis e podem ser camuflados por efeitos de teto sob doses de AMPH e condições que geram de novo sensibilização.
Na experiência 3, o padrão bifásico de resposta às doses de 0.5 mg / kg e a emergência progressiva de superioridade no grupo 50 são consistentes com o perfil esperado para ratos Lewis em resposta à metanfetamina (Camp et al., 1994). Isso dá suporte à validade dos presentes achados e sugere uma sobreposição entre os fatores que moderam a vulnerabilidade à sensibilização do psicoestimulante e aos horários de recompensa semelhantes aos jogos de azar.
Entre os experimentos, a resposta locomotora pós-sensibilização do grupo 50 geralmente excedeu a dos outros grupos sob diferentes doses de anfetamina e em diferentes cepas de animais. No entanto, a alta variabilidade dentro do grupo e os modestos tamanhos de efeito entre os grupos indicam um papel para outros fatores na reatividade do sistema DA à anfetamina após a exposição a variados horários de recompensa de sacarose condicionada. Embora as respostas dos neurónios DA para recompensar os sinais possam fornecer um modelo grosseiro de jogo (Fiorillo et al., 2003), como todos os modelos, há uma perda de informação por uma questão de parcimônia - isto é, para demonstrar um processo-chave. Como resultado, o padrão de efeitos nas condições de CS-US no original Fiorillo et al. O estudo não generaliza totalmente a resposta locomotora à anfetamina. Refinamentos adicionais do modelo são necessários para capturar completamente os aspectos do jogo que impactam na função do sistema DA.
Em conjunto, os resultados dessa série de experimentos fornecem suporte provisório para a hipótese de que a exposição crônica a programas de recompensa similares ao jogo aumenta a reatividade do sistema DA cerebral ao desafio psicoestimulante. Como tal, eles estendem as descobertas de Singer et al. (2012) que demonstraram que, em relação a um cronograma fixo, a exposição prévia a um cronograma de reforçamento variável em um paradigma operante aumenta a resposta locomotora subseqüente à anfetamina. Mais especificamente, os presentes resultados apontam para a incerteza da entrega de recompensas como o fator crítico subjacente aos efeitos da recompensa variável. A magnitude dos efeitos no paradigma operante foi substancialmente maior que os efeitos encontrados nos presentes experimentos. Isso pode refletir uma exposição crônica maior à atividade semelhante ao jogo (55 X XUMUM dias); pode refletir os efeitos de exigir uma resposta operante para obter a recompensa (ou seja, um papel para a agência) em vez de uma exposição passiva, como no presente estudo. Aumentar a duração do treinamento no paradigma atual ajudaria a resolver essas questões.
A validade dos esquemas variáveis de recompensa e reforço como modelos de jogo não pode ser obtida a partir desses experimentos. Pesquisas futuras que examinem o impacto do histórico de condicionamento no comportamento de risco em tarefas de jogo de roedores poderiam resolver esse problema. Da mesma forma, a correspondência entre a sensibilização comportamental encontrada aqui e a resposta do corpo estriado elevado à anfetamina encontrada recentemente em jogadores patológicos deve aguardar investigação adicional (Boileau et al., 2013). A micro-diálise poderia abordar essa questão, e a previsão baseada nos dados humanos seria que maior liberação de DA no grupo 50 “fenótipo de jogo” seria mais claramente observada no estriado dorsal (sensório-motor) do que no estriado ventral (límbico) . A validação da variável 50% CS + exposição de recompensa nesses outros paradigmas suportaria sua utilidade como modelo experimental genuíno do PG.
Enquanto algumas formas de jogo implicam claramente uma resposta instrumental (por exemplo, caça-níqueis), em outras formas de jogo (por exemplo, loteria) a ligação entre a ação (comprar o bilhete, ou seja, fazer a aposta), as dicas para a recompensa (ou seja, , números de loteria) e a recompensa em si (o número vencedor e a recompensa monetária) é muito mais difusa. No entanto, a ativação de DA durante o intervalo CS-US pode ocorrer. Isso pode explicar por que, quando o “número vencedor” é anunciado, a atenção é concentrada conforme cada bola da loteria individual cai em sucessão para compor a sequência específica de dígitos no número vencedor. Embora a probabilidade de ocorrência de um dígito específico seja matematicamente definida, o resultado de cada bola da loteria individual é binário - acerto (corresponde ao número do jogador) ou falha (não corresponde ao número do jogador) - e o resultado em qualquer tentativa é desconhecido. Tal cenário pode caracterizar melhor a experiência do grupo 50 nos presentes experimentos, onde a recompensa foi fornecida não contingentemente, mas também de forma imprevisível e o CS meramente indicou o potencial de recompensa sem revelar se isso ocorreria em uma determinada tentativa. As máquinas caça-níqueis estão mais fortemente ligadas ao PG do que os bilhetes de loteria (Cox et al., 2000; Bakken et al., 2009), indicando um papel importante para fatores instrumentais (e imediatos) nos aspectos recompensadores do jogo para esta população (Loba et al., 2001). Não obstante, o processo pavloviano modelado nos experimentos atuais (CS + recompensa incerta) parece ser um elemento necessário, se não suficiente, da experiência de jogo.
Juntamente com a falta de um requisito instrumental claro, várias outras características do projeto podem ter contribuído para o padrão relativamente modesto e variável dos efeitos experimentais. Os grupos diferiram na exposição global de sacarose, bem como a contingência entre CS e recompensa de sacarose. Embora isso possa ter contribuído para a variabilidade intergrupal, não é possível explicar imediatamente por que os animais com maior exposição à sacarose (grupo 100) apresentaram menor sensibilização que o grupo 50. Além disso, o grupo 0 não recebeu nenhum estímulo antes da exposição à sacarose em cada tentativa. Embora isso impedisse uma expectativa de recompensa induzida pela sugestão, ela não controlava a presença de um estímulo antes da entrega da recompensa, que existia em todos os outros grupos. Para abordar esta questão, pesquisas futuras devem incluir uma condição em que os animais recebam recompensa em cada ensaio após a exposição aleatória a um estímulo neutro (ou seja, cuja presença não sinaliza o potencial de recompensa).
Outra limitação do design é o potencial surgimento de comportamentos adjuvantes que podem influenciar os efeitos do cronograma de treinamento. Diante da incerteza, os animais podem desenvolver comportamentos supersticiosos projetados para melhorar o controle percebido e reduzir a ativação da DA induzida pela incerteza (cf. Harris et al., 2013). Portanto, é possível que aspectos não controlados do desenho experimental tenham permitido que os animais compensassem os efeitos do cronograma de condicionamento. Tal efeito poderia contribuir para a resposta relativamente modesta e variável à anfetamina no grupo 50 após treinamento com SC + sacarose. Pesquisas futuras devem registrar o comportamento espontâneo, além de cutucadas no nariz, durante as sessões de treinamento para testar essa possibilidade, e controlá-la estatisticamente caso ela surja. Como se espera que tal comportamento neutralize ou diminua os efeitos da incerteza induzida pelo cronograma, a resposta locomotora à anfetamina no grupo 50 deve ser aumentada quando ela é controlada (processual ou estatisticamente). Portanto, o design atual (não controlado) fornece um teste conservador dos efeitos da recompensa 50% CS + na sensibilização à anfetamina.
Em termos de validade externa, o uso de ratos machos também limita a generalização dos resultados. A falta de uma condição clara de “punição” também difere do jogo, em que grandes perdas monetárias são comuns e exercem efeitos motivacionais importantes (Nieuwenhuis et al., 2005; Singh e Khan, 2012). A capacidade de acumular recompensas também está ausente do paradigma atual e os ganhos acumulados em um jogo de caça-níqueis foram encontrados para interagir com manipulações de DA em humanos (Tremblay et al., 2011; Smart et al., 2013). Da mesma forma, a oportunidade de um jackpot é uma diferença importante entre o modelo atual e o jogo real.
Apesar dessas limitações, os presentes resultados sugerem que a variável% CS + 50 recompensa pode envolver as vias de DA implicadas nos efeitos reforçadores do jogo (Fiorillo et al., 2003; Anselme, 2013). A sensibilização cruzada da resposta à AMPH, seguindo este esquema do tipo jogo, é consistente com um papel fundamental para DA no jogo e efeitos de drogas psicoestimulantes (Zack e Poulos, 2009), e estende estudos anteriores sobre o cruzamento de motivação para jogar por AMPH em jogadores patológicos (Zack e Poulos, 2004). Os presentes resultados também sugerem indiretamente que doses modestas de AMPH, que não causam liberação supra-fisiológica de DA, podem modelar melhor a atividade cerebral em resposta a sinais de recompensa intermitentes (ie, durante o jogo) do que a exposição a altas (ie, binge-like) doses de drogas estimulantes (cf. Vanderschuren e Pierce, 2010). O suporte direto para esta correspondência pode ser obtido pela avaliação da liberação de DA em resposta à variável 50% do esquema CS-US e diferentes doses de AMPH usando microdiálise.
Do ponto de vista experimental, o presente modelo pavloviano e o modelo operante anterior de reforço variável parecem engendrar um fenótipo que se assemelha ao jogador patológico humano. Como tal, eles fornecem um valioso complemento para as tarefas de jogo de roedores que modelam o comportamento de jogo (como uma medida dependente), mas que até agora só empregavam animais saudáveis, o equivalente a jogadores sociais humanos. Com base na literatura, os animais cronicamente expostos a recompensa variável podem muito bem diferir nessas tarefas, particularmente em resposta a drogas DA-ergicas. A combinação do fenótipo de jogo do rato com as tarefas de jogos de azar pode permitir o desenvolvimento sistemático de medicamentos para o tratamento do PG, que pode não ser totalmente realizado apenas com animais saudáveis. Refinamentos adicionais no planejamento experimental e no regime de treinamento, como descrito acima, devem melhorar a correspondência entre os animais treinados neste paradigma e os jogadores patológicos reais.
Do ponto de vista clínico-sociológico, o achado de que a exposição ao 50% variável CS + recompensa, que corresponde ao cronograma de recompensa em uma slot machine comercial (Tremblay et al., 2011), altera o sistema DA cerebral de maneira confiável e duradoura, sugerindo que, em alguns casos, a atividade de jogo, como drogas de abuso, pode ser um “patógeno” capaz de causar dependência. No entanto, o modesto tamanho do efeito e a alta variabilidade em resposta à recompensa 50% CS + sugerem que, assim como as drogas de abuso, a tendência de programas de recompensa semelhantes ao jogo promover dependência depende muito do perfil de risco pré-existente do jogador. No entanto, para poupar a exposição de indivíduos de alto risco a potenciais efeitos adversos relacionados ao jogo, parece razoável que as políticas aplicadas para impedir o uso e minimizar os danos causados por drogas de abuso também possam ser estendidas ao jogo.
Declaração de conflito de interesse
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Esta pesquisa foi financiada por doações do Conselho de Pesquisa de Ciências Naturais e Engenharia do Canadá para Paul J. Fletcher. Agradecemos sinceramente a Djurdja Djordjevic pela preparação dos números.
Referências
Anselme, P. (2013). Dopamina, motivação e significado evolutivo do comportamento semelhante ao jogo. Behav. Res do cérebro. 256, 1 – 4. doi: 10.1016 / j.bbr.2013.07.039
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
APA (2013). Manual Diagnóstico e Estatístico de Transtornos Mentais, 5th Edn. Arlington, VA: American Psychiatric Publishing.
Bakken, IJ, Gotestam, KG, Grawe, RW, Wenzel, HG e Oren, A. (2009). Comportamento de jogo e problemas de jogo na Noruega 2007. Scand. J. Psychol. 50, 333 – 339. doi: 10.1111 / j.1467-9450.2009.00713.x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Boileau, I., Payer, D., Chugani, B., Lobo, DS, Houle, S., Wilson, AA, et ai. (2013) Na Vivo evidência para maior liberação de dopamina induzida por anfetaminas no jogo patológico: um estudo de tomografia por emissão de pósitrons com [C] - (+) - PHNO. Mol. Psiquiatria doi: 10.1038 / mp.2013.163. [Epub ahead of print].
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Bolles, RC (1972). Reforço, expectativa e aprendizado. Psychol. Rev. 79, 394 – 409. doi: 10.1037 / h0033120
Camp, DM, Browman, KE e Robinson, TE (1994). Os efeitos da metanfetamina e cocaína no comportamento motor e dopamina extracelular no estriado ventral de ratos Lewis versus Fischer 344. Brain Res.. 668, 180–193. doi: 10.1016/0006-8993(94)90523-1
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Conversano, C., Marazziti, D., Carmassi, C., Baldini, S., Barnabei, G. e Dell'Osso, L. (2012). Jogo patológico: uma revisão sistemática de achados bioquímicos, de neuroimagem e neuropsicológicos. Harv. Rev. Psiquiatria 20, 130 – 148. doi: 10.3109 / 10673229.2012.694318
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Cox, BJ, Kwong, J., Michaud, V. e Enns, MW (2000). Problema e provável jogo patológico: considerações de um levantamento comunitário. Pode. J. Psiquiatria 45, 548-553.
Dalley, JW, Theobald, DE, Águia, DM, Passetti, F. e Robbins, TW (2002). Déficits no controle de impulsos associados à função serotonérgica tonicamente elevada no córtex pré-frontal de ratos. Neuropsychopharmacology 26, 716–728. doi: 10.1016/S0893-133X(01)00412-2
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Everitt, BJ e Robbins, TW (2005). Sistemas neurais de reforço para dependência de drogas: das ações aos hábitos à compulsão. Nat. Neurosci. 8, 1481 – 1489. doi: 10.1038 / nn1579
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Fiorillo, CD, Tobler, PN e Schultz, W. (2003). Codificação discreta da probabilidade de recompensa e incerteza pelos neurônios dopaminérgicos. Ciência 299, 1898 – 1902. doi: 10.1126 / science.1077349
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Flagel, SB, Watson, SJ, Akil, H. e Robinson, TE (2008). Diferenças individuais na atribuição de saliência de incentivo a uma dica relacionada à recompensa: influência na sensibilização da cocaína. Behav. Res do cérebro. 186, 48 – 56. doi: 10.1016 / j.bbr.2007.07.022
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Fletcher, PJ, Tenn, CC, Rizos, Z., Lovic, V. e Kapur, S. (2005). A sensibilização à anfetamina, mas não à PCP, prejudica a mudança de configuração da atenção: reversão por um agonista do receptor D1 injetado no córtex pré-frontal medial. Psicofarmacologia (Berl.) 183, 190–200. doi: 10.1007/s00213-005-0157-6
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Flores, G., Wood, GK, Barbeau, D., Quirion, R. e Srivastava, LK (1998). Ratos Lewis e Fischer: uma comparação dos níveis de transportadores e receptores de dopamina. Brain Res.. 814, 34–40. doi: 10.1016/S0006-8993(98)01011-7
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Frascella, J., Potenza, MN, Brown, LL e Childress, AR (2010). As vulnerabilidades cerebrais compartilhadas abrem o caminho para vícios não subsistentes: esculpir o vício em uma nova articulação? Ann. NY Acad. Sci. 1187, 294 – 315. doi: 10.1111 / j.1749-6632.2009.05420.x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Grimm, JW, Buse, C., Manaois, M., Osincup, D., Fyall, A. e Wells, B. (2006). Dissociação dependente do tempo dos efeitos dose-resposta da cocaína sobre o desejo e a locomoção da sacarose. Behav. Pharmacol. 17, 143 – 149. doi: 10.1097 / 01.fbp.0000190686.23103.f8
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Haile, CN, Hiroi, N., Nestler, EJ e Kosten, TA (2001). Respostas comportamentais diferenciais à cocaína estão associadas à dinâmica de proteínas dopaminérgicas mesolímbicas em ratos Lewis e Fischer 344. Sinapse 41, 179 – 190. doi: 10.1002 / syn.1073
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Harris, JA, Andrew, BJ e Kwok, DW (2013). A abordagem revista durante um sinal de comida depende de condicionamento pavloviano, não instrumental. J. Exp. Psychol. Anim Behav. Processo. 39, 107 – 116. doi: 10.1037 / a0031315
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Howell, DC (1992). Métodos Estatísticos para Psicologia. Boston, MA: Duxbury.
Ito, R., Dalley, JW, Robbins, TW e Everitt, BJ (2002). Liberação de dopamina no estriado dorsal durante o comportamento de procura de cocaína sob o controle de uma sugestão associada à droga. J. Neurosci. 22, 6247 – 6253.
Jiao, X., Pare, WP e Tejani-Butt, S. (2003). Diferenças de tensão na distribuição de locais transportadores de dopamina no cérebro de ratos. Prog. Neuropsychopharmacol. Biol. Psiquiatria 27, 913–919. doi: 10.1016/S0278-5846(03)00150-7
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Koob, GF e Le Moal, M. (2008). Reveja. Mecanismos neurobiológicos para processos motivacionais adversários na dependência. Philos. Trans. R. Soc. Lond. Biol. Sci. 363, 3113 – 3123. doi: 10.1098 / rstb.2008.0094
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Kosten, TA, Miserendino, MJ, Chi, S. e Nestler, EJ (1994). As cepas de ratos de Fischer e Lewis mostram efeitos diferenciais da cocaína na preferência de lugar condicionada e na sensibilização comportamental, mas não na atividade locomotora ou na aversão ao gosto condicionado. J. Pharmacol. Exp. Ther. 269, 137 – 144.
Kosten, TA, Zhang, XY e Haile, CN (2007). Diferenças de tensão na manutenção da auto-administração de cocaína e sua relação com respostas de atividade inovadora. Behav. Neurosci. 121, 380 – 388. doi: 10.1037 / 0735-7044.121.2.380
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Leeman, RF e Potenza, MN (2012). Semelhanças e diferenças entre jogo patológico e transtornos por uso de substâncias: um foco na impulsividade e compulsividade. Psicofarmacologia (Berl.) 219, 469–490. doi: 10.1007/s00213-011-2550-7
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Leshner, AI (1997). O vício é uma doença cerebral e é importante. Ciência 278, 45 – 47. doi: 10.1126 / science.278.5335.45
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Loba, P., Stewart, SH, Klein, RM e Blackburn, JR (2001). Manipulação das características dos jogos padrão de terminal de loteria de vídeo (VLT): efeitos em jogadores patológicos e não patológicos. J. Gambl. Viga. 17, 297 – 320. doi: 10.1023 / A: 1013639729908
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Martinez, D., Narendran, R., Foltin, RW, Slifstein, M., Hwang, DR, Broft, A., et ai. (2007) Liberação de dopamina induzida por anfetaminas: marcadamente embotada na dependência de cocaína e preditiva da escolha pela auto-administração de cocaína. Sou. J. Psiquiatria 164, 622 – 629. doi: 10.1176 / appi.ajp.164.4.622
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Mateo, Y., Falta, CM, Morgan, D., Roberts, DC e Jones, SR (2005). Redução da função terminal da dopamina e insensibilidade à cocaína após autoadministração e privação de cocaína. Neuropsychopharmacology 30, 1455 – 1463. doi: 10.1038 / sj.npp.1300687
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Nestler, EJ (2001). Bases moleculares da plasticidade a longo prazo subjacente à dependência. Nat. Rev. Neurosci. 2, 119 – 128. doi: 10.1038 / 35053570
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Nieuwenhuis, S., Heslenfeld, DJ, von Geusau, NJ, Marte, RB, Holroyd, CB e Yeung, N. (2005). A atividade em áreas cerebrais sensíveis à recompensa é fortemente dependente do contexto. Neuroimage 25, 1302 – 1309. doi: 10.1016 / j.neuroimage.2004.12.043
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Pierce, RC e Kalivas, PW (1997). Um modelo de circuitos da expressão de sensibilização comportamental para psicoestimulantes semelhantes a anfetaminas. Cérebro Res. Cérebro Res. Rev. 25, 192. doi: 10.1016 / S0165-0173 (97) 00021-0
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Robbins, TW e Everitt, BJ (1999). Dependência de drogas: maus hábitos se somam. Natureza 398, 567 – 570. doi: 10.1038 / 19208
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Robinson, TE, Becker, JB e Presty, SK (1982). Facilitação a longo prazo do comportamento rotacional induzido por anfetaminas e liberação de dopamina no estriado produzida por uma única exposição a anfetaminas: diferenças entre os sexos. Brain Res.. 253, 231–241. doi: 10.1016/0006-8993(82)90690-4
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Robinson, TE e Berridge, KC (1993). A base neural do desejo de drogas: uma teoria de incentivo-sensibilização da dependência. Cérebro Res. Cérebro Res. Rev. 18, 247 – 291. doi: 10.1016 / 0165-0173 (93) 90013-P
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Robinson, TE e Berridge, KC (2001). Sensibilização de incentivo e vício. Vício 96, 103 – 114. doi: 10.1046 / j.1360-0443.2001.9611038.x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Singer, BF, Scott-Railton, J. e Vezina, P. (2012). O reforço imprevisível da sacarina aumenta a resposta locomotora à anfetamina. Behav. Res do cérebro. 226, 340 – 344. doi: 10.1016 / j.bbr.2011.09.003
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Singh, V. e Khan, A. (2012). Tomada de decisão nas variantes de recompensa e punição da tarefa de jogo no Iowa: evidência de “previsão” ou “enquadramento”? Frente. Neurosci. 6: 107. doi: 10.3389 / fnins.2012.00107
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Skinner, BF (1953) Ciência e Comportamento Humano. Nova Iorque, NY: Free Press.
Smart, K., Desmond, RC, Poulos, CX e Zack, M. (2013). O modafinil aumenta a saliência de recompensa em um jogo de caça-níqueis em jogadores patológicos de baixa e alta impulsividade. Neurofarmacologia 73, 66 – 74. doi: 10.1016 / j.neuropharm.2013.05.015
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Tremblay, AM, Desmond, RC, Poulos, CX e Zack, M. (2011). O haloperidol modifica os aspectos instrumentais do jogo de slot machine em jogadores patológicos e controles saudáveis. Viciado. Biol. 16, 467 – 484. doi: 10.1111 / j.1369-1600.2010.00208.x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Vanderschuren, LJ e Kalivas, PW (2000). Alterações na transmissão dopaminérgica e glutamatérgica na indução e expressão de sensibilização comportamental: uma revisão crítica de estudos pré-clínicos. Psicofarmacologia (Berl.) 151, 99 – 120. doi: 10.1007 / s002130000493
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Vanderschuren, LJ e Pierce, RC (2010). Processos de sensibilização na toxicodependência. Curr. Topo. Behav. Neurosci. 3, 179 – 195. doi: 10.1007 / 7854_2009_21
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Vanderschuren, LJ, Schoffelmeer, AN, Mulder, AH e De Vries, TJ (1999). Mecanismos dopaminérgicos que medeiam a expressão a longo prazo da sensibilização locomotora após pré-exposição à morfina ou à anfetamina. Psicofarmacologia (Berl.) 143, 244 – 253. doi: 10.1007 / s002130050943
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Verdejo-Garcia, A., Lawrence, AJ e Clark, L. (2008). Impulsividade como um marcador de vulnerabilidade para transtornos por uso de substâncias: revisão dos resultados de pesquisas de alto risco, jogadores problemáticos e estudos de associação genética. Neurosci. Biobehav. Rev. 32, 777 – 810. doi: 10.1016 / j.neubiorev.2007.11.003
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Vezina, P. (2004). Sensibilização da reatividade dos neurônios dopaminérgicos mesencéfalos e da autoadministração de drogas estimulantes psicomotoras. Neurosci. Biobehav. Rev. 27, 827 – 839. doi: 10.1016 / j.neubiorev.2003.11.001
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Volkow, ND, Wang, GJ, Fowler, JS, Logan, J., Gatley, SJ, Hitzemann, R., et ai. (1997) Diminuição da responsividade dopaminérgica do estriado em indivíduos dependentes de cocaína destoxificados. Natureza 386, 830 – 833. doi: 10.1038 / 386830a0
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Volkow, ND, Wang, GJ, Fowler, JS e Tomasi, D. (2012). Circuitos de vício no cérebro humano. Annu Rev. Pharmacol. Toxicol. 52, 321 – 336. doi: 10.1146 / annurev-pharmtox-010611-134625
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Winer, B. (ed.) (1971) Princípios Estatísticos no Design Experimental. New York, NY: McGraw-Hill.
Zack, M. e Poulos, CX (2004). A anfetamina estimula a motivação para jogar e redes semânticas relacionadas a jogos de azar em jogadores problemáticos. Neuropsychopharmacology 29, 195 – 207. doi: 10.1038 / sj.npp.1300333
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Zack, M. e Poulos, CX (2009). Papéis paralelos da dopamina no jogo patológico e dependência psicoestimulante. Curr. Rev de abuso de drogas. 2, 11 – 25. doi: 10.2174 / 1874473710902010011
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Zamudio, S., Fregoso, T., Miranda, A., De La Cruz, F. e Flores, G. (2005). Diferenças de tensão dos níveis de receptores de dopamina e comportamentos relacionados à dopamina em ratos. Cérebro Res. Touro. 65, 339 – 347. doi: 10.1016 / j.brainresbull.2005.01.009
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Palavras-chave: jogo patológico, sensibilização, anfetaminas, dopamina, incerteza
Citação: Zack M, Featherstone RE, Mathewson S e Fletcher PJ (2014) A exposição crônica a um programa semelhante a um jogo de estímulos preditivos de recompensa pode promover a sensibilização à anfetamina em ratos. Frente. Behav. Neurosci. 8: 36. doi: 10.3389 / fnbeh.2014.00036
Recebido: 01 November 2013; Aceito: 23 janeiro 2014;
Publicado online: 11 February 2014.
Editado por:
Bryan F. SingerUniversidade do Michigan, EUA
Revisados pela:
Louk VanderschurenUniversidade de Utrecht, Holanda
Ruud Van Den Bos, Radboud University Nijmegen, Holanda
Patrick AnselmeUniversidade de Liège, Bélgica
Direitos autorais © 2014 Zack, Featherstone, Mathewson e Fletcher. Este é um artigo de acesso aberto distribuído sob os termos do Licença Creative Commons Attribution (CC BY). O uso, distribuição ou reprodução em outros fóruns é permitido, desde que o (s) autor (es) original (is) ou licenciador (s) sejam creditados e que a publicação original desta revista seja citada, de acordo com a prática acadêmica aceita. Não é permitida a utilização, distribuição ou reprodução que não esteja em conformidade com estes termos.
* Correspondência: Martin Zack, Laboratório de Psicofarmacologia Cognitiva, Departamento de Neurociências, Centro de Dependência e Saúde Mental, 33 Russell Street, Toronto, ON M5S 2S1, Canadá e-mail: [email protegido]
 Martin Zack
Martin Zack