Frente. Behav. Neurosci., 02 April 2014 |
Carla Kalkhoven1, Cor Sennef1Ard Peeters1 e Ruud van den Bos2*
- 1Chardon Pharma, Herpen, Holanda
- 2Departamento de Fisiologia Animal Organizadora, Faculdade de Ciências, Radboud University Nijmegen, Nijmegen, Holanda
A doença de Huntington (DH) é uma desordem genética, neurodegenerativa, que afeta especificamente os neurônios do estriado da via indireta, resultando em um declínio progressivo da coordenação muscular e perda do controle emocional e cognitivo. Curiosamente, a predisposição para o jogo patológico e outros vícios envolvem distúrbios nos mesmos circuitos corticoestriatais que são afetados na DH, e apresentam sintomas similares relacionados à desinibição, incluindo sensibilidade alterada a punições e recompensas, impulsividade e incapacidade de considerar as vantagens a longo prazo. sobre recompensas de curto prazo. Pacientes com HD e jogadores patológicos também apresentam déficits de desempenho similares em tarefas de tomada de decisão arriscadas, como a Iowa Gambling Task (IGT). Estas semelhanças sugerem que os pacientes em HD são um provável grupo de risco para problemas de jogo. No entanto, tais problemas foram apenas observados em pacientes em HD. Nesta revisão, pretendemos caracterizar o risco de jogo patológico em HD, bem como os mecanismos neurobiológicos subjacentes. Especialmente com o aumento atual das oportunidades de jogos de azar na Internet, é importante entender esses riscos e fornecer suporte adequado ao paciente. Com base nos achados neuropatológicos e comportamentais, propomos que os pacientes em HD não apresentem uma tendência aumentada de buscar riscos e começar a jogar, mas têm uma chance maior de desenvolver um vício quando se envolvem em atividades de jogos de azar. Portanto, os desenvolvimentos atuais e futuros das possibilidades de jogos de azar na Internet e vícios relacionados devem ser encarados com cuidado, especialmente para grupos vulneráveis como pacientes em HD.
Introdução
A doença de Huntington (DH) é um distúrbio genético neurodegenerativo herdado de forma autossômica dominante. A doença é caracterizada por sintomas motores, cognitivos e comportamentais progressivos, que geralmente se tornam aparentes entre 30 e 50 anos de idade, e levam à morte prematura em 10-20 anos após o início da doença. A HD é causada por uma mutação no gene Huntingtin (HTT), que leva à agregação de proteínas, desregulação de vários processos celulares e, eventualmente, morte celular. A degeneração neuronal ocorre inicialmente de forma seletiva no estriado (núcleo caudado e putâmen), onde afeta as vias córtico-estriatais que servem para controlar as funções motoras e cognitivas (Reiner et al., 2011; Vonsattel e outros, 2011). No nível motor, esse processo degenerativo é expresso como movimentos desorganizados (coreia), enquanto no nível cognitivo / comportamental os pacientes exibem uma “síndrome de disfunção executiva”, englobando, entre outros, impulsividade, avaliação de risco insatisfatória e incapacidade de interromper um curso deficiente. açao (Hamilton et al., 2003; Duff et al., 2010b). Sintomas comportamentais e cognitivos similares são observados no comportamento aditivo relacionado a substâncias ou atividades (Newman, 1987; Rosenblatt, 2007; Iacono e outros, 2008). Portanto, pode-se esperar que os pacientes em HD apresentem risco de desenvolver dependência. Os paradigmas de tomada de decisão em ambientes laboratoriais têm, de fato, sugerido déficits na tomada de decisões arriscadas em pacientes em HD avançado (por exemplo, Stout et al., 2001) e o jogo patológico foi observado incidentalmente neste grupo de pacientes (De Marchi e outros, 1998). No entanto, esses achados são raros e, surpreendentemente, poucos estudos examinaram diretamente os sintomas e consequências, por exemplo, da desinibição comportamental na HD.
Nesta revisão, argumentaremos que os pacientes em HD podem ser um grupo de risco para o desenvolvimento de jogos problemáticos. Em primeiro lugar, o jogo problemático é caracterizado pela incapacidade dos participantes em parar o jogo, apesar dos problemas financeiros, pessoais ou profissionais. Com base em distúrbios neurobiológicos e sintomas comportamentais, a capacidade de parar o comportamento do jogo parece diminuída ou ausente em pacientes em HD. Em segundo lugar, devido às atitudes mais liberais em relação ao jogo e às possibilidades crescentes de jogos de azar legais e ilegais na Internet (ver, por exemplo, Griffiths, 2003), podemos esperar que a ocorrência de problemas de jogo aumente nos próximos anos. O aumento da acessibilidade pode representar um risco específico para grupos vulneráveis, como pacientes em HD, que não tenham sido previamente expostos a esses riscos.
Em geral, mudanças nas condições externas e métodos de tratamento podem ter efeitos inesperados e indesejáveis no comportamento do paciente, especialmente em doenças neurológicas complexas. Tais efeitos são facilmente perdidos quando os sintomas comportamentais não são regularmente reavaliados. Isso pode ser melhor ilustrado pelo caso da doença de Parkinson, onde a introdução do tratamento medicamentoso com agonistas dopaminérgicos levou a transtornos do controle dos impulsos, como jogo compulsivo, compras, alimentação e hipersexualidade, causados pela superestimulação do sistema dopaminérgico mesolímbico (Dodd et al., 2005; Witjas et al., 2012; Weintraub et al., 2013). No entanto, esses efeitos colaterais não foram reconhecidos até anos após a introdução de terapias com agonistas dopaminérgicos em combinação com mudanças sociais relacionadas à (disponibilidade de) compras, consumo de alimentos, sexualidade, Internet e jogos de azar. Este exemplo ilustra que a reavaliação dos fatores de risco é importante para ser capaz de fornecer tratamento eficaz e orientação aos pacientes diante de um ambiente em mudança.
Aqui, vamos explorar o perfil da doença em HD em relação à dependência, problemas de jogo e déficits de decisão. Na seção HD: Neuropatologia, Sintomas e Progressão, a progressão dos sintomas da DH será discutida em relação aos distúrbios nos circuitos corticoestriatais envolvidos na aprendizagem de tarefas, sensibilidade à punição e controle cognitivo / impulsivo. Na seção Tomada de Risco e Comportamento Patológico do Jogo em HD, o perfil neurobiológico dos pacientes em HD será discutido no contexto do jogo e dos testes de tomada de decisão e risco bem estabelecidos, como o Iowa Gambling Task (IGT) e o Cambridge Gambling Task (CGT). Na seção Discussão, discutiremos como uma caracterização dos riscos do jogo pode levar a recomendações para pacientes em HD e seus cuidadores sobre como lidar com esse problema e quais situações devem ser evitadas. Também pretendemos identificar questões ainda não respondidas, que podem servir como ponto de partida para pesquisas futuras sobre a ocorrência e os riscos de problemas de jogo em pacientes em HD.
HD: Neuropatologia, Sintomas e Progressão
Mecanismos de Doenças Neurobiológicas
A HD é causada por uma repetição instável de CAG (trinucleotídeo; citosina-adenina-guanina) na região codificadora do gene HTT, que leva à produção de proteína huntingtina mutante (Htt) com um trecho de poliglutamina expandida (polyQ) (MacDonald e outros, 1993). O número de repetições trinucleotídicas é inversamente correlacionado com a idade de início da doença (Snell et al., 1993; Stine e outros, 1993). A maioria dos pacientes em HD apresenta repetições 40-55 que causam distúrbio típico de início na idade adulta, enquanto expansões de mais de 70 repetem levar a distúrbio de início juvenil. Indivíduos com menos de 35 CAG repetidas no gene HTT não desenvolverão HD. Embora os mecanismos exatos da patogênese da DH permaneçam desconhecidos e não possam ser discutidos aqui em detalhes, eles envolvem a formação de agregados proteicos por polyQ Htt expandido, bem como a interação de Htt mutante com numerosas proteínas que estão envolvidas no metabolismo energético, proteína e vesícula transporte e regulação da transcrição gênica (Li e Li, 2004; Jones e Hughes, 2011). A desregulação resultante desses processos celulares eventualmente leva à degeneração neuronal através de mecanismos envolvendo excitotoxicidade e apoptose.
A degeneração neuronal é inicialmente restrita aos gânglios da base, onde os neurônios espinhosos médios no estriado (núcleo caudado e putâmen) são especificamente afetados (Vonsattel e DiFiglia, 1998; Kassubek e outros, 2004). O corpo estriado recebe sua entrada principal excitatória (glutamatérgica) das áreas corticais, enquanto recebe sua entrada dopaminérgica da substância nigra. O corpo estriado possui dois principais outputs inibitórios (GABA-ergic): uma via direta e indireta (Figura 1A). Os neurônios do estriado do caminho direto se projetam para o globo pálido interno (GPi), que por sua vez tem projeções inibitórias no tálamo. O tálamo dá origem ao principal estímulo excitatório para o córtex. Assim, com efeito, a ativação da via direta do estriado inibe a atividade do GPi, o que, por sua vez, desinibe a atividade talamocortical, facilitando assim o movimento e as funções cognitivas. A via indireta do estriado, por outro lado, se projeta para o GP externo (GPe), que por sua vez envia projeções inibitórias para o núcleo subtalâmico (STN). A STN envia projeções excitatórias para o GPi. Consequentemente, a ativação da via indireta do estriado desinibe, dessa forma, o NST, permitindo que ele ative o GPi, que por sua vez inibe a atividade talamocortical, suprimindo o movimento e as funções cognitivas. O comportamento adaptativo resulta de um (delicado) equilíbrio de atividade na via direta e indireta. A patologia na via indireta é fundamental para a DH e perturba o equilíbrio no controle do estriado, resultando na perda do controle inibitório sobre o funcionamento e o comportamento motor (Figura 1). 1B; Albin et al., 1989; Alexander e Crutcher, 1990).
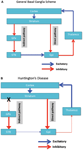
Figura 1. (UMA) Esquema simplificado da organização de redes de gânglios córtico-basais (áreas corticais, estriatais, pálidas e talâmicas) mostrando as vias diretas e indiretas em cérebros normais. (B) A degeneração específica da via indireta (X) na HD leva a uma diminuição no controle inibitório das funções corticais. GPe: globus pallidus externo; GPi: globus pallidus interno; STN: núcleo subtalâmico. Vermelho: vias inibitórias (GABA), Azul: vias excitatórias (glutamato).
Os circuitos dos gânglios córtico-basais, englobando conexões entre áreas corticais, áreas estriadas, áreas pálidas e áreas talâmicas, são organizados de forma paralela, servindo a diferentes funções na organização do comportamento. Existem muitas revisões excelentes sobre a anatomia e função desses circuitos (por exemplo, Alexander et al., 1986, 1990; Alexander e Crutcher, 1990; Yin e Knowlton, 2006; Verny e outros, 2007; Yin et al., 2008; Haber e Knutson, 2010; Sesack e Grace, 2010), destacamos apenas algumas questões aqui propícias à nossa análise. Em primeiro lugar, grosso modo, existe uma organização topográfica dorsal a ventral nas áreas corticais e estriatais. Assim, as áreas pré-frontais dorsais estão associadas a áreas estriatais dorsais, enquanto as áreas pré-frontais mais ventrais estão associadas a mais áreas estriatais ventrais (incluindo o nucleus accumbens). Em segundo lugar, em geral, três circuitos funcionalmente diferentes podem ser descritos. O circuito sensório-motor engloba o estriato sensório-motor (putâmen) e córtices sensório-motores associados à execução do comportamento motor. O circuito de controle associativo / cognitivo envolve o córtex pré-frontal dorsolateral, o córtex cingulado anterior e o estriado associativo (núcleo caudado). Este circuito é especialmente relevante para o funcionamento executivo, ou seja, está envolvido no controle cognitivo, planejamento e memória de trabalho. Além disso, está envolvido na promoção do comportamento adaptativo de longo prazo, reforçando ou interrompendo (punindo) o comportamento instrumental, ou seja, sequências de atos comportamentais aprendidos em interação com o ambiente (Kravitz et al., 2012; Paton e Louie, 2012). O circuito límbico inclui o córtex orbitofrontal, o córtex pré-frontal ventromedial, a amígdala e o corpo estriado límbico (nucleus accumbens). Este circuito é especialmente relevante para avaliar o valor afetivo dos estímulos, sinalizando a recompensa ou punição esperada de um próximo estímulo, escolha ou evento, controle emocional e aprendizagem adaptativa (emocional) (O'Doherty e outros, 2001; Rushworth et al., 2007; van den Bos e outros, 2013b, 2014).
A patologia na DH é observada tanto no putâmen como no núcleo caudado (Vonsattel e DiFiglia, 1998; Kassubek e outros, 2004; Vonsattel, 2008; Vonsattel e outros, 2011; Hadzi et al., 2012). Além disso, em ambas as estruturas a atrofia segue um padrão característico, iniciando nas regiões dorsal e caudal e se movendo em direção às regiões ventral e rostral à medida que a doença progride (Vonsattel e DiFiglia, 1998; Kassubek e outros, 2004; Vonsattel, 2008). No entanto, a atrofia precoce também foi observada no nucleus accumbens e no globus pallidus em alguns estudos (van den Bogaard e outros, 2011; Sánchez-Castañeda e outros, 2013). Embora os distúrbios no circuito sensório-motor (putâmen) possam estar relacionados aos sintomas motores, distúrbios no circuito de controle associativo / cognitivo (núcleo caudado) podem estar relacionados à disfunção executiva e causar déficits, por exemplo, na memória de trabalho em pacientes em HD precoce (Lawrence et al., 1996; Bonelli e Cummings, 2007; Wolf et al., 2007). Distúrbios no circuito límbico, como a atrofia precoce no núcleo accumbens, podem estar relacionados à apatia e depressão (Bonelli e Cummings, 2007; Unschuld et al., 2012). A atrofia progressiva no estriado pode levar a uma disfunção sucessiva dos circuitos corticoestriatais. Por exemplo, o núcleo caudado ventral também faz parte do circuito orbitofrontal, que é afetado à medida que a doença progride. A disfunção deste circuito está relacionada à desinibição comportamental (Bonelli e Cummings, 2007). Eventualmente, a degeneração pode se espalhar para outras áreas do cérebro, incluindo outras partes dos gânglios da base (áreas pálida e tálamo), hipocampo, amígdala e áreas corticais nos estágios finais da doença.
Em suma, a HD é caracterizada por uma degeneração específica dos neurônios estriados pertencentes à via indireta. À medida que a doença progride, a atrofia do estriado se espalha ao longo de um gradiente caudal-rostral e dorsal-ventral, causando uma perturbação seqüencial dos circuitos corticoestriatais. A perda resultante do controle inibitório nesses circuitos está diretamente relacionada à progressão dos sintomas motores, cognitivos e comportamentais em HD, como discutido abaixo.
Sintomas de HD
A DH é caracterizada por uma variedade de sintomas motores, cognitivos e comportamentais progressivos. Os primeiros sintomas geralmente surgem na meia-idade, com uma idade média de início de 40, embora uma pequena porcentagem de pacientes sofra de HD juvenil, que começa antes da idade de 20. Como os sintomas e a progressão da HD de início juvenil são um tanto distintos do distúrbio de início na vida adulta, enfocaremos o último grupo de pacientes nesta revisão. Um dos primeiros sintomas a se tornar aparente na DH é a coréia (distúrbio do movimento involuntário), e um diagnóstico clínico geralmente é feito após o início de anormalidades de movimento (Shannon, 2011). Alguns estudos, no entanto, relatam mudanças cognitivas e emocionais sutis antes do início dos sintomas motores, e a ordem exata de ocorrência e progressão dos sintomas da DH ainda é assunto de debate. No entanto, várias revisões abrangentes das manifestações clínicas da DH estão disponíveis (Roos, 2010; Anderson, 2011; Shannon, 2011).
Sintomas motores
Os sintomas motores começam a se tornar aparentes nos estágios iniciais da HD, e são geralmente os primeiros sintomas a serem notados em ambientes laboratoriais e por parentes de primeiro grau de pacientes em HD (de Boo et al., 1997; Kirkwood et al., 1999, 2001). Distúrbios motores parecem começar como uma disfunção no controle de feedback de erro (Smith et al., 2000), consistente com o papel do circuito motor córtico-estriado na aprendizagem e controle sensório-motor (Graybiel et al., 1994). Os primeiros sinais de anomalias motoras são frequentemente movimentos involuntários sutis (coreia) de, por exemplo, músculos faciais, dedos das mãos e dos pés ("contração"), hiperreflexia e movimentos voluntários exagerados (Young et al., 1986; Shannon, 2011), que levam a uma aparência geral de inquietação e desajeitamento nos pacientes em HD precoce. Estes movimentos anormais são sutis e muitas vezes passam despercebidos no início, mas gradualmente pioram e se espalham para todos os outros músculos ao longo do tempo. Outros sintomas motores precoces incluem movimentos oculares sacádicos lentos ou retardados (Peltsch et al., 2008) e disartria (Ramig, 1986; Young et al., 1986). A disartria, um distúrbio de fala motora, leva à dificuldade de articulação e ao ruído das palavras, o que torna a fala progressivamente mais difícil de entender. A disfagia (dificuldades de deglutição) é observada na maioria dos pacientes com início nos estágios intermediários da doença, e piora gradualmente até que os pacientes não consigam mais comer sem auxílio e geralmente precisam de um tubo de alimentação na fase tardia da HD (Heemskerk e Roos, 2011). Outros sintomas motores não coreicos que geralmente se tornam aparentes na doença em estágio intermediário incluem transtorno de marcha complexo, instabilidade postural e distonia (contrações musculares involuntárias que causam movimentos repetitivos lentos e posturas anormais), que é frequentemente acompanhada de quedas freqüentes (Koller e Trimble, 1985; Tian et al., 1992; Louis et al., 1999; Grimbergen et al., 2008). Rigidez e bradicinesia (lentidão de movimentos e reflexos) são às vezes observadas, mas são restritas principalmente a casos de HD juvenil (Bittenbender e Quadfasel, 1962; Hansotia et al., 1968). Esses sintomas motores são consistentes com a disfunção dos circuitos corticoestriatais sensoriomotores (e associativos / cognitivos) que são comumente afetados na HD.
Sintomas comportamentais e psiquiátricos
Os transtornos comportamentais na DH podem ser complexos e difíceis de classificar, e sua ocorrência e início são altamente variáveis entre os indivíduos. Além disso, às vezes pode ser difícil distinguir os transtornos comportamentais do enfrentamento normal com uma doença angustiante (Caine e Shoulson, 1983). O número de estudos que caracterizaram sintomas comportamentais na DH é limitado e, como resultado, há relativamente pouca percepção sobre sua prevalência na doença (van Duijn e outros, 2007). Os sintomas comportamentais e emocionais mais freqüentemente relatados na HD são irritabilidade, apatia e depressão, que ocorrem com uma prevalência de aproximadamente 50% (Caine e Shoulson, 1983; Folstein e Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van Duijn e outros, 2007, 2014; Tabrizi e outros, 2009). A irritabilidade e a apatia são às vezes observadas em pacientes em HD pré-manifestos (Tabrizi e outros, 2009; van Duijn e outros, 2014) e também foi relatada depressão nos estágios clínicos iniciais (Shiwach, 1994; Julien e outros, 2007; Epping et al., 2013). Esses sintomas afetivos estão entre os primeiros sintomas não motores a serem percebidos pelos parentes de primeiro grau (Kirkwood et al., 2001). Os sintomas típicos relacionados à apatia, que gradualmente pioram durante o curso da doença, incluem falta de energia, motivação e iniciativa, diminuição da perseverança e da qualidade do trabalho, julgamento prejudicado, autocuidado ruim e embotamento emocional (Craufurd et al., 2001; Kirkwood et al., 2001). Sintomas depressivos têm sido relacionados ao aumento da atividade no córtex pré-frontal ventromedial (Unschuld et al., 2012). A irritabilidade está associada à disfunção do circuito orbitofrontal, que leva à diminuição do controle sobre as respostas emocionais na amígdala (Klöppel et al., 2010).
Outros sintomas e transtornos psiquiátricos menos comumente observados na DH são ansiedade, transtorno obsessivo-compulsivo, mania, sintomas psicóticos esquizofrênicos, como paranóia, alucinações e delírios (Caine e Shoulson, 1983; Folstein e Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van Duijn e outros, 2007). Esses sintomas geralmente não ocorrem até os estágios intermediários ou tardios da doença, embora tenham sido relatados incidentemente em pacientes pré-clínicos em HD (Duff et al., 2007). O transtorno obsessivo-compulsivo tem sido associado a danos no córtex orbitofrontal e no córtex cingulado anterior, enquanto a esquizofrenia, um transtorno que envolve déficits na organização, planejamento e atenção, está relacionada à disfunção dorsolateral do córtex pré-frontal (Tekin e Cummings, 2002).
Sugere-se que a maioria dos sintomas psiquiátricos em HD são na verdade parte de uma “síndrome do lobo frontal” ou “síndrome de disfunção executiva” ampla e mal definida, que inclui sintomas como apatia, irritabilidade, desinibição, impulsividade, obsessividade e perseveração (Lyketsos e outros, 2004; Rosenblatt, 2007), todos comumente observados em pacientes em HD (Hamilton et al., 2003; Duff et al., 2010b). Em conjunto, a literatura indica que o início e a progressão dos sintomas comportamentais na HD são heterogêneos, com transtornos afetivos ocorrendo com mais frequência e com início precoce, enquanto ansiedade, transtorno obsessivo-compulsivo e sintomas psicóticos são menos comuns e geralmente ocorrem mais tarde na doença. . Esses sintomas psiquiátricos estão associados à disfunção dos circuitos corticoestriatais de controle límbico e associativo / cognitivo que são comumente afetados na HD.
Sintomas cognitivos
O declínio cognitivo é outro aspecto importante da patologia da DH. Muitos estudos têm focado especificamente na ocorrência de sintomas cognitivos nos estágios pré-clínicos e iniciais da HD, na esperança de descobrir os biomarcadores clínicos precoces da doença (revisados em Papp e outros, 2011; Dumas et al., 2013). De modo geral, os resultados sugerem que mudanças cognitivas sutis podem ser observadas até 5-10 anos antes do início dos sintomas motores com métodos suficientemente sensíveis. Um estudo descobriu ainda que, nos estágios clínicos pré-clínicos e iniciais da DH, cerca de 40% dos pacientes já atendem aos critérios de comprometimento cognitivo leve (um distúrbio associado à perda limitada de memória, que não atende aos critérios para o diagnóstico de demência; Duff et al., 2010a). No entanto, nem todos os estudos apóiam esses achados (Blackmore e outros, 1995; Giordani et al., 1995; de Boo et al., 1997; Kirkwood et al., 2001). Em geral, a literatura concorda que o processamento de informações e a velocidade psicomotora são especialmente afetados nesta fase inicial (Rothlind et al., 1993; Kirkwood et al., 1999; Verny e outros, 2007; Paulsen et al., 2008). Outros comprometimentos cognitivos precoces comumente observados incluem problemas com atenção, memória (de trabalho) e desempenho visuoespacial (Jason et al., 1988; Rothlind et al., 1993; Foroud et al., 1995; Lawrence et al., 1996; Hahn-Barma e outros, 1998; Verny e outros, 2007; Paulsen et al., 2008; Tabrizi e outros, 2009; Papp e outros, 2011; Stout et al., 2011). A inflexibilidade cognitiva foi observada em pacientes com doença precoce (Jason et al., 1988), em que estágio as mudanças extradimensionais são especificamente prejudicadas, enquanto a aprendizagem reversa ainda está intacta (Lawrence et al., 1996). Assim, os pacientes ainda são capazes de reavaliar o valor do estímulo e aprender novas contingências de estímulo-recompensa dentro da mesma dimensão (por exemplo, forma ou cor), mas têm problemas para desviar sua atenção para uma dimensão diferente (por exemplo, da cor para a forma) a nova regra de tarefa para obter recompensa. Nos estágios posteriores da doença, a inflexibilidade cognitiva e a perseveração também causam prejuízo na aprendizagem reversa em pacientes em HD (Josiassen et al., 1983; Lange et al., 1995). Esta progressão dos sintomas é consistente com a disfunção específica do circuito pré-frontal dorsolateral no início da doença, uma vez que a mudança de conjunto extradimensional é mediada pelo córtex pré-frontal dorsolateral, enquanto a aprendizagem reversa é mediada pelo córtex orbitofrontal (Dias et al., 1996; McAlonan e Brown, 2003). Outras deficiências precoces incluem comportamento desorganizado, planejamento prejudicado, julgamento pobre e controle comportamental e emocional reduzido (Watkins et al., 2000; Paradiso et al., 2008; Duff et al., 2010b). A desinibição foi observada em pacientes precoces em HD, cujo desempenho é prejudicado em tarefas que exigem a inibição de respostas pré-potentes, mas inadequadas (Holl et al., 2013). Finalmente, vários estudos descobriram que pacientes pré-clínicos em HD estão prejudicados no reconhecimento de emoções negativas como raiva, repulsa, medo e tristeza. O reconhecimento emocional diminui progressivamente e pode propagar-se a problemas com emoções neutras nos estágios clínicos iniciais da doença (Johnson et al., 2007; Tabrizi e outros, 2009; Labuschagne et al., 2013). Esse fenótipo está relacionado à disfunção do córtex orbitofrontal, que está envolvido no processamento de informações emocionais e de recompensa (Henley et al., 2008; Ille et al., 2011).
Estudos com modelos animais de DH mostram deficiências cognitivas similares àquelas observadas em pacientes humanos. Embora nem todos os estudos encontrem défices cognitivos robustos (Fielding et al., 2012), os achados nos modelos de HD de ratos e camundongos incluem ansiedade, aumento da responsividade a estímulos emocionais negativos e prejuízos na aprendizagem reversa e mudança de estratégia (Faure et al., 2011; Abada et al., 2013). Um estudo encontrou déficits precoces específicos na aprendizagem reversa antes do início dos sintomas motores em um modelo de HD em ratos (Fink e outros, 2012). Curiosamente, os animais em HD parecem ter uma resposta aumentada aos estímulos emocionais negativos, enquanto os pacientes humanos mostram um reconhecimento diminuído das emoções negativas. No momento, não está claro se isso reflete diferenças na tarefa administrada (reconhecendo as emoções contra respostas comportamentais a estímulos ameaçadores), diferenças relacionadas com as espécies no resultado da patologia ou uma diferença fundamental entre o modelo do rato e a condição humana. Em geral, estudos em pacientes humanos e modelos animais de DH demonstram que uma ampla gama de funções cognitivas já pode ser prejudicada no início da DH. Anormalidades precoces incluem principalmente déficits de atenção, memória, flexibilidade cognitiva e reconhecimento emocional. Nessa fase inicial, os pacientes frequentemente têm consciência prejudicada de suas próprias habilidades cognitivas (declínio).Hoth et al., 2007). Com o tempo, os sintomas cognitivos pioram progressivamente, levando a uma demência subcortical grave nos estágios avançados da doença. Embora a ocorrência de sintomas seja geralmente consistente com o comprometimento sucessivo do controle associativo / cognitivo e dos circuitos corticoestriatais límbicos, respectivamente, funções específicas relacionadas ao circuito límbico também podem já ser afetadas na fase inicial da HD.
Conclusão
Os sintomas motores, comportamentais e cognitivos na DH foram estudados extensivamente no passado e continuam a ser um tópico de interesse devido à grande variedade e variabilidade na ocorrência e no início destes sintomas entre os pacientes. Em geral, os sintomas comportamentais e cognitivos estão relacionados a três categorias comportamentais frontais: apatia, disfunção executiva e desinibição. A combinação destes sintomas é por vezes referida como “síndrome de disfunção executiva”. Todos esses sintomas estão relacionados a déficits nos circuitos corticoestriatais envolvendo o córtex orbitofrontal, o córtex pré-frontal dorsolateral e o córtex cingulado anterior. Como discutido acima, estudos neuropatológicos observaram uma degeneração gradual do estriado na direção dorsal a ventral em pacientes em HD. Embora as observações comportamentais e cognitivas concordem em parte com um comprometimento progressivo dos circuitos corticoestriatais, os achados sintomáticos parecem ser mais difusos do que o esperado com base em observações patológicas. O início e a progressão dos sintomas comportamentais e cognitivos na HD são altamente heterogêneos, indicando que os danos às regiões do estriado podem ser mais variáveis e disseminados nos estágios iniciais da HD do que se pensava anteriormente. Esta visão é apoiada por evidências de vários estudos estruturais de imagem (Thieben et al., 2002; Rosas et al., 2005; van den Bogaard e outros, 2011).
Tomada de Risco e Comportamento Patológico do Jogo em HD
Jogo Patológico
Embora muitas pessoas consigam jogar de forma recreativa, isso pode se tornar um problema evidente para alguns, pois desenvolvem formas patológicas desse comportamento. O jogo patológico é caracterizado por um desejo excessivo de jogar, apesar de consequências financeiras, pessoais e profissionais negativas. Recentemente, ele foi classificado como um vício no DSM-V, uma vez que se assemelha aos distúrbios do abuso de substâncias em ambos os critérios diagnósticos e neuropatológicos (van Holst e outros, 2010; Clark e Goudriaan, 2012). O jogo patológico será o primeiro e único “vício comportamental” reconhecido dentro da categoria “Dependência e Distúrbios Relacionados ”. No entanto, deve-se notar que existem diferenças entre o vício em substâncias psicoativas e o vício em jogos de azar. Em primeiro lugar, satisfazer o desejo por substâncias psicoativas consiste em consumir a substância de que o efeito é conhecido, enquanto satisfazer o desejo de jogar pode ter um resultado incerto, pois o dinheiro pode ser ganho ou não, a menos que seja o ato de apostar em si mesmo, por exemplo. como uma atividade emocionante. Assim, o jogo patológico pode ser mais heterogêneo a esse respeito, com um resultado ainda mais incerto do que o abuso de substâncias. Deve-se notar que a variabilidade de resultados, incluindo vitórias e derrotas, pode ser crucial para o desenvolvimento do vício do jogo, pois apresenta um padrão intermitente variável de reforço, que é a forma mais poderosa de condicionamento instrumental / clássico (Sharpe, 2002; Fiorillo et al., 2003). Em segundo lugar, as substâncias psicoativas podem alterar mais fortemente a atividade cerebral e o sistema nervoso periférico do que o jogo, devido à sua atividade farmacológica direta em vários sistemas neurotransmissores, acelerando os processos aditivos, tornando o abuso de substâncias uma forma mais poderosa de dependência.
Os mecanismos neurobiológicos subjacentes do jogo são complexos e envolvem muitas regiões cerebrais e sistemas neurotransmissores diferentes Raylu e Oei, 2002; Goudriaan et al., 2004; Potenza, 2013). A predisposição à dependência tem sido relacionada a um nível reduzido de receptores D2 de dopamina no estriado, que funcionam em um ciclo de realimentação para inibir a liberação adicional de dopamina. A hiperatividade resultante das vias dopaminérgicas aumenta a sensibilidade à recompensa, motivação e reforço positivo do comportamento aditivo (Volkow et al., 2002; Di Chiara e Bassareo, 2007). Mudanças motivacionais específicas que ocorrem quando o jogo patológico se desenvolve incluem maior motivação para jogar (van Holst e outros, 2012) e maior atenção aos estímulos relacionados com o jogo (Brevers e outros, 2011a,b). Além disso, os jogadores patológicos reduziram o controle cognitivo sobre o comportamento em geral, como exemplificado pelo desempenho reduzido em tarefas de inibição de resposta, impulsividade aumentada e uma preferência por recompensas imediatas em atraso em tarefas neurocognitivas (Goudriaan et al., 2004; Brevers e outros, 2012a; van den Bos e outros, 2013a).
Os jogadores patológicos têm um desempenho fraco em comparação com os controles em tarefas de tomada de decisões arriscadas relacionadas à recompensa formal (por exemplo, Cavedini e outros, 2002; Brand et al., 2005; Brevers e outros, 2012b; Reveja: Brevers e outros, 2013). Este fraco desempenho é independente de se as tarefas contêm regras explícitas e estáveis para ganhos e perdas, como a Tarefa Jogo de Dados (Brand et al., 2005) ou se os sujeitos têm que aprender por tentativa e erro quais escolhas são vantajosas a longo prazo, como a IGT (Cavedini e outros, 2002; Brevers e outros, 2012b; veja a seção Tomada de Decisão Arriscada por Pacientes em HD em Tarefas de Laboratório para detalhes desta tarefa). No entanto, a gravidade do jogo foi bastante correlacionada com o desempenho em tarefas de tomada de decisão em que a probabilidade de resultado é desconhecida (IGT) do que com tarefas com regras explícitas (Brevers e outros, 2012b). Essa observação é interessante, tendo em vista o fato de que, em indivíduos normais, a segunda metade do IGT, quando os sujeitos aprenderam contingências de tarefas, é semelhante a tarefas com regras explícitas. Coletivamente, esses dados sugerem que, no jogo patológico, os prejuízos na tomada de decisões podem resultar tanto do controle executivo diminuído, que está relacionado a regras mais explícitas, quanto do processamento de punição-recompensa (emocional) perturbado, que está mais relacionado ao julgamento-e- erro de aprendizagem para avaliar o valor a longo prazo das opções (van den Bos e outros, 2013a, 2014). Além disso, sugere que distúrbios no último podem ser um fator predisponente para a escalada do comportamento de jogo.
A partir desses estudos, fica claro que a predisposição neurobiológica para o desenvolvimento do comportamento patológico do jogo envolve distúrbios tanto no circuito de controle associativo / cognitivo quanto no circuito límbico (van den Bos e outros, 2013a). Como resultado, os jogadores patológicos exibem controle cognitivo reduzido, impulsividade aumentada e maior sensibilidade à recompensa, todos aspectos da desinibição comportamental (Iacono e outros, 2008). A chance de que um indivíduo desenvolva um vício em sua vida, no entanto, também depende de muitos outros aspectos, como experiências da primeira infância e riscos ambientais.
Jogo Patológico na DH: Evidências Epidemiológicas
Com o crescente número de possibilidades oferecidas pela Internet, houve também um aumento nas oportunidades legais e ilegais de jogos de azar on-line nos últimos anos. Estas actividades de jogo facilmente acessíveis e muitas vezes descontroladas podem representar um risco para qualquer pessoa que tenha uma maior susceptibilidade ao vício do jogo, mas que, de outra forma, não se envolveria nessas actividades (Griffiths, 2003). Os pacientes em HD são um dos grupos para os quais o jogo na Internet pode representar tal risco, porque a desinibição comportamental - uma característica comum da doença - é um fator importante no desenvolvimento de dependências (Iacono e outros, 2008). De fato, como mencionado acima, os pacientes em HD apresentam vários sinais de desinibição, como irritabilidade, inibição da resposta prejudicada e reconhecimento emocional reduzido, em um estágio inicial da doença. Outros sintomas que foram observados na DH e podem influenciar a capacidade dos pacientes de tomar decisões racionais são a inflexibilidade cognitiva, perseveração, falta de discernimento e autoconsciência reduzida. Além dessas semelhanças sintomáticas entre pacientes em HD e jogadores patológicos, ambos os grupos apresentam anormalidades estruturais e funcionais em circuitos corticoestriatais similares.
Em vista dessas semelhanças entre os jogadores patológicos e os pacientes em HD, podemos esperar que a incidência de problemas de jogo aumente entre os pacientes em HD em comparação com a população normal. No entanto, apenas um estudo até o momento relatou casos de jogo patológico em uma família italiana com HD (De Marchi e outros, 1998). Nessa família, dois indivíduos foram diagnosticados com jogo patológico por volta da idade de 18, bem antes do início dos sinais clínicos de HD. Outros estudos epidemiológicos não relataram esta questão, embora tenha sido demonstrado que o comprometimento da tomada de decisões, a tomada de risco e a falta de julgamento representam um risco para os pacientes em HD lidarem com importantes decisões sobre a vida e questões financeiras (Klitzman et al., 2007; Shannon, 2011). Da mesma forma, relatos sobre questões relacionadas, como abuso de substâncias e dependência ao uso da Internet estão faltando na literatura atual sobre patologia HD. Neste momento, não está claro se a ausência de relatos de problemas de jogo na literatura de HD é causada pela falta de atenção para este fenômeno, ou se realmente não há aumento da prevalência de jogo patológico entre pacientes em HD. Vários motivos podem explicar por que tais problemas não foram relatados com mais frequência. Em primeiro lugar, mesmo que a incidência de jogo patológico aumente na DH, isso provavelmente afetará apenas uma pequena porcentagem dos pacientes. Em combinação com o fato de que a população afetada pela DH em si é limitada em número, isso pode fazer com que problemas de jogo passem despercebidos como uma questão específica nesse grupo de pacientes. Em segundo lugar, a falta de problemas de jogo na DH pode estar relacionada à incapacidade ou falta de vontade dos pacientes de sair de casa devido a distúrbios motores e sinais freqüentemente observados de apatia e depressão. Antes do advento do jogo na Internet, isso pode ter impedido os pacientes de HD de visitar locais públicos de jogo como o cassino. Finalmente, a adolescência parece ser um período sensível para o desenvolvimento de problemas de jogo (van den Bos e outros, 2013a), enquanto a maioria dos pacientes em HD não começa a apresentar sintomas relacionados à desinibição até mais tarde na vida. No entanto, com o aumento das atividades relacionadas à Internet dos adolescentes, elas podem adquirir formas de comportamento lúdico, como o jogo online, que se transformam em um problema quando os sintomas da DH se manifestam mais tarde na vida. Assim, embora o ambiente no qual os pacientes com HD suscetíveis ao jogo possam se encontrar não tenha promovido tal comportamento no passado, fica claro que uma maior acessibilidade e disponibilidade de oportunidades de jogo em casa podem alterar a prevalência de problemas relacionados na população em HD. .
Tomada de Decisão Arriscada por Pacientes em HD em Tarefas de Laboratório
Tarefas de laboratório são comumente usadas para avaliar anormalidades cognitivas e comportamentais em distúrbios neurológicos. Para obter informações sobre os processos e deficiências envolvidos na tomada de decisões e comportamento de risco, várias tarefas foram desenvolvidas, incluindo a IGT (Bechara et al., 1994) e da CGT (Rogers et al., 1999). No IGT, os participantes são apresentados com quatro baralhos de cartas. Eles são instruídos a escolher cartas desses baralhos, com os quais podem ganhar ou perder dinheiro; O objetivo da tarefa é ganhar o máximo de dinheiro possível. Os decks diferem uns dos outros na frequência e quantidade de ganhos e perdas. Dois destes são decks "ruins", levando a uma perda geral a longo prazo, e dois são decks "bons", levando a um ganho geral. Os participantes não recebem essa informação, no entanto, e precisam descobrir quais baralhos são mais vantajosos durante os experimentos. Os participantes normais, saudáveis, aprendem com sucesso as regras da tarefa depois de uma certa quantidade de amostragem e, eventualmente, começam a preferir os dois “bons” decks. No entanto, existem diferenças individuais significativas no desempenho mesmo entre participantes saudáveis, incluindo, por exemplo, diferenças de sexo claro (van den Bos e outros, 2013b). Na CGT, os participantes são apresentados com uma linha de caixas 10 de duas cores diferentes e precisam tomar uma decisão probabilística em qual caixa de cores um token está oculto. Eles devem então apostar pontos de crédito em sua confiança nesta decisão. Nesta tarefa, todas as informações relevantes são apresentadas ao participante durante o experimento, e as tentativas são independentes, minimizando assim a memória de trabalho e as demandas de aprendizagem. Ambas as tarefas de jogo estão bem estabelecidas, e o IGT é aceito como uma simulação válida de tomada de decisão na vida real (Buelow e Suhr, 2009), enquanto a CGT é especialmente útil para estudar a tomada de decisão fora de um contexto de aprendizagem.
Pacientes em HD foram testados tanto na Iowa quanto na Cambridge Gambling Task. Em um estudo com pacientes em estágio intermediário, Stout et al. (2001) descobriram que o desempenho no IGT foi reduzido em comparação com indivíduos normais. A diferença no desempenho tornou-se aparente na segunda parte da tarefa; onde os indivíduos normalmente começam a mostrar uma preferência pelos bons decks, os pacientes em HD continuaram a fazer seleções freqüentes nos decks ruins. Isso sugere que os pacientes em HD não aprenderam quais baralhos eram vantajosos, ou continuaram a escolher cartas dos baralhos ruins apesar desse conhecimento. Os autores observaram que vários participantes em HD indicaram saber que alguns baralhos eram desvantajosos, mas ainda continuavam a selecionar cartões daqueles baralhos, sugerindo que os pacientes em HD podem aprender as regras da tarefa, mas não são capazes de impor um padrão de seleção vantajoso e resistir. respondendo a punições individuais e recompensas. No entanto, o desempenho reduzido foi associado ao comprometimento da memória e da conceituação, levando os autores a especularem que os pacientes em HD podem ter dificuldade para aprender ou lembrar as consequências a longo prazo da escolha de cartões de um baralho específico. Pacientes em HD também tiveram maior pontuação na desinibição do que controles saudáveis, mas essa medida não se correlacionou com o desempenho da tarefa. Em um acompanhamento dos mesmos dados, Stout e colegas compararam três modelos de decisão cognitiva para explicar o déficit de desempenho de pacientes em HD, e descobriram que isso era melhor explicado por déficits na memória de trabalho e por aumento de imprudência e impulsividade (Busemeyer e Stout, 2002). Desempenho prejudicado de pacientes em HD no IGT também pode estar relacionado a um impacto reduzido de perdas nesses pacientes, o que foi encontrado medindo as respostas de condutância da pele durante o IGT (Campbell et al., 2004). Esse achado é consistente com o prejuízo no reconhecimento de emoções negativas em pacientes em HD (Johnson et al., 2007; Ille et al., 2011), e sugere que eles podem ser menos sensíveis a grandes punições e, portanto, menos propensos a se afastar dos baralhos de cartas ruins. Especialmente a segunda parte da IGT requer a habilidade de suprimir cursos de ação desvantajosos em resposta a punições, enquanto reforça ações lucrativas (de Visser et al., 2011; van den Bos e outros, 2013b, 2014).
Um número limitado de outros estudos testou a tomada de decisão arriscada nos estágios iniciais da HD, mas não encontrou dificuldades de desempenho nesses pacientes tanto no IGT quanto no CGT (Watkins et al., 2000; Holl et al., 2013). Assim, parece que deficiências na tomada de decisão e risco de problemas de jogo não se desenvolvem até os estágios intermediários da doença. No entanto, esses estudos encontraram deficiências em tarefas que exigiam planejamento e inibição de respostas pré-potentes em pacientes precoces em HD. Assim, parece que os pacientes em HD primeiro desenvolvem problemas sutis com inibição, planejamento, reconhecimento emocional e memória de trabalho. Em alguns pacientes isso já pode levar a problemas de julgamento e tomada de decisão nos estágios iniciais da doença, mas a maioria dos pacientes em HD não tem problemas com tarefas de tomada de decisão arriscadas até atingir um estágio intermediário da doença.
Mecanismos Neurobiológicos de Tomada de Decisão em HD
Caminhos neurobiológicos subjacentes aos processos de tomada de decisão normais na IGT
Os mecanismos neurobiológicos subjacentes aos processos de decisão na IGT foram bem estudados e descritos (ver, por exemplo, Bechara et al., 2000; Doya, 2008; de Visser et al., 2011; van den Bos e outros, 2013b, 2014). A execução normal dessa tarefa requer uma interação entre os circuitos corticoestriatais de controle límbico e associativo / cognitivo. Acredita-se que a atividade no circuito límbico seja dominante durante a primeira fase da IGT, durante a qual está envolvida no comportamento exploratório, respondendo a recompensas e punições, e aprendendo os valores afetivos dos resultados de curto e longo prazo das decisões no tarefa (Manes et al., 2002; Clark e Manes, 2004; Companheiros e Farah, 2005; Gleichgerrcht et al., 2010; de Visser et al., 2011; van den Bos e outros, 2014). O circuito de controle associativo / cognitivo, por outro lado, é mais importante durante a segunda parte do IGT, quando é necessário suprimir respostas impulsivas a recompensas e punições para benefício a longo prazo, reforçar padrões comportamentais vantajosos e suprimir padrões desvantajosos (Manes et al., 2002; Clark e Manes, 2004; Companheiros e Farah, 2005; Gleichgerrcht et al., 2010; de Visser et al., 2011; van den Bos e outros, 2014).
Anormalidades neurobiológicas nos processos de decisão da IGT em HD
Como os processos de tomada de decisão no IGT envolvem uma interação de circuitos corticoestriatais de controle límbico e associativo / cognitivo, não é surpreendente que os pacientes em HD estejam comprometidos no desempenho dessa tarefa. Uma das observações de Stout e colegas é que o impacto da perda na tomada de decisão é reduzido em pacientes em HD (Campbell et al., 2004). Isso é consistente com os achados de que esses pacientes são prejudicados no reconhecimento de emoções negativas e podem ser explicados por distúrbios no córtex orbitofrontal (Ille et al., 2011). O córtex orbitofrontal é importante para o processamento emocional e é ativado em indivíduos normais em resposta a punições e recompensas em uma tarefa de tomada de decisão (O'Doherty e outros, 2001). Outra descoberta por Stout et al. (2001) é que o desempenho de pacientes em HD no IGT está correlacionado com a diminuição da conceituação e medidas de memória de longo prazo na Mattis Dementia Rating Scale. Uma falha em aprender ou lembrar quais decks são vantajosos a longo prazo pode estar associada à diminuição da atividade do circuito de controle associativo / cognitivo, que é necessário para o planejamento a longo prazo e controle de impulsos (Manes et al., 2002; Clark e Manes, 2004; Companheiros e Farah, 2005; Gleichgerrcht et al., 2010). Isso também é consistente com déficits específicos da via indireta na HD, uma vez que um estudo recente mostra que a via indireta é importante para a sensibilidade à punição em uma tarefa de aprendizagem por reforço (Kravitz et al., 2012; Paton e Louie, 2012). A insensibilidade às conseqüências futuras de uma decisão também pode ser causada pela disfunção do córtex pré-frontal ventromedial, uma vez que uma insensibilidade similar é observada em pacientes com dano a essa área pré-frontal (Bechara et al., 1994). Assim, o desempenho diminuído de pacientes em HD no IGT pode ser causado por uma combinação de disfunções em circuitos corticoestriatais envolvendo o córtex orbitofrontal, o córtex pré-frontal ventromedial e o córtex pré-frontal dorsolateral. Isso leva a uma redução da responsividade à punição na primeira fase da tarefa, e a incapacidade de aprender quais plataformas são vantajosas a longo prazo, planeja de acordo e suprime respostas impulsivas na segunda fase da IGT.
Discussão
HD e Jogo Patológico: Quais são os riscos?
A matriz típica de sintomas motores, emocionais e cognitivos da DH é causada por atrofia progressiva do estriado que afeta os diferentes circuitos corticoestriatais. Embora o início e a progressão dos sintomas comportamentais e cognitivos pareçam ser altamente heterogêneos, os circuitos motores e cognitivos são tipicamente afetados precocemente na doença, enquanto o circuito límbico é afetado em um estágio posterior. Curiosamente, a predisposição neurobiológica ao jogo patológico e outras dependências envolve distúrbios nos mesmos circuitos corticoestriatais que são afetados na HD. Apesar dessas semelhanças notáveis, no entanto, na literatura médica, a DH não tem sido associada ao jogo patológico ou a outros comportamentos aditivos. Apenas um estudo até agora descreveu uma família em que problemas de jogo ocorreram em vários membros da família afetados pela DH (De Marchi e outros, 1998). Nós especulamos que os sintomas motores dos pacientes, bem como sua idade e ambiente social, podem até agora ter impedido o desenvolvimento do jogo patológico, apesar de sua maior suscetibilidade a tais problemas. Por outro lado, pode-se esperar que a depressão frequentemente diagnosticada aumente a impulsividade e o risco de problemas de jogo, com base em estudos de correlação (Clarke, 2006). Outra explicação para a falta de observações de problemas de jogo na DH pode estar relacionada a diferenças na neuropatologia subjacente. Embora os distúrbios cognitivos pareçam ser muito semelhantes entre jogadores patológicos e pacientes em HD, as mudanças emocionais são de natureza diferente. Os jogadores patológicos mostram principalmente uma maior sensibilidade às recompensas, incentivando-os a começar e continuar jogando. A HD, por outro lado, tem sido associada a uma diminuição da sensibilidade a punições e emoções negativas. Essa diferença pode ser uma razão importante para que os pacientes em HD não pareçam ter uma tendência crescente de começar a jogar ou de se engajar em outros comportamentos viciantes e recompensadores.
No entanto, distúrbios no circuito cortico-estriado límbico de pacientes em HD ainda podem promover tomadas de decisão de risco em situações com resultados incertos, como demonstrado no IGT (Doya, 2008). Além disso, a combinação de diminuição da sensibilidade à punição, incapacidade de inibir respostas impulsivas a recompensas imediatas e incapacidade de considerar recompensas tardias a longo prazo e impor padrões comportamentais vantajosos, torna provável que os pacientes em HD desenvolvam problemas de jogo, quando encontram situação que promove tal comportamento. Problemas característicos de pacientes em HD com mudança de estratégia e sintomas de inflexibilidade cognitiva e perseverança podem contribuir para a progressão do comportamento patológico nessas situações. Assim, propomos que os pacientes em HD não tenham uma tendência aumentada para começar o jogo ou outros comportamentos aditivos inerentes à sua neuropatologia, mas que eles têm um risco aumentado de desenvolver um vício uma vez que se envolvam em jogos de azar. De acordo com essa ideia, observou-se que os pacientes com lesão frontal tornam-se impulsivos e freqüentemente tomam decisões ruins, mas não exibem um comportamento de risco aumentado (Miller, 1992; Bechara et al., 2000). Isso sugere que o comprometimento do processo de tomada de decisão e de tomada de risco ou de acompanhamento não necessariamente ocorre em conjunto e que combinações diferentes de perturbações do circuito de controle límbico e associativo / cognitivo podem ter efeitos diferentes na tomada de decisões arriscadas e no comportamento do jogo. Nossa hipótese também explicaria por que os pacientes em HD não apresentaram pior desempenho na CGT. Como todas as informações sobre chances e valores de ganhos e perdas são disponibilizadas antecipadamente nessa tarefa, os pacientes em HD podem não desenvolver estratégias desvantajosas, porque não estão buscando ativamente riscos. No entanto, isso precisaria ser testado em pacientes com doença mais avançada.
Se os pacientes com DH realmente têm um risco aumentado de desenvolver um comportamento patológico do jogo quando apresentam a situação apropriada, o aumento de oportunidades de jogo na Internet de fácil acesso pode representar um risco específico para este grupo de pacientes. Mesmo que não busquem ativamente essas situações, é muito mais provável que os pacientes em HD se deparem com oportunidades de jogo do que no passado. Isto é especialmente verdadeiro para pacientes que passam a maior parte do tempo em casa devido aos seus sintomas, onde a Internet pode ser um meio importante para ocupá-los. Uma maior probabilidade de se engajar no comportamento do jogo pode, portanto, causar um aumento desproporcional de problemas relacionados na população em HD. Sugerimos que os cuidadores estejam cientes desses possíveis riscos e, de preferência, tentem evitar que os pacientes em HD participem de atividades de jogos de azar on-line. Além disso, argumentamos que os médicos devem avaliar regularmente o risco e a prevalência de problemas relacionados ao jogo na população em HD, para poder oferecer tratamento e orientação apropriados aos pacientes e cuidadores.
Direções Futuras
Além de estudos epidemiológicos para avaliar a prevalência de jogo patológico e outras dependências em HD, várias linhas de pesquisa podem ser sugeridas para aumentar nossa compreensão das questões discutidas neste artigo. Em primeiro lugar, seria interessante vincular os déficits de desempenho no IGT diretamente a distúrbios na atividade corticoestriada em pacientes em HD. Para este fim, os padrões de ativação cerebral dos pacientes em HD podem ser estudados com ressonância magnética funcional durante a realização do IGT, e comparados à atividade em indivíduos normais. Espera-se que a atividade no estriado, no córtex pré-frontal dorsolateral e no córtex orbitofrontal esteja diminuída em pacientes em HD durante a tomada de decisão no IGT.
Para estudar mais detalhadamente os aspectos comportamentais e neurobiológicos do comportamento de jogo em HD, podem ser utilizados modelos de doenças de roedores atualmente disponíveis. Em um nível comportamental, pode-se esperar que esses animais apresentem desempenho reduzido no IGT, semelhante a pacientes humanos. Versões de roedores da IGT estão disponíveis (revisão: de Visser et al., 2011) e o envolvimento de diferentes estruturas neuronais nesses modelos é bem caracterizado (de Visser et al., 2011; van den Bos e outros, 2013a, 2014). Portanto, tais experimentos são viáveis e podem ser combinados com uma análise profunda das alterações neuronais subjacentes em modelos de HD de roedores usando uma variedade de técnicas. Além disso, com o advento de métodos e ferramentas de pesquisa mais ecologicamente válidos para avaliar o desenvolvimento de comportamentos patológicos, o risco de desenvolvimento do jogo patológico pode ser estudado sob condições (semi) naturais em humanos e animais (van den Bos e outros, 2013a). Juntos, esses estudos sobre os sintomas relacionados ao jogo e sobre a neuropatologia subjacente em pacientes humanos e modelos animais de DH nos fornecerão uma melhor compreensão dos riscos relacionados ao jogo - e possivelmente outros comportamentos de dependência - na DH e melhorar nossa capacidade de fornecer tratamento e orientação apropriados.
Declaração de conflito de interesse
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Referências
Abada, YK, Schreiber, R. e Ellenbroek, B. (2013). Déficits motor, emocional e cognitivo em camundongos adultos BACHD: um modelo para a doença de Huntington. Behav. Cérebro Res. 238, 243 – 251. doi: 10.1016 / j.bbr.2012.10.039
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Albin, RL, Young, AB e Penney, JB (1989). A anatomia funcional dos distúrbios dos gânglios da base. Tendências Neurosci. 12, 366–375. doi: 10.1016/0166-2236(89)90074-x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Alexander, GE e Crutcher, MD (1990). Arquitetura funcional de circuitos de gânglios da base: substratos neurais de processamento paralelo. Tendências Neurosci. 13, 266–271. doi: 10.1016/0166-2236(90)90107-l
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Alexander, GE, Crutcher, MD e DeLong, MR (1990). Circuitos gânglios da base-talamocorticais: substratos paralelos para funções motoras, oculomotoras, “pré-frontais” e “límbicas”. Prog. Cérebro Res. 85, 119–146. doi: 10.1016/s0079-6123(08)62678-3
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Alexander, GE, DeLong, MR e Strick, PL (1986). Organização paralela de circuitos funcionalmente segregados ligando gânglios da base e córtex. Annu Rev. Neurosci. 9, 357 – 381. doi: 10.1146 / annurev.neuro.9.1.357
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Anderson, KE (2011). “Capítulo 2 - doença de Huntington,” em Manual de Neurologia ClínicaEds WJ Weiner e E. Tolosa, Transtornos do Movimento Hipercinético (London: Elsevier), 15-24.
Bechara, A., Damasio, AR, Damasio, H. e Anderson, SW (1994). Insensibilidade a consequências futuras após danos no córtex pré-frontal humano. Conhecimento 50, 7–15. doi: 10.1016/0010-0277(94)90018-3
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Bechara, A., Damasio, H. e Damasio, AR (2000). Emoção, tomada de decisão e o córtex orbitofrontal. Cereb. Córtex 10, 295 – 307. doi: 10.1093 / cercor / 10.3.295
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Bittenbender, JB e Quadfasel, FA (1962). Formas rígidas e acinéticas da coreia de Huntington. Arco. Neurol 7, 275 – 288. doi: 10.1001 / archneur.1962.04210040027003
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Blackmore, L., Simpson, SA e Crawford, JR (1995). Desempenho cognitivo na amostra britânica de pessoas presintomáticas portadoras do gene da doença de Huntington. J. Med. Genet 32, 358 – 362. doi: 10.1136 / jmg.32.5.358
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Bonelli, RM e Cummings, JL (2007). Circuitos frontais-subcorticais e comportamento. Diálogos Clin. Neurosci. 9, 141-151.
Brand, M., Kalbe, E., Labudda, K., Fujiwara, E., Kessler, J. e Markowitsch, HJ (2005). Deficiências de tomada de decisão em pacientes com jogo patológico. Psiquiatria Res. 133, 91 – 99. doi: 10.1016 / j.psychres.2004.10.003
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Brevers, D., Bechara, A., Cleeremans, A., e Noël, X. (2013). Iowa Gambling Task (IGT): vinte anos após - transtorno do jogo e IGT. Frente. Psychol. 4: 665. doi: 10.3389 / fpsyg.2013.00665
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Brevers, D., Cleeremans, A., Bechara, A., Laloyaux, C., Kornreich, C., Verbanck, P., et ai. (2011a). Evolução temporal do viés de atenção para informações sobre jogos de azar no jogo problemático. Psychol. Viciado. Behav. 25, 675 – 682. doi: 10.1037 / a0024201
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Brevers, D., Cleeremans, A., Goudriaan, AE, Bechara, A., Kornreich, C., Verbanck, P., et al. (2012b). A tomada de decisão sob ambigüidade, mas não sob risco, está relacionada à gravidade do jogo problemático. Psiquiatria Res. 200, 568 – 574. doi: 10.1016 / j.psychres.2012.03.053
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Brevers, D., Cleeremans, A., Verbruggen, F., Bechara, A., Kornreich, C., Verbanck, P., et ai. (2012a). A ação impulsiva, mas a escolha impulsiva, determina a gravidade do jogo problemático. PLoS One 7: e50647. doi: 10.1371 / journal.pone.0050647
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Brevers, D., Cleeremans, A., Tibboel, H., Bechara, A., Kornreich, C., Verbanck, P., et al. (2011b). Piscar de atenção reduzido para estímulos relacionados ao jogo em jogadores problemáticos. J. Behav. Ther. Exp. Psiquiatria 42, 265 – 269. doi: 10.1016 / j.jbtep.2011.01.005
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Buelow, MT e Suhr, JA (2009). Validade de construção da tarefa de jogo de iowa. Neuropsychol. Rev. 19, 102–114. doi: 10.1007/s11065-009-9083-4
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Busemeyer, JR e Stout, JC (2002). Uma contribuição de modelos de decisão cognitiva para avaliação clínica: desempenho em decomposição na tarefa de jogo de Bechara. Psychol. Avaliar. 14, 253 – 262. doi: 10.1037 / 1040-3590.14.3.253
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Caine, ED e Shoulson, I. (1983). Síndromes psiquiátricas na doença de Huntington. Sou. J. Psiquiatria 140, 728-733.
Campbell, MC, Stout, JC e Finn, PR (2004). Redução da capacidade de resposta autonômica às perdas de tarefas de jogo na doença de Huntington. J. Int. Neuropsychol. Soc. 10, 239 – 245. doi: 10.1017 / s1355617704102105
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Cavedini, P., Riboldi, G., Keller, R., D'Annucci, A. e Bellodi, L. (2002). Disfunção do lobo frontal em pacientes com jogo patológico. Biol. Psiquiatria 51, 334–341. doi: 10.1016/s0006-3223(01)01227-6
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Clark, L. e Goudriaan, AE (2012). “Neuroimagem no jogo problemático”, em Enciclopédia de comportamentos aditivos, Ed PM Miller (Londres: Elsevier).
Clark, L. e Manes, F. (2004). Tomada de decisão social e emocional após lesão do lobo frontal. Neurocase 10, 398 – 403. doi: 10.1080 / 13554790490882799
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Clarke, D. (2006). Impulsividade como mediadora na relação entre depressão e problema do jogo. Pers. Individ. Diferir. 40, 5 – 15. doi: 10.1016 / j.paid.2005.05.008
Craufurd, D., Thompson, JC e Snowden, JS (2001). Mudanças comportamentais na doença de Huntington. Neuropsiquiatria Neuropsychol. Behav. Neurol 14, 219-226.
de Boo, GM, Tibben, A., Lanser, J., Jennekens-Schinkel, A., Hermans, J., Maat-Kievit, A., et ai. (1997) Sintomas cognitivos e motores precoces em portadores identificados do gene da doença de Huntington. Arco. Neurol 54, 1353 – 1357. doi: 10.1001 / archneur.1997.00550230030012
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
De Marchi, N., Morris, M., Mennella, R., La Pia, S. e Nestadt, G. (1998). Associação de transtorno obsessivo-compulsivo e jogo patológico com doença de Huntington em um pedigree italiano: possível associação com a mutação da doença de Huntington. Acta Psychiatr. Scand. 97, 62–65. doi: 10.1111/j.1600-0447.1998.tb09964.x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
de Visser, L., Homberg, JR, Mitsogiannis, M., Zeeb, FD, Rivalan, M., Fitoussi, A., et al. (2011) Versões de roedores da tarefa de jogo de iowa: oportunidades e desafios para a compreensão da tomada de decisão. Frente. Neurosci. 5: 109. doi: 10.3389 / fnins.2011.00109
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Di Chiara, G. e Bassareo, V. (2007). Sistema de recompensa e vício: o que a dopamina faz e o que não faz. Curr. Opin. Pharmacol. 7, 69 – 76. doi: 10.1016 / j.coph.2007.02.001
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Dias, R., Robbins, TW e Roberts, AC (1996). Dissociação no córtex pré-frontal das mudanças afetivas e atencionais. Natureza 380, 69 – 72. doi: 10.1038 / 380069a0
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Dodd, M., Klos, K., Bower, J., Geda, Y., Josephs, K. e Ahlskog, J. (2005). Jogo patológico causado por drogas usadas para tratar a doença de Parkinson. Arco. Neurol 62, 1377 – 1381. doi: 10.1001 / archneur.62.9.noc50009
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Doya, K. (2008). Moduladores de tomada de decisão. Nat. Neurosci. 11, 410 – 416. doi: 10.1038 / nn2077
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR e Stout, JC (2007). Sintomas psiquiátricos na doença de Huntington antes do diagnóstico: o estudo predict-HD. Biol. Psiquiatria 62, 1341 – 1346. doi: 10.1016 / j.biopsych.2006.11.034
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR, Wang, C., Stout, JC, et al. (2010b). Comportamentos “frontais” antes do diagnóstico da doença de Huntington e sua relação com os marcadores de progressão da doença: evidências de falta de consciência precoce. J. Neuropsychiatry Clin. Neurosci. 22, 196 – 207. doi: 10.1176 / appi.neuropsych.22.2.196
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Duff, K., Paulsen, J., Mills, J., Beglinger, LJ, Moser, DJ, Smith, MM, et al. (2010a). Comprometimento cognitivo leve na doença de Huntington pré-diagnosticada. Neurologia 75, 500–507. doi: 10.1212/wnl.0b013e3181eccfa2
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Dumas, EM, Van den Bogaard, SJ, Middelkoop, HA e Roos, RA (2013). Uma revisão da cognição na doença de Huntington. Frente. Biosci (Schol. Ed.) 5, 1 – 18. doi: 10.2741 / s355
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Epping, EA, Mills, JA, Beglinger, L.J., Fiedorowicz, JG, Craufurd, D., Smith, MM, et ai. (2013) Caracterização da depressão na doença prodrômica de Huntington nos preditores neurobiológicos do estudo HD (PREDICT-HD). J. Psychiatr. Res. 47, 1423 – 1431. doi: 10.1016 / j.jpsychires.2013.05.026
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Faure, A., Höhn, S., von Hörsten, S., Delatour, B., Raber, K., Le Blanc, P., et ai. (2011) Processamento emocional e motivacional alterado no modelo de rato transgênico para doença de Huntington. Neurobiol. Aprender. Mem. 95, 92 – 101. doi: 10.1016 / j.nlm.2010.11.010
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Fellows, LK e Farah, MJ (2005). Diferentes deficiências subjacentes na tomada de decisão após danos no lobo frontal ventromedial e dorsolateral em humanos. Cereb. Córtex 15, 58 – 63. doi: 10.1093 / cercor / bhh108
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Fielding, SA, Brooks, SP, Klein, A., Bayram-Weston, Z., Jones, L. e Dunnett, SB (2012). Perfis de comprometimento motor e cognitivo no modelo de ratos transgênicos da doença de Huntington. Cérebro Res. Touro. 88, 223 – 236. doi: 10.1016 / j.brainresbull.2011.09.011
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Fink, KD, Rossignol, J., Crane, AT, Davis, KK, Bavar, AM, Dekorver, NW, et al. (2012) Disfunção cognitiva precoce no modelo de rato transgênico HD 51 CAG da doença de Huntington. Behav. Neurosci. 126, 479 – 487. doi: 10.1037 / a0028028
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Fiorillo, CD, Tobler, PN e Schultz, W. (2003). Codificação discreta da probabilidade de recompensa e incerteza pelos neurônios dopaminérgicos. Ciência 299, 1898 – 1902. doi: 10.1126 / science.1077349
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Folstein, SE e Folstein, MF (1983). Características psiquiátricas da doença de Huntington: abordagens e descobertas recentes. Psiquiatria Dev. 1, 193-205.
Foroud, T., Siemers, E., Kleindorfer, D., Bill, DJ, Hodes, MIM, Norton, JA, et al. (1995) Escores cognitivos em portadores do gene da doença de Huntington em comparação com não portadores. Ann. Neurol. 37, 657 – 664. doi: 10.1002 / ana.410370516
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Giordani, B., Berent, S., Boivin, MJ, Penney, JB, Lehtinen, S., Markel, DS, et ai. (1995) Análise longitudinal neuropsicológica e genética de pessoas com risco de doença de Huntington. Arco. Neurol 52, 59 – 64. doi: 10.1001 / archneur.1995.00540250063014
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Gleichgerrcht, E., Ibanez, A., Roca, M., Torralva, T. e Manes, F. (2010). Cognição de tomada de decisão em doenças neurodegenerativas. Nat. Rev. Neurol. 6, 611 – 623. doi: 10.1038 / nrneurol.2010.148
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Goudriaan, AE, Oosterlaan, J., de Beurs, E. e Van den Brink, W. (2004). Jogo patológico: uma revisão abrangente dos achados biocomportamentais. Neurosci. Biobehav. Rev. 28, 123 – 141. doi: 10.1016 / j.neubiorev.2004.03.001
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Graybiel, AM, Aosaki, T., Flaherty, AW e Kimura, M. (1994). Os gânglios da base e controle motor adaptativo. Ciência 265, 1826 – 1831. doi: 10.1126 / science.8091209
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Griffiths, M. (2003). Jogo na Internet: questões, preocupações e recomendações. Cyberpsicol Behav. 6, 557 – 568. doi: 10.1089 / 109493103322725333
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Grimbergen, YAM, Knol, MJ, Bloem, BR, Kremer, BPH, Roos, RAC e Munneke, M. (2008). Quedas e distúrbios da marcha na doença de Huntington. Mov. Desordem. 23, 970 – 976. doi: 10.1002 / mds.22003
Haber, SN e Knutson, B. (2010). O circuito de recompensa: ligando a anatomia dos primatas e a imagem humana. Neuropsychopharmacology 35, 4 – 26. doi: 10.1038 / npp.2009.129
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Hadzi, TC, Hendricks, AE, Latourelle, JC, Lunetta, KL, Cupples, LA, Gillis, T., e outros. (2012) Avaliação do envolvimento cortical e estriado em cérebros de doença de Huntington 523. Neurologia 79, 1708–1715. doi: 10.1212/wnl.0b013e31826e9a5d
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Hahn-Barma, V., Deweer, B., Dhrr, A., Dodé, C., Feingold, J., Pillon, B., et ai. (1998) As alterações cognitivas são os primeiros sintomas da doença de Huntington? Um estudo de portadores de genes. J. Neurol. Neurocirurgia Psiquiatria 64, 172 – 177. doi: 10.1136 / jnnp.64.2.172
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Hamilton, JM, Salmon, DP, Corey-Bloom, J., Gamst, A., Paulsen, JS, Jerkins, S., et al. (2003) Anormalidades comportamentais contribuem para o declínio funcional na doença de Huntington. J. Neurol. Neurocirurgia Psiquiatria 74, 120 – 122. doi: 10.1136 / jnnp.74.1.120
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Hansotia, P., Cleeland, CS e Chun, RW (1968). Coréia juvenil de Huntington. Neurologia 18, 217-224.
Heemskerk, A.-W. e Roos, RAC (2011). Disfagia na doença de Huntington: uma revisão. Disfagia 26, 62–66. doi: 10.1007/s00455-010-9302-4
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Henley, SMD, Wild, EJ, Hobbs, Nova Zelândia, Warren, JD, Frost, C., Scahill, RI, et ai. (2008) O reconhecimento de emoções defeituosas no início da DH é neuropsicológica e anatomicamente genérico. Neuropsychologia 46, 2152 – 2160. doi: 10.1016 / j.neuropsychologia.2008.02.025
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Holl, AK, Wilkinson, L., Tabrizi, SJ, Painold, A. e Jahanshahi, M. (2013). Disfunção executiva seletiva, mas intato de tomada de decisão arriscada no início da doença de Huntington. Mov. Desordem. 28, 1104 – 1109. doi: 10.1002 / mds.25388
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Hoth, KF, Paulsen, JS, Moser, DJ, Tranel, D., Clark, LA e Bechara, A. (2007). Pacientes com doença de Huntington apresentam comprometimento da consciência das habilidades cognitivas, emocionais e funcionais. J. Clin. Exp. Neuropsychol. 29, 365 – 376. doi: 10.1080 / 13803390600718958
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Iacono, WG, Malone, SM e McGue, M. (2008). Desinibição comportamental e desenvolvimento de dependência precoce: influências comuns e específicas. Annu Rev. Clin. Psychol. 4, 325 – 348. doi: 10.1146 / annurev.clinpsy.4.022007.141157
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Ille, R., Schäfer, A., Scharmuller, W., Enzinger, C., Schöggl, H., Kapfhammer, HP, et ai. (2011) Reconhecimento de emoções e experiência na doença de Huntington: um estudo de morfometria baseado em voxel. J. Psiquiatria Neurosci. 36, 383 – 390. doi: 10.1503 / jpn.100143
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Jason, GW, Pajurkova, E., Suchowersky, O., Hewitt, J., Hilbert, C., Reed, J., et ai. (1988) Comprometimento neuropsicológico pré-sintomático na doença de Huntington. Arco. Neurol 45, 769 – 773. doi: 10.1001 / archneur.1988.00520310079021
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Johnson, SA, Stout, JC, Salomon, AC, Langbehn, DR, Aylward, EH, Cruce, CB, et al., E Investigadores Predict-HD do Huntington Study Group (2007). Além do nojo: prejuízo no reconhecimento de emoções negativas antes do diagnóstico na doença de Huntington. Cérebro 130, 1732 – 1744. doi: 10.1093 / brain / awm107
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Jones, L. e Hughes, A. (2011). “Mecanismos patogênicos na doença de Huntington”, em Revista Internacional de Neurobiologia, eds J. Brotchie, E. Bezard e P. Jenner, Pathophysiology, Pharmacology and Biochemistry of Discinesia (London: Academic Press), 373-418.
Josiassen, RC, Curry, LM e Mancall, EL (1983). Desenvolvimento de déficits neuropsicológicos na doença de Huntington. Arco. Neurol 40, 791 – 796. doi: 10.1001 / archneur.1983.04050120041005
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Julien, CL, Thompson, JC, Wild, S., Yardumian, P., Snowden, JS, Turner, G., et ai. (2007) Transtornos psiquiátricos na doença de Huntington pré-clínica. J. Neurol. Neurocirurgia Psiquiatria 78, 939 – 943. doi: 10.1136 / jnnp.2006.103309
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Kassubek, J., Juengling, FD, Kioschies, T., Henkel, K., Karitzky, J., Kramer, B., et al. (2004) Topografia da atrofia cerebral na doença de Huntington precoce: estudo morfométrico por RM baseado em voxel. J. Neurol. Neurocirurgia Psiquiatria 75, 213 – 220. doi: 10.1136 / jnnp.2002.009019
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Kirkwood, SC, Siemers, E., Stout, JC, Hodes, MIM, Conneally, PM, Christian, JC, et al. (1999) Alterações cognitivas e motoras longitudinais entre portadores de genes pré-sintomáticos da doença de Huntington. Arco. Neurol 56, 563 – 568. doi: 10.1001 / archneur.56.5.563
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Kirkwood, SC, Su, JL, Conneally, P. e Foroud, T. (2001). Progressão dos sintomas nos estágios inicial e médio da doença de Huntington. Arco. Neurol 58, 273 – 278. doi: 10.1001 / archneur.58.2.273
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Klitzman, R., Thorne, D., Williamson, J., Chung, W. e Marder, K. (2007). Tomada de decisão sobre escolhas reprodutivas entre indivíduos em risco para doença de Huntington. J. Genet. Couns. 16, 347–362. doi: 10.1007/s10897-006-9080-1
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Klöppel, S., Stonnington, CM, Petrovic, P., Mobbs, D., Tüscher, O., Craufurd, D., et ai. (2010) Irritabilidade na doença de Huntington pré-clínica. Neuropsychologia 48, 549 – 557. doi: 10.1016 / j.neuropsychologia.2009.10.016
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Koller, WC e Trimble, J. (1985). Anormalidade da marcha da doença de Huntington. Neurologia 35, 1450 – 1454. doi: 10.1212 / wnl.35.10.1450
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Kravitz, AV, Tye, LD e Kreitzer, AC (2012). Papéis distintos para os neurônios estriados da via direta e indireta no reforço. Nat. Neurosci. 15, 816 – 818. doi: 10.1038 / nn.3100
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Labuschagne, I., Jones, R., Callaghan, J., Whitehead, D., Dumas, EM, Say, MJ, et al. (2013) Deficits emocionais de reconhecimento facial e efeitos de medicação no pré-manifesto até a doença de Huntington no estágio II. Psiquiatria Res. 207, 118 – 126. doi: 10.1016 / j.psychres.2012.09.022
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Lange, KW, Sahackian, BJ, Quinn, NP, Marsden, CD e Robbins, TW (1995). Comparação da função da memória executiva e visuoespacial na doença de Huntington e na demência do tipo Alzheimer compatível com o grau de demência J. Neurol. Neurocirurgia Psiquiatria 58, 598 – 606. doi: 10.1136 / jnnp.58.5.598
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Lawrence, AD, Sahackian, BJ, Hodges, JR, Rosser, AE, Lange, KW e Robbins, TW (1996). Funções executivas e mnemônicas no início da doença de Huntington. Cérebro 119, 1633 – 1645. doi: 10.1093 / brain / 119.5.1633
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Li, SH e Li, XJ (2004). Interações proteína-hunting e a patogênese da doença de Huntington. Tendências Genet. 20, 146 – 154. doi: 10.1016 / j.tig.2004.01.008
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Louis, ED, Lee, P., Quinn, L. e Marder, K. (1999). Distonia na doença de Huntington: prevalência e características clínicas. Mov. Desordem. 14, 95–101. doi: 10.1002/1531-8257(199901)14:1<95::aid-mds1016>3.0.co;2-8
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Lyketsos, CG, Rosenblatt, A. e Rabins, P. (2004). Síndrome do lobo frontal esquecida ou “Síndrome da Disfunção Executiva”. Psicossomática 45, 247 – 255. doi: 10.1176 / appi.psy.45.3.247
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
MacDonald, ME, e outros, e grupo de pesquisa colaborativa da doença de Huntington (1993). Um novo gene contendo uma repetição trinucleotídica que é expandida e instável nos cromossomos da doença de Huntington. Célula 72, 971–983. doi: 10.1016/0092-8674(93)90585-e
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Manes, F., Sahackian, B., Clark, L., Rogers, R., Antoun, N., Aitken, M., et al. (2002) Processos de tomada de decisão após danos no córtex pré-frontal. Cérebro 125, 624 – 639. doi: 10.1093 / brain / awf049
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
McAlonan, K. e Brown, VJ (2003). O córtex pré-frontal orbital medeia o aprendizado por reversão e não o deslocamento da atenção no rato. Behav. Cérebro Res. 146, 97 – 103. doi: 10.1016 / j.bbr.2003.09.019
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Miller, LA (1992). Impulsividade, risco e capacidade de sintetizar informação fragmentada após lobectomia frontal. Neuropsychologia 30, 69–79. doi: 10.1016/0028-3932(92)90015-e
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Newman, JP (1987). Reação à punição em extrovertidos e psicopatas: implicações para o comportamento impulsivo de indivíduos desinibidos. J. Res. Pers. 21, 464–480. doi: 10.1016/0092-6566(87)90033-x
O'Doherty, J., Kringelbach, ML, Rolls, ET, Hornak, J. e Andrews, C. (2001). Representações abstratas de recompensa e punição no córtex orbitofrontal humano. Nat. Neurosci. 4, 95 – 102. doi: 10.1038 / 82959
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Papp, KV, Kaplan, RF e Snyder, PJ (2011). Marcadores biológicos da cognição na doença de Huntington prodrômica: uma revisão. Brain Cogn. 77, 280 – 291. doi: 10.1016 / j.bandc.2011.07.009
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Paradiso, S., Turner, BM, Paulsen, JS, Jorge, R., Ponto, LLB e Robinson, RG (2008). Bases neurais da disforia na doença de Huntington precoce. Psiquiatria Res. 162, 73 – 87. doi: 10.1016 / j.pscychresns.2007.04.001
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Paton, JJ e Louie, K. (2012). Recompensa e punição iluminadas. Nat. Neurosci. 15, 807 – 809. doi: 10.1038 / nn.3122
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Paulsen, JS, Langbehn, DR, Stout, JC, Aylward, E., Ross, CA, Nance, M., et al. (2008) Detecção da doença de Huntington décadas antes do diagnóstico: o estudo predict-HD. J. Neurol. Neurocirurgia Psiquiatria 79, 874 – 880. doi: 10.1136 / jnnp.2007.128728
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Peltsch, A., Hoffman, A., Armstrong, I., Pari, G. e Munoz, DP (2008). Alterações sacádicas na doença de Huntington. Exp. Cérebro Res. 186, 457–469. doi: 10.1007/s00221-007-1248-x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Potenza, MN (2013). Neurobiologia dos comportamentos de jogo. Curr. Opin. Neurobiol. 23, 660 – 667. doi: 10.1016 / j.conb.2013.03.004
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Ramig, LA (1986). Análises acústicas da fonação em pacientes com doença de Huntington. Relatório preliminar. Ann. Otol. Rhinol. Laringol. 95, 288-293.
Raylu, N. e Oei, TPS (2002). Jogo patológico. Uma revisão abrangente. Clin. Psychol. Rev. 22, 1009–1061. doi: 10.1016/S0272-7358(02)00101-0
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Reiner, A., Dragatsis, I. e Dietrich, P. (2011). “Genética e neuropatologia da doença de Huntington”, em Revista Internacional de Neurobiologia, eds J. Brotchie, E. Bezard e P. Jenner, Pathophysiology, Pharmacology and Biochemistry of Discinesia (London: Academic Press), 325-372.
Rogers, RD, Everitt, BJ, Baldacchino, A., Blackshaw, AJ, Swainson, R., Wynne, K., et ai. (1999) Déficits dissociáveis na cognição de tomada de decisão de usuários crônicos de anfetamina, usuários de opióides, pacientes com dano focal ao córtex pré-frontal e voluntários normais com depleção de triptofano: evidências de mecanismos monoaminérgicos. Neuropsychopharmacology 20, 322–339. doi: 10.1016/s0893-133x(98)00091-8
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Roos, RA (2010). Doença de Huntington: uma revisão clínica. Orphanet J. Rare Dis. 5:40. doi: 10.1186/1750-1172-5-40
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Rosas, HD, Hevelone, ND, Zaleta, AK, Greve, DN, Salat, DH e Fischl, B. (2005). Emagrecimento cortical regional na doença de Huntington pré-clínica e sua relação com a cognição. Neurologia 65, 745 – 747. doi: 10.1212 / 01.wnl.0000174432.87383.87
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Rosenblatt, A. (2007). Neuropsiquiatria da doença de Huntington. Diálogos Clin. Neurosci. 9, 191-197.
Rothlind, JC, Bylsma, FW, Peyser, C., Folstein, SE e Brandt, J. (1993). Correlatos cognitivos e motores do funcionamento diário no início da doença de Huntington. J. Nerv. Ment. Dis. 181, 194–199. doi: 10.1097/00005053-199303000-00008
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Rushworth, MFS, Behrens, TEJ, Rudebeck, PH e Walton, ME (2007). Papéis contrastantes para o córtex cingulado e orbitofrontal em decisões e comportamento social. Tendências Cogn. Sci. 11, 168 – 176. doi: 10.1016 / j.tics.2007.01.004
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Sánchez-Castañeda, C., Cherubini, A., Elifani, F., Péran, P., Orobello, S., Capelli, G., et ai. (2013) Buscando biomarcadores da doença de huntington por imagens multimodais de gânglios da base transversais. Cantarolar. Mapp do cérebro. 34, 1625 – 1635. doi: 10.1002 / hbm.22019
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Sesack, SR e Grace, AA (2010). Rede de recompensa dos gânglios córtico-basais: microcircuitos. Neuropsychopharmacology 35, 27 – 47. doi: 10.1038 / npp.2009.93
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Shannon, KM (2011). “Capítulo 1 - Doença de Huntington - sinais clínicos, sintomas, diagnóstico e diagnóstico pré-sintomático”, em Manual de Neurologia ClínicaEds WJ Weiner e E. Tolosa, Transtornos do Movimento Hipercinético (London: Elsevier), 3-13.
Sharpe, L. (2002). Um modelo cognitivo-comportamental reformulado do jogo-problema. Uma perspectiva biopsicossocial. Clin. Psychol. Rev. 22, 1–25. doi: 10.1016/s0272-7358(00)00087-8
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Shiwach, R. (1994). Psicopatologia em pacientes com doença de Huntington. Acta Psychiatr. Scand. 90, 241–246. doi: 10.1111/j.1600-0447.1994.tb01587.x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Smith, MA, Brandt, J. e Shadmehr, R. (2000). A desordem motora na doença de Huntington começa como uma disfunção no controle de feedback de erro. Natureza 403, 544 – 549. doi: 10.1038 / 35000576
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Snell, RG, MacMillan, JC, Cheadle, JP, Fenton, I., Lazarou, LP, Davies, P., et ai. (1993) Relação entre expansão repetida trinucleotídica e variação fenotípica na doença de Huntington. Nat. Genet. 4, 393 – 397. doi: 10.1038 / ng0893-393
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Stine, OC, Pleasant, N., Franz, ML, Abbott, MH, Folstein, SE e Ross, CA (1993). Correlação entre a idade de início da doença de Huntington e o tempo de repetição do trinucleotídeo no IT-15. Murmurar. Mol. Genet 2, 1547 – 1549. doi: 10.1093 / hmg / 2.10.1547
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Stout, JC, Paulsen, JS, Queller, S., Salomão, AC, Whitlock, KB, Campbell, JC, et ai. (2011) Sinais neurocognitivos na doença prodrômica de Huntington. Neuropsicologia 25, 1 – 14. doi: 10.1037 / a0020937
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Stout, JC, Rodawalt, WC e Siemers, ER (2001). Tomada de decisão arriscada na doença de Huntington. J. Int. Neuropsychol. Soc. 7, 92 – 101. doi: 10.1017 / S1355617701711095
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Tabrizi, SJ, Langbehn, DR, Leavitt, BR, Roos, RA, Durr, A., Craufurd, D., et ai. (2009) Manifestações biológicas e clínicas da doença de Huntington no estudo longitudinal TRACK-HD: análise transversal dos dados iniciais. Lancet Neurol. 8, 791–801. doi: 10.1016/S1474-4422(09)70170-X
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Tekin, S. e Cummings, JL (2002). Circuitos neuronais frontais-subcorticais e neuropsiquiatria clínica: uma atualização. J. Psychosom. Res. 53, 647–654. doi: 10.1016/s0022-3999(02)00428-2
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Thieben, MJ, Duggins, AJ, Good, CD, Gomes, L., Mahant, N., Richards, F., et al. (2002) A distribuição da neuropatologia estrutural na doença de Huntington pré-clínica. Cérebro 125, 1815 – 1828. doi: 10.1093 / brain / awf179
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Tian, J., Herdman, SJ, Zee, DS e Folstein, SE (1992). Estabilidade postural em pacientes com doença de Huntington. Neurologia 42, 1232 – 1238. doi: 10.1212 / wnl.42.6.1232
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Unschuld, PG, Joel, SE, Pekar, JJ, Reading, SA, Oishi, K., McEntee, J., et al. (2012) Os sintomas depressivos na doença de Huntington prodrômica se correlacionam com a conectividade funcional relacionada à interferência de choque no córtex pré-frontal ventromedial. Psiquiatria Res. 203, 166 – 174. doi: 10.1016 / j.pscychresns.2012.01.002
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
van den Bogaard, SJ, Dumas, EM, Acharya, TP, Johnson, H., Langbehn, DR, Scahill, RI, et al. (2011) Atrofia precoce do núcleo pálido e acumbente na doença de Huntington. J. Neurol. 258, 412–420. doi: 10.1007/s00415-010-5768-0
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
van den Bos, R., Davies, W., Dellu-Hagedorn, F., Goudriaan, AE, Granon, S., Homberg, J., et ai. (2013a). Abordagens entre espécies para o jogo patológico: uma revisão que visa as diferenças entre os sexos, a vulnerabilidade dos adolescentes e a validade ecológica das ferramentas de pesquisa. Neurosci. Biobehav. Rev. 37, 2454 – 2471. doi: 10.1016 / j.neubiorev.2013.07.005
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
van den Bos, R., Homberg, J. e de Visser, L. (2013b). Uma revisão crítica das diferenças entre os sexos nas tarefas de tomada de decisão: foco na tarefa de jogo no Iowa. Behav. Cérebro Res. 238, 95 – 108. doi: 10.1016 / j.bbr.2012.10.002
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
van den Bos, R., Koot, S. e de Visser, L. (2014). Uma versão para roedores da tarefa de apostas no iowa: 7 anos de progresso. Frente. Psychol. 5: 203.doi: 10.3389 / fpsyg.2014.00203
van Duijn, E., Kingma, EM e van der Mast, RC (2007). Psicopatologia em portadores de genes da doença de Huntington. J. Neuropsychiatry Clin. Neurosci. 19, 441 – 448. doi: 10.1176 / appi.neuropsych.19.4.441
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
van Duijn, E., Reedeker, N., Giltay, EJ, Eindhoven, D., Roos, RAC e van der Mast, RC (2014). Curso de irritabilidade, depressão e apatia na doença de Huntington em relação aos sintomas motores durante um período de acompanhamento de dois anos. Neurodegener. Dis. 13, 9 – 16. doi: 10.1159 / 000343210
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
van Holst, RJ, van den Brink, W., Veltman, DJ e Goudriaan, AE (2010). Por que os jogadores não conseguem vencer: uma revisão dos achados cognitivos e de neuroimagem no jogo patológico. Neurosci. Biobehav. Rev. 34, 87 – 107. doi: 10.1016 / j.neubiorev.2009.07.007
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
van Holst, RJ, Veltman, DJ, Buchel, C., Van den Brink, W., e Goudriaan, AE (2012). Cognição distorcida codificando em jogo de problema: é o viciante na antecipação? Biol. Psiquiatria 71, 741 – 748. doi: 10.1016 / j.biopsych.2011.12.030
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Verny, C., Allain, P., Prudean, A., Malinge, MC, Gohier, B., Scherer, C., et al. (2007) Alterações cognitivas em portadores assintomáticos do gene mutante da doença de Huntington. EUR. J. Neurol. 14, 1344 – 1350. doi: 10.1111 / j.1468-1331.2007.01975.x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Volkow, ND, Fowler, JS e Wang, GJ (2002). Papel da dopamina no reforço e dependência de drogas em humanos: resultados de estudos de imagem. Behav. Pharmacol. 13, 355–366. doi: 10.1097/00008877-200209000-00008
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Vonsattel, JP e DiFiglia, M. (1998). Doença de Huntington. J. Neuropathol. Exp. Neurol 57, 369–384. doi: 10.1097/00005072-199805000-00001
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Vonsattel, JPG, Keller, C. e Cortes Ramirez, EP (2011). Capítulo 4 - Doença de Huntington - neuropatologia ”em Manual de Neurologia Clínica, eds W. Weiner e E. Tolosa, Transtornos do Movimento Hipercinético (London: Elsevier), 83-100.
Vonsattel, JPG (2008). Modelos de doença de Huntington e neuropatologia humana: semelhanças e diferenças. Acta Neuropathol. 115, 55–69. doi: 10.1007/s00401-007-0306-6
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Watkins, LHA, Rogers, RD, Lawrence, AD, Sahackian, BJ, Rosser, AE e Robbins, TW (2000). Planejamento prejudicado, mas tomada de decisão intacta na doença de Huntington precoce: implicações para a patologia fronto-estriatal específica. Neuropsychologia 38, 1112–1125. doi: 10.1016/s0028-3932(00)00028-2
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Weintraub, D., Papay, K., Siderowf, A. e Parkinson's Progression Markers Initiative. (2013) Triagem para sintomas de controle de impulso em pacientes com doença de Parkinson de novo: um estudo caso-controle. Neurologia 80, 176–180. doi: 10.1212/wnl.0b013e31827b915c
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Witjas, T., Eusebio, A., Fluchère, F. e Azulay, JP (2012). Comportamentos aditivos e doença de Parkinson. Rev. Neurol. (Paris) 168, 624 – 633. doi: 10.1016 / j.neurol.2012.06.014
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Wolf, RC, Vasic, N., Schönfeldt-Lecuona, C., Landwehrmeyer, GB e Ecker, D. (2007). Disfunção pré-frontal do córtex dorsolateral na doença de Huntington pré-sintomática: evidências de fMRI relacionada a eventos. Cérebro 130, 2845 – 2857. doi: 10.1093 / brain / awm210
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Yin, HH e Knowlton, BJ (2006). O papel dos gânglios da base na formação de hábitos. Nat. Rev. Neurosci. 7, 464 – 476. doi: 10.1038 / nrn1919
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Yin, HH, Ostlund, SB e Balleine, BW (2008). Aprendizagem guiada pela recompensa além da dopamina no nucleus accumbens: as funções integradoras das redes de gânglios córtico-basais. EUR. J. Neurosci. 28, 1437 – 1448. doi: 10.1111 / j.1460-9568.2008.06422.x
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Young, AB, Shoulson, I., Penney, JB, Starosta-Rubinstein, S., Gomez, F., Travers, H., et al. (1986) Doença de Huntington na Venezuela Características neurológicas e declínio funcional. Neurologia 36, 244 – 249. doi: 10.1212 / WNL.36.2.244
Resumo Pubmed | Texto Completo Pubmed | Texto Completo de CrossRef
Palavras-chave: doença de Huntington, tomada de risco, jogos de azar, córtex pré-frontal, gânglios da base, desinibição
Citação: Kalkhoven C, Sennef C, Peeters A e van den Bos R (2014) Risco e comportamento patológico do jogo na doença de Huntington. Frente. Behav. Neurosci. 8: 103. doi: 10.3389 / fnbeh.2014.00103
Recebido: 30 November 2013; Paper pendente publicado: 18 January 2014;
Aceito: 12 March 2014; Publicado online: 02 April 2014.
Editado por:
Patrick AnselmeUniversidade de Liège, Bélgica
Revisados pela:
Damien Brevers, Université Libre de Bruxelles, Bélgica
Bryan F. SingerUniversidade do Michigan, EUA