Dialogjet Clin Neurosci. 2013 Dec;15(4):431-43.
Abstrakt
Pavarësisht nga rëndësia e faktorëve të shumtë psiko-socialë, në varësi të saj, varësia nga droga përfshin një proces biologjik: aftësia e ekspozimit të përsëritur ndaj një droge abuzimi për të nxitur ndryshime në një truri të prekshëm që nxit kërkimin dhe marrjen e drogës dhe humbjen e kontrollit mbi përdorimin e drogës, që përcaktojnë një gjendje të varësisë. Këtu, ne shqyrtojmë llojet e adaptimeve molekulare dhe qelizore që ndodhin në rajonet specifike të trurit për të ndërmjetësuar anomalitë e sjelljes të lidhura me varësinë. Këto përfshijnë ndryshime në shprehjen e gjeneve të arritura pjesërisht përmes mekanizmave epigjenetik, plasticitet në funksionimin neurofiziologjik të neuroneve dhe sinapseve, dhe plasticitetin e lidhur në morfologjinë neuronale dhe sinapike të ndërmjetësuar pjesërisht nga sinjalizimi i faktorit neurotrofik të ndryshuar. Secila prej këtyre llojeve të modifikimeve të nxitura nga droga mund të shihet si një formë e "kujtesës qelizore ose molekulare". Për më tepër, është e habitshme se shumica e formave të lidhura me varësinë e plasticitetit janë shumë të ngjashme me llojet e plasticitetit që janë shoqëruar me forma më klasike të "kujtesës së sjelljes", ndoshta duke reflektuar repertorin e fundëm të mekanizmave adaptivë në dispozicion të neuroneve kur përballen me mjedisin sfida. Së fundi, përshtatjet molekulare dhe qelizore të lidhura me varësinë përfshijnë shumicën e rajoneve të trurit të njëjta që ndërmjetësojnë forma më klasike të kujtesës, në përputhje me qëndrimin se kujtimet jonormale janë drejtues të rëndësishëm të sindromave të varësisë. Qëllimi i këtyre studimeve që synojnë të shpjegojnë bazën molekulare dhe qelizore të varësisë nga droga është përfundimisht zhvillimi i analizave biologjike të bazuara në diagnozë, si dhe trajtime më efektive për çrregullimet e varësisë.
Prezantimi
Varësia e drogës, e cila mund të përkufizohet si kërkimi dhe marrja e drogës, pavarësisht nga pasojat e tmerrshme ose humbja e kontrollit mbi përdorimin e drogës, është shkaktuar nga ndryshime afatgjata të drogës që ndodhin në rajone të caktuara të trurit.1 Megjithatë, vetëm disa individë i nënshtrohen varësisë përballë ekspozimit të përsëritur të drogës, ndërsa të tjerët janë të aftë të përdorin një ilaç të rastësishëm dhe të ikin nga një sindrom i varësisë. Faktorët gjenetikë përbëjnë përafërsisht 50% të kësaj ndryshueshmërie individuale në cenueshmërinë e varësisë, dhe kjo shkallë e trashëgueshmërisë vlen për të gjitha klasat kryesore të barnave problematike, përfshirë stimuluesit, opiatet, alkoolin, nikotinën dhe kanabinoidet.2 Nuk ka qenë ende e mundur të identifikohen shumica e gjeneve që përbëjnë këtë rrezik gjenetik, ndoshta për shkak të përfshirjes së ndoshta qindra ndryshimeve gjenetike që përmbledhin në një individ të vetëm për të dhënë dobësi të varësisë (ose, në individë të tjerë, rezistencë).
50% e tjera e rrezikut për varësi është për shkak të një mori faktorësh mjedisorë, që ndodhin gjatë gjithë jetës, që ndërveprojnë me përbërjen gjenetike të një individi për ta bërë atë ose atë të prekshëm ndaj varësisë në një masë më të madhe ose më të vogël. Disa lloje të faktorëve mjedisorë janë implikuar në varësi, përfshirë streset psikosociale, por deri tani faktori më i fuqishëm është ekspozimi ndaj një droge abuzimi vetë. Disa ilaçe "porta hyrëse", në veçanti, nikotina, është treguar se rrisin ndjeshmërinë e dikujt ndaj një varësie ndaj një droge tjetër.3 Për më tepër, ka dëshmi gjithnjë e më të mëdha se, pavarësisht nga një sërë rreziqesh gjenetike për varësinë në të gjithë popullsinë, ekspozimi ndaj dozave mjaft të larta të një droge për periudha të gjata kohore mund të transformojë dikë që ka ngarkim gjenetik relativisht më të ulët në një të varur.4
Progres i madh është bërë gjatë dy dekadave të fundit në identifikimin e rajoneve diskrete të trurit që janë të rëndësishme në ndërmjetësimin e një sindromi të varësisë, si dhe llojet e ndryshimeve në nivelet molekulare dhe qelizore që barnat nxisin në këto rajone për të vënë në themel aspekte kyçe e varësisë.1,5 Qarku që ka marrë më shumë vëmendje quhet sistemi mesolimbik i dopaminës, i cili përfshin neuronet e dopamines në zonën tegmentale të barkut (VTA) të midurons që inervurojnë neuronet e mesme të mprehtë në nucleus accumbens (NAc, një pjesë e striatumit të ventralit). Këto neurone VTA gjithashtu innervate shumë rajone të tjera pararendëse, duke përfshirë hippocampus, amygdala, dhe korteksit paraballor (PFC).
Ka kuptim që të marrin në konsideratë këto mekanizma të varësisë nga droga në këtë vëllim në kujtesë për tre arsye të mbivendosura.6
- Së pari, të gjitha përshtatjet e nxitura nga droga mund të shihen si lloje të "kujtesës molekulare ose qelizore:" qeliza nervore që i nënshtrohet ndryshimeve të tilla është e ndryshme si rezultat i ekspozimit të drogës dhe kështu i përgjigjet ndryshe njëjta drogës, për droga të tjera, ose për një mori të stimujve të tjerë si rezultat.
- Së dyti, është interesante se shumë, ndoshta më së shumti, llojet e ndryshimeve që janë shoqëruar me një gjendje të varësisë (p.sh., transkriptimi i gjeneve të ndryshuara, epigenetika, plasticiteti synaptik dhe i tërë qelizave, morfologjia nervore dhe mekanizmat neurotrofikë) gjithashtu përfshihen në format tradicionale të "kujtesës së sjelljes" siç janë kujtesa hapësinore, kondicionimi i frikës dhe kushtëzimi operues, ndër të tjera.
- Së treti, në mesin e rajoneve të trurit të prekur nga drogat e abuzimit janë ato që janë substrate kyçe nervore për kujtesën e sjelljes, duke përfshirë hippocampus, amygdala, dhe PFC. Kjo përputhet me rritjen e realizimit se disa prej karakteristikave më të rëndësishme të varësisë të shikuara klinikisht (p.sh. dëshirat e drogës dhe rikthimi i drogës) pasqyrojnë anomalitë në qarqet tradicionale të kujtesës, me kujtimet afatgjata të përvojës së drogës që shërbejnë si drejtues të fuqishëm të patologjisë së varësisë.4,7,8 Në të kundërt, rajonet e shpërblimit të trurit (p.sh., VTA dhe NAc) ndikojnë fuqishëm në kujtesën e sjelljes.
Ky artikull ofron një pasqyrë të llojeve kryesore të ndryshimeve molekulare dhe qelizore që ndodhin në disa rajone të trurit në modelet e kafshëve të varësisë, duke u përqëndruar në bërthamën accumbens për të cilën shumica e informacionit është aktualisht në dispozicion. E rëndësishmja, ka qenë e mundur gjithnjë e më shumë për të vërtetuar disa nga këto ndryshime në të varur nga njerëzit bazuar në studimet e trurit të pasmorteve. Përkundër faktit që droga e abuzimit ka struktura kimike të dallueshme dhe vepron në caqe të dallueshme proteinash, është e habitshme që shumë përshtatje të rëndësishme të varësisë janë të përbashkëta për shumë dhe në disa raste të gjitha, drogat e abuzimeve dhe mund të kontribuojnë në karakteristikat e përbashkëta të një Sindromi i varësisë.4,9 Në të kundërtën, shumë përshtatje të tjera të nxitura nga droga janë specifike për një drogë të caktuar dhe mund të ndërmjetësojnë aspekte më unike të një varësie të caktuar. Këtu përqendrohemi në drogë stimuluese dhe opiate të abuzimit, të cilat prodhojnë efekte më dramatike në modelet e kafshëve në krahasim me barnat e tjera. Ne gjithashtu nxjerrim në pah fusha të rëndësishme për hulumtimet e ardhshme që do të rrisin më tej njohuritë tona për sindromet e varësisë dhe përkthejnë këto përparime në analiza dhe trajtime të përmirësuar diagnostike.
Mekanizmat transkripcionalë dhe epigjenetikë
Njohuritë se të varurit mund të mbeten në rrezik në rritje për rikthim, pavarësisht nga vitet e abstinencës, do të thotë se varësia përfshin ndryshime të shkaktuara nga droga në tru që mund të jenë shumë të qëndrueshme. Kjo ka bërë që disa grupe të marrin në konsideratë ndryshimet në shprehjen e gjeneve si një komponent i rëndësishëm i procesit të varësisë (Figura 1). Në përputhje me rrethanat, studimet e gjeneve të kandidatëve ose të hulumtimeve të gjinisë gjenetike që përfshijnë mikroarra të ADN-së dhe kohët e fundit RNA-seq (sekuenca e lartë e transmetimit të ARN-ve të shprehura) ka identifikuar gjenet e shumta, shprehja e të cilave është ndryshuar në një rajon të caktuar të trurit në modelet e bërrylit dhe primateve të varësisë dhe në të varur nga njerëzit (p.sh., refs 10-17). Shembuj të këtyre gjeneve diskutohen në seksionet pasuese të këtij rishikimi.
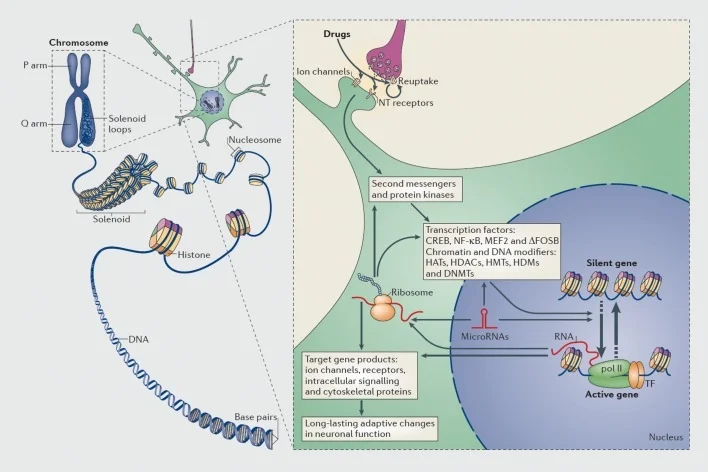
Mekanizmat e rregullimit transcriptional dhe epigenetik nga droga e abuzimit. Në qelizat eukariotike, ADN-ja është e organizuar duke u mbështjellë rreth okto-meve histone për të formuar nukleozome, të cilat më pas organizohen dhe kondensohen për të formuar kromozome (pjesa e majtë). Vetëm duke zbërthyer përkohësisht kromatin kompakt, ADN-ja e një gjeni të caktuar mund të vihet në dispozicion të makinerisë së transkriptimit. Drogat e abuzimit veprojnë nëpërmjet synimeve synaptike siç janë mekanizmat e rimarrjes, kanalet e joneve dhe receptorët e neurotransmetuesit (NT) për të ndryshuar kaskadat intracellulare të sinjalizimit (pjesa e djathtë). Kjo çon në aktivizimin ose frenimin e faktorëve të transkriptimit (TFs) dhe të shumë objektivave të tjerë bërthamorë, duke përfshirë proteinat e rregullimit të kromatinit (të treguara nga shigjetat e trasha); mekanizmat e hollësishëm të përfshirë në rregullimin sinaptik të proteinave të rregullimit të kromatinës mbeten të kuptueshme pak. Këto procese përfundimisht rezultojnë në induksionin ose shtypjen e gjeneve të veçanta, duke përfshirë ato për ARN-të pa-koduese si mikroRNA; shprehja e ndryshuar e disa prej këtyre gjeneve mund të rregullojë më tej rregullimin e transkriptimit të gjeneve. Është propozuar që disa nga këto ndryshime të nxitura nga droga në nivelin e kromatinit janë jashtëzakonisht të qëndrueshme dhe në këtë mënyrë vënë në jetë sjelljet afatgjata që përcaktojnë varësinë. CREB, proteina lidhëse ciklike e AMP-përgjegjshëm; DNMTs, metiltransferazat e ADN; HATs, acetyltransferases histone; HDACs, deacetilaze histone; HDMs, demetilatet histone; HMTs, histone metiltransferaze; MEF2, faktor i rritjes specifike myokit 2; NF-kB, faktori bërthamor-KB; pol II, RNA polimeraza II. Riprodhuar nga ref 44: Robison AJ, Nestler EJ. Mekanizmat transkripcionalë dhe epigjenetikë të varësisë. Nat Rev Neurosci. 2011; 12: 623-637.
Gjithashtu, shumë lloje të faktorëve të transkriptimit - proteinat që lidhen me rajonet rregullatore të gjeneve dhe në këtë mënyrë rrisin ose zvogëlojnë transkriptimin e atyre gjeneve - kanë qenë të implikuar në ndërmjetësimin e efekteve afatgjata të abuzimit të drogës në shprehjen e gjeneve në tru. Shembuj të shquar përfshijnë CREB (proteina e lidhjes së elementit të reagimit të cAMP), ΔFosB (një faktor i transkriptimit të familjes Fos), NFkB (faktori bërthamor kB), MEF2 (faktori i rritjes së miokit-2) dhe receptorët glukokortikoid, ndër disa të tjerë.5,10,18-22 Ka qenë gjithnjë e më e mundur të kuptojmë rrugët e sinjalizimit qelizor përmes të cilave barnat e abuzimit aktivizojnë një faktor të dhënë të transkriptimit në tru dhe të lidhin shkakësisht aktivizimin e tillë me gjenet e synuara të këtij faktori transkriptimi dhe me aspektet specifike të sjelljes së varësisë (shih Figura 1). Ky progres ilustrohet nga shqyrtimi i CREB dhe ΔFosB, të cilat janë faktorët më të mirë të studiuar të transkriptimit në modelet e varësisë.
Proteina lidhëse e elementit të reagimit cAMP
Nxitjet nxitëse dhe opiate të abuzimit aktivizohen CREB në disa rajone të trurit të rëndësishme për varësinë, duke përfshirë dukshëm në NAc.23,24 CREB dihet të aktivizohet në sisteme të tjera nga cAMP, Ca2+, dhe rrugët e faktorit të rritjes,25 dhe ende nuk dihet se cili prej tyre ndërmjetëson aktivizimin e tij në NAc nga droga abuzimi. Aktivizimi i drogës i CREB në NAc është treguar të përfaqësojë një mekanizëm klasik feedback negativ, ku CREB shërben për të zvogëluar ndjeshmërinë e një kafshe ndaj efekteve shpërblyese të këtyre barnave (tolerancën) dhe për të ndërmjetësuar një gjendje negative emocionale gjatë tërheqjes së drogës (varësia).18,26,27 Këto efekte janë treguar kohët e fundit për të nxitur rritjen e vetë-administrimit të drogës dhe rikthim, me sa duket përmes një procesi të përforcimit negativ.28 Këto veprime të CREB duket të përfshijnë të dy nëntipe të mëdha të neuroneve mesatare të pjerrët NAc, ato që shprehin kryesisht D1 kundrejt D2 dopamin receptorët.24 INë mënyrë të jashtëzakonshme, një numër i madh i literaturës ka treguar se CREB, duke vepruar në hippocampus dhe amygdala, është një molekulë kyçe në kujtesën e sjelljes.29-31 Ky rol i gjerë në varësinë dhe kujtesën e sjelljes mund të pasqyrojë faktin se neuronet janë të mbushur me një numër të kufizuar mekanizmash molekulare me të cilat përshtaten në një mjedis që ndryshon vazhdimisht.
Gjenet e synuara për CREB që ndërmjetësojnë këtë fenotip të sjelljes janë identifikuar përmes analizave të gjenomit të gjerë, si dhe përpjekjeve më të përzgjedhura.10,18,32 Një shembull është dinorfina e peptidit opioid: induksion nxitës i shprehjes së dynorfinës në neuronet e NAc, të ndërmjetësuar nëpërmjet CREB, rrit dinamizimin e aktivizimit të receptorëve të opioideve në receptorët e VTA neuroneve dopamine dhe në këtë mënyrë shtyp transmetimin dopaminergjik tek NAc dhe dëmton shpërblimin.18 Disa qëllime të tjera të CREB janë treguar të jenë të rëndësishme për plasticitetin synaptik të shkaktuar nga droga, siç diskutohet më poshtë. Ndërsa CREB është aktivizuar edhe në disa rajone të trurit nga stimulantë dhe opiate,23,24 dihet më pak për pasojat e sjelljes të këtij efekti dhe gjenet e synuara përmes të cilave ato ndodhin. Po kështu, dihet më pak për rolin e CREB në ndërmjetësimin e veprimeve të barnave të tjera të abuzimit.19
ΔFosB
Ekspozimi akut ndaj pothuajse çdo droge të abuzimit shkakton të gjithë faktorët e transkriptimit të familjes Fos në NAc dhe disa rajone të tjera të trurit. Ky induksion është i shpejtë, por gjithashtu shumë i përkohshëm, me nivelet e proteinave të Fos që kthehen në normale brenda orëve 8 deri në 12. Unike midis këtyre proteinave të familjes Fos është ΔFosB, një produkt i shkrirë i gjenit FosB, e cila në sajë të stabilitetit të saj të pazakontë, gradualisht akumulon përmes një rrjedhe të ekspozimit të përsëritur të drogës dhe bëhet proteina mbizotëruese Fos e shprehur në këto kushte.22,33 Për më tepër, për shkak të kësaj stabiliteti, nivelet e ΔFosB vazhdojnë për javë pas tërheqjes së drogës. Induksioni i tillë kronik i ΔFosB është demonstruar për pothuajse të gjitha drogat e abuzimit34 dhe, për shumicën e barnave, është selektiv për neuronët NAc të tipit Dl.34,35 Ka qenë gjithashtu demonstruar në të varur nga njerëzit.35 Një numër i madh letrash ka demonstruar se një induksion i tillë ΔFosB në D1-neuronet e tipit NAc rrit ndjeshmërinë e një kafshe ndaj ilaçeve, si dhe shpërblimeve natyrore dhe promovon vetë-administrimin e ilaçeve, me sa duket përmes një procesi të përforcimit pozitiv (shih refs 34 në 38). Interesante, induksioni i drogës i ΔFosB në NAc është më dramatik në kafshët adoleshente, një kohë e cenueshmërisë më të madhe të varësisë,39 dhe induktimi i saj nga nikotina ka treguar që ndërmjetëson në rritjen e shpërblimit të kokainës si nikotina.40
Sa për CREB, gjene të shumta të targetuara për ΔFosB janë identifikuar në NAc duke përdorur gjenet e kandidatëve dhe qasjet e gjenomit.10,32 Ndërsa CREB indukton dinorfinë, ΔFosB e shtyp atë, e cila kontribuon në efektet pro-shpërblimit të ΔFosB.38 Një tjetër objektiv i ΔFosB është cFos: si ΔFosB akumulohet me ekspozim të përsëritur të drogës ai shtyp bosh dhe kontribuon në kalimin molekulare ku ΔFosB është induktuar në mënyrë selektive në gjendje kronike të trajtuar me drogë.41 Shumë qëllime të tjera të ΔFosB kanë treguar të ndërmjetësojnë aftësinë e disa ilaçeve të abuzimit për të nxitur plasticitetin synaptik në NAc dhe ndryshimet shoqëruese në arborizimin e dendritit të neuroneve mesatare të pjerrët NAc, siç do të diskutohet më poshtë.
Pasojat funksionale të induksionit ΔFosB në rajonet e tjera të trurit janë më pak të kuptuara, edhe pse indukcioni i tij në korteksin orbitofrontal (OFC) është studiuar në disa detaje. Këtu, ΔFosB ndërmjetëson tolerancën që ndodh ndaj efekteve kognitive-ndërprerëse të kokainës gjatë një rrjedhe të ekspozimit kronik, dhe kjo përshtatje lidhet me rritjen e vetë-administrimit të kokainës.42,43
Analizat e gjerë të gjenomit kanë sugjeruar disa gjeneve të mundshëm të synuar që ndërmjetësojnë këto efekte.42 Megjithë vetitë unike kohore të ΔFosB dhe njohuritë që ai nxitet në qarqet tradicionale të kujtesës (p.sh. hipokampusi), ende nuk është bërë një hulumtim i rolit të ΔFosB në kujtesën e sjelljes, një temë interesante për hulumtimet e ardhshme.
Mekanizmat epigenetike
Në vitet e fundit, studimet e transkriptimit janë shtyrë përpara një epigenetike44 (Shih Figura 1), e cila mund të definohet gjerësisht si një ndryshim në shprehjen e gjeneve që ndodh në mungesë të një ndryshimi në sekuencën e ADN-së. Mekanizmat epigenetike kontrollojnë paketimin e ADN-së brenda një blloku qelizë nëpërmjet ndërveprimeve të tij me histone dhe shumë lloje të tjera të proteinave bërthamore, të cilat së bashku përbëjnë kromatin. Shprehja e gjeneve kontrollohet nga gjendja e kësaj paketimi nëpërmjet modifikimit kovalent të histoneve, proteinave të tjera dhe vetë ADN-së. Si vetëm disa shembuj, acetilizimi i histoneve tenton të promovojë aktivizimin e gjeneve, metilimi i histoneve ose mund të nxisë aktivizimin ose shtypjen e gjenit në varësi të mbetjeve Lys që i nënshtrohen këtij modifikimi, dhe metilimi i ADN-së përgjithësisht është i lidhur me represionin e gjeneve edhe pse forma të caktuara variantesh të metilimit p.sh., 5-hydroxymethylation) mund të shoqërohet me aktivizimin e gjeneve.
Epigenetika është një mekanizëm tërheqës, sepse në sisteme të tjera, për shembull, biologjia e zhvillimit dhe kancerit, disa modifikime epigjenike mund të jenë të përhershme. Per kete arsye, epigenetika është ndjekur si në modelet e mësimit dhe kujtesës (p.sh. refs 45-48) ashtu edhe në varësi;44,49 në të dy sistemet janë raportuar ndryshime të thella në acetilimin histone dhe metilimin dhe në metilimin e ADN-së. Si vetëm një shembull, histoni metiltransferazë, G9a, është implikuar në të dy kujtimet50 dhe varësisë.51,52 Në modelet e varësisë, Shprehja G9a është poshtëreguluar në NAc në përgjigje të drogës nxitëse ose opiate të abuzimit dhe ttij është treguar të rrisë efektet e dobishme të këtyre barnave.51,52 Interesante, shtypja e kokainës së G9a ndërmjetësohet nga ΔFosB. G9a katalizon dimetilimin e Lys9 të histonit H3 (H3K9me2), një ndërmjetës i madh i represionit të gjeneve. ChIP-chip ose ChIP-seq (imunoprecipitat e kromatit ndjekur respektivisht nga patate të skuqura promoter ose sekuenca të lartë të xhiros) janë përdorur për të marrë harta të gjenomit të gjerë të gjeneve në NAc që shfaqin ndryshuar H3K9me2 pas ekspozimit stimulues ose opiate.32,52,53 Me mbivendosjen e këtyre listave të gjeneve me listat e gjinive të gjeneve të ndryshimeve të shprehjes gjenetike dhe me hartat e gjerë të gjenomit të shumë formave të tjera të modifikimeve epigjenetike (p.sh., lidhja e FosB, lidhja e CREB, modifikimet e tjera të histonit etj)32,53 duhet të jetë e mundur të identifikohen një grup gjithnjë e më i plotë i gjeneve që rregullohen nga drogat e abuzimit dhe për të kuptuar mekanizmat epigenetikë të përfshirë.
Një formë tjetër e rregullimit epigjenik të implikuar në kujtesë dhe varësi është gjenerimi i mikroRNAs. Këto ARN të vogla, jo-koduese lidhen me rajonet plotësuese të ARNi dhe në këtë mënyrë shtypin përkthimin e tyre ose nxisin degradimin e tyre. Zhdukja e Argonaut, një proteinë e rëndësishme për përpunimin e miRNAs, ndryshon përgjigjet e sjelljes ndaj kokainës, me efekte të dallueshme të vërejtura për DNUMX - krahasuar me neuronet e mesme të tipit D1.54 Disa miRNA specifike gjithashtu kanë treguar të jenë të rregulluara nga ekspozimi i drogës dhe, nga ana tjetër, të ndikojnë në përgjigjet e sjelljes ndaj drogës (p.sh. refs 55,56). Do të jetë emocionuese në studimet e ardhshme për të identifikuar objektivat e mRNA-së të këtyre miRNA-ve dhe të karakterizojnë se si ato ndikojnë në procesin e varësisë.
Plastikiteti synaptik
Të njëjtat lloje të përgjithshme të modifikimeve synaptike në sinapset glutamatergike, të cilat janë implikuar në hippocampus dhe amygdala në kujtesën e sjelljes (shih artikujt e tjerë në këtë çështje), gjithashtu kanë treguar të ndodhin në rajonet e shpërblimeve të trurit në modelet e varësisë dhe të jenë të rëndësishme në ndërmjetësimin procesi i varësisë.57,58 Kjo plasticitet synaptik i shkaktuar nga droga është përshkruar në disa rajone të trurit, megjithatë, ne përqendrohemi këtu në NAc ku shumica e hulumtimeve janë fokusuar deri më sot (Figura 2).
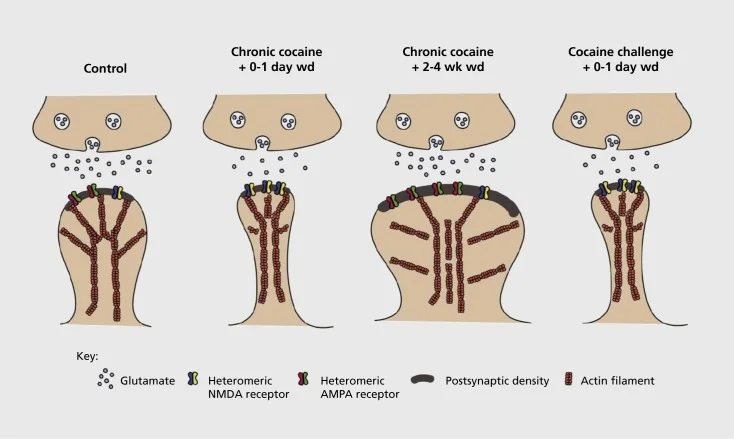
Modeli i plasticitetit synaptik dhe strukturor të lidhura me varësinë në nucleus accumbens (NAc). Ekspozimi kronik ndaj kokainës rezulton në një riorganizim të përkohshëm dhe të përkohshëm të receptorëve të acidit α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic (AMPA) dhe N-methyl-D-aspartic acid (NMDA) në NAc medium (MSN) synapses, si dhe ndryshimet strukturore në kokën e shtyllës kurrizore të NAc MSNs që lidhen me format e ndryshme të plasticitetit synaptic. Për shembull, kokaina kronike nxit shprehjen sipërfaqësore të receptorëve të NMDA, formimin e heshtur të sinapsit dhe depresionin afatgjatë (LTD) në momentet e hershme të tërheqjes. Gjatë tërheqjes më të zgjatur (wd), këto ndryshime sinaptike ndryshojnë me rezultatin duke rritur ekspresionin e receptorëve të sipërfaqes AMPA, një konsolidim të sinapsit në një shpinë në formë kërpudhe dhe fuqizim afatgjatë (LTP). Këto efekte kthehen shpejt pas ekspozimit ndaj dozës sfiduese të kokainës që çon në ristrukturimin e shtyllës kurrizore në shtyllat e hollë dhe në një depresion të forcës synaptike.
Eksperimentet fillestare treguan se ekspozimi i përsëritur ndaj drogave stimuluese të abuzimit shkakton një gjendje të depresionit LTD (afatgjatë) në synapset glutamatergike në NAc.59 Sidoqoftë, puna më e fundit ka treguar që një lloj i tillë është shumë i varur nga koha, ndërsa LTD ndodh herët pas ekspozimit të fundit të kokainës që evoluon në më shumë se një shtet LTP (potencial afatgjatë) pas pikës më të gjatë të tërheqjes.60,61 Kjo punë, e cila deri më sot është kryer kryesisht duke përdorur hetuesin e administruar, në krahasim me barnat e vetë-administruara, ka përcaktuar nevojën për hetime më sistematike në modelet e vetadministrimit që ndjekin format e plasticitetit synaptik që ndodhin në sinapset glutamatergike në NAc gjatë një kursi të detajuar kohor nga marrja e vetë administrimit në mirëmbajtjen e tij, nëpër kohë të ndryshme të tërheqjes dhe zhdukjes, dhe në përgjigje të stimujve që ngjallin rikthimin. Puna deri më tani ka përcaktuar disa nga mekanizmat molekulare që kontribuojnë në këtë plasticitet synaptik të shkaktuar nga droga, duke përfshirë trafikimin e receptorëve AMPA në synaps ndoshta ndërmjetësuar pjesërisht nëpërmjet CaMKII (Ca2+/ calmodulin-dependent protein kinase II) fosforilimi i disa nën-njësive të receptorit AMPA si dhe shprehja e ndryshuar e nën-njësive të receptorit AMPA (p.sh. 60,62-65, Shifrat 2 dhe 3). Një rol për CREB dhe ΔFosB është implikuar në këto fenomene, si dhe në ndryshimet e lidhura me morfologjinë e sinapseve glutamatergike (shih më poshtë). Për shembull, GluAl është një objektiv për CREB në NAc, ku GluA2 dhe CaMKII janë dy objektiva të ΔFosB, në këtë rajon të trurit .35,36,66,67 Duke u nisur përpara, do të jetë e rëndësishme të lidhim përshtatje specifike me ndryshimet e varura nga koha në funksionin sinapti dhe tiparet e sjelljes së varësisë.

Mekanizmat molekularë që qëndrojnë në themel të induksionit të kokainës të spines dendritike në neuronet mesatare me gjemba të bërthamës akumbens (NAc). A) tregon rritje të shkaktuara nga kokaina në numrin e shtyllës kurrizore dendritike që mund të bllokohet nga mbishprehja virale e G9a ose JunD (një antagonist i transkriptimit të ndërmjetësuar nga AP1), ose imituar nga mbishprehja virale e FosB. B) Rregullimi i trafikimit të receptorëve AMPA (AMPAR) dhe i citoskeletit të aktinës (majtas), si dhe rregullimi i transkriptimit të receptorëve glutamate dhe proteinave rregulluese të aktinës (p.sh., siç ndërmjetësohet përmes ΔFosB, djathtas) janë treguar të luajnë role të rëndësishme në ndërmjetësimin e rregullimit të kokainës të densitetit të shpinës dendritike NAc. UMK, kinaza e domenit LIM; RAC, substrate e toksinës botulinike të lidhur me Ras.
Mjetet e reja eksperimentale po bëjnë të mundur që për herë të parë të përcaktohen me saktësi në rritje që qarqet e veçanta shfaqin këto forma të plasticitetit synaptik dhe çfarë anomalie të sjelljes ato ndërmjetësojnë. Për shembull, tai nënshkrimet shell dhe thelbësore të NAc shfaqin dallimet në plasticitetin synaptik të shkaktuar nga droga, ashtu si edhe neuronet mesatare D1- kundrejt D2-së në secilin nën-rajon.60,63,64,67 Po ashtu, eksperimentet optogjenetike kanë ofruar njohuri të reja në kontributin e një forme të veçantë të plasticitetit synaptik (p.sh., LTD) në popullata specifike të sinapave glutamatergike në NAc, për shembull, ato që lindin nga PFC mesatare kundrejt amygdalës bazolaterale kundrejt subikulit të ventralit (prodhimi i madh e hippocampus).68-70 Në fund të fundit, do të jetë e nevojshme të mbivendosni adaptimet molekulare të nxitura nga ilaçet në secilin prej këtyre neuroneve aferente me përshtatje specifike të sinapsës që ndodhin në dendritet e tyre post-sinaptike për të përpiluar një kuptim të plotë se si ilaçet e abuzimit modifikojnë qarkun e trurit për të drejtuar aspekte të veçanta të shtet i varur. Kjo përpjekje do të kërkojë një vlerësim më të madh të plasticitetit të shkaktuar nga ilaçet në sinapzat frenuese brenda këtyre rajoneve të trurit, një zonë që ka marrë shumë pak vëmendje deri më tani.65
Plastizmi i tërë qelizave
Ndërsa shumica e hulumtimeve që përfshijnë ndryshime neurofiziologjike në neuronet në fenomenet e abuzimit me drogën, si në fenomenet e të mësuarit dhe kujtesës, janë përqendruar në plasticitetin synaptik, ka dëshmi në rritje për rëndësinë e plasticitetit të tërë qelizës gjithashtu. Plastizmi i tërë qelizor, i referuar gjithashtu si plasticitet homeostatik,71 përfshin ndryshime në excitability brendshëm të një qelizë nervore të tërë në një mënyrë që ajo nuk është synaps-specifike. Duke pasur parasysh se disa tipare të varësisë nga droga përfshijnë ndjeshmëri të shtuar ose të reduktuar ndaj një droge, ka kuptim që nxitimi i shtuar ose i reduktuar i qelizave nervore të caktuara kontribuon në këto përshtatje të sjelljes.5
La shembulli më i mirë i konstatuar i plasticitetit të tërë qelizës ndaj një droge abuzimi është aftësia e opiateve kronike për të rritur ngacmueshmërinë e brendshme të neuroneve noradrenergike të locus coeruleus (LC).72 Kjo rritje e ngacmueshmërisë ndërmjetësohet nëpërmjet CREB dhe induksionit të saj të disa izoformave të adenilil ciklase, të cilat çojnë në shtimin e qitjes së neuroneve LC ndoshta përmes induksionit të kanaleve Na +.72-75 Ky hyperexcitabilty e neurons LC përfaqëson një mekanizëm klasik të tolerancës dhe varësisë dhe drejton disa nga shenjat dhe simptomat e tërheqjes opiate. Është interesante se CREB ndërmjetëson një formë të ngjashme të plasticitetit të tërë qelizave në neuronet e mesme të pjerrta të NAc, të cilat gjithashtu janë bërë të paqëndrueshme nga ekspozimi kronik ndaj drogave të abuzimit nëpërmjet CREB.76 Prandaj do të jetë kritike në hetimet e ardhshme për të kuptuar se si plasticiteti synaptik i sinteksës së glutamatergicit të ndërmjetësuar nga CREB në neuronet mesatare të ARN-së65,66 summates me hyperexcitability brendshëm të ndërmjetësuar nga CREB e këtyre neuroneve76 për të kontrolluar tiparet e sjelljes së varësisë.
Një tjetër shembull i plasticitetit të tërë qelizave në modelet e varësisë është hipertekstibiliteti i neuroneve dopamine të VTA që ndodh pas ekspozimit kronik të drogës opiate të abuzimitdhe (Figura 4).77,78 Ky adaptim, i cili ka qenë i lidhur me ndryshimet morfologjike në këto qeliza nervore (shih seksionin e ardhshëm), nuk ndërmjetësohet nga CREB por arrihet nëpërmjet rregullimit të kaskadave neurotrofike të sinjalizimit, siç përshkruhet më poshtë.
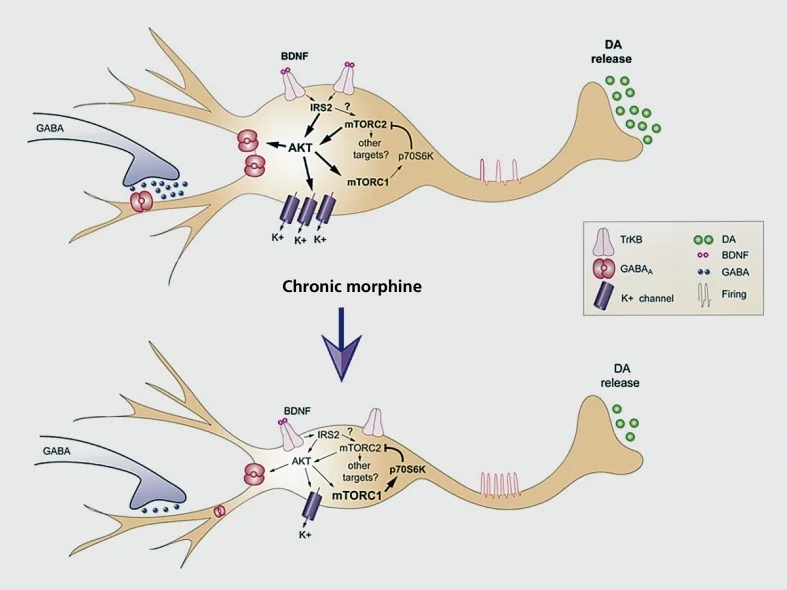
Modeli i punës i adaptimeve kronike morfine-induced në zonën tegmentale ventral (VTA) dopamin neurone. Morfina kronike zvogëlon madhësinë e SOM-it të dopamines VTA (DA), megjithatë rrit ndjeshmërinë neurone, ndërsa transmetimi i dopamines në bërthamë accumbens është zvogëluar. Efekti neto i morfinës është një rrugë shpërblimi më pak e përgjegjshme, pra, tolerancën e shpërblimit. Downregulation of IRS2-AKT sinjalizuar në VTA ndërmjetëson efektet e morphine kronike në madhësinë soma dhe excitability elektrike; efekti në ngacmueshmërinë ndërmjetësohet përmes rrymave të zvogëluara të acidit γ-aminobutirik (GABA) dhe shtypja e shprehjes së kanalit K '. Reduktimi i aktivitetit të mTORC2 në VTA është i rëndësishëm për këto adaptime morfologjike dhe fiziologjike të detyruar nga morfina si dhe për tolerancën e shpërblimit. Në dallim nga mT0RC2, morfina kronike rrit aktivitetin mTORCI, i cili nuk ndikon në këto përshtatje të morfinëve. BDNF, faktor neurotrofik që rrjedh nga truri; IRS, substanca e receptorit të insulinës; mTORC, kompleks mTOR; AKT, protein kinaza B Riprodhuar nga ref 77
Plastizmi morfologjik dhe mekanizmat neurotrofike
Rritja e dëshmive, shumica e saj nga studimet e neuroneve hippocampal dhe cerebral cortical, ka treguar se ndryshimet në plasticitet synaptic lidhen me ndryshimet morfologjike në synapse. Për shembull, LTD dhe gjenerimi i sinapave të heshtura shoqërohen me formimin e shtizave të hollë ose të dendritit, ndërsa LTP është e lidhur me spina më të mëdha në formë kërpudhash.79,80 Prandaj është interesante që fusha e abuzimit të drogës është përqendruar në ndryshimet e shkaktuara nga ilaçet në shtyllat kurrizore dendritike për> 15 vjet. Ekspozimi kronik ndaj droga stimuluese e abuzimit rrit densitetin e dendritit të shtresës së shpinës të neuroneve të mesme të shtyllave të NAc, një ndryshim që mbizotëron për neuronet Dl-lloj.67,81,82 Induksioni i shtyllave është shoqëruar pjesërisht me reagime sensibilizuese të sjelljes ndaj këtyre barnave, edhe pse disa dëshmi janë në konflikt me këtë pikëpamje.
Ashtu si me studimet e plasticitetit synaptik, megjithatë, nevojitet shumë më tepër punë për të definuar në mënyrë sistematike ndryshimet në spines dendriti që ndodhin gjatë një kursi të vetadministrimit të drogës, tërheqjes dhe rikthimit. Sderi më sot, duke përfshirë drogën hetues dhe vetë-administruar, sugjerojnë ndryshime shumë të ndryshme të shtyllës kurrizore që ndodhin në pikat e ndryshme të tërheqjes dhe në nëngrupe shell NAc kundrejt nënrave kryesore.83-86 Do të jetë gjithashtu e rëndësishme përcaktimi i mekanizmave të sakta molekulare me të cilat kokaina ose një stimulues tjetër prodhon këto efekte specifike të varur nga koha dhe qeliza. ΔFosB është treguar të jetë e nevojshme dhe e mjaftueshme për induksionin e shtyllave të papjekura në DN-tipin neurons NAc.35,51,67 Një rregullim i tillë ndodh në përputhje me rregullimin e kokainës dhe ΔFosB të disa proteinave të njohura për të kontrolluar riorganizimin e citoskeletit të aktinës. Si vetëm një shembull, rregullimi transkripsion i disa faktorëve të shkëmbimit të nukleotideve guanine dhe proteinave aktivizuese të GTPase vë në pah Rac1, një GTPase të vogël, për zvogëlimin e përkohshëm të aktivitetit në përgjigje të secilës ekspozim të kokainës dhe ulje të tilla të ulëta në aktivitetin Rac1, duke përdorur kontrollin optogenetik e Rac1, për të ndërmjetësuar induksionin e shtizave të papjekura.87 Këto efekte të Racl me sa duket ndodhin nëpërmjet kontrollit të saj të cofilin dhe proteinave rregullatore të aktinës, të cilat gjithashtu kanë treguar të ndërmjetësojnë rregullimin e kokainës të rritjes së shtyllës së shpinës.87,88 Sidoqoftë, është e rëndësishme të theksohet se kjo është vetëm një rrugë e përfshirë në rregullimin e kokainës në shtyllat kurrizore të papjekura, pasi që shumë proteina të tjera janë treguar të luajnë gjithashtu një rol thelbësor, duke përfshirë CDK5 (kinase-5 e varur nga ciklina-2), CaMKII, NFkB , MEF9, CREB, G3a dhe DNMT3 (metiltransfi i ADN-së fshin XNUMXa), për të përmendur disa.20,21,35,51,67,89,90 Interesante është që rregullimi i kokainës i disa prej këtyre gjeneve, përfshirë induksionin e CDK5, CaMKII dhe NFkB, dhe represioni i G9a, gjithashtu ndërmjetësohet nëpërmjet ΔFosB.20,35,51,91
Çuditërisht, drogat opiate të abuzimit ushtrojnë efektin e kundërt dhe zvogëlojnë densitetin e shpinës dendriti të neuroneve mesatare të pjerrët NAc.81 Nuk dihet pak për pasojat e sjelljes së kësaj përshtatjeje dhe të mekanizmave molekularë të përfshirë. Ky fenomen është, megjithatë, të habitshme, duke pasur parasysh se CREB dhe ΔFosB janë të nxitura nga të dy stimuluesit dhe opiatet dhe janë të dy të implikuar në nxitës-mediated induksion i NAc density dendritic shpinë. Kjo ngre pyetjen se si opiatet shtypin densitetin e shtyllës kurrizore të NAc pavarësisht induksionit të tyre të këtyre faktorëve.
Forma tjetër e madhe e plasticitetit morfologjik që shihet në modelet e abuzimit me drogën është reduktimi fizik në madhësinë e qelizës soma të neuroneve dopamine të VTA të shkaktuara nga administrimi opiat kronik.77,92,93 Një përshtatje e ngjashme ndodh në përgjigje të kanabinoidëve.94 Kjo tkurrje e neuroneve dopamine VTA, e cila ndodh me vetë-administrimin opiate93 dhe është dokumentuar në varësi të heroinës njerëzore të ekzaminuar pas vdekjes,77 duket se ndërmjetëson tolerancën e shpërblimit dhe lidhet me lirimin e reduktuar të dopaminës në NAc. Dëshmitë e konsiderueshme tani tregojnë se kjo reduktim në madhësinë e qelizës soma është ndërmjetësuar nga shtypja e opiateve të shprehjes neurotrofike të lindur nga truri (BDNF) brenda këtyre neuroneve. Ne kemi lidhur drejtpërsëdrejti këtë tërheqje të mbështetjes BDNF dhe tkurrjes së neuronit të VTA, në aktivitetin e zvogëluar të kaskadave sinjalizuese të BDNF në rrjedhën e poshtme në VTA dopamin neuronet, veçanërisht aktivitetin e reduktuar të IRS2 (substrate-receptor i insulinës-2), AKT (një serine-threonine kinase), dhe TORC2 (objektivi i rapamycin-2, i cili është i pandjeshëm ndaj rapamicinës).77,93 Ne gjithashtu kemi lidhur këtë nënregullim të BDNF sinjalizimit drejtpërdrejt me rritjen e ngacmueshmërisë që morfina shkakton në këto neurone, siç u përmend më herët.77,78 Në të vërtetë, madhësia e zvogëluar e sasisë së qelizës dhe ngacmueshmëria në rritje janë të lidhura së bashku, pasi induksioni i një të çon tek tjetri dhe anasjelltas. Ky kontroll mbi excitability qelizore përfshin shtypjen e K+ kanalet dhe GABAA aktuale në këto neurone.
Ky rol për BDNF në kontrollin e përgjigjeve morfine në nivelin e VTA kontrast me përfshirjen e saj shumë të ndryshme në veprimet e kokainës dhe stimuluesve të tjerë. Stimuluesit nxisin sinjalizimin BDNF tek NAc, një efekt për shkak të rritjes së sintezës lokale të BDNF si dhe lirimit të rritur nga disa rajone afferente.95 Për më tepër, rritja e sinjalizimit të BDNF në NAc, por jo në VTA, është treguar të promovojë efektet e sjelljes së këtyre barnave duke përfshirë vetë-administrimin e tyre.95,96 Rregullimi i kundërt i sinjalizimit të BDNF në shtegun VTA-NAc nga opiumet kundrejt stimuluesve ngre mundësinë që ndryshime të tilla të ndërmjetësojnë në rregullimin e kundërt të ilaçeve të spines dendritike NAc, një mundësi që tani është nën hetim.
Drejtime të ardhshme
Narrimi i mësipërm nënvizon përparimet e jashtëzakonshme që janë bërë në kuptimin e adaptimeve molekulare dhe qelizore që ndodhin në rajonet e shpërblimit të trurit në përgjigje të ekspozimit të përsëritur ndaj një droge abuzimi dhe në lidhjen e përshtatjeve individuale me disa tipare të sjelljes të sindromeve të varësisë në modelet e kafshëve . Pavarësisht nga këto përparime, mbeten çështje të mëdha. Shumica e njohurive tona ekzistuese përqendrohen në VTA dhe NAc, me informacione shumë më pak të disponueshme për rajonet e tjera kryesore të trurit, të cilat janë gjithashtu vendimtare për varësinë nga droga. Përveç kësaj, të gjitha demonstratat eksperimentale të rolit kauzal të adaptimit molekular-qelizor në një sjellje të lidhur me drogën kanë manipuluar përshtatjet individuale një nga një. Për të manipuluar adaptime të shumta në të njëjtën kohë është qartë shumë më e vështirë, por është gjithashtu e domosdoshme, pasi ne e dimë që barnat prodhojnë një numër të madh ndryshimesh të ndryshëm madje edhe brenda neuroneve individuale, të cilat mund të përmblidhen në mënyra të ndërlikuara për të ndikuar në sjelljen. Një sistem i tillë biologjik do të jetë vendimtar për të përfunduar në fund të fundit bazat biologjike të varësisë. Së fundmi, përpjekjet për të kuptuar mekanizmat molekulare të kujtimeve që lidhen me varësinë e gjejnë veten në pikën ku të gjitha përpjekjet e tjera për të kuptuar bazën biologjike të kujtesës së sjelljes tani luftojnë: aftësia jonë për të lidhur dukuritë biologjike me kujtesën komplekse të sjelljes mbetet jashtëzakonisht e vështirë. Tejkalimi i kësaj ndarje përfaqëson ndoshta sfidën më të madhe në neurosciences.
Shkurtesat dhe akronimet e përzgjedhura
- NAC
- bërthamë accumbens
- CREB
- proteina lidhëse e elementit të reagimit cAMP
- ΔFosB
- një faktor transkriptimi i familjes Fos
- VTA
- zona bërthamore tegmentale
- AMPA
- α-amino-3-hidroksi-5-metil-4-acid izoksazolepropionik
- LTD
- depresion afatgjatë
- LTP
- protetizim afatgjatë
- BDNF
- faktor neurotrofik i trurit
- NKkB
- faktor bërthamor kB
REFERENCAT